镰形棘豆总生物碱抗肿瘤活性部位的体外筛选
2017-04-20骆雨璇
陈 醒,骆雨璇,王 楠
镰形棘豆总生物碱抗肿瘤活性部位的体外筛选
陈 醒,骆雨璇,王 楠
目的 筛选出镰形棘豆总生物碱抗肿瘤的主要活性部位。 方法 将镰形棘豆生物碱粗提部位经萃取后按照极性大小分为二氯甲烷部位、乙酸乙酯部位和正丁醇部位,采用四甲基偶氮唑盐(MTT)法观察各部位对人肝癌细胞SMMC⁃7721、人肺癌细胞A549、人胃癌细胞MKN⁃45、人结肠癌细胞LOVO、人宫颈癌细胞HeLa以及人乳腺癌细胞MDA⁃MB⁃231等6种人癌细胞株增殖的影响。 结果 总生物碱的正丁醇部位几乎没有抑制细胞增殖的作用,乙酸乙酯部位抑制作用比较弱,而二氯甲烷部位显示有较明显地抑制肿瘤细胞增殖的活性,且对6种细胞都有效。此外,不同的肿瘤细胞株对同一药物的敏感性也各不相同,人肺癌细胞A549和人乳腺癌细胞MDA⁃MB⁃231对药物有较高的敏感性。 结论 镰形棘豆抗肿瘤的活性部位为总生物碱的二氯甲烷部位。
镰形棘豆;抗肿瘤;总生物碱;四甲基偶氮唑盐
镰形棘豆为豆科棘豆属(Oxytropis D.C.)植物镰形棘豆(Oxytropis falcata Bunge)的干燥全草,藏药名为莪达夏[1]。其味辛、性寒,有小毒,入肺、脾二经,具有清热解毒、生肌愈疮、涩脉止血、抗炎止痛、通利大便等功效,用于治疗流感、扁桃体炎、黄水病、创伤、骨伤疼痛等,享有“草药之王”的美誉[2]。国内外研究发现棘豆属植物中黄花棘豆、小花棘豆生物碱均具有良好的抗肿瘤活性[3,4],我们通过研究发现镰形棘豆总生物碱具有明显的抗肿瘤作用,其机制可能是通过增强小鼠的免疫调节功能来实现的[5]。笔者将镰形棘豆生物碱粗提部位经萃取后按照极性大小分为二氯甲烷部位、乙酸乙酯部位和正丁醇部位,采用四甲基偶氮唑盐(MTT)法观察各部位对人肝癌细胞SMMC⁃7721、人肺癌细胞A549、人胃癌细胞MKN⁃45、人结肠癌细胞LOVO、人宫颈癌细胞HeLa以及人乳腺癌细胞MDA⁃MB⁃231等6种人癌细胞株增殖的影响,以期筛选出镰形棘豆抗肿瘤的活性部位,为镰形棘豆抗肿瘤物质基础研究提供一定的依据。
1 材料与方法
1.1 仪器 AE240电子分析天平(METTLER⁃TOLE⁃DO);TD10001型电子天平(天津市天平仪器有限公司);TGL⁃16台式高速离心机(金坛市医疗仪器厂);Rotavapor R⁃205旋转蒸发器(瑞士Büchi公司);SHB⁃Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司);DZF⁃6050型真空干燥箱(上海精宏实验设备有限公司);多功能提取罐、单效浓缩器(江苏省中医院药学部);KQ5200DB型数控超声波清洗器(昆山市超声仪器有限公司);CO2细胞培养箱(FORMA,THER⁃MO);Bio⁃Rad 680酶标分光光度读板仪(USA);BP211D精密电子分析天平(Startorius);超净工作台(苏州净化设备厂);OLYMPUS倒置显微镜(Japan);WH⁃861型旋涡混合器(江苏省太仓市科教器材厂);离心机(JingLiLDS⁃10B);HH⁃4数显恒温水浴锅(国华电器有限公司);96孔细胞培养板(Costar)。
1.2 材料与试药 镰形棘豆原植物来源于青海省共和县,2012年7月采收,经南京中医药大学刘训红教授鉴定为豆科棘豆属植物镰形棘豆(Oxytropis falcata Bunge)的干燥全草。DMEM培养基(GIBCO,美国);RPMI 1640培养基(GIBCO,美国);新生牛血清(56℃水浴灭活 0.5 h);胰酶(GIBCO,美国);MTT(Amresco,美国);青霉素、链霉素(山东鲁抗药业公司);0.1 mmol/L磷酸盐缓冲液(PBS;pH7.2~7.4,自制);二甲基亚砜(DMSO,Amresco,国药集团上海化学试剂有限公司);无水乙醇、二氯甲烷、乙酸乙酯、正丁醇、甲醇、氨水、浓盐酸等(均为分析纯,南京化学试剂有限公司);纯净水(南京中天净水有限公司);其余试剂均为国产分析纯。
1.3 细胞株 人肝癌细胞株SMMC⁃7721、人肺癌细胞株 A549、人结肠癌细胞 LOVO、人宫颈癌细胞HeLa、人胃癌细胞株MKN⁃45和人乳腺癌细胞MDA⁃MB⁃231由南京中医药大学实验室培养。
1.4 方法
1.4.1 样品的准备 镰形棘豆药材40 kg,加入体积分数95%的乙醇约480 L,于室温下冷浸过夜,次日回流提取3次,分别为2.5、1.5、1 h,减压抽滤,收集滤液,于50℃下减压回收乙醇,并进一步浓缩成浸膏(5 kg);药渣再加入体积分数50%的乙醇约480 L,于室温下冷浸过夜,次日回流提取3次,分别为2.5、1.5、1 h,减压抽滤,收集滤液;于50℃下减压回收乙醇,浓缩成浸膏。取95%乙醇提取所得浸膏(3.8 kg),加入1%的盐酸溶液10 L,室温下搅拌成悬浮状,离心,取上清液,加入二氯甲烷(1 L×9)反复振摇提取除去色素后,加入浓氢氧化钠溶液调碱性为pH 9~10,然后依次以二氯甲烷(1 L×20)、乙酸乙酯(1 L ×20)、正丁醇(1 L×20)反复振摇提取至提取液接近无色,分取各有机溶剂振摇提取液和最后所得的残余液,分别减压浓缩至干,得到二氯甲烷部位提取浓缩物(11.86 g)、乙酸乙酯部位提取浓缩物(20.80 g)以及正丁醇部位提取浓缩物(688.05 g),供实验用。
1.4.2 样品处理 分别取二氯甲烷部位、乙酸乙酯部位、正丁醇部位的干浸膏各50 mg,加入二甲基亚枫(DMSO)100 μL,涡旋使溶解,分别作为二氯甲烷部位、乙酸乙酯部位、正丁醇部位的储备液,用时稀释。DMSO的最终浓度不超过0.1%。将配制好的不同浓度的药物以0.22 μm微孔滤膜过滤除菌,4℃保存待用。
1.4.3 MTT比色法[6]取处于对数生长期的细胞,用0.25%的胰酶消化,吹打成单细胞悬液,调整细胞密度2×105个/mL,接种于96孔板中,每孔100 μL,在细胞贴壁并生长融合至50%~70%时加药处理,每种药物设5个浓度梯度,使药物终浓度分别为25、50、100、250、500 μg/mL,每孔100 μL,每个浓度设3个复孔,同时设立空白对照组(含相同浓度的DMSO)。空白对照组加入等体积的无血清培养液,阴性对照组只含有细胞,并未加药,阳性对照组加入不同浓度(5、10、15 μg/mL)的顺铂PBS溶液,每孔100 μL,同样设3个复孔,分别于给药24、48、72 h后,每孔加入12 μL浓度为5 mg/mL的MTT溶液,平面混匀后,置于培养箱中继续孵育4 h,然后弃去各孔中的上清液,再加入100 μL DMSO,平面振荡混匀10 min,待其各孔中的紫色结晶完全溶解后,置于酶标分光光度读板仪下测定各孔中的吸光度值(OD,λ490nm)。按下面公式计算细胞抑制率:
细胞抑制率 =(1-实验组OD值/对照组OD值)× 100%
2 结 果
2.1 镰形棘豆生物碱各极性部位对SMMC⁃7721体外抗肿瘤活性评价 研究发现二氯甲烷部位抑制作用较明显,乙酸乙酯部位次之,而正丁醇部位的抑制作用比较弱。其中,二氯甲烷部位抑制SMMC⁃7721细胞增殖的 IC50(μg/mL)分别为 736.63(12 h)、480.30(24 h)、296.96(48 h)、237.87(72 h)。见图1。
2.2 镰形棘豆生物碱各极性部位对A549体外抗肿瘤活性评价 乙酸乙酯部位和正丁醇部位无抑制A549细胞增殖的作用,而二氯甲烷部位的抑制作用显著。给药后随着作用时间的延长,二氯甲烷部位对A549的抑制增殖作用增强,且呈剂量依赖关系。尤其给药48 h及72 h后,剂量依赖关系明显。其IC50(μg/mL)分别为11950.00(24 h)、76.64(48 h)、47.89(72 h)。见图2。
2.3 镰形棘豆生物碱各极性部位对MKN⁃45体外抗肿瘤活性评价 乙酸乙酯部位和正丁醇部位没有抑制MKN⁃45细胞增殖的作用,而二氯甲烷部位抑制作用比较显著,高剂量(500 μg/mL)时,抑制作用与阳性药顺铂相当。当药物浓度较低时,随着剂量的增加,二氯甲烷部位对MKN⁃45细胞增殖的抑制作用增加并不明显,当药物浓度达到100 μg/mL以上时,呈明显的剂量依赖关系。其IC50(μg/mL)分别为 761.02(24 h)、257.32(48 h)、138.76(72 h)。 见图3。

图1 各组药物对SMMC⁃7721细胞增殖的影响
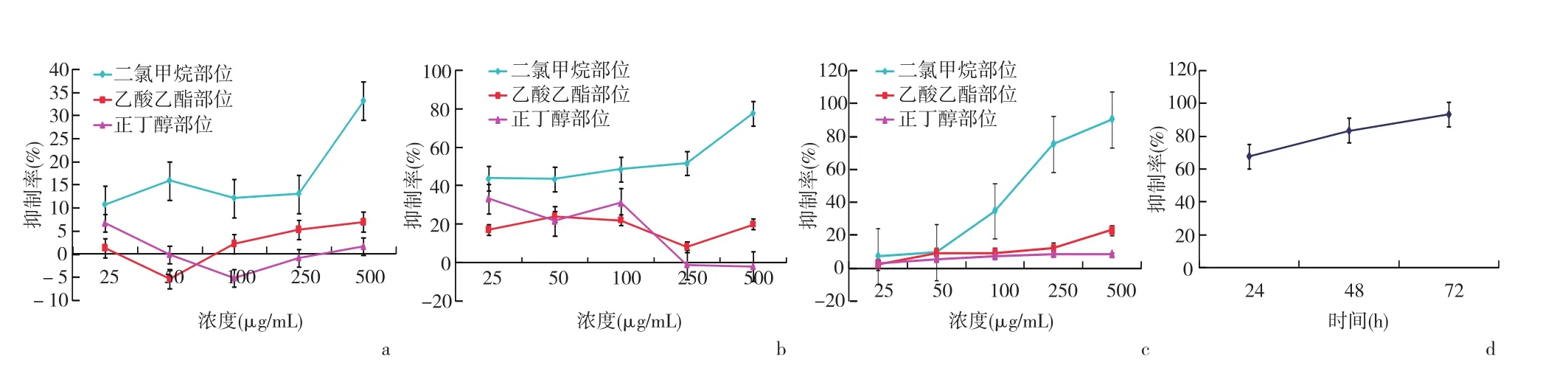
图2 各组药物对A549细胞增殖的影响
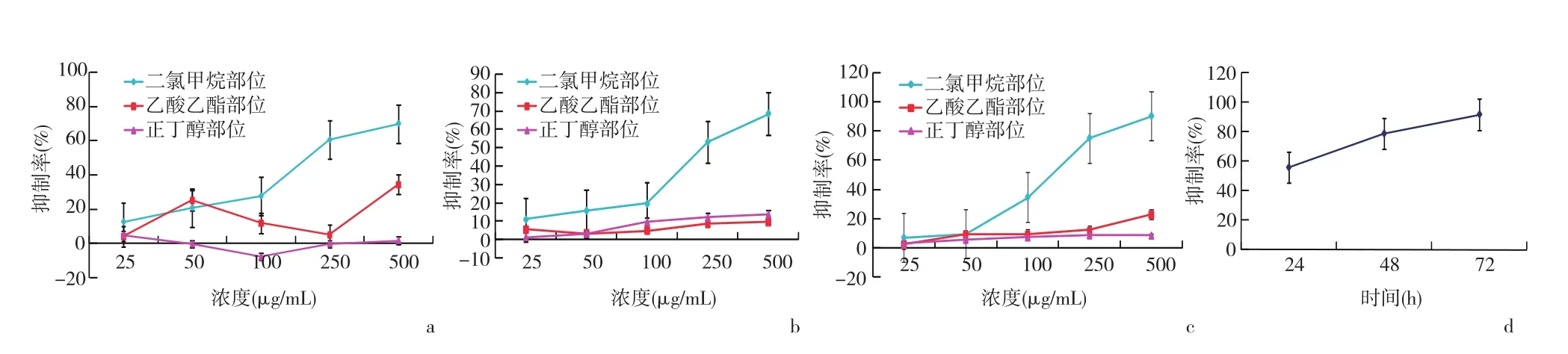
图3 各组药物对MKN⁃45细胞增殖的影响
2.4 镰形棘豆生物碱各极性部位对LOVO体外抗肿瘤活性评价 正丁醇部位没有显示抑制LOVO细胞增殖的作用,乙酸乙酯部位作用较弱,二氯甲烷部位作用比较显著,且呈明显的剂量依赖关系。其IC50(μg/mL)分别为205.86(24 h)、88.90(48 h)、93.42(72 h)。见图4。
2.5 镰形棘豆生物碱各极性部位对HeLa体外抗肿瘤活性评价 乙酸乙酯部位和正丁醇部位对人宫颈癌细胞HeLa增殖的抑制作用很弱,二氯甲烷部位抑制作用比较显著。当药物浓度较低时,随着剂量的增加,二氯甲烷部位对HeLa细胞增殖的抑制作用增加并不明显,当药物浓度达到100 μg/mL以上时,呈明显的剂量依赖关系。其IC50(μg/mL)分别为 4201.70(24 h)、129.07(48 h)、113.03(72 h)。见图5。
2.6 镰形棘豆生物碱各极性部位对MDA⁃MB⁃231体外抗肿瘤活性评价 正丁醇部位对MDA⁃MB⁃231的增殖无明显的抑制作用,乙酸乙酯部位抑制作用很弱,而二氯甲烷部位抑制作用比较显著,且呈明显的剂量依赖关系,高剂量(500 μg/mL)时,对MDA⁃MB⁃231细胞增殖的抑制作用与阳性药顺铂相当。其IC50(μg/mL)分别为1267.98(24 h)、104.63(48 h)、50.14(72 h)。见图6。

图4 各组药物对LOVO细胞增殖的影响
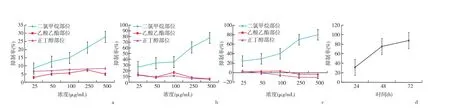
图5 各组药物对HeLa细胞增殖的影响
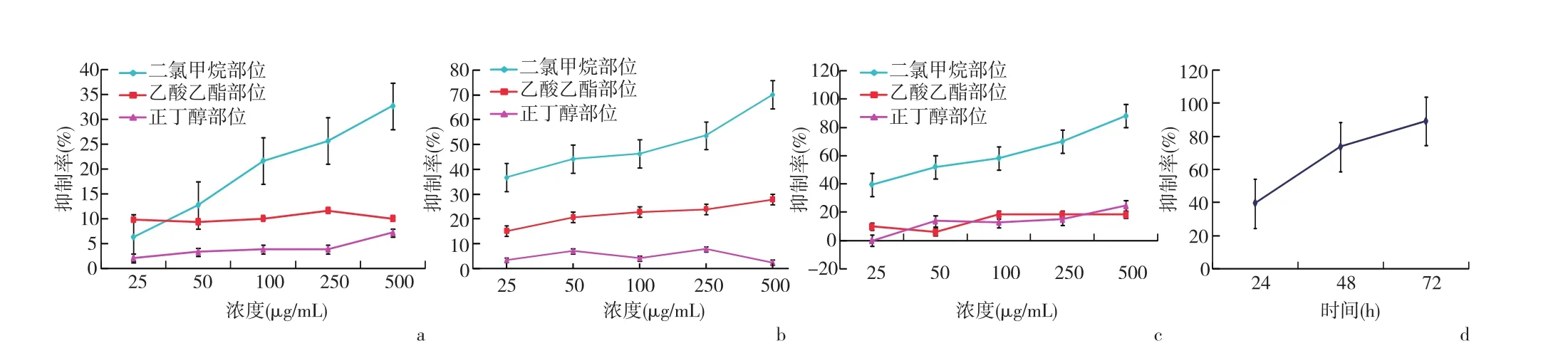
图6 各组药物对MDA⁃MB⁃231细胞增殖的影响
3 讨 论
笔者通过对生物碱粗提物3个不同极性部位进行体外抗肿瘤筛选实验发现,正丁醇部位几乎没有抑制细胞增殖的作用,乙酸乙酯部位抑制作用比较弱,而二氯甲烷部位显示了较明显的抑制肿瘤细胞增殖的活性,且对6种细胞都有效,因此确定了镰形棘豆抗肿瘤的活性部位为总生物碱的二氯甲烷部位。这可能与各部位的生物碱种类和含量有关。前期薄层色谱发现,镰形棘豆中二氯甲烷部位生物碱种类多,紫外分光光度法对各部位生物碱含量进行测定也表明二氯甲烷部位生物碱含量为0.08 mg/g,较乙酸乙酯部位(0.05 mg/g)、正丁醇部位(0.002 mg/g)多。此外,不同的肿瘤细胞株对同一药物的敏感性也各不相同,通过对6种人癌细胞进行筛选发现,人肺癌细胞A549以及人乳腺癌细胞MDA⁃MB⁃231对药物有较高的敏感性。在作用72 h后,二氯甲烷部位抑制A549及MDA⁃MB⁃231的IC50分别为47.89 μg/mL和50.14 μg/mL,为今后进一步进行镰形棘豆抗肿瘤的物质基础研究及机制研究提供了科学的依据与参考。此外,实验中发现正丁醇部位抑制率呈现部分负值的情况,可能和正丁醇部位含有的其它成分有关,有待于进一步考证。
[1] 陈锦珊,杨钦磊,刘晓玲,等.藏药镰形棘豆的化学成分、药理作用及毒理学研究进展[J].中国药房,2016,27(28):3945⁃3948.
[2] 姜 华,胡君茹,刘 霞.镰形棘豆的研究进展[J].中草药,2006,37(2):314⁃315.
[3] Long L, LiQW.The effectofalkaloid from Oxytropis ochrocephala on growth inhibition and expression of PCNA and p53 in mice bearing H22 hepatocellular carcinoma[J].Yakugaku Zasshi,2005,125(8):665⁃670.
[4] 刘 斌.中国棘豆属药用植物及其现代研究[J].中国野生植物资源,1997,16(2):15⁃18.
[5] 陈 醒,杨光明,何媛媛,等.镰形棘豆总生物碱对S180荷瘤小鼠的抗肿瘤作用研究[J].中华中医药杂志,2011,26(11):2540⁃2542.
[6] 郭以河,张闽峰,孟家榕.MTT法体外药敏试验研究进展及临床应用[J].东南国防医药,2005,7(1):77⁃78.
Screening of anti⁃tumor parts from the total alkaloids of Oxytropis falcata Bunge
CHEN Xing,LUO Yu⁃xuan,WANG Nan
(Department of Pharmacy,Nanjing General Hospital of Nanjing Military Region,PLA,Nanjing210002,Jiangsu,China)
Objective To select anti⁃tumor activity fraction from the total alkaloids ofOxytropis falcataBunge. Methods The crude alkaloids extracts fromOxytropis falcataBunge were divided into three fractions according to the polarity:dichloromethane fractions,ethyl acetate fractions and n⁃butanol fractions.Then the three fractions were screened on human hepatocellular cancer SMMC⁃7721 cells,human lung cancer A549 cells,human gastric cancer MKN⁃45 cells,human colon cancer LOVO cells,human cervix cancer HeLa cells and human mammary adenocarcinoma MDA⁃MB⁃231 cells to evaluate the anti⁃tumor fractions. Results The n⁃butanol fraction almost did not inhibit cell proliferation,and inhibition of ethyl acetate extract was relatively weak.However,the dichloromethane fraction showed a more significant inhibition of tumor cell proliferation activity.In addition,different tumor cells have different sensitivity to the same drug.The study showed that A549 human lung cancer cells and human breast cancer cell line MDA⁃MB⁃231 had a higher sensitivity to the drug. Conclusion The dichloromethane fractions are the anti⁃tumor fractions from the total alkaloids ofOxytropis falcataBunge.
Oxytropis falcata;Anti⁃tumor;Total alkaloids;MTT
R285.5
A
1672⁃271X(2017)01⁃0037⁃05
10.3969/j.issn.1672⁃271X.2017.01.010
2016⁃12⁃14;
2017⁃01⁃05)
(本文编辑:叶华珍; 英文编辑:王建东)
210002 江苏南京,南京军区南京总医院药品科
王 楠,E⁃mail:njpilicewn@163.com
陈 醒,骆雨璇,王 楠.镰形棘豆总生物碱抗肿瘤活性部位的体外筛选[J].东南国防医药,2017,19(1):37⁃41.
