抗体药物研发热点分析
2017-04-20杜鹏孙志伟
杜鹏,孙志伟
军事医学科学院生物工程研究所,北京 100071
抗体药物研发热点分析
杜鹏,孙志伟
军事医学科学院生物工程研究所,北京 100071

孙志伟,医学博士,军事医学科学院生物工程研究所研究员,博士生导师。主要从事生物技术药物研究,领衔完成“重大新药创制”等国家和军队多项重大课题,主导研发的安美木单抗(全人源anti-EGFR)已获得国家治疗类生物制品一类临床批件。E-mail:szwyhhh@aliyun.com
从新靶点、新技术、新适应证三个方面对当前抗体药物的研发热点进行了综述,并着重分析了肿瘤免疫治疗抗体、白介素抗体以及双特异性抗体的研究现状、特点和难点以及应用前景。
免疫检查点;肿瘤免疫治疗;白介素;双特异性抗体;抗体-药物偶联剂
2016年,美国食品药品监督管理局(FDA)下属的药品评价及研究中心(CDER)共批准了19个新分子实体(NME)的上市申请,其中7个为抗体分子,保持了平稳的发展势头,仅次于2015年的最高水平(9个)。截至2016年年底,国外共批准了71个原研抗体药物上市(含已撤市的品种)。全球抗体药物市场规模也在不断扩张,从2001年的30亿美元增长到2015年的916.3亿美元,15年间涨幅超过30倍,年均增长率25.6%。2016年全球抗体药物销售额更是突破1000亿美元(含Fc融合蛋白)。据不完全统计,目前处于研发阶段的抗体药物超过700种,其中超过50个项目已进入Ⅲ期临床研究阶段,必将为抗体药物市场规模的持续扩大注入强劲的动力。在关注市场数据攀升的同时,更应看到抗体药物的发展在疾病治疗方面显现的巨大社会效益。就已上市的抗体药物而言,适应证涉及肿瘤、免疫相关疾病、感染以及眼科、神经、呼吸、代谢和骨相关疾病等众多领域,为人类疾病的治疗提供了丰富的产品、策略和疗法。
自首个单克隆抗体药物OKT-3于1986年获批至今,基于抗体分子的药物研发已然经历了30年的发展历程。杂交瘤技术的问世催生了单克隆抗体药物的出现,同时,诸如抗体库技术、抗体人源化技术、转基因小鼠技术、肿瘤免疫治疗等一系列技术的进步和基础研究的突破,不仅促进了抗体工程技术的进步,改变了抗体药物的研发格局和模式,更是极大地扩展了抗体分子作为治疗药物的应用范畴。由此可见,抗体药物研发的主题在于创新——靶点创新、技术创新和应用创新,三者共同的依托是基础研究的深入开展和积累,共同的结果是新的研发思路、治疗药物、治疗方法的产生和新机制的发现。
1 抗体药物靶标热点分析
截至2016年年底,美国FDA批准的药物涵盖了893个治疗靶点,其中243个生物制剂涉及179个靶点,而上市抗体药物靶点仅39个,抗体药物靶点的开发存在广阔的创新空间。
1.1 免疫检查点抗体与肿瘤免疫治疗
肿瘤细胞的免疫逃逸机制主要可归结为三个方面:一是肿瘤通过改变肿瘤相关抗原的表达水平或者降低MHC I类分子的表达来规避免疫细胞的识别;二是通过释放如TGF-β、IL-10等免疫抑制因子形成抑制性的肿瘤微环境;三是通过调节肿瘤细胞表面的共刺激分子水平降低肿瘤致免疫能力,从而有效避免对T细胞的激活。肿瘤免疫治疗(cancer immunotherapy)的目的是克服肿瘤细胞的免疫逃逸机制,重建免疫系统对肿瘤细胞的识别和清除。肿瘤免疫治疗的制剂类型广泛,包括抗体、多肽、免疫佐剂、小分子化合物、细胞因子、溶瘤病毒、瘤苗以及细胞治疗等。凭借独特的技术特征、潜在的持久的肿瘤免疫力和临床获益以及对多种肿瘤类型的有效性,肿瘤免疫治疗已经逐步发展成肿瘤治疗学的一个独立分支。2013年,肿瘤免疫疗法被《科学》杂志评为年度最重要的科学突破。2014年、2015年连续两年,免疫肿瘤学(immuno-oncology)获得摩根大通(J. P. Morgan)投行会议最高估价。预计,到2023年肿瘤免疫治疗的市场规模将达到350亿美元[1]。截至2016年年底,有5个肿瘤免疫治疗领域的抗体药物获批(表1),其中4个为免疫检查点抗体。值得一提的是,2016年10月,美国FDA批准了Merck公司的Keytruda(pembrolizumab)用于一线治疗非小细胞肺癌(NSCLC)的方案,成为免疫治疗冲击一线治疗的标志性事件[2];同时,还有超过30种免疫治疗抗体药物处于临床研究阶段,其中多个免疫检查点抗体被FDA授予突破性疗法资格,获得加速审评的权利。
所谓免疫检查点(immune checkpoint),即是控制T细胞免疫响应的分子开关,被证实在自身免疫耐受、免疫响应调控等方面具有重要作用,也是肿瘤免疫逃逸的重要机制之一[2]。免疫检查点的发现最早可追溯到1987年Brunet等成功克隆出CLTA-4基因。随后几年,PD-1/PD-L1等一系列免疫检查点相继被发现。直到2011年,全球首个免疫检查点抗体伊匹单抗(ipilimumab,anti-CTLA-4)获批上市,正式开启了肿瘤免疫治疗的全新时代。
从作用机制上看,肿瘤免疫治疗主要涉及了四个方面的策略,如图1所示,也可从中看出相关靶点的分布情况[3]。一是消除免疫抑制,主要是通过抑制免疫抑制细胞的活性及相关免疫抑制因子的分泌,或者阻断免疫检查点等抑制性受体的功能,解除肿瘤细胞及肿瘤微环境对T细胞等效应细胞的抑制,重启抗肿瘤免疫活性。代表性的靶点有CTLA-4、PD-1、LAG-3、TIM-3、TIGIT、CD96等免疫检查点以及VEGF、CSF1、TGF-β、IL-10、IL-34、IL-35、CCL2、FGF等免疫抑制因子及受体,靶向这类分子的抗体均为拮抗型。目前已获批的免疫治疗单抗药物均属于此类。二是诱导免疫原性肿瘤细胞死亡(immunogenic cancer-cell death),一些常规靶向治疗制剂可划归此类。三是促进T细胞、巨噬细胞和NK细胞等效应细胞的活化,代表性的靶点有OX40、GITR、CD28、CD47、CD137、CD200、B7-H3、B7-H4、B7-H5、B7-H6、IL-15R、SIRPα/ CD47和KIR等。四是增强APC细胞的抗原呈递和辅助性,进而激活效应细胞的功能,代表性的靶点有SIRPα、CD40、STING、TLR等。后两类靶点因功能和分布的不同,需要区分拮抗剂和激动剂。据统计,临床在研的免疫治疗抗体覆盖了约20个前述靶点,随着大量处于早期研发阶段的抗体相继进入临床,将进一步丰富肿瘤免疫治疗抗体的靶点和类型。
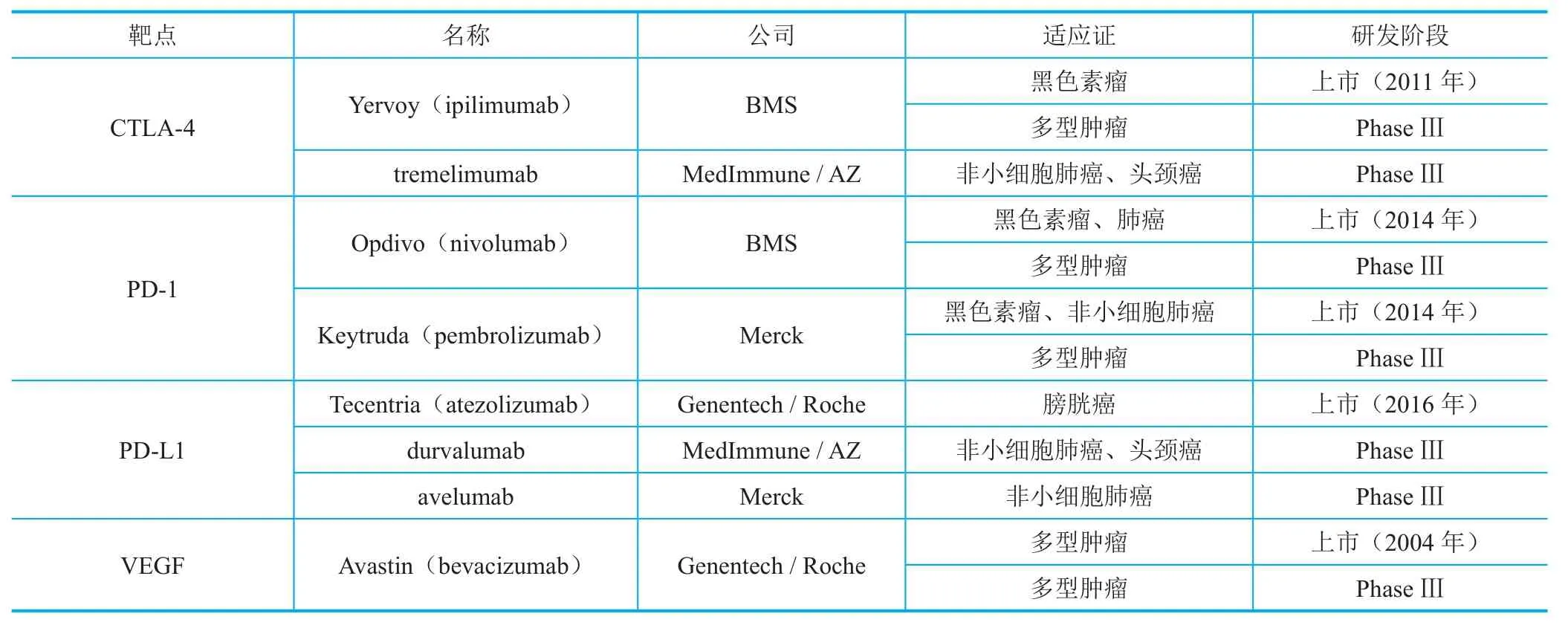
表1 已上市/临床Ⅲ期在研的肿瘤免疫治疗抗体药物

图1 肿瘤免疫治疗的作用机制与靶点分布[3]
对于肿瘤免疫治疗抗体的评价,有四个方面是至关重要的。一是早期研究中的评价方法和模型。免疫治疗抗体作用于复杂的免疫系统网络,合适的临床前药效评价方法对于抗体的成药性及药理研究是有益的。二是疗效评价标准。免疫治疗的优势在于持久的临床获益,irRC标准的制定已经极大地推动了免疫治疗评价的发展[1,4],但随着免疫治疗制剂品种与机制的日渐丰富,疗效评价标准也需要相应的调整和完善。三是生物标志物。生物标志物的选择与药物研发本身同等重要,对于靶向抗体药物,需要合适的分子标志物来预测治疗是否适用以及患者获益程度。围绕着免疫检查点抗体,除了以相应分子的表达水平作为依据外,诸如肿瘤突变负荷(TMB)、肿瘤边界CD8+ T细胞浸润数量等生物标志物也在探索中。四是耐药性和安全性的监测。从4个已获批的免疫检查点抗体的研究结果看,总体不良反应较小,但仍需密切关注细胞因子风暴以及长期免疫风险等。
尽管肿瘤免疫检查点抗体药物取得巨大成就,但临床上获益的患者仍是少数。究其原因,除了要深入研究用药标志物以提高有效率外,更重要的是如何克服肿瘤微环境的免疫抑制问题。该问题的解决是肿瘤免疫治疗取得决定性突破的核心。针对这一问题,采用的策略主要有前述不同作用机制的免疫治疗靶点抗体的联合应用或与其他疗法的联合应用,以及积极开发纠正肿瘤局部免疫抑制的新靶点。对于前者,已有多项临床研究证实,CTLA-4和PD-1抗体(ipilimumab与nivolumab)的联合用药能够使晚期黑色素瘤的客观缓解率达到53%~61%,显著优于单一用药(10%~40%)[5-7]。CTLA-4和PD-1虽然均在T细胞上表达,但两者机制却完全不同。CTLA-4通过与CD28竞争结合CD80/CD86,阻断CD28的共刺激信号,抑制T细胞的活化;而PD-1在活化的T细胞上高表达,被PD-L1结合后会抑制T细胞的活性和细胞毒性。理论上来说,通过合理的选择靶点与机制,达到疗效的协同,从而增强缓解率,延长响应持续时间,激活抗肿瘤免疫记忆是可以实现的,Teng等已就肿瘤免疫治疗的联合用药方案作了详细的论述[3]。目前,多项免疫治疗抗体与常规疗法以及与其他免疫治疗制剂联合用药的临床研究正在进行。后者主要包括抑制M1→M2巨噬细胞类型转换、抑制效应性T淋巴细胞→Treg细胞的类型转换、抑制肿瘤内部免疫抑制细胞(Treg、MDSCM2、巨噬细胞、肿瘤相关成纤维细胞等)的功能、抑制免疫抑制性细胞进入肿瘤内部、阻断免疫抑制细胞因子功能、破坏肿瘤赖以生存的肿瘤基质等机制,涉及的靶点主要有CD25、Gr-1、CXCL12/CXCR4、CSF1/CSF1R、TGF-β、IL-10、IL-35和EphA3等[8-9],上述靶点将是肿瘤免疫治疗抗体研发的新热点。
1.2 白介素家族
白介素(interleukin,IL)是一类重要的细胞因子,有约40个家族成员,结构各异,功能多样,涉及细胞的增殖、分化、成熟、存活以及趋化(IL-8和IL-16)等。受体广泛分布,有超过20种白介素共用三类受体亚基:γc、gp130和βc,部分白介素彼此共享受体亚基。研究表明,白介素与类风湿性关节炎(RA)、银屑病、哮喘、炎性肠病(IBD)、系统性红斑狼疮(SLE)、I型糖尿病以及其他一些炎症性疾病存在广泛的相关性,呈“一种疾病与多种白介素分子相关,一种白介素分子与多种疾病相关”的特点。以银屑病为例,已见报道的相关白介素成员就有IL-1、IL-8、IL-17、IL-18、IL-19、IL-20、IL-22、IL-23、IL-24等。
配体-受体相互作用的广泛交叉以及疾病相关性的复杂性无疑给以白介素及其受体为靶点的药物研发带来了巨大的挑战。尽管如此,靶向白介素及其受体的抗体药物(以下简称“白介素抗体”)研发热度不减。2016年FDA新批的7个抗体药物中,白介素抗体占3个。从2014~2016年获批新抗体数量来看,白介素抗体势头良好,依次为2014年1个、2015年2个、2016年3个。截至2016年年底,上市抗体药物中,白介素抗体已累计达到11个,另外还有超过10个处于临床后期研究阶段,共覆盖了12个白介素靶点(表2)。市场规模方面,2015年销售额达到10亿美元以上的靶点有12个,其中白介素占2个,分别是IL-12/23(24.74亿美元)和IL-6R(14.9亿美元)。目前,白介素抗体在银屑病、RA、哮喘等疾病治疗方面取得了不俗的成绩。以IL-17A单抗Cosentyx为例,其在一项纳入334例轻至重度银屑病患者的临床试验中,成功达到16周PASI(银屑病面积和严重程度指数)90优效的主要临床终点,且52周维持PASI 90~100的患者比例接近80%。而伴随着多个IL-17、IL-6和IL-12/23抗体的加入,传统TNF-α抗体的RA和银屑病市场也受到巨大的挑战和冲击。
白介素抗体药物的成功,不仅为临床用药提供了更多样的选择,同时也为白介素与疾病相关的基础研究提供了充分的临床试验数据。
白介素抗体的研发一方面仍需进一步加深相关基础领域的研究,开发更多有效的靶点,扩展应用范围。例如,一些白介素与肿瘤的发生、发展或预后关系密切,如IL-2、IL-3、IL-8、IL-10、IL-12、IL-15、IL-24、IL-34和IL-35等,可能成为扩展白介素抗体应用领域的新靶点。另一方面,也需要立足联合用药、双特异性抗体等策略方法,为临床用药提供更为丰富的选择。
1.3 其他热点靶标
除了前述众多肿瘤免疫治疗相关靶点和白介素家族的成员外,近年来围绕前蛋白转化酶枯草溶菌素(PCSK9)、降钙素基因相关肽(CGRP/CGRP受体)、β淀粉样蛋白(Aβ)等靶点开展的抗体药物研发显得尤为突出(表3),多个趋化因子受体(如CCR2、 CCR5、CXCR4)的抗体也初露端倪。同时,针对如TNF-α、VEGF/VEGFR、Her2、CD20等明星靶点的药物研发仍是热度不减。另外,针对病原微生物及其毒素的抗体药物研发将在近期取得巨大进步。
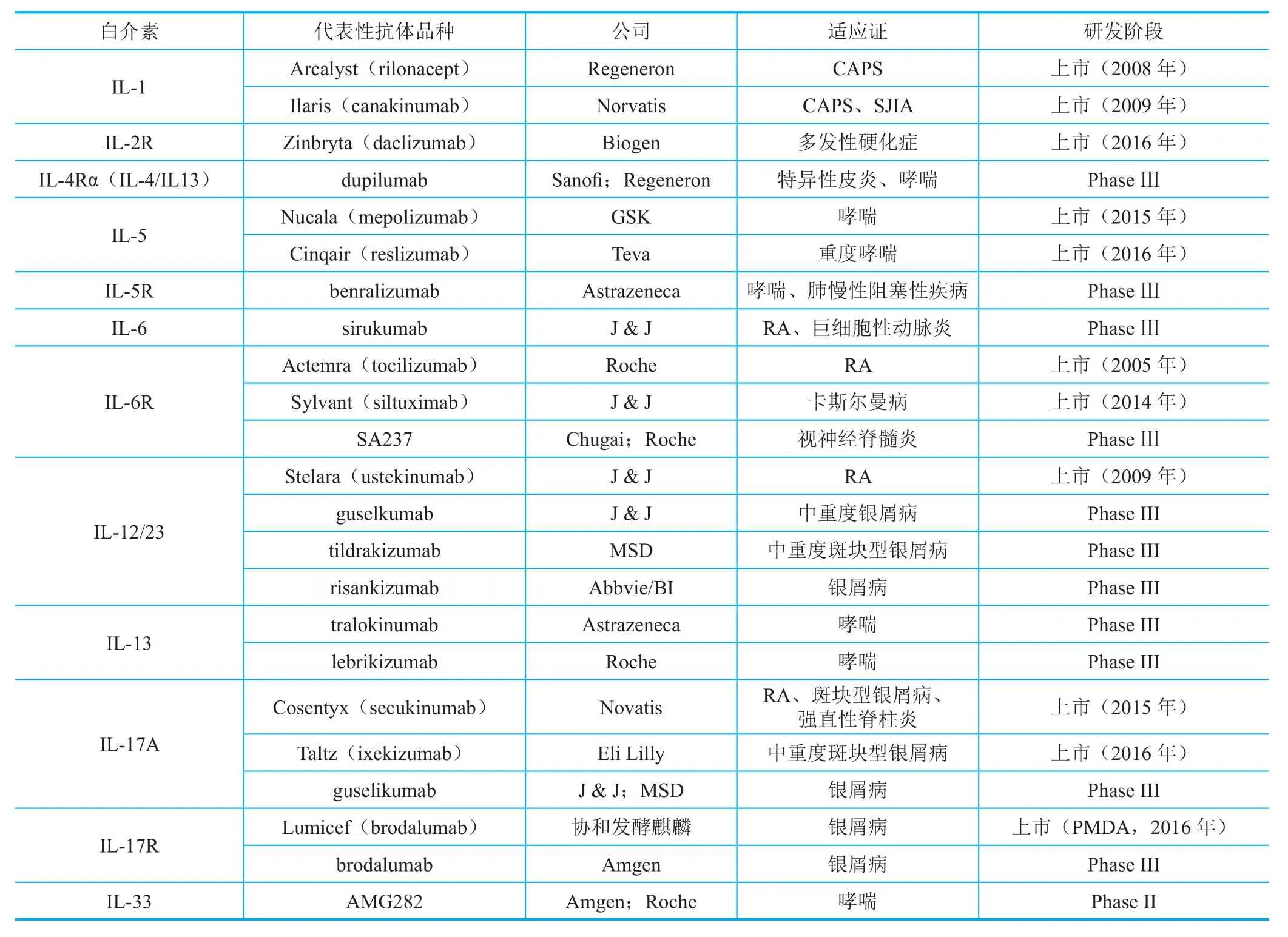
表2 已上市/临床后期在研的白介素抗体药物
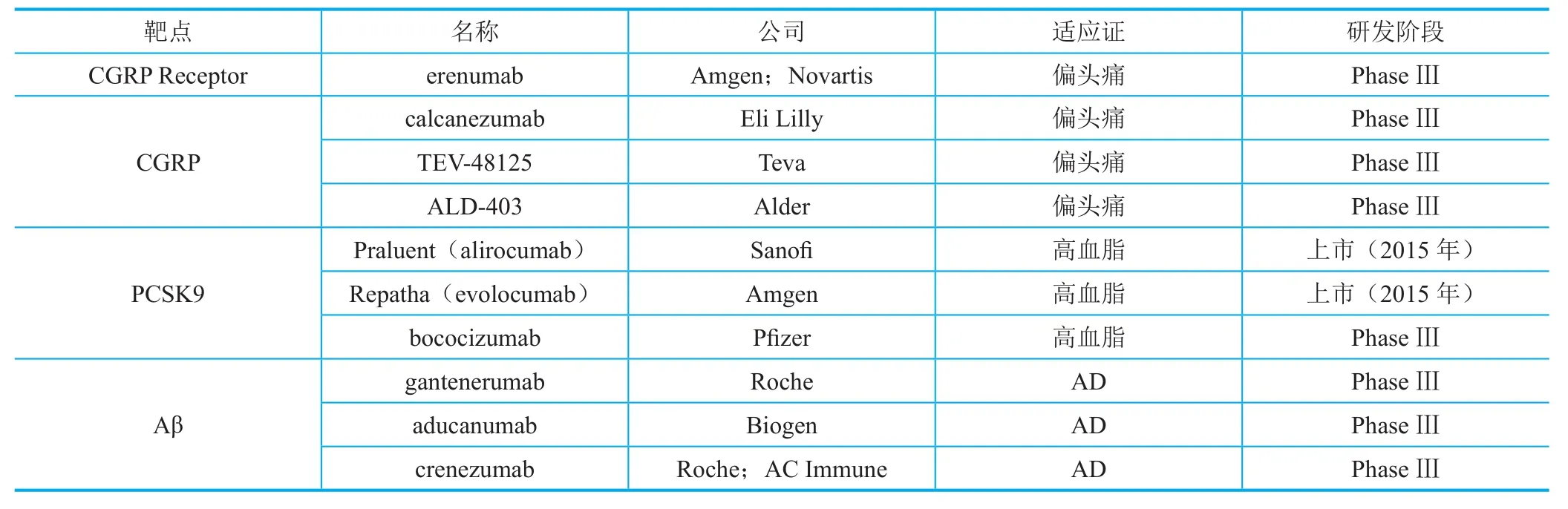
表3 其他热点靶标在研抗体药物统计
2 技术热点分析
基于对抗体结构和功能关系的充分认知与灵活运用,近年来抗体工程技术领域进步明显,多种技术平台的发展为抗体药物的研发提供了多样化的思路和手段。
2.1 双特异性抗体技术平台
双特异性抗体(bispecif c antibodies,bsAbs)是采用抗体工程和基因工程技术(或体外偶联)构建的能够特异性结合两种抗原或两个表位的重组抗体/抗体片段。双特异抗体作用机理灵活,目前临床上应用双特异性抗体的机制主要分为免疫细胞的募集与活化、分子阻断与/或通路抑制的协同、分子递送与转运、蛋白复合物连接等四大类、十多个具体分支[10]。例如,强生在研的EGFR×cMet 双特异性抗体JNJ-61186372,临床前结果显示,其能够同时抑制EGFR与cMet的磷酸化及下游信号通路的激活,肿瘤杀伤和抑制效果远优于单一用药,耐受性较联合用药优势明显,且在食蟹猴模型中未见其他EGFR靶向药物常见的不良反应,极大地克服了目前EGFR靶向药物的耐药性和毒副作用问题,将很大程度地扩展临床应用的范围。又如罗氏在研的凝血因子Ⅸa×凝血因子Ⅹ双特异性抗体RG6013,通过两臂的作用弥补了A型血友病患者体内缺失的凝血因子Ⅷa的功能,将凝血因子Ⅸa和Ⅹ连接形成复合物,介导正常的下游反应,克服了外源补充凝血因子Ⅷa疗法中免疫排斥、半衰期短以及生物利用度低等问题。RG6013是目前唯一一个处于Ⅲ期临床的在研双特异性抗体,被FDA授予A型血友病治疗的突破性疗法资格。理论上来说,双特异性抗体能够实现诸多单抗药物或联合用药不能兼具的功能,也能够适用于单抗药物的全部治疗领域,应用前景广阔。
双特异性概念的提出与单克隆抗体药物的诞生几乎是同时的,但直到2009年,第一个双特异性抗体药物Removab(catumaxomab)才获得欧洲药品管理局(EMA)批准上市。而美国FDA到2014年才批准了首个双特异性抗体药物Blincyto(blinatumomab)。巨大的时间落差一方面是受制于双特异性抗体功能特征所要求的结构特征的实现难度,即可制备性。对于IgG类结构的双特异性抗体,其技术难点在于如何解决错配问题,包括重链-重链和重链-轻链的错配。以Genetech公司为例,在早期的研究中,针对两个单抗共表达制备双抗得率仅10%的问题,通过knobsinto-holes技术(KiH),即对两个针对不同靶点的抗体CH3相互作用界面的氨基酸残基进行突变,构建类似于“钮”(knob)和“扣”(hole)的咬合结构,成功克服了重链间错配的问题,将目的抗体的得率提高到了25%;随后直到2011年CrossMab技术诞生,才解决了轻重链间错配的问题,真正完成了双特异性抗体的分子制备和产业化实现[11]。双特异性抗体制备技术的难度由此可见一斑。另一方面,双特异性抗体的研发也受制于结构调整导致的成药性问题,包括分子稳定性、免疫原性、药代动力学(PK)特征等关键性成药因素。例如,早期采用片段化、单链等形式构建的双特异性抗体分子大多存在稳定性和PK的问题。以采用BiTE技术构建的Blincyto为例,尽管已被批准用于急性淋巴细胞白血病,但其体内半衰期不到1h,患者需要通过输液泵持续静脉给药,顺应性差,一定程度上限制了其临床应用。
目前,已发展出20多种双特异性抗体技术平台,有110余个双特异性抗体在研,其中超过50个双特异性抗体已进入临床研究阶段(Ⅲ期临床1个,Ⅱ期12个,Ⅰ期或Ⅰ/Ⅱ期41个)。现阶段的双特异性抗体类型按结构可大致分为IgG类结构和非IgG类结构,其中IgG类结构又可分为对称(symmetric)和非对称结构(asymmetric)两类,对应的代表性双特异性抗体技术平台如表4所列。对于这些种类繁复的技术平台,除了考虑前述的可制备性和成药性问题之外,另外一个重要的考量因素是其平台通用性,即能否实现任意两个抗体的组配。通用性高的技术平台具有的显著优势是能够充分利用临床上已被验证的抗体,这无疑是双特异性抗体研发的资源宝库。
现阶段的双特异性抗体技术平台各有特色,技术成熟的也不少,但真正能够很好地兼顾可制备性、成药性和通用性三项要素的寥寥无几。因此,从技术角度来看,一方面是现有平台仍有改进空间,另一方面对创新的技术平台需求仍很强烈。从药物研发的情况来看,目前在研双特异性抗体的适应证以肿瘤为主,靶点多样性不足,更多新的靶点组配和作用机理是双特异性抗体药物研发需要着重发掘的领域。例如双特异性抗体在肿瘤免疫治疗领域的应用,基于双
特异性抗体的跨越血脑屏障(BBB)的药物递送等。从应用空间扩展来看,糖基工程改造、优化FcRn结合特性等技术手段同样适用于双特异性抗体的改造,Azymetric EFECT技术平台即是很好的案例。

表4 代表性的双特性抗体技术平台

表4 代表性的双特性抗体技术平台 (续表)
2.2 其他热点技术
传统的技术热点领域还包括抗体-药物偶联剂(antibody-drug conjugates,ADCs)、糖基工程抗体等。
目前,上市的ADCs仅有2个,罗氏的Kadcyla(transtuzumab emtansine,2013年)与西雅图基因的Adcetris(brentuximab vedotin,2011年)。从市场规模看,Kadcyla在2015年销售额仅为7.69亿美元,2016年销售额为8.23亿美元,呈增长乏力之势。与市场表现截然不同的是,目前临床在研的ADCs超过60个,其中,有10个处于后期临床研究阶段。ADCs的研发集中在偶联物(化学药物)、连接物(linker)的开发以及抗体与靶点的选择三个方面,近年来取得了长足的进步,如非天然氨基酸介导和酶切介导的定点偶联技术,亲水性高且细胞穿透能力低的偶联物(如Amanitin类RNA聚合酶抑制剂),以及多种新形式的可裂解连接物[12-13]。此外,基于双特异性抗体以及PD-L1抗体的ADCs也在研究中。当然,ADCs面临的诸多挑战依旧存在,如连接稳定性、制剂开发、linker残留、检测手段以及监管法规等,革命性的突破仍值得期待[14]。
糖基工程抗体研究领域,目前已发展出多种修饰改造平台,以岩藻糖缺失以提高抗体药物的ADCC效应为主。已上市抗体有3个,分别是vedolizumab(Takeda)、mogamulizumab(Kyowa Hakko Kirin)以及obinutuzumab(Roche),均为ADCC增强抗体。
此外,诸如pH高敏感型(pH-sensitive)抗体平台技术、纳米抗体(nanobody)、HexaBody平台的IgG六聚体等一系列探索性研究也正在开展,为抗体药物的研发提供了广阔的发展空间。
3 治疗领域热点分析
肿瘤和免疫相关疾病是抗体药物研发的传统热点领域。神经退行性疾病作为现代医学最难以攻克的领域之一,也早已成为抗体药物研发的热点。但与免疫疗法为肿瘤治疗带来曙光形成鲜明对比的是,被寄予厚望的礼来的阿尔茨海默症(AD)治疗药物Aβ单抗solanezumab在III期临床中未达到主要临床终点,宣告失败,AD治疗再次遭遇“滑铁卢”。不过,后续多个Aβ单抗(表3)仍在继续推进,结果值得期待;同时,靶向Tau等多种不同机制的抗体也在积极开展AD治疗的临床研究。
此外,近年来针对感染性疾病(如炭疽、艰难梭菌、埃博拉等)、心血管疾病(如高血脂症)、神经系统疾病(如偏头痛)、Ⅱ型糖尿病、骨相关疾病(如骨质疏松、肿瘤骨转移)等领域多种适应证的抗体药物研发同样可圈可点,并已在一些领域取得突破性进展。在罕见病的治疗方面,抗体药物也逐步崭露头角。
抗体药物历经30余年的发展,已经成为最为火热的药物研发领域之一。随着人类对疾病致病机制研究的不断深入,以及抗体药物研发产业链的不断完善,抗体药物的研发热点将不断涌现,新的靶点将不断被挖掘出来,新的适应证也将得到逐渐扩展,为更多的患者带来福音。
[1] HOOS A. Development of immuno-oncology drugs-from CTLA4 to PD1 to the next generations[J]. Nature Reviews Drug Discovery,2016,15(4):235-247.
[2] LEE L,GUPTA M,SAHASRANAMAN S. Immune checkpoint inhibitors:an introduction to the next-generation cancer immunotherapy[J]. Journal of Clinical Pharmacology,2016,56(2):157-169.
[3] SMYTH M J,NGIOW S F,RIBAS A,et al. Combination cancer immunotherapies tailored to the tumour microenvironment[J]. Nature Reviews Clinical Oncology,2016,13(3):143-158.
[4] HOOS A,BRITTEN C M,HUBER C,et al. A methodological framework to enhance the clinical success of cancer immunotherapy[J]. Nat Biotechnol,2011,29(10):867-870.
[5] WOLCHOK J D,KLUGER H,CALLAHAN M K,et al. Nivolumab plus ipilimumab in advanced melanoma[J]. The New England Journal of Medicine,2013,369(2):122-133.
[6] TOPALIAN S L,SZNOL M,MCDERMOTT D F,et al. Survival,durable tumor remission,and long-term safety in patients with advanced melanoma receiving nivolumab[J]. Journal of Clinical Oncology,2014,32(10):1020-1030.
[7] HODI F S,O'DAY S J,MCDERMOTT D F,et al. Improved survival with ipilimumab in patients with metastatic melanoma[J]. The New England Journal of Medicine,2010,363(8):711-723.
[8] GU L,MOONEY D J. Biomaterials and emerging anticancer therapeutics:engineering the microenvironment[J]. Nature Reviews Cancer,2016,16(1):56-66.
[9] MAHONEY K M,RENNERT P D,FREEMAN G J. Combination cancer immunotherapy and new immunomodulatory targets[J]. Nature Reviews Drug Discovery,2015,14(8):561-584.
[10] KONTERMANN R E,BRINKMANN U. Bispecific antibodies[J]. Drug Discovery Today,2015,20(7):838-847.
[11] KLEIN C,SCHAEFER W,REGULA J T. The use of CrossMAb technology for the generation of bi- and multispecif c antibodies[J]. mAbs,2016,8(6):1010-1020.
[12] CHUDASAMA V,MARUANI A,CADDICK S. Recent advances in the construction of antibody-drug conjugates[J]. Nature Chemistry,2016,8:114-119.
[13] GAO W,ZHANG J,XIANG J,et al. Recent advances in site specif c conjugations of antibody drug conjugates(ADCs)[J]. Current Cancer Drug Targets,2016,16(6):469-479.
[14] KAMATH A V,IYER S. Challenges and advances in the assessment of the disposition of antibody-drug conjugates[J]. Biopharmaceutics & Drug Disposition,2016,37(2):66-74.
Hotspots analysis of antibody drug R&D
DU Peng,SUN Zhiwei
Institute of Biotechnology, Academy of Military Medical Sciences, Beijing 100071, China
This paper reviews the hotspots of targets, technologies and indications in current antibody drug research and development. The emphasis is on the analysis of immunotherapy antibodies, interleukin antibodies as well as bispecif c antibodies about their research actualities, characteristics and diff culties and application prospects.
immune checkpoint; cancer immunotherapy; interleukin; bispecific antibodies; antibody-drug conjugates
10.3969/j.issn.1674-0319.2017.02.008
杜鹏,理学博士,军事医学科学院生物工程研究所助理研究员。主要从事抗体工程研究,抗多亚型IFN-α抗体项目主要完成人,参与多个抗体药物研发项目的分子设计工作。E-mail:dudedu@sina.com
