竹纤维细胞壁研究进展
2017-04-20胡凯莉黄艳辉姚春丽类延豪
胡凯莉 黄艳辉 姚春丽 类延豪 赵 畅
(北京林业大学材料科学与技术学院,北京,100083)
综 述
竹纤维细胞壁研究进展
胡凯莉 黄艳辉*姚春丽 类延豪 赵 畅
(北京林业大学材料科学与技术学院,北京,100083)
竹纤维细胞壁的多壁层构造是竹材卓越性能的决定因素,也是难以攻克的基础问题。文中阐述了竹纤维细胞壁的超微结构、力学性能和化学特征,以深入探讨竹纤维细胞壁的多壁层构造,同时,总结了关于竹纤维细胞壁研究的概况,以期为读者深入认识竹材、了解竹纤维细胞壁及其相关理论和应用提供参考。
竹纤维细胞壁;微纤丝角;多壁层构造;力学性能;化学组成
竹子是生长迅速和具有良好机械性能的天然复合材料。目前,全球共有竹类70余属1200多种,竹林面积2200万hm2,年产竹材2000多万t,广泛分布于热带和亚热带国家[1]。竹材是重要的非木材料和优异的木材替代品,广泛应用于造纸、建筑、家具、燃料等领域[2-3]。竹材主要由薄壁细胞、纤维细胞和疏导组织(导管和筛管)组成,分别约占52%、40%和8%,不同竹种间占比会略有不同[4]。竹纤维赋予了竹材高强、高韧、高延展性等卓越的力学特性。因此,研究竹纤维细胞壁对深入了解竹材宏观性能与超微结构间的关系至关重要。
本文系统地阐述了竹纤维细胞壁的超微结构、力学性能、化学组成及特征,并总结了近几十年来的研究概况,以便读者更好地了解竹纤维细胞壁的结构和性能。
1 超微结构
竹材的纤维细胞一般以维管束鞘或分离的纤维束形式存在于竹材中,形态特点是形长、两端尖、纵向排列。竹纤维的细胞壁上有少量小而圆的单纹孔,有明显的节状加厚,壁厚一般随竹龄而增长,属韧性纤维。一般来讲,竹纤维细胞的平均长度1.5~4.5 mm,平均宽度为11~19 μm,长宽比大,是制浆造纸工业的优良原料[1,5]。从纤维的性质来看,丛生竹作为纤维原料优于散生竹,因为丛生竹的纤维长度和宽度都较大[5- 6]。
1.1 壁层构造
细胞壁是构成竹纤维细胞的实体物质,是竹材力学、化学各项性能的决定因素。竹纤维细胞的壁层构造比木材更为复杂,是初生壁和薄厚交替的多层次次生壁复合而成的超微结构[7]。因此,关于竹纤维细胞壁超微结构的研究一直是研究者关注的重点。早在1950年,Preston等[8]利用X射线衍射技术开展了竹纤维细胞壁超微结构方面的研究。Tono等[9]利用化学处理的膨胀作用研究了竹纤维的多壁层结构。Parameswaran等[10]利用透射电镜(TEM)研究了竹纤维细胞壁的多壁层构造,提出了如图1所示的竹纤维细胞壁的结构模型;首先,厚层微纤丝基本沿纤维轴向取向,而薄层的与纤维轴向垂直;其次,与厚层相比,薄层的木质素和多糖含量、木质化程度都偏高。Murphy等[11]利用偏振光显微镜研究得出,纤维在维管束中的位置是影响纤维细胞壁层次的显著因素,同时,细胞壁的层次还受其在竹壁中的位置和竹龄的影响,他将竹纤维壁层结构分为4类:①略有亮光,无明显偏光亮层;②1/3区域的壁内有1~3层亮层;③达到6层均匀间隔的偏光亮层;④众多均匀的偏光亮层。该实验中最多观察到18层偏振光亮层和暗层[11],与Parameswaran等[10]提出的观点一致。贺新强等[12]利用透射电镜对毛竹纤维细胞次生壁的形成过程进行了深入研究,发现随着次生壁的加厚和木质化,细胞壁逐渐形成了宽窄间隔排列的多层结构。甘小洪等[13]根据实验观察认为,在每年3~6月,竹材进入生长旺盛期,之后随温度的变化,呼吸作用加强,生长放缓;根据一年中生长速度的不同,他提出了竹纤维细胞次生壁的薄厚交替的壁层构造类似于树木年轮结构的生长规律。
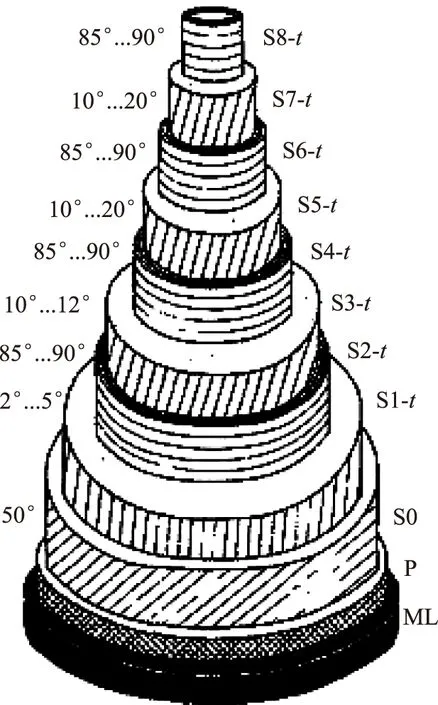
图1 竹纤维细胞壁结构模型图[8]
1.2 微纤丝角
Abe等[14]研究发现,S2层微纤丝形成之时恰是管胞停止膨胀的时候,这表明针对纤丝角的探索,对研究包括竹材在内的植物的生长特性具有重要意义。竹纤维细胞具有厚薄交替的多壁层构造,各层的沉积方向不同,与细胞主轴方向有一定的微纤丝角(MFA)。目前,关于MFA的研究主要集中于微纤丝的排布和变异规律方面。
Parameswaran等[10]利用TEM对竹纤维细胞壁的微区结构进行了观察,指出纤维厚层的MFA由胞间层向细胞腔方向有增大趋势。他认为次生壁的薄层夹角为85°~90°,与轴向近于垂直;厚层的MFA与主轴呈20°~30°,与纤维轴向近于平行;且MFA随层数的变化而变化(见图1)。在微纤丝的走向表征中,原子力显微镜(Atomic Force Microscope,AFM)是近年来刚刚兴起的表征方法。自Kirby等[15]首次利用AFM从纳米尺寸研究植物纤维细胞壁以来,AFM就以其较高的分辨率、简便的制样方法、较强的可操作性而备受关注。2008年,余雁等首次将该技术应用到竹材纤维细胞壁的微区结构表征中,观察到毛竹纤维初生壁微纤丝的无序排列,而次生壁层的微纤丝呈高度的定向排列。随后Zou、陈红等[16-17]也使用AFM研究了竹纤维细胞壁内微纤丝的排布。偏振光显微镜技术是研究竹材MFA的常用方法,然而,它仅限于测定纤维试样MFA的平均值。目前,随着该技术的发展,现已开发出Abrio液晶偏光影像系统,其附带功能强大的可定量图像延迟值(Retardance value)的LC-Polscope图像系统。Abraham等[18]成功利用该系统,对南洋杉(Triticumturgidum)纤维细胞壁内各层的MFA进行了量化研究。笔者所在课题组正尝试将该技术应用于测量结构更加复杂的竹纤维细胞壁的各层MFA。
X射线衍射法是研究竹材MFA平均值及其变异规律的常用方法。余雁等[19]研究了毛竹纤维MFA随时间和空间的变异规律:从空间径向分析,MFA的差异不大;从空间轴向分析,MFA与垂直高度成反比,绝对值差不超过1°;从竹龄观察,MFA与竹龄成正比。Wang等[20]采用大角X射线衍射技术研究毛竹的微纤丝走向,发现从竹黄到竹青,MFA平均值从40°逐渐降至10°,其原因可能与该方向的薄壁组织细胞的密度变化相关。此外,文献[21-22]也报道了相关研究。然而,由于受X射线光斑尺寸的限制,直接用X射线测竹纤维细胞壁的MFA方面的研究尚处于尝试阶段。
1.3 结晶度
竹纤维有结晶区和非结晶区之分,随结晶度的变化,各项物理性质也随之发生变化。其中,与结晶度正相关的有硬度、弹性模量、抗张强度、密度及尺寸稳定性,负相关的有伸长率、润胀度、保水值、柔软性、染料吸着度及化学反应等[23]。
在竹纤维发育过程中,结晶度随细胞壁发育和木质化过程而变化。甘小洪等[13]开展了毛竹(Phyllostachyspubescens)纤维细胞结晶度随时间变化的研究工作,根据细胞壁加厚和木质化的不同阶段,把结晶度变化分为增加、下降、趋于稳定3个阶段:首先,从开始至次生壁形成的阶段(第1年10月—第2年6月),结晶度有逐渐增大的趋势,在此阶段,纤维素的有序沉积是影响结晶度的主要因素;随后,进入次生壁加厚阶段(第2年7月—第5年),木质素的沉积增加,此时,木质素的沉积成为影响结晶度的主导因素;最后,进入稳定阶段,次生壁加厚趋势下降,结晶度也随之平稳。在纤维细胞壁与其他类型细胞结晶度的对比研究中,Abe等[24]通过X射线衍射技术测得,在干燥状态下,同株毛竹纤维细胞壁和薄壁细胞壁的结晶度几乎相同,还认为这2种细胞壁的纤维素的合成过程相同。蒋建新等[25]采用红外光谱与X射线衍射技术对比分析了不同竹种间纤维素的结晶度,发现结晶度由大到小依次为唐竹、茶秆竹、慈竹、黄金间碧玉竹和厚壁毛竹;其中,唐竹的纤维素结晶度最大为76.1%,毛竹的纤维素结晶度最小为67.7%;另外,经过蒸汽爆破处理后慈竹纤维素结晶度从72.3%增至73.3%。
2 力学性能
竹类作为单子叶植物,无次生形成层,进而无径向次生长。因此,竹子的几何优化和机械负载的能力会受到严重影响。在几何机械负载能力不足的情况下,竹类却拥有优异的力学性能:平均抗拉强度为木材的2倍、单位重量抗拉强度为钢材的2~3倍以及极强的抗弯、抗横纹破坏的能力等,素有“植物钢铁”的美誉[17]。早在20世纪90年代,冼杏娟等[26]研究发现,竹材特有的纤维结构是其优良力学性能的关键:竹材纤维厚壁细胞沿轴向整齐排列,具有较高的刚度和挺度,竹纤维含量从竹黄部分到外层竹青部分逐渐增加,使竹材抗断裂性能优异。
2.1 竹纤维静态和动态力学性能
目前,关于竹纤维静态性能表征主要集中于弹性模量、抗压强度、纵向拉伸模量、硬度等方面的研究;而动态力学表征主要集中于蠕变、松弛、储能模量、损耗模量、损耗因子等动态黏弹性和形变特性等方面的研究。
静态力学方面,单根纤维拉伸技术是重要的研究方法。1971年,Page等[27]在《Nature》上首次提出了针叶材管胞的测定方法,并用该方法得到了针叶材管胞的力学性能。随后,植物单纤维力学测试成为力学研究的重要方法。黄艳辉等[28-29]利用该技术研究了毛竹单根纤维的纵向力学性质,测得毛竹纤维细胞壁的纵向弹性模量为21 GPa,而硬度变化范围为0.4665~0.5603 GPa,同时,还发现靠近竹青位置处半年生毛竹纤维细胞壁的纵向力学特性能够满足工业需求。王戈等[30]也进行了竹纤维和纤维束拉伸测试及纵向力学性能研究,发现竹纤维细胞壁的纵向力学性能比横向大;基于细胞之间的弱界面作用,研究还发现,与单根纤维相比,纤维束的拉伸强度和弹性模量减少量分别为50%和20%。Yu等[31]对比研究了11种竹材的单根纤维的纵向力学性能,结果表明竹纤维的纵向拉伸模量和抗张强度显著高于木纤维。断裂特性是研究单纤维力学的重要部分,也是决定纤维材料性能的重要因素。纤维拉伸至断裂时会产生破坏应变,不同竹龄单根纤维的平均破坏应变相对集中在3.63%~5.74%、平均值为4.85%[29]。
近些年发展起来的纳米压痕技术是研究竹纤维细胞壁力学性能的另一重要方法。Wimmer等[32]应用该技术研究针叶材管胞中次生壁S2层与胞间层纵向硬度的差异,开启了纳米压痕技术应用的先河。王戈等[30]在竹材的压痕实验中发现,竹纤维细胞壁的纵向弹性模量和硬度平均值分别为16.01 GPa和0.3600 GPa,横向弹性模量和硬度平均值分别为5.91 GPa和0.391 GPa,相较其他静态力学性能,硬度变化不大。Wang等[33]将拉曼光谱仪结合纳米压痕技术进行毛竹纤维细胞壁力学性能的表征,认为轴向纤维素使纤维的纵向弹性模量最大化,细胞壁增厚和木质化过程增加了横向的刚性,进而防止了压缩载荷下竹纤维的压曲,这解释了在几何机械负载能力不足的前提下,比木材细得多的竹秆为何能拥有卓越的抗弯曲性。Ren等[34]通过峰值力定量纳米力学成像技术研究了4年生毛竹纤维细胞壁的弹性模量,得到复合中间层和细胞次生壁的弹性模量分别为(14.4±3.6)GPa和(21.3±2.9)GPa,该结果与纳米压痕技术所得结果吻合。
动态力学性能研究方面,竹纤维细胞壁的储能模量Er′、损耗模量Er″、损耗角正切(tanδ=Er″/Er′),均随温度的升高而减小。归其原因,有学者认为可能是基于半纤维素的降解融化。基于纳米动态力学分析得出,随竹纤维细胞壁动态缩进的谐波频率的变化,3种动态黏弹数据则表现出不同类型的变化规律。储能模量Er′随着频率的增大稳步上升,而损耗模量Er″和损耗角正切tanδ则显著下降[35]。Zhang等[36]解释这是由于不同频率下分子链的作用模式不同:在低频率中,运动相对缓慢的部分大分子链是储能模量Er′的主体;在较高频率时,只有分子链的局部运动,主链的动作几乎被冻结,储能模量Er′随之增大,导致竹纤维细胞壁刚性增强;而随着频率增大,纤维细胞壁短时间硬化加剧而引起的分子链重排增加,Er″和tanδ随之下降。
2.2 不同含水率和热处理对纤维细胞壁力学性能的影响
毛竹纤维的水分吸着等温线呈反“竹纤型”;20℃时,其饱和点含水率为34.07%[37]。在纤维饱和点以下,不同含水率与纤维细胞壁S2层各项力学性能变化关系密切,数据表明,竹材的次生壁S2层的纵向弹性模量、拉伸强度、硬度与含水率呈负线性相关特性,而断裂伸长率、压入深度、残余变形率、最大变形量与含水率呈正线性相关特性,进一步证明了随含水率的增大,细胞壁的塑性增强,此外,MFA与含水率也呈正线性相关特性[38]。
Anokye等[39]研究了滇竹(Gigantochloalevis)和龙头竹(Bambusavulgaris)不同水平高度含水率的变化,提出竹材尺寸稳定性与含水率密切相关。对不同竹龄竹纤维细胞壁的力学性能研究发现,纵向拉伸弹性模量、抗拉强度、断裂伸长率都与含水率紧密相关。随着含水率的增大,纵向拉伸弹性模量和抗拉强度的降低幅度为2.5年生>1.5年生>4.5年生>0.5年生,其中,2.5年生降幅最大可能是其半纤维素含量最高导致;同时,断裂伸长率的增幅为2.5年生>0.5年生>4.5年生>1.5年生[38]。
此外,不同热处理温度对竹纤维细胞壁的力学性能也有很大影响。当热处理温度从70℃升至180℃,竹纤维的断裂伸长率逐渐提高,但断裂强度却呈平滑下降趋势,且下降显著[40]。当热处理温度由180℃升至200℃时,竹材的平均密度和质量下降;当热处理温度高于180℃时,竹纤维细胞壁的弹性模量变化微小,但硬度明显增大,此外,经过热处理的竹纤维细胞壁的动态力学性能——损耗模量和储能模量,随着热处理温度的升高而降低[35]。
3 化学特征
相对于竹纤维细胞壁力学性能的研究,其化学性能研究才刚刚起步。从组成上看,竹纤维细胞壁主要是由纤维素(40%~50%)、半纤维素(20%~30%)、木质素(15%~25%)三大组分组成[41- 42]。其中,纤维素是由吡喃式葡萄糖通过β-1,4糖苷键连接成的链状高分子结构,其结构特征和性质已较为清楚。为了解木质素和半纤维素在竹纤维细胞壁中的精确分布,研究人员采取如下诸多尝试。
3.1 木质素分布和木质化过程
Suzuki等[23]采用冰冻蚀刻电镜技术(RFDE),研究了罗汉竹木质化和未木质化的纤维细胞壁的三维纳米结构,其中,未木质化纤维细胞的初生壁微纤丝之间有较小的孔隙,次生壁含裂缝状孔隙,而木质化的次生壁并没有类似的孔隙结构;经过脱木质素实验处理过后,纤维细胞次生壁显示了类似未木质化次生壁的孔隙结构。Lybeer等[43]通过透射电镜和紫外分光光度计描述了木质素结构单元在不同部位的分布情况,对比了热带竹种滇竹属(Gigantochloalevis)和温带竹种毛竹属的木质化情况,发现两者纤维细胞壁构造差异较大,滇竹属纤维细胞壁S2层木质素中的对-香豆酸和阿魏酸分布更广泛;该属早熟纤维在280 nm处出峰(愈创木基),晚熟的纤维在310~320 nm处有肩峰,而毛竹属均在280 nm处出峰。
上述这些方法仅仅是测量细胞某点的信息,为了获取更全面的化学信息,学者又进行了多种尝试。近几年,新兴起的激光共聚焦拉曼显微技术(Laser confocal Raman microscopy)能够实现在线无损检测,并以其高分辨率,成为了结构化学分析的有力工具[44- 45]。Wang等[33]采用共聚焦拉曼显微技术,研究2月生毛竹纤维素和木质素在纤维细胞壁中的分布情况,发现木质素与纤维素的光谱带区分相当明显,且纤维细胞次生壁表现出高水平的木质化,但是,木质素相关化合物的分布并不均匀,在细胞壁上从外壁向内逐渐降低,即使在木质化程度较高的细胞角隅,其木质化程度也不均匀,说明2月生毛竹的木质化过程尚未结束。
此外,学者对于木质素含量的时空变异规律、细胞壁各微区木质素组成单元和含量变化等木质化过程也进行了研究。刘波[46]将组织化学染色法结合可见光显微分光光度计技术,对竹纤维细胞在生长发育过程中的木质化过程进行了研究;分别采用Mäule反应和Wiesner反应对材料进行组织化学染色,获知竹纤维细胞中主要含有愈创木基(G型)和紫丁香基(S型)木质素结构单元,从竹龄角度看,S型和G型木质素总量呈先上升(1年生)后下降(1~4年生)的趋势,而木质素径向分布规律随时间变异性较大。韦鹏练[47]采用纳米红外原位成像技术获知竹纤维纳米水平的胞壁木质素分布,并提出木质素和聚木糖在细胞壁中的分布具有良好的协同性。
为研究竹纤维细胞木质素的复杂结构,Wen等[48- 49]通过原位异核单量子相干谱核磁共振技术(HSQC-NMR)对连续处理的氚代溶液溶解的乙酰化和非乙酰化的竹纤维样品的化学成分进行了表征,发现竹纤维细胞木质素中的阿魏酸和对-香豆酸会与细胞壁多糖(β-O- 4、β-β、β-5键等)连接,形成LCC键(苄醚键、苯基糖苷键等);该研究者还通过拉曼光谱检测芳环的共轭结构,测得阿魏酸和对-香豆酸的含量,进而得出木质素的含量。
3.2 半纤维素
半纤维素是把纤维素和木质素紧密连接起来的聚糖混合物。核磁共振结果表明,竹纤维半纤维素分子的主链为(β-1,4)-聚木糖,侧链为a-L-阿拉伯糖或4- O-甲基-D-葡萄糖醛酸,侧链通过α-(1,3)和/或α-(1,2)方式连接到聚木糖分子主链上[50]。在半纤维素中,肉桂酸类物质尤其是阿魏酸,在LCC(木质素碳水化合物连接键)形成过程中,起到重要的交联作用;而半纤维素和纤维素之间无化学键,但存在氢键和范德华力,两者紧密结合,它们之间的相互作用影响了其在制浆造纸、木材改性等领域的应用[50]。
作为三大素中的填充物质,半纤维素对于竹纤维的力学和化学性能有重要影响。Salmén[51]指出,半纤维素的结构和不同部位木质素含量的差异对单根纤维的黏弹性影响较大。Silveira等[52]采用3D-RISM-KH分子理论,获知半纤维素化合物中的碱基是影响初生壁纳米力学性能的重要因素。Suzuki等[53]运用免疫标记技术研究了罗汉竹发育过程,结果表明,纤维细胞壁形成过程中,半纤维素的化学结构和分布都发生了变化;高取代度聚木糖存在于次生壁未木质化阶段之前,相反,低支链聚木糖于次生壁未木质化阶段开始形成并持续存在。陈红[17]通过逐级增加NaOH的浓度,抽提脱除竹纤维细胞壁中的半纤维素;研究表明,随着NaOH浓度的不断提高,竹纤维纵向拉伸模量不断降低,同时,裂断伸长率也有所增大,当NaOH浓度达到25%时,裂断伸长率是未处理的73倍,且断裂方式也从韧性断裂转为脆性断裂;研究结果表明,随着NaOH浓度的提高,纤维素的Ⅰ型结晶逐渐重结晶为Ⅱ型,且竹纤维的纤维素结晶度有一定幅度的提高。
4 结束语
在竹纤维细胞壁的超微结构、纤维细胞壁的力学性能和化学特征等方面,研究者已经取得了较为可喜的进展,但是,受样品本身和表征方法的限制,相关研究仍需要继续深入。
(1)竹纤维细胞多壁层构造的复杂性和制样的困难性导致了竹纤维细胞壁超微结构方面的研究进展比较缓慢。为此,研究者一直在寻求新的更加精密的表征技术,如纳米CT、液晶偏振光显微镜、中子散射、原子力显微镜(AFM)等。但是,直至目前,竹纤维细胞壁各层微纤丝角(MFA)的具体量化仍然是研究的热点和难点。
(2)为探讨竹纤维细胞壁薄层乃至各层的力学性能,研究者采用纳米压痕技术、纳米动态力学分析技术、基于峰值力成像的AFM技术等检测手段对相关性能进行了测定和分析。但是,竹纤维细胞壁薄层的厚度只有100 nm左右,而且竹纤维细胞变异性大、壁层多、制样方法和要求高等,薄层的力学特性仍是一个亟待解决的难题。
(3)以化学处理法、生物处理法(酶解法、真菌降解法)为代表的研究方法,以冰冻蚀刻电镜技术(RFDE)、拉曼光谱仪、紫外显微分光光度计等为代表的表征手段也都已被应用到竹纤维细胞壁的化学表征中。然而,相较超微结构、力学方面的研究,竹纤维细胞壁的化学特性研究才刚刚起步,尤其是竹纤维细胞壁中的半纤维素、纤维素及木质素在各壁层的精确分布,都是亟待研究的课题。
[1] 江泽慧. 世界竹藤[M]. 沈阳: 辽宁科学技术出版社, 2002: 3.
[2] 刘一山, 王修明. 关于竹浆产业发展的思考[J]. 中国造纸, 2013, 32(6): 60.
[3] Dixon P G, Gibson L J. The structure and mechanics of Moso bamboo material[J]. Journal of the Royal Society, Interface, 2014, 11(99): 1.
[4] Grosser D, Liese W. On the anatomy of Asian bamboos,with special reference to their vascular bundles[J]. Wood Science and Technology, 1971, 5(4): 290.
[5] 杨淑敏, 江泽慧, 任海青, 等. 几种散生、 丛生和混生竹材的比较解剖研究[J]. 中国造纸学报, 2011, 26(2): 11.
[6] 马灵飞, 韩 红, 马乃训, 等. 丛生竹材纤维形态及主要理化性能 [J]. 浙江林学院学报, 1994, 11(3): 274.
[7] Huang Y, Fei B, Wei P, et al. Mechanical properties of bamboo fiber cell walls during the culm development by nanoindentation[J]. Industrial Crops and Products, 2016, 92: 102.
[8] Preston R D, Singh K. The fine structure of bamboo fibres. I. Optical properties and X-ray data[J]. Journal of Experimental Botany, 1950, 1(2):214.
[9] Tono T, Ono K. Research on the morphological sturcture and physical properties of bamboo fibers for paper making Ⅱ. The layered structure and its morphological transformation by acid treatment[J]. Journal of Japanese Wood Research Society, 1962, 8: 245.
[10] Parameswaran N, Liese W. On the fine structure of bamboo fibres[J]. Wood Science and Technology, 1976, 10(4): 231.
[11] Murphy R J, Alvin K L. Variation in fiber wall structure in bamboo[J]. IAWA Bulletin, 1992,13(4): 403.
[12] 贺新强, 王幼群, 胡玉熹, 等. 毛竹茎纤维次生壁形成过程的超微结构观察[J]. 植物学报, 2000, 42(10): 1003.
[13] 甘小洪, 丁雨龙. 毛竹茎秆纤维发育过程中细胞壁的变化规律研究 [J]. 林业科学研究, 2006, 19(4): 457.
[14] Abe H, Funada R, Ohtani J, et al. Changes in the arrangement of cellulose microfibrils associated with the cessation of cell expansion in tracheids[J]. Trees, 1997, 11(6): 328.
[15] Kirby A R, Gunning A P, Waldron K W, et al. Visualization of plantcell walls by atomic force microscopy[J]. Biophysical Journal, 1996, 70(3): 1138.
[16] Zou L H, Jin H, Lu W Y, et al. Nanoscale structural and mechanical characterization of the cell wall of bamboo fibers[J]. Mater Sci Engineering, 2009, 29(4): 1375.
[17] 陈 红. 竹纤维细胞壁结构特征研究[D]. 北京: 中国林业科学研究院, 2014.
[18] Abraham Y, Elbaum R. Quantification of microfibril angle in se-condary cell walls at subcellular resolution by means of polarized light microscopy[J]. New Phytologist, 2013, 197: 1012.
[19] 余 雁, 王 戈, 覃道春, 等. X射线衍射法研究毛竹微纤丝角的变异规律[J]. 东北林业大学学报, 2007, 35(8): 28.
[20] Wang Y R, Leppänen K, Andersson S, et al. Studies on the nanostructure of the cell wallof bamboo using X-ray scattering[J]. Wood Science and Technology, 2012, 46(1): 317.
[21] 杨淑敏, 江泽慧, 任海青, 等. 毛竹材质生成过程中微纤丝角的变化[J]. 南京林业大学学报: 自然科学版, 2009, 33(5): 73.
[22] 李霞镇, 任海青, 王小青. 毛竹材微纤丝角变异规律研究[J]. 安徽农业大学学报, 2011, 38(4):500.
[23] Suzuki K, Itoh T. The changes in cell wall architecture during lignification of bamboo,PhyllostachysaureaCarr[J]. Trees, 2001, 15(3): 137.
[24] Abe K, Yano H. Comparison of the characteristics of cellulose microfibril aggregates isolated from fiber and parenchyma cells of Moso bamboo (Phyllostachyspubescens)[J]. Cellulose, 2010, 17(2): 271.
[25] 蒋建新, 杨中开, 朱莉伟, 等. 竹纤维结构及其性能研究[J]. 北京林业大学学报, 2008, 30(1): 128.
[26] 冼杏娟, 冼定国. 竹材的微观结构及其与力学性能的关系[J]. 竹子研究汇刊, 1990, 9(3): 10.
[27] Page D H, El-Hosseiny F, Winkler K. Behavior of single wood fibers under axial tensile strain[J]. Nature, 1971, 229: 252.
[28] 黄艳辉. 毛竹纤维细胞力学性质研究[D]. 北京: 中国林业科学研究院, 2010.
[29] Huang Y H, Fei B H, Yu Y,et al. Plant age effect on the mechanical properties of Moso bamboo (Phyllostachysheterocyclavar.Pubescens) single fibers[J]. Wood and Fiber Science, 2012, 44(2): 196.
[30] 王 戈, 陈 红, 余 雁, 等. 竹纤维细胞水平的物理力学性能精细表征技术[J]. 北京林业大学学报, 2011, 33(4): 143.
[31] Yu Y, Tian G L, Wang H K, et al. Mechanical characterization of single bamboo fiber with nanoindentation and microtensile technique[J]. Holzforschung, 2011, 65(1): 113.
[32] Wimmer R, Lucas B N, Tsui T Y, et al. Longitudinal hardness and Young′s modulus of spruce tracheid secondary walls using nanoindentation technique[J]. Wood Sci Technol, 1997, 31: 131.
[33] Wang X, Ren H, Zhang B, et al. Cell wall structure and formation of maturing fibres of Moso bamboo (Phyllostachyspubescens) increase buckling resistance[J]. Journal of the Royal Society Interface, 2012, 9(70): 988.
[34] Ren Dan, Wang Hankun, Yu Zixuan, et al. Mechanical imaging of bamboo fiber cell walls and their composites by means of peak force quantitative nanomechanics (PQNM) technique[J]. Holzforschung, 2015, 69(8): 975.
[35] Li Yanjun, Yin Liping, Huang Chengjian, et al.Quasistatic and dynamic nanoindentation to determine the influence of thermal treatment on the mechanical properties of bamboo cell walls[J]. Holzforschung, 2015, 69(7): 909.
[36] Zhang Y M, Yu Y L, Yu W J. Effect of thermal treatment on the physical and mechanical properties ofPhyllostachyspubescensbamboo[J]. Holz Roh Werkst, 2013, 71(1): 61.
[37] 江泽慧, 王汉坤, 余 雁, 等. 毛竹及其组成单元的水分吸着特性[J]. 南京林业大学学报: 自然科学版, 2012, 36(2): 11.
[38] 王汉坤, 喻云水, 余 雁. 水分对毛竹细胞壁及宏观力学行为的影响机制[D]. 长沙: 中南林业科技大学, 2010.
[39] Anokye R, Kalong R M, Bakar E S,et al. Variations in Moisture Content Affect the Shrinkage ofGigantochloascortechiniiandBambusavulgarisat Different Heights of the Bamboo Culm[J]. BioResources, 2014, 9(4): 7484.
[40] 闫红芹, 李 龙. 竹纤维力学性能的研究[J]. 新纺织, 2004, 6(11): 10.
[41] Pai Peng, Diao She. Isolation, structural characterization, andpotential applications of hemicelluloses from bamboo: A review[J]. Carbohydrate Polymers, 2014, 112(4): 701.
[42] 苏文会, 范少辉, 余 林, 等. 3种丛生竹化学成分与纤维形态研究[J]. 中国造纸学报, 2011, 26(2): 1.
[43] Lybeer B, Koch G. A topochemical and semiquantitative study of the lignification during ageing of bambooculms(Phyllostachys viridiglaucescens) [J]. IAWA Journal, 2005, 26(1): 99.
[44] Gierlinger N, Schwanninger M. Chemical imaging of poplar wood cell walls by confocal Raman microscopy[J]. Plant Physiol, 2006, 140: 1246.
[45] Gierlinger N, Schwanninger M. The potential of Raman microscopy and Raman imaging in plant research[J]. Spectroscopy, 2007, 21: 69.
[46] 刘 波. 毛竹发育过程中细胞壁形成的研究[D]. 北京: 中国林业科学研究院, 2008.
[47] 韦鹏练. 竹材细胞壁主要化学组分的分布规律研究[D]. 北京: 中国林业科学研究院, 2016.
[48] Wen Jia-Long, Xue Bai-Liang, Xu Feng, et al. Unveiling the structural heterogeneity of bamboo lignin by in situ HSQC NMR technique[J]. BioEnergy Research, 2012, 5(4): 886.
[49] Wen Jia-Long, Xue Bai-Liang, Xu Feng, et al. Unmasking the structural features and property of lignin from bamboo[J]. Industrial Crops and Products, 2013, 42: 332.
[50] 史正军. 甜龙竹及巨龙竹半纤维素、 木质素结构诠释及相互间化学键合机制解析[D]. 北京: 北京林业大学, 2013.
[51] Salmén L. Micromechanical understanding of the cell wall structure[J]. Comptes Rendus Biologies, 2004, 327(9/10): 873.
[52] Silveira R L, Stoyanov S R, Gusarov S, et al. Plant biomass recalcitrance: Effect of hemicellulose composition on nanoscale forces that control cell wall strength[J]. Journal of the American Chemical Society, 2013, 135(51): 19048.
[53] Suzuki K, Kitamura S, Sone Y, et al.Immunohistochemical localization of hemicelluloses and pectins variesduring tissue development in the bamboo culm[J]. The Histochemical Journal, 2003,34(11): 535.
(责任编辑:马 忻)
Research Advances in Bamboo Fiber Cell Wall
HU Kai-li HUANG Yan-hui*YAO Chun-li LEI Yan-hao ZHAO Chang
(CollegeofMaterialsScienceandTechnology,BeijingForestryUniversity,Beijing, 100083)
(*E-mail: huangyanhui@bjfu.edu.cn)
The multilayered structure of bamboo cell wall plays a decisive role in the excellent property of bamboo. In order to deeply comprehend the multilayered structure of bamboo fiber wall, not only the ultra structure, mechanical properties and chemical characteristics of bamboo fiber wall were systematically described, but also the research status was summarized.
bamboo fiber cell wall; microfiber angle; multi-layer structure; mechanical property; chemical characteristic
2016- 04-11
中央高校基本科研业务费专项(BLX2013004);国家自然科学基金青年项目(31500472);国家自然科学基金面上项目(31370563)。
胡凯莉,女,1992年生;在读硕士研究生;主要从事竹材细胞壁方面的研究。
*通信联系人:黄艳辉,E-mail:huangyanhui@bjfu.edu.cn。
TS721+.2
A
1000- 6842(2017)01- 0055- 07
