稳定期慢性阻塞性肺疾病患者呼吸道潜在致病微生物特点及对气道炎症的影响
2017-04-20赵江瑞谭冠文方明月
赵江瑞 谭冠文 方明月 李 越
(信阳职业技术学院护理学院,河南 信阳 464000)
稳定期慢性阻塞性肺疾病患者呼吸道潜在致病微生物特点及对气道炎症的影响
赵江瑞 谭冠文 方明月 李 越1
(信阳职业技术学院护理学院,河南 信阳 464000)
目的 探讨稳定期慢性阻塞性肺疾病(COPD)患者呼吸道潜在致病微生物(PPMs)的特点及其与气道炎症、COPD急性加重的关系。方法 稳定期COPD患者185例,采用自行咳痰或痰诱导方法留取合格痰液,进行痰白细胞计数和细菌培养。随后进行随访,随访间歇3个月,共随访3次,每次随访均取痰液行痰白细胞计数和细菌培养。记录随访期间COPD急性加重次数。结果 总PPMs阳性率为37.3%,其中最常检测到的PPMs为流感嗜血杆菌(HI)。与PPMs阴性组相比,PPMs阳性组的第1秒用力呼气容积(FEV1)、FEV1/预计值、FEV1/用力肺活量(FVC)较低,而外周血中性粒细胞和百分比、痰白细胞、中性粒细胞和百分比较高(P<0.05)。4个时点均完成痰液检测的患者共有163例,PPMs阴性率、1次、2次、多次(3次或4次)PPMs阳性率分别为45.4%、23.3%、18.4%、12.9%,其中19例持续存在HI。与HI阴性组相比,HI阳性组痰白细胞、中性粒细胞和百分比均较高(P<0.05)。结论 稳定期COPD患者呼吸道有较高的PPMs阳性率,尤其是流感嗜血杆菌持续存在于呼吸道中,并且与COPD气道炎症关系密切。
慢性阻塞性肺疾病;气道炎症;潜在致病微生物;流感嗜血杆菌
慢性阻塞性肺疾病(COPD)与炎症关系密切〔1〕。患者自身口咽和胃肠道存在潜在致病微生物(PPMs),以革兰阴性需氧菌、葡萄球菌、酵母菌多见,可移行导致感染〔2〕。PPMs常在稳定期COPD患者的气管肺泡灌洗液和痰液中发现,最常见的菌株为流感嗜血杆菌(HI)和卡他莫拉菌〔3〕。此外,应用抗生素治疗痰液细菌负荷较高的稳定期COPD患者可降低痰中性粒细胞数量〔4〕。目前关于稳定期COPD患者PPMs的研究极少,本研究拟探讨稳定期COPD患者PPMs的特点及其与气道炎症、COPD急性加重的关系。
1 资料与方法
1.1 对象 2014年1月1日至12月31日在信阳职业技术学院医院门诊复查的COPD患者185例,男126例,女59例,年龄42~86岁,平均(65.8±12.5)岁。纳入标准:(1)复合COPD的诊断标准,并处于稳定期:既往6 w内无急性加重症状,且至少6 w未再口服或静脉应用糖皮质激素〔5〕;(2)必要时愿意配合进行诱导痰细菌学检查。排除标准:(1)合并支气管哮喘、矽肺、支气管扩张等严重肺疾病、肿瘤、具有免疫缺陷如糖尿病等患者;(2)预防性应用抗生素患者。研究经院伦理委员会通过,研究对象均知情同意。
1.2 基线检测 纳入研究后进行第一次痰标本监测,其中98例痰标本来自于自行咳痰,87例因痰量少而采取诱导痰检测技术。诱导痰的操作采用中山大学附属第一医院曾勉等〔6〕制定的操作流程。痰液质控标准:多核白细胞>25个/低倍视野,鳞状上皮细胞<10个/低倍视野,或鳞状上皮细胞∶白细胞<1∶2.5为合格痰液〔5〕,否则重新留取痰液。标本在咳痰后2 h内处理:首先在显微镜下观察白细胞情况,计数中性粒细胞数目和百分比;然后将痰标本按标准流程〔7〕预处理后,分别在血平板、中国蓝和巧克力平板中接种,在5%CO2、37℃箱体内孵化18 h后行菌落计数和分离鉴定。出现优势菌,菌落计数>106CFU/ml为培养阳性。另外,所有患者纳入研究后均常规行肺功能检查。抽空腹静脉血化验血常规和C反应蛋白。
1.3 随访 每隔3个月随访1次,共3次,每次随访均如前所述取痰标本进行细菌学检查和白细胞观察。与研究对象的联系方式包括电话、短信、邮箱、QQ和微信等,辅以门诊随访和住院随访。如果随访时患者近期有急性发作,则适当延迟取痰标本的时间(距急性发作>6 w)。随访期间主要观察指标为痰细菌学和痰白细胞情况,次要观察指标为COPD急性加重次数。
1.4 统计学分析 采用SPSS16.0软件行t检验、χ2检验、秩和检验。
2 结 果
2.1 基线痰液检测结果 185例参与者中,最常检测到的PPMs为HI,阳性率为17.8%(33/185),其他依次为卡他莫拉菌7.6%(14/185)、肺炎链球菌6.5%(12/185)、金黄色葡萄球菌3.8%(7/185)、铜绿假单胞菌1.6%(3/185),总阳性率为37.3%(69/185)。与PPMs培养阴性者(PPMs阴性组)相比,PPMs培养阳性者(PPMs阳性组)的第1秒用力呼气容积(FEV1)、FEV1/预计值、FEV1/用力肺活量(FVC)较低(P<0.05),而外周血中性粒细胞和百分比、痰白细胞、中性粒细胞和百分比较高(P<0.05),见表1。
2.2 随访期间痰液PPMs培养情况 第1、2、3次随访分别有9例、13例、15例患者未完成痰液检测,每个时点(共4个)均完成痰液检测的患者共有163例。HI病原体持续性较强,见表2。
2.3 HI持续阴性和持续阳性患者的痰液和临床结局比较 在4次痰细菌学检测中,80例HI培养始终阴性(HI阴性组),21例阳性次数≥3(HI阳性组)。与HI阴性组相比,HI阳性组的痰白细胞、中性粒细胞和百分比均较高(P<0.05),而两组急性加重次数未见明显差异(P>0.05),见表3。

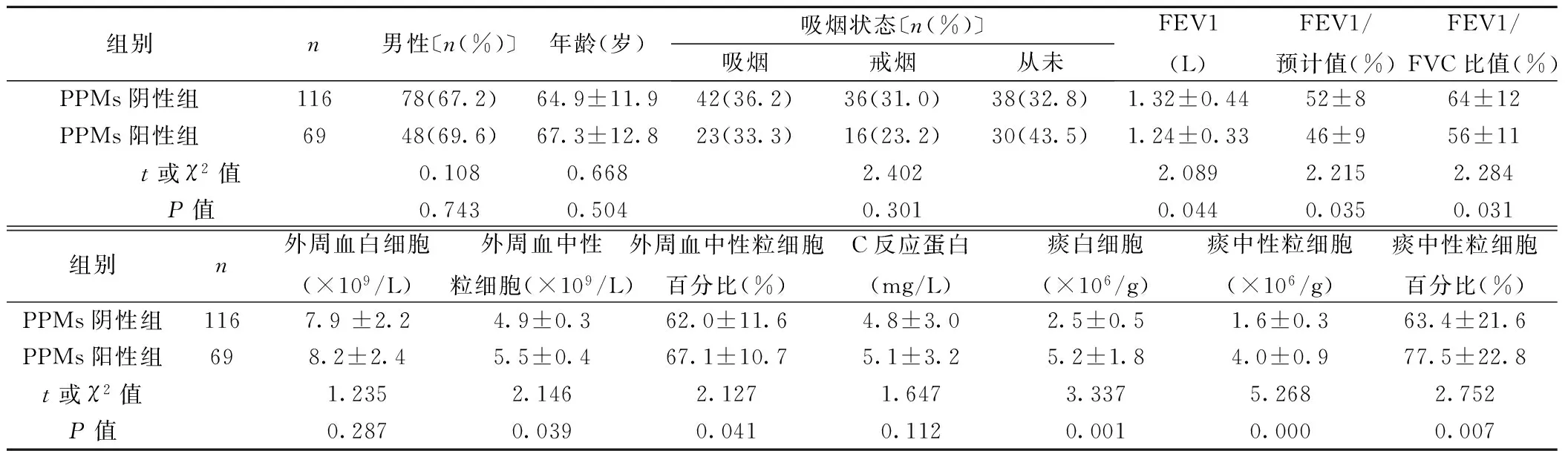
组别n男性〔n(%)〕年龄(岁)吸烟状态〔n(%)〕吸烟戒烟从未FEV1(L)FEV1/预计值(%)FEV1/FVC比值(%)PPMs阴性组11678(67.2)64.9±11.942(36.2)36(31.0)38(32.8)1.32±0.4452±864±12PPMs阳性组6948(69.6)67.3±12.823(33.3)16(23.2)30(43.5)1.24±0.3346±956±11t或χ2值0.1080.6682.4022.0892.2152.284P值0.7430.5040.3010.0440.0350.031组别n外周血白细胞(×109/L)外周血中性粒细胞(×109/L)外周血中性粒细胞百分比(%)C反应蛋白(mg/L)痰白细胞(×106/g)痰中性粒细胞(×106/g)痰中性粒细胞百分比(%)PPMs阴性组1167.9±2.24.9±0.362.0±11.64.8±3.02.5±0.51.6±0.363.4±21.6PPMs阳性组698.2±2.45.5±0.467.1±10.75.1±3.25.2±1.84.0±0.977.5±22.8t或χ2值1.2352.1462.1271.6473.3375.2682.752P值0.2870.0390.0410.1120.0010.0000.007

表2 痰PPMs重复培养情况〔n(%),n=163〕

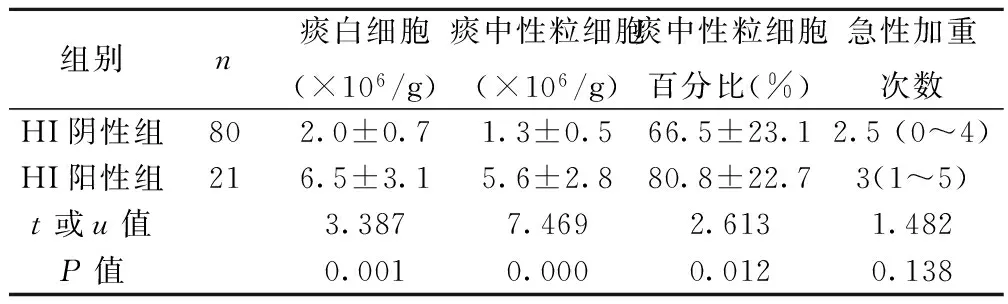
组别n痰白细胞(×106/g)痰中性粒细胞(×106/g)痰中性粒细胞百分比(%)急性加重次数HI阴性组802.0±0.71.3±0.566.5±23.12.5(0~4)HI阳性组216.5±3.15.6±2.880.8±22.73(1~5)t或u值3.3877.4692.6131.482P值0.0010.0000.0120.138
3 讨 论
本研究结果表明,COPD患者气道内具有较高的PPMs阳性率,其中最为常见的是HI。同时,本研究发现PPMs阳性者的肺功能较差,而外周血和痰液的炎症反应更为严重,提示PPMs与肺功能和炎症反应关系密切。有研究表明,短期抗生素治疗可以降低稳定期COPD患者痰细菌负荷和中性粒细胞〔4〕,支持PPMs和气道炎症之间的因果关系。本研究结果发现,HI是最常见且唯一一种持续存在的呼吸道PPM,这与国外的研究结果一致〔3〕。研究表明,COPD患者先天免疫反应功能受损,对HI的吞噬反应减弱〔8〕。而且,与其他呼吸道PPMs相比,HI已被发现具有侵入肺实质的能力,并且可以在细胞内发现〔9〕,使其更加难以被清除。与其他PPMs相比,HI的持续存在提示其与COPD关系更为密切,但是其对COPD的发病机制、临床表现、预后以及治疗策略的确切影响,目前并不清楚。
本研究结果表明,HI与气道炎症密切相关,与Garcha等〔10〕研究结果相似。研究表明,HI一旦定植于气道,会增加气道黏膜肿瘤坏死因子(TNF)的产生,并具有明显的细胞毒性T细胞反应〔11〕,可直接引发中性粒细胞的气道炎症;最近Barker等〔12〕研究表明,存在HI是气道产生TNF和白细胞介素(IL)-1的一个独立危险因素。另外,本研究中COPD的急性加重次数在HI阳性组和HI阴性组之间并无显著差异,一个可能的原因是本研究的随访时间较短,尚难以显现HI对临床事件的影响。
本研究的优点在于,这是国内较早探讨呼吸道PPMs与COPD疾病和炎症之间关系的研究,并且是一个纵向研究,结果较为准确;本研究的缺点在于,首先,我们检测PPMs的手段是传统的细菌培养,与qPCR等分子技术相比,其准确度可能较差,尤其是当细菌处于静息状态时,这可能会导致假阳性和假阴性的出现;其次,限于样本量,不同PPMs的COPD患者之间的炎症指标是否存在差异难以进行比较。
1 金 秋,王宏飞,王勇强,等.神经调节辅助通气对慢性阻塞性肺疾病患者炎性反应及脱机的影响〔J〕.中华急诊医学杂志,2015;24(5):530-5.
2 杨 燕,王建平.老年慢性阻塞性肺疾病气道炎症及其治疗前景〔J〕.中国老年学杂志,2010;30(1):139-41.
3 Monsó E,Rosell A,Bonet G,etal.Risk factors for lower airway bacterial colonization in chronic bronchitis〔J〕.Eur Respir J,1999;13(2):338-42.
4 Siva R,Bafadhel M,Monteiro W,etal.Effect of levofloxacin on neutrophilic airway inflammation in stable COPD:a randomized,double-blind,placebo-controlled trial〔J〕.Int J Chron Obstruct Pulmon Dis,2014;9(1):179-86.
5 中华医学会呼吸病学分会.中国成人社区获得性肺炎诊断和治疗指南(2016年版)〔J〕.中华结核和呼吸杂志,2016;39(4):253-79.
6 曾 勉,吴健锋,谢灿茂,等.慢性阻塞性肺疾病急性加重期患者规范化痰诱导安全性的初步研究〔J〕.中华结核和呼吸杂志,2005;28(4):238-41.
7 牛颖梅,童朝晖,王 辰,等.稳定期慢性阻塞性肺疾病气道炎症的研究〔J〕.国际呼吸杂志,2009;29(3):132-6.
8 Taylor AE,Finney-Hayward TK,Quint JK,etal.Defective macrophage phagocytosis of bacteria in COPD〔J〕.Eur Respir J,2010;35(5):1039-47.
9 Drömann D,Rupp J,Rohmann K,etal.The TGF-beta-pseudoreceptor BAMBI is strongly expressed in COPD lungs and regulated by nontypeable Haemophilus influenzae〔J〕.Respir Res,2010;11(1):67-75.
10 Garcha DS,Thurston SJ,Patel AR,etal.Changes in prevalence and load of airway bacteria using quantitative PCR in stable and exacerbated COPD〔J〕.Thorax,2012;67(12):1075-80.
11 King PT,Lim S,Pick A,etal.Lung T-cell responses to nontypeable Haemophilus influenzae in patients with chronic obstructive pulmonary disease〔J〕.J Allerg Clin Immunol,2013;131(5):1314-21.
12 Barker BL,Haldar K,Patel H,etal.Association between pathogens detected using quantitative polymerase chain reaction with airway inflammation in COPD at stable state and exacerbations〔J〕.Chest,2015;147(1):46-55.
〔2016-12-03修回〕
(编辑 李相军/滕欣航)
1 郑州大学第三附属医院呼吸一病区
赵江瑞(1983-),女,讲师,主要从事临床护理研究。
R569
A
1005-9202(2017)07-1675-03;
10.3969/j.issn.1005-9202.2017.07.046
