miRNA-21和磷酸酶-张力蛋白基因的表达在老年结直肠癌浸润转移中的作用及机制
2017-04-20刘长伟吴晓艳
刘长伟 吴晓艳
(白城医学高等专科学校,吉林 白城 137000)
miRNA-21和磷酸酶-张力蛋白基因的表达在老年结直肠癌浸润转移中的作用及机制
刘长伟 吴晓艳
(白城医学高等专科学校,吉林 白城 137000)
目的 探讨miRNA-21和磷酸酶-张力蛋白基因(PTEN)在老年结直肠癌浸润转移中的作用机制。方法 行大肠癌根治术的老年患者70例,术中取癌组织标本和距癌组织20 cm以上的切缘大肠正常组织。采用实时荧光定量RT-PCR检测标本中miRNA-21和PTEN 的mRNA表达水平;免疫组化和Western印迹分析PTEN蛋白表达水平。结果 结直肠癌组织中miRNA-21表达水平明显高于正常切缘组织(P<0.05),其中伴淋巴结转移的结直肠癌患者miRNA-21表达水平明显高于不伴淋巴结转移者;随着结直肠癌浸润深度增加,miRNA-21表达水平明显提升(P<0.05)。结直肠癌组织中PTEN mRNA表达水平明显低于正常切缘组织(P<0.05);结直肠癌组织中PTEN蛋白中阳性细胞数比例明显低于正常切缘组织(P<0.05),PTEN蛋白表达水平明显低于正常切缘组织(P<0.05)。伴淋巴结转移的结直肠癌患者PTEN mRNA及蛋白表达水平明显低于不伴淋巴结转移者;随着结直肠癌浸润深度和Dukes分期增加,PTEN mRNA及蛋白表达水平明显降低(P<0.05)。Pearson相关性分析显示,结直肠癌组织中miRNA-21转录水平与PTEN mRNA和蛋白表达水平之间呈明显负相关。结论 老年结直肠癌组织中miRNA-21过表达会下调PTEN的表达,导致结直肠癌的浸润转移。
结直肠癌;miRNA-21;磷酸酶-张力蛋白基因
结直肠癌是我国最常见的恶性肿瘤之一,约2/3的结直肠癌发生在60岁以上〔1〕。miRNA-21在肿瘤发生、发展中具有重要作用,在多种癌组织中表达异常升高〔2〕。磷酸酶-张力蛋白基因(PTEN)可通过编码磷酸酶调控AKT信号通路,维持细胞间正常生理功能〔3〕。研究显示,在肝癌细胞中miRNA-21可对PTEN蛋白表达进行调控〔4〕。本次研究选取老年结直肠癌组织和正常切缘组织,检测其中miRNA-21和PTEN的表达水平,探讨其在老年结直肠癌浸润转移中的作用机制。
1 资料与方法
1.1 一般资料 选取2014年1月至2015年12月在白城医学高等专科学校附属医院行大肠癌根治术的老年患者70例,术前均未接受放疗、化疗或生物治疗;均自愿参与本次研究并签署知情同意书。其中男42例,女28例;年龄62~85岁,平均(68.51±7.93)岁;结肠癌45例,直肠癌25例。术中取癌组织标本(肉眼观察坏死组织较少,黏膜较为完整的癌块组织),立即分为3份,1份放入RNA存储液保存用于mRNA检测,1份用10%多聚甲醛溶液固定后用于免疫组化染色,1份放入液氮中冻存用于蛋白质检测。正常标本取自距癌组织20 cm以上的切缘大肠组织。
1.2 实时荧光定量RT-PCR检测 采用Trizol试剂盒抽提总RNA,分光光度法检测总RNA含量和质量;使用Taka逆转录试剂盒得到cDNA,快速实时荧光定量PCR仪行RT-PCR检测(扩增长度230 bp,Tm 58℃)。反应体系共20 μl,包括通用PCR反应混合物10 μl;上、下游引物各1 μl,引物合成由北京三博远志生物技术有限责任公司完成;cDNA 4 μl,去离子水4 μl。反应条件:94℃预变性5 min,94℃变性15 s,60℃退火20 s,72℃延伸30 s,共35个循环,每个样本设3个复孔,采用2-△△CT法分析基因相对表达量,内参为GAPDH,校正miRNA-21和PTEN mRNA的表达量。
1.3 免疫组化检测 标本经10%多聚甲醛溶液固定后,常规石蜡包埋组织,4 μm连续切片,烘干脱蜡,高温修复抗原5 min,室温冷却,行SP法免疫组化染色,鼠抗人PTEN单克隆抗体购于上海常斤生物科技有限公司。封片后在光学显微镜下观察,细胞质中呈黄色或棕黄色片状物为PTEN蛋白阳性染色,高倍镜下随机选取10个视野,每个视野计数100个细胞,计算阳性细胞比值。
1.4 Western印迹检测 用RIPA蛋白裂解液试剂盒提取癌组织标本和正常标本的总蛋白质,BCA法检测蛋白浓度,行SDS-PAGE电泳,目标蛋白湿法转至PVDF膜上,TBST溶液封闭60 min,TBST洗膜后加PTEN一抗(1∶500稀释),4℃孵育过夜;洗膜后加二抗(1∶500稀释)室温下孵育60 min;滴加ECL超敏发光液,使用凝胶成像仪检测标本的发光信号,用Image J分析蛋白条带灰度值。
1.5 统计学分析 采用SPSS18.0软件进行t检验、Pearson相关分析。
2 结 果
2.1 癌组织中miRNA-21表达水平与临床病理指标的关系 结直肠癌组织中miRNA-21表达水平为(2.15±0.43),明显高于正常切缘组织的(1.05±0.27,P<0.05)。其中miRNA-21表达与结直肠癌分化程度、肿瘤部位之间无相关性(P>0.05);伴淋巴结转移的结直肠癌患者miRNA-21表达水平(3.95±0.65)明显高于不伴淋巴结转移者(1.16±0.12,P<0.05);随着结直肠癌浸润深度增加,miRNA-21表达水平明显提升(浸润<0.5 cm:2.64±0.82,浸润0.5~1.0 cm:3.40±1.13,浸润>1.0 cm:5.36±1.50;P<0.05)。
2.2 癌组织与正常组织中PTEN mRNA及免疫组化染色 结直肠癌组织中PTEN mRNA表达水平为(7.71±1.93),明显低于正常切缘组织(5.53±1.36,P<0.05);结直肠癌组织中PTEN蛋白中阳性细胞数比例为(75.30±7.55)%,明显低于正常切缘组织〔(94.05±2.38)%,P<0.05〕。见图1。
2.3 Western印迹检测PTEN蛋白表达水平 结直肠癌组织中PTEN蛋白表达水平为(0.406±0.019),明显低于正常切缘组织(1.952±0.293,P<0.05)。见图2。
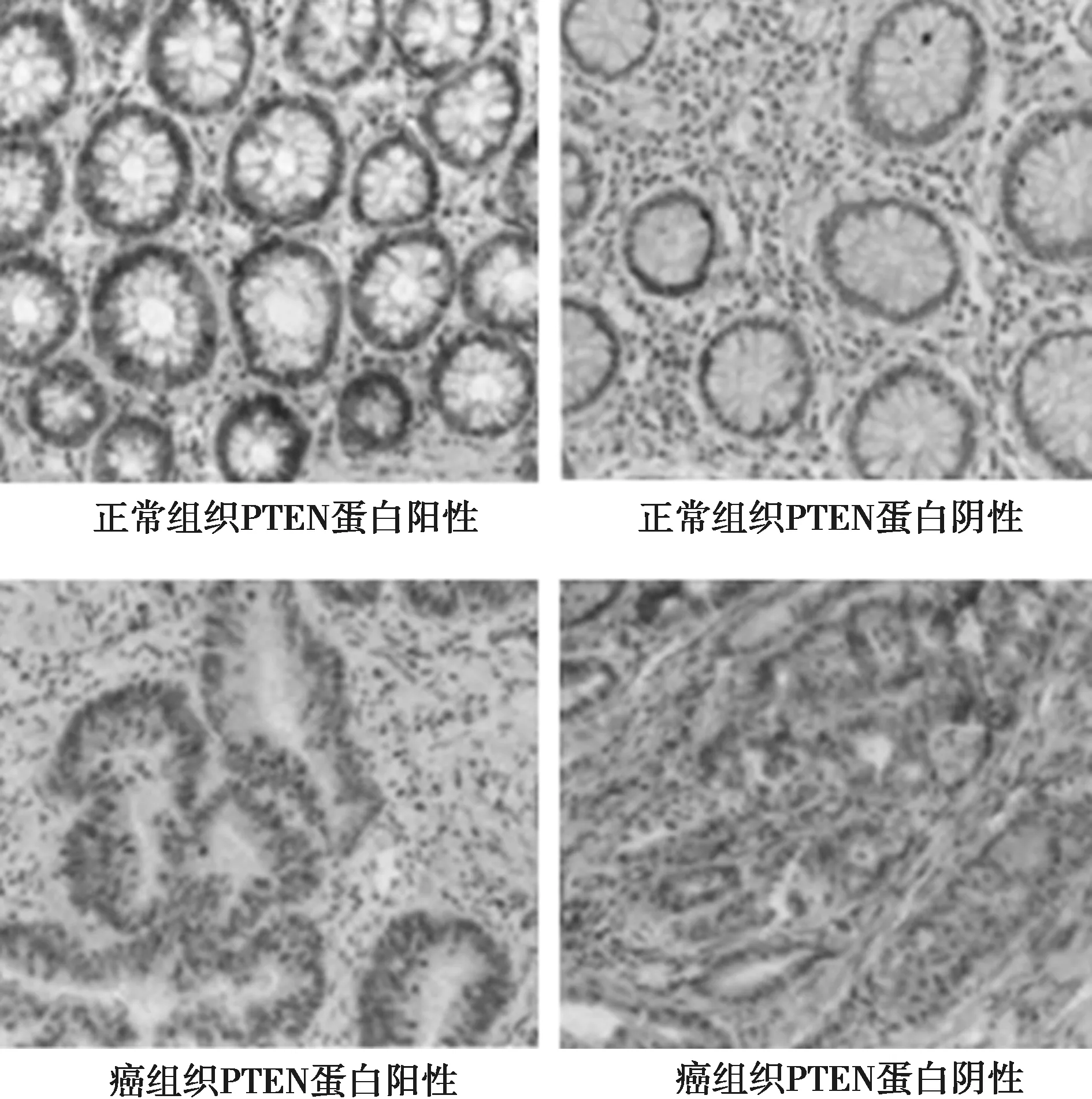
图1 正常组织与癌组织中PTEN蛋白表达的免疫组化染色(×200)
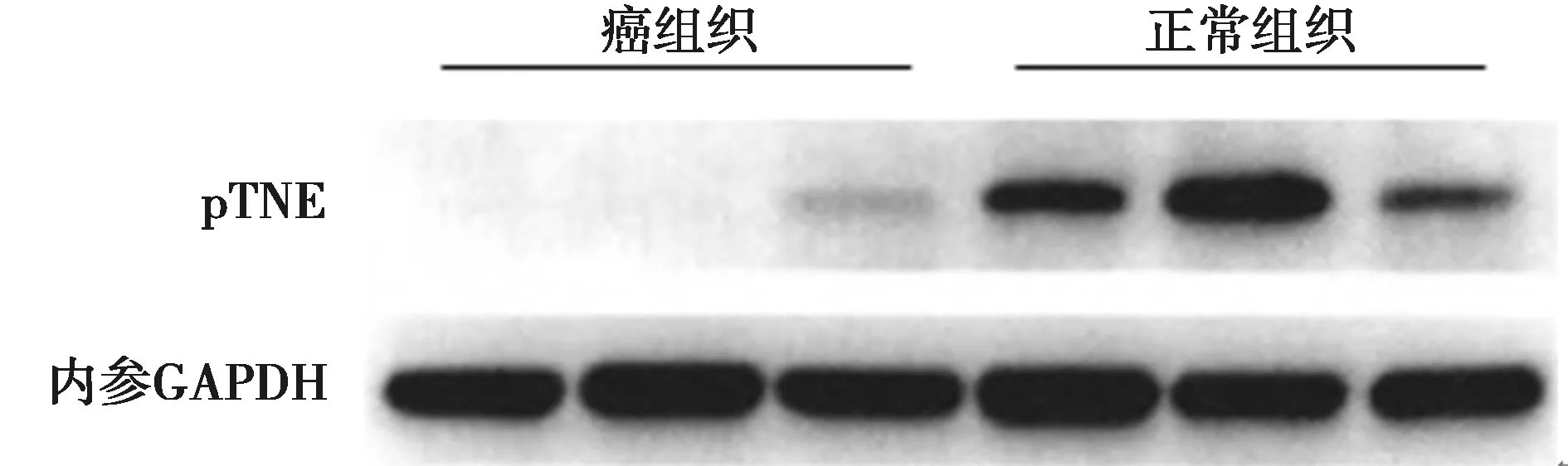
图2 PTEN蛋白在结直肠癌组织中的表达水平
2.4 PTEN mRNA及蛋白表达水平与临床病理指标的关系 结直肠癌组织中PTEN mRNA及蛋白表达水平与肿瘤分化程度、部位之间无相关性(P>0.05);伴淋巴结转移的结直肠癌患者PTEN mRNA及蛋白表达水平(1.62±0.35)明显低于不伴淋巴结转移者(3.05±0.61,P<0.05);直肠癌肿瘤浸润距离<0.5 cm的PTEN RNA表达水平4.18±0.65,0.5~1.0 cm为3.50±0.82,>1.0 cm为1.43±0.28;改良版DUKES分期,T1期PTEN RNA表达水平4.81±0.92,T2期为3.82±0.75,T3期为2.16±0.50,T4期为1.48±0.11,随着结直肠癌浸润深度和Dukes分期增加,PTEN mRNA及蛋白表达水平明显降低(P<0.05)。
2.5 结直肠癌组织中miRNA-21与PTEN表达的相关性 结直肠癌组织中miRNA-21转录水平与PTEN mRNA和蛋白表达水平之间呈明显负相关(r=-0.983、-0.916,均P<0.05)。
3 讨 论
miRNA-21的编码基因定位于液泡膜蛋白基因编码区,是第10个内含子。相关研究显示,多种癌组织标本均存在miRNA-21表达水平异常升高。本研究说明miRNA-21对结直肠癌的进展、预后具有重要影响。最新研究显示,miRNA-21表达水平升高可影响β-链蛋白、PDCD4、促进癌变的发生,消除该基因可有效降低相关疾病的癌变风险〔5〕。结合本次研究结果可推测,检测miRNA-21水平可作为诊断和靶向治疗的指标,可用于临床对结肠和直肠癌变早期的筛查。PTEN是近期发现的首个具有双特异性磷酸酶活性的抑癌基因,在调控细胞周期,调节细胞正常生长、发育方面具有重要作用〔6〕。本研究说明PTEN参与了结直肠癌的发生、发展,表达水平降低可促进结直肠癌病情恶化和病灶转移。相关研究显示,PTEN受多种ceRNAs调控,而其中多数ceRNAs是之前认为与PTEN功能无关联的基因〔7〕。本研究显示,PTEN mRNA表达水平与PTEN蛋白表达呈明显正相关,该结论可为多种依靠调控蛋白表达来治疗结直肠癌的构想提供理论基础。肿瘤的发生与发展受多种基因共同作用,其中癌基因与抑癌基因之间构成了复杂的肿瘤促进和抑制网络。相关研究显示,miRNA-21转录后可调控PTEN/PI3K/AKT通路,进而影响结肠癌细胞的扩散〔8〕。结合本次研究结果可认为,结直肠癌组织中miRNA-21过表达会明显降低PTEN表达水平,导致结直肠癌的浸润转移。
1 丁如良.影响老年直肠癌患者术后生存时间的风险因素〔J〕.中国老年学杂志,2013;33(21):5415-6.
2 Feng YH,Wu CL,Tsao CJ,etal.Deregulated expression of sprouty2 and microRNA-21 in human colon cancer:correlation with the clinical stage of the disease〔J〕.Cancer Biol Ther,2011;11(1):111-21.
3 Li X,Zhang G,Luo F,etal.Identification of aberrantly expressed miRNAs in rectal cancer〔J〕.Oncol Rep,2012;28(1):77-84.
4 Okayama H,Schetter AJ,Harris CC,etal.MicroRNAs and inflammation in the pathogenesis and progression of colon cancer〔J〕.Dig Dis,2012;30(S2):9-15.
5 Lan F,Yue X,Han L,etal.Genome-wide identification of TCF7L2/TCF4 target miRNAs reveals a role for miR-21 in Wnt-driven epithelial cancer〔J〕.Int J Oncol,2012;40(2):519-26.
7 Kjaer-Frifeldt S,Hansen TF,Nielsen BS,etal.The prognostic importance of miR-21 in stage Ⅱ colon cancer:a population-based study〔J〕.Br J Cancer,2012;107(7):1169-74.
8 Rathore S,Hussain M,Ali A,etal.A recent survey on colon cancer detection techniques〔J〕.IEEE/ACM Trans Comput Biol Bioinform,2013;10(3):545-63.
〔2016-06-27修回〕
(编辑 滕欣航)
刘长伟(1980-),男,讲师,主要从事外科学临床教学研究。
R73
A
1005-9202(2017)07-1659-03;
10.3969/j.issn.1005-9202.2017.07.039
