不同严重程度阿尔茨海默病患者血浆Aβ40和Aβ42水平的比较
2017-04-20陈静华陶雪琴黄河浪周跃平
陈静华 廖 雄 陶雪琴 黄河浪 周跃平 吴 磊
(南昌大学公共卫生学院,江西 南昌 330006)
不同严重程度阿尔茨海默病患者血浆Aβ40和Aβ42水平的比较
陈静华 廖 雄 陶雪琴 黄河浪 周跃平 吴 磊
(南昌大学公共卫生学院,江西 南昌 330006)
目的 探讨血浆β淀粉样蛋白(Aβ)浓度对于评价阿尔茨海默病(AD)患者严重程度的应用价值。方法 选取2014~2015年南昌市某社区老年痴呆随访队列中全部确诊的AD患者134例,按总体衰退量表GDS评分分为轻、中、重三组,通过双抗体夹心酶联免疫吸附法检测各组血浆中Aβ40 和Aβ42蛋白浓度。结果 不同严重程度AD患者组间血浆Aβ40浓度差异无统计学意义(F=0.250,P=0.619),Aβ42蛋白浓度差异有统计学意义(F=24.651,P<0.01)。结论 血浆Aβ42蛋白浓度的检测有助于AD患者严重程度的评价,低血浆Aβ42蛋白浓度可能与AD的认知功能减退有关。
阿尔茨海默病;β淀粉样蛋白
阿尔茨海默病(AD)是一种慢性神经系统退行性疾病,以进行性认知功能和行为损伤为临床表现,是老年痴呆最常见的疾病。随着人口老龄化加剧和人均期望寿命的延长,AD的发病率不断增加〔1〕,目前AD严重程度的评价方法主要为氟脱氧葡萄糖正电子发射成像(FDG-PET)和β淀粉样蛋白(Aβ)正电子发射成像技术〔2〕。然而由于正电子发射成像费用昂贵、操作复杂等限制了其推广应用,故临床上急需一种廉价、易检测可推广的评价方法。Aβ尤其是Aβ40和Aβ42蛋白作为AD患者大脑病理损伤的生物标记物成为近年来AD早期诊断研究的热点,但关于其外周循环血液中的含量与AD的相关性研究报道不一。有研究显示血浆Aβ40和Aβ42水平在AD组和正常对照组中无明显差异,另一些研究表明AD患者中血浆Aβ42和Aβ42/40比例显著下降〔3〕。本研究检测了不同严重程度AD患者血浆中Aβ40和Aβ42的浓度,旨在研究血浆Aβ蛋白浓度对于评价AD患者严重程度的应用价值。
1 资料与方法
1.1 研究对象 选取课题组2014至2015年南昌市某社区老年痴呆随访队列中全部确诊的AD患者134例,男55例,女79例,年龄57~85岁,均符合美国国立神经病、语言交流障碍和卒中研究所——老年性痴呆及相关疾病学会很可能AD的诊断标准〔4〕。排除标准:合并心脑等器质性疾病、视力听力减退及其他干扰评估准确性的精神性疾病。所有受试者均有详细的病史记录、神经系统检查及量表筛查评分。量表包括:简易精神状态量表(MMSE)、哈金斯缺血指数评分表(HIS)、总体衰退量表(GDS)。AD的严重程度根据总体衰退量表分级,GDS评分3、4分者为轻度,5分为中度,6、7分为重度〔5〕。
1.2 样本采集 社区随访过程中所有受试对象均取静脉血5 ml置于乙二胺四乙酸(EDTA)抗凝管,现场静置2 h后,以1 000 r/min的速度离心3 min,吸取上清液,编号后及时带回实验室于-70℃冰箱保存。
1.3 检测方法 采用双抗体夹心酶联免疫吸附法(ELISA)检测血浆中Aβ40和Aβ42蛋白浓度,试剂由江苏依科赛生物科技有限公司提供,操作严格按照试剂说明书进行。
1.4 统计学方法 应用SPSS20.0统计软件进行分析,受试对象一般情况采用χ2检验或方差分析,Aβ蛋白浓度采用协方差分析或非参数秩和检验。
2 结 果
2.1 一般资料 本研究对象中轻度AD 56例,中度AD 43例,重度AD 35例。不同严重程度痴呆分组在性别、受教育程度上差异无统计学意义(P>0.05),各组间的年龄差异有统计学意义,轻度AD患者的年龄较中、重度AD患者小(P<0.05)。见表1。

表1 不同严重程度AD分组的一般情况比较(n)
与轻度AD比较:1)P<0.05
2.2 不同严重程度AD组血浆Aβ40、Aβ42蛋白浓度比较 通过协方差分析排除年龄的影响后,不同严重程度AD患者组间血浆Aβ40浓度差异无统计学意义(F=0.250,P=0.619),但各组间Aβ42蛋白浓度差异有统计学意义(F=24.651,P<0.01)。见表2。
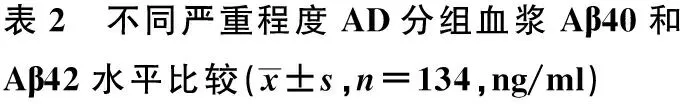
组别Aβ40Aβ42轻度AD118.3±5.684.7±5.3中度AD113.5±4.553.4±5.6重度AD107.2±5.228.5±4.2F值0.25024.651P值0.619<0.01
3 讨 论
痴呆是一个重大的公共卫生问题,预计到2050年全世界痴呆的患病人数将达到1.15亿人,其中AD约占50%~70%〔6〕。以往AD患者的神经病理损伤只有通过尸检后的报告确诊,随着生物标记物的深入研究,AD患者神经病理损伤过程在活体状态下即能追踪。Aβ(主要为Aβ40 与Aβ42)是AD患者大脑神经损伤最显著的生物标记物,其主要通过脑脊液直接检测和大脑影像学检测Aβ沉积物〔7〕。这些检测手段是目前关于AD的严重程度主要评价方法。但由于腰椎穿刺具有侵入性,影像学检查又昂贵、复杂限制了Aβ的广泛应用。
外周血Aβ的浓度与AD或痴呆风险之间的相关性存在不少争议,最近Koyama等〔8〕的Meta分析和随后的一些研究均证实它们之间的相关性。但是不同的分析方法、研究设计、随访时间研究的得出的结果间存在明显差异。本次研究结果显示,在控制年龄的影响后AD患者越严重,血浆Aβ42蛋白浓度越低,这与Chouraki等〔9〕在由2 189例非痴呆组成的弗明汉心血管队列研究发现高浓度血浆Aβ42是痴呆的保护因素(HR=0.80,P<0.01),Aβ40与AD或痴呆发病风险无关结果。Izco等〔10〕在小鼠模型也发现低血浆Aβ42易导致小鼠认知功能损伤结果一致。相反的是国内Zhou等〔11〕研究却提示AD患者血浆Aβ42浓度高于正常对照组。Blasko等〔12〕在维也纳经过2.5年衰老随访研究显示认知水平从正常转变为AD患者血浆Aβ42浓度比维持正常认知水平者高,血浆Aβ42浓度升高为AD危险因素。此外,AD神经影像学协会研究显示血浆Aβ水平与轻度认知障碍(MCI)转变为AD患者无明显相关〔13〕。由于部分血浆Aβ也可来源于损伤的血小板组织,故血浆Aβ浓度是否能反映脑组织中Aβ的聚集情况仍有待考究。但笔者认为血浆Aβ与AD的病情发展密切相关,随着AD患者严重程度增加血浆Aβ42浓度下降的原因有:(1)目前学界公认Aβ的沉积是AD病理生理变化机制;(2)Aβ42比Aβ40更容易聚集沉积在大脑神经元,对神经细胞的损伤更大〔9〕;(3)Aβ正电子发射成像技术研究显示血浆Aβ42与Aβ40比率的降低失衡将进一步使脑组织对Aβ的摄取增加,导致血浆Aβ42浓度下降〔14〕。
综上所述,本研究的结果提示血浆Aβ42浓度的检测有助于AD患者严重程度的评价,低血浆Aβ42浓度有可能与AD的认知功能减退有关。但是需要更多的大样本队列研究评价或证实血浆Aβ42与AD严重程度之间的联系。
1 Keogh-Brown MR,Jensen HT,Truyen L,etal.The growing macroeconomic burden of Alzheimer′s disease in China〔J〕.Alzheimer Dementia,2015;11(7):P181-2.
2 Coliva A,MonterisiC,Apollaro A,etal.Synthesis optimization of2-(4-N-〔11C〕methylaminophenyl)-6-hydroxybenzothiazole (〔11C〕PIB),β-amyloid PET imaging tracer for Alzheimer′s disease diagnosis〔J〕.App Radiat Isot,2015;105(1):66-71.
3 Mizoi M,Yoshida M,Saiki R,etal.Distinction between mild cognitive impairment and Alzheimer′s disease by CSF amyloid β40 and β42,and protein-conjugated acrolein〔J〕.Clin Chim Acta,2014;430(2):150-55.
4 Beach TG,Monsell SE,Phillips LE,etal.Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers,2005-2010〔J〕.J Neuropathol Exp Neurol,2012;71(4):266-73.
5 Reisberg B,Ferris SH,de Leon MJ,etal.The Global Deterioration Scale for assessment of primary degenerative dementia〔J〕.Am J Psychiatry,1982;139(9):1136-9.
6 Wortmann M.Dementia:a global health priority-highlights from an ADI and World Health Organization report〔J〕.Alzheimers Res Ther,2012;4(5):40.
7 Henry MS,Passmore AP,Todd S,etal.The development of effective biomarkers for Alzheimer′sdisease:a review〔J〕.Int J Geriatr Psychiatry,2013;28(6):331-40.
8 Koyama A,Okereke OI,Yang T,etal.Plasma amyloid-β as a predictor of dementia and cognitive decline:a systematic review and meta-analysis〔J〕.Arch Neurol 2012;69(4):824-31.
9 Chouraki V,Beiser A,Younkin L,etal.Plasma amyloid-β and risk of Alzheimer′s disease in the Framingham Heart Study〔J〕.Alzheimer Dement,2015;11(3):249-57.
10 Izco M,Martínez P,Corrales A,etal.Changes in the brain and plasma Aβ peptide levels with age and its relationship with cognitive impairment in the APPswe/PS1dE9 mouse model of Alzheimer′s disease〔J〕.Neuroscience,2014;263(3):269-79.
11 Zhou L,Chan KH,Chu L W,etal.Plasma amyloid-β oligomers level is a biomarker for Alzheimer′s disease diagnosis〔J〕.Biochem Biophys Res Commun,2012;423(4):697-702.
12 Blasko I,Jellinger K,Kemmler G,etal.Conversion from cognitive health to mild cognitive impairment and Alzheimer′s disease:prediction by plasma amyloid beta 42,medial temporal lobe atrophy and homocysteine〔J〕.Neurobiol Aging,2008;29(1):1-11.
13 Goldberg TE.Utility of combinations of biomarkers,cognitive markers,and risk factors to predict conversion from MCI to AD and magnitude of functional decline in ADNI subjects〔J〕.Alzheimer Dementia,2010;6(4):e40-1.
14 Rembach A,Wilson B,Villemagne V,etal.Plasma beta-amyloid levels are significantly associated with a transition toward Alzheimer′s disease as measured by cognitive decline and change in neocortical amyloid burden〔J〕.Alzheimer Dementia,2013;9(4):681-2.
〔2016-04-19修回〕
(编辑 袁左鸣)
国家自然科学基金资助项目(No.81260441)
吴 磊(1970-),女,教授,硕士生导师,主要从事老年痴呆疾病及衰老相关研究。
陈静华(1991-),女,硕士,主要从事慢性非传染病的研究。
R749
A
1005-9202(2017)07-1655-02;
10.3969/j.issn.1005-9202.2017.07.037
