姜黄素增强脂多糖跨膜转运的机制及其抗动脉粥样硬化作用
2017-04-20周音频向立权吴永才杨义航
周音频 宁 琳 向立权 吴永才 杨义航 黎 明
(重庆市涪陵区中心医院心内科,重庆 408000)
姜黄素增强脂多糖跨膜转运的机制及其抗动脉粥样硬化作用
周音频 宁 琳 向立权 吴永才 杨义航 黎 明
(重庆市涪陵区中心医院心内科,重庆 408000)
目的 探究姜黄素增强脂多糖(LPS)跨血管内皮细胞的转运机制及其抗动脉粥样硬化作用。方法 采用TER法检测姜黄素处理后心肌细胞通透性的变化,放射法检测姜黄素处理的心肌细胞内LPS流出率, Western印迹法检测心肌细胞内小窝蛋白(Cav)-1的表达,qRT-PCR法检测姜黄素作用后的小鼠心肌细胞内层VCAM-1、ICAM-1的基因表达。结果 与对照组比较,不同浓度姜黄素处理后的心肌细胞单层电阻值逐渐增加;心肌细胞膜内的LPS流出率下降,随着姜黄素浓度升高,其流出率逐渐降低,与剂量浓度呈负相关。与对照组相比,姜黄素处理后Cav-1蛋白表达量均下降,随着时间的延长表达量逐渐降低,在药量浓度范围内呈负相关。姜黄素处理过的心肌细胞内VCAM-1、ICAM-1基因表达量均升高且与姜黄素浓度呈负相关,随着姜黄素药物作用浓度的升高,VCAM-1、ICAM-1基因表达量逐渐降低。结论 姜黄素通过提高细胞通透性加强LPS在小鼠心肌内皮细胞转运,并且通过调控VCAM-1、ICAM-1基因抑制动脉粥样硬化的形成。
姜黄素;心肌细胞;脂多糖;小窝蛋白-1;动脉粥样硬化
姜黄素是从植物Curcuma longa L.中提取到的多酚物质,难溶于水,易溶于乙醇、氯仿等有机溶剂〔1〕。临床研究证明,姜黄素在抗肿瘤、治疗心血管疾病方面具有良好的效果〔2〕。Chang等〔3〕研究发现姜黄素通过抑制MDR1蛋白的表达可诱导口腔癌细胞凋亡且对牙龈的毒性小。赵秀峰等〔4,5〕证实姜黄素对小鼠心肌缺血性细胞损伤具有保护作用。本文主要对姜黄素增强脂多糖(LPS)跨膜转运的机制及其抗动脉粥样硬化作用进行初步探究。
1 材料与方法
1.1 材料 体重约为150 g的健康小鼠20只由第三军医大学动物实验室饲养;姜黄素由重庆市中药研究所提供。
1.2 实验试剂及器材 胎牛血清,Gibco公司;DMEM,Invitrogen公司;胰酶,Thermo Scientific 公司;RPMI-1640培养基,Gibco公司;MTT,华美公司;兔抗大鼠 p-Caveolin-1、GAPDH 等一抗抗体,北京博奥森生物技术有限公司;辣根过氧化物酶标记羊抗兔 IgG,北京博胜经纬科技有限公司;聚丙烯酰胺、Tris-HCl、NC膜,Amersham公司;EDTA,Amresco公司;Transwell小室,北京优尼生物科技有限公司;MERS00002型跨膜细胞电阻仪,美国Millipore 公司;SYBRTM Premix Ex TaqⅡ,Takara公司;Bio-Red荧光定量PCR仪,Thermo Scientific公司。
1.3 方法
1.3.1 小鼠心肌细胞的培养 将20只小鼠随机分为五组,每组4只。对照组灌输生理盐水,治疗组和模型组小鼠提前3 d给予脂多糖(LPS)喂养,治疗组分别灌输姜黄素(0.3 g/L)一倍药量、两倍药量、三倍药量、四倍药量,2次/d,5 d后将小鼠用4%水合氯醛麻醉,麻醉后将小鼠解剖取出心脏,迅速置于100 ml PBS溶液中,清洗3次,用无菌剪刀去除心脏表面的组织血管等,用PBS溶液清洗后,将组织用剪刀剪成1 mm3大小的组织块放入锥形瓶,加入2 g/L的胰酶置于37℃摇床100 r/min培养30 min,将上层细胞悬浮液用移液枪吸取后,加入含10%胎牛血清的DEME,混匀后得到心肌细胞,将细胞置于37℃、5%CO2的培养箱中,当细胞贴壁数目达到80%时加入0.5%胰酶溶液进行消化,按照1∶3进行传代培养,培养的第三代细胞用于后续实验。
1.3.2 采用TER法检测姜黄素作用后心肌细胞通透性的变化 在体外将不同药量处理后的5组小鼠心肌细胞接种于DMEM液体培养基37℃培养1 d,加入胰酶消化细胞,使细胞浓度为1.5×105个/ml,取100 μl接种于六孔板置于Transwell上室中,上下室内均加入500 μl DMEM培养液,上室中细胞培养分为5组,每组四个重复,细胞培养至单层,用电阻仪检测上下室之间的电阻值,观察细胞通透性的变化。
1.3.3 放射法检测含药的心肌细胞的通透性 将体外5组培养生长到对数期的细胞接种于加入〔3〕H标记LPS的DMEM液体培养基中,培养1 d待反应结束后加入不含血清DMEM液体培养基漂洗2次,加入含5%BSA的DMEM液体培养基和载体蛋白apoA-I后连续培养6 h,设置阴性对照为不加载体蛋白apoA-I,分别收集上清培养基和破裂细胞,用0.22 μm的微孔过滤器过滤,PBS溶液清洗2次,取上清和裂解细胞液200 μl,用液闪计数仪测定上清、细胞及阴性对照细胞〔3〕H内毒素放射量,内毒素的流出率=(上清〔3〕H内毒素放射量-阴性对照量)/(总〔3〕H内毒素放射量)。
1.3.4 Western印迹法检测小窝蛋白(Cav)-1蛋白的表达 参照Triton-100细胞裂解液膜蛋白试剂盒进行裂解后细胞内Cav-1蛋白的提取,利用BCA蛋白浓度测定试剂盒进行蛋白浓度的测定,配置8%的分离胶与5%的浓缩胶,蛋白样品中加入1/2体积的SDS上样缓冲液,每孔上样蛋白10 μg,Marker 5 μl,50 V电压30 min,待指示剂进入分离胶后100 V电压至电泳结束。以兔抗鼠Cav-1、PKC、P-ERM、ERM抗体作为一抗,4℃过夜转膜,用PBS-T洗膜4次,按照(1∶5 PBS-T稀释)加入二抗,室温下反应1 h,用PBS-T洗膜4次。用ELC试剂盒检测发光剂显影,之后采用凝胶成像仪保存图像。
1.3.5 qRT-PCR检测姜黄素作用后细胞内皮ICAM-1、VCAM-1基因表达 采取最佳姜黄素处理浓度1.2 g/L灌喂治疗组小鼠后提取心肌组织内皮RNA,参照RNA试剂盒进行操作,参照cDNA反转录试剂盒进行RNA反转录,根据ICAM-1的序列设计引物序列:正义:5′-AGGTATCCATCCATCCCACA-3′,反义:5′-AGT-GTCTCATTCCCACGGA-3′;VCAM-1的引物:反义:5′-CGGTCATGGTCAAGTGTTTG-3′,正义:5′-GAGATCCAGGGGAGATGTCA-3′。内参β-actin序列:反义:5′-CGTTGACATCCGTAAAGA-3′,正义:5′AGCCACCAATCCACACAG-3′。反应体系:SYBRTM Premix Ex TaqⅡ 10 μl,ddH2O 8 μl,上下游引物各0.5 μl,cDNA模板1 μl。在Bio-Red荧光定量PCR仪上按照反应程序94℃变性3 min;95℃ 10 s;60℃ 20 s;72℃ 20 s;40个循环;95℃ 1 min进行反应,以β-actin基因为内参,采用2-ΔΔcq算法进行基因表达数据的分析。
1.4 统计学分析 使用GraphPad Prism 5 统计学软件行方差分析并绘图。
2 结 果
2.1 TER法检测姜黄素作用心肌细胞后单细胞层的电阻值 对照组随着时间的增加,细胞膜的通透性并未发生明显的变化。与对照组比较,姜黄素处理后的心肌细胞层的电阻值降低,并且随着姜黄素浓度增加,细胞的通透性逐渐升高。见表1。
2.2 放射法检测含药的心肌细胞〔3〕H LPS流出率 姜黄素作用后的小鼠心肌细胞膜内的LPS流出率与对照组相比下降;随着姜黄素浓度的升高,流出率逐渐降低,与剂量浓度呈现负相关。见表1。
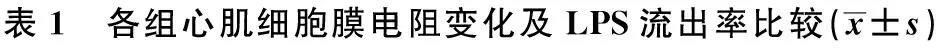

组别电阻值TER(Ω,×cm2)流出率(%)对照组19.21±0.6311.74±0.46模型组31.52±0.397.69±0.570.3g/L姜黄素28.68±0.5410.23±0.741)0.6g/L姜黄素22.59±0.751)12.38±0.651)0.9g/L姜黄素18.52±0.761)14.37±0.362)1.2g/L姜黄素15.27±0.662)16.07±0.262)
与对照组相比:1)P<0.05;2)P<0.01
2.3 姜黄素作用后对心肌细胞Cav-1蛋白表达的影响 与对照组相比,姜黄素处理后Cav-1蛋白表达量均下降,且随着时间的延长,表达量逐渐降低,在药量浓度范围内呈负相关,表明姜黄素处理后转运蛋白Cav-1量降低,减少了细胞的炎症反应。见图1。

a:对照组;b:模型组;c:治疗组+0.3 g/L姜黄素;d:治疗组+0.6 g/L姜黄素;e:治疗组+0.9 g/L姜黄素;f:治疗组+1.2 g/L姜黄素;下图同图1 姜黄素处理后细胞膜内Cav-1蛋白的表达
2.4 姜黄素作用后细胞内皮ICAM-1、VCAM-1蛋白表达量 与对照组(1.02±0.82,1.00±0.85)不做任何处理的心肌细胞对比,LPS处理过的心肌细胞内VCAM-1、ICAM-1蛋白表达量(1.98±0.62,2.34±0.18)均升高,且与姜黄素浓度呈负相关;随着姜黄素药物作用浓度的升高,VCAM-1、ICAM-1基因和蛋白的表达量逐渐降低(0.3、0.6、0.9、1.2 g/L姜黄素组分别为1.74±0.15,1.49±0.36;1.25±0.62,1.28±0.14;0.96±0.56,0.89±0.21;0.73±0.17,0.80±0.11)。表明姜黄素可能通过调控VCAM-1、ICAM-1基因抑制动脉粥样硬化的形成。见图2。

图2 姜黄素作用后细胞内皮ICAM-1、VCAM-1蛋白表达
3 讨 论
姜黄素通过抑制LPS诱导型一氧化氮合酶(iNOS)的产生,进而抑制过氧化物的产生起到消炎的作用〔6〕。有研究表明姜黄素能够抑制血管生成,其主要通过抑制肿瘤细胞的增殖进而促进血管内皮细胞迁移,并且对血管的抑制具有特异性〔7〕。
体内发生炎症反应时,LPS、TNF-α会使内皮细胞产生间隙,细胞通透性升高〔8〕。本研究通过TER法检测单细胞层的电阻值,表明心肌细胞的通透性升高,姜黄素可能通过增加心肌细胞的通透性使LPS在内皮细胞膜间运输。TER法(跨膜电阻测定)一般分为两种:接触式与非接触式培养〔9〕,两者区别在于组织内皮细胞和组织细胞接种于培养室的两侧,二者之间的细胞间物质是否可以进行自由交换〔10〕,接触式培养主要研究组织细胞之间的相互作用,非接触式培养研究细胞间物质的运输,张水华等〔11〕通过非接触式培养法测定血脑屏障模型的TER。TER法关键的技术操作在于组织细胞单层细胞的培养及接种浓度的确定,若非单层细胞或细胞浓度过高,均会影响实验结果〔12〕。Cav-1是位于胞膜上的凹陷囊状结构,体内广泛存在,主要参与细胞增殖、肿瘤、凋亡等生命活动〔13〕。已有研究证实,Cav-1基因沉默会导致细胞通透性增强〔14〕。Jie等〔15〕研究发现脑缺血后,Cav-1的表达升高,从而诱导claudin-5的表达,表现出脑部组织水肿。本实验结果表明姜黄素通过抑制Cav-1蛋白的表达,降低了膜上LPS等大分子的运输,增强细胞的自我保护能力,但对于具体参与抑制Cav-1蛋白的信号路径尚未清楚,还需要进一步深入研究。
放射性核素标记法是检测微量物质的一种实验方法,具有操作简单、灵敏度高、作用范围广,在医学及生物界广泛应用〔16〕。本实验表明姜黄素可能是通过抑制LPS跨膜转运而对细胞进行保护。同位素标记法实验也存在局限性:(1)标记后的化合物其生化结构稳定性降低,(2)辐射后化合物自身分解,(3)标记的原子会因为结构的不稳定发生移动造成实验错误〔17〕。因此,在实验操作过程中要控制好放射标记物反应的时间。 动脉粥样硬化是常见的心脑血管疾病之一,伴随着炎症反应的发生,寻找新型抗动脉粥样硬化药物是当前主要任务〔18〕。姜黄素除了在治疗心血管病方面发挥着重要的作用外,在抑制动脉粥样硬化方面也起到了良好的效果〔19〕。 研究发现他汀类药物具有抗动脉粥样硬化的作用,主要是通过抑制GTP酶的表达而起到消炎的作用〔20〕。P 选择素抑制剂 PSI-697能有效降低小血管表皮白细胞的聚集,减小表面脂块的大小,起到消炎及抗动脉粥样硬化的作用〔21〕。 ICAM-1、VCAM-1基因在动脉粥样硬化的炎症反应中起着关键重要作用,负责血管内皮表面白细胞的迁移、聚集。ICAM-1、VCAM-1基因表达量升高可促进内皮细胞之间黏附,进而在血管表面形成脂块。本实验表明姜黄素通过调节心肌细胞表皮ICAM-1、VCAM-1基因的表达来抑制炎症的产生,从而抑制动脉粥样硬化的产生。姜黄素作为良好的心血管、逆肿瘤中药,具有廉价、高效、对人体副作用好,体外实验误差小等优点。
1 周代营,赵肃清,郑 希,等.哌啶酮类姜黄素类似物的合成及抗肿瘤活性研究〔J〕.中国药学 (英文版),2015;24(8):524-9.
2 Rapsomaniki E,Timmis A,George J,etal.Blood pressure and incidence of twelve cardiovascular diseases:lifetime risks,healthy life-years lost,and age-specific associations in 1.25 million people〔J〕.Lancet,2014;383(9932):1899-911.
3 Chang PY,Peng SF,Lee CY,etal.Curcumin-loaded nanoparticles induce apoptotic cell death through regulation of the function of MDR1 and reactive oxygen species in cisplatin-resistant CAR human oral cancer cells〔J〕.Int J Oncol,2013;43(4):1141-50.
4 赵秀峰,常 超,信栓力,等.姜黄素在大鼠心肌缺血再灌注中的作用研究〔J〕.中西医结合心脑血管病杂志,2010;8(8):956.
5 Ferreira FD,Kemmelmeier C,Arrotéia CC,etal.Inhibitory effect of the essential oil of Curcuma longa L.and curcumin on aflatoxin production by Aspergillus flavus Link〔J〕.Food Chem,2013;136(2):789-93.
6 Thangavelu K,Ravisankar N,Siddiq A,etal.In vitro antioxidant and anticancer potential of flowers of toddalia asiatica (Rutaceae)〔J〕.Int J Pharm Pharmaceutical Sci,2015;7(3):95-9.
7 窦志金,杜文众,刘 幸,等.姜黄素通过Hedgehog信号通路抑制胶质瘤细胞增殖〔J〕.中国微侵袭神经外科杂志,2014;19(5):228-31.
8 Witteman BPL,Conchillo JM,Rinsma NF,etal.Randomized controlled trial of transoral incision less fundoplication vs.proton pump inhibitors for treatment of gastroesophageal reflux disease〔J〕.Am J Gastroenterol,2015;110(4):531-42.
9 Meliton A,Meng F,Tian Y,etal.Role of krev interaction trapped-1 in prostacyclin-induced protection against lung vascular permeability induced by excessive mechanical forces and thrombin receptor activating peptide 6〔J〕.Am J Resp Cell Mol Biol,2015;53(6):834-43.
10 Chichger H,Duong H,Braza J,etal.p18,a novel adaptor protein,regulates pulmonary endothelial barrier function via enhanced endocytic recycling of VE-cadherin〔J〕.FASEB J,2015;29(3):868-81.
11 张水华,季龙凤,马 璟.非接触式共培养体外血脑屏障模型的跨膜电阻及通透性〔J〕.中国药理学与毒理学杂志,2012;26(6):882-7.
12 Srinivasan B,Kolli AR,Esch MB,etal.TEER measurement techniques for in vitro barrier model systems〔J〕.J Lab Automation,2015;20(2):107-26.
13 Cipriani P,Benedetto PD,Capece D,etal.Impaired Cav-1 expression in SSc mesenchymal cells upregulates VEGF signaling:a link between vascular involvement and fibrosis〔J〕.Fibrogenesis Tissue Repair,2014;7(1):13.
14 Zhang Y,Qu X,Li C,etal.miR-103/107 modulates multidrug resistance in human gastric carcinoma by downregulating Cav-1〔J〕.Tumour Biol,2014;36(4):2277-85.
15 Jie L,Xinchun J,Liu KJ,etal.Matrix metalloproteinase-2-mediated occludin degradation and caveolin-1-mediated claudin-5 redistribution contribute to blood-brain barrier damage in early ischemic stroke stage〔J〕.J Neurosci,2012;32(9):3044-57.
16 Luk L YP,Ruiz-Pernía JJ,Adesina AS,etal.Chemical ligation and isotope labeling to locate dynamic effects during catalysis by dihydrofolate reductase〔J〕.Angew Chem Int Ed Engl,2015;54(31):9016-20.
17 Von TC,Menzler J,Ly A,etal.Identification of a novel neurotrophic factor from primary retinal Müller cells using stable isotope labeling by amino acids in cell culture (SILAC).〔J〕.Mol Cell Proteom,2014;13(9):2371-81.
18 杨文慧,杨 莉,何 燕,等.外周动脉粥样硬化与冠状动脉病变 Gensini 评分的相关性〔J〕.中国老年学杂志,2015;35(9):2391-3.
19 Cao SQ,Li P,Yin TY,etal.Curcumin reverses multidrug resistance of human hepatocellular carcinoma bel7402/5-FU cells〔J〕.World Chin J Digestol,2012;18(2):135-9.
20 Cannon CP,Cariou B,Blom D,etal.Efficacy and safety of alirocumab in high cardiovascular risk patients with inadequately controlled hypercholesterolaemia on maximally tolerated doses of statins:the ODYSSEY COMBO Ⅱ randomized controlled trial〔J〕.Eur Heart J,2015;36(19):1186-94.
21 Dewyer NA,El-Sayed OM,Luke CE,etal.Divergent effects of Tlr9 deletion in experimental late venous thrombosis resolution and vein wall injury〔J〕.Thrombosis and Haemostasis,2015;114(5):1028-37.
〔2016-08-08修回〕
(编辑 郭 菁)
重庆市医学科研计划项目(No.2013-1-056)
周音频(1969-),男,博士, 副主任医师,主要从事心内科疾病研究。
R543.5
A
1005-9202(2017)07-1617-03;
10.3969/j.issn.1005-9202.2017.07.021
