黄芪注射液减轻缺氧缺糖/复氧复糖大鼠海马神经元凋亡的机制
2017-04-20董雅洁卢锴锋高维娟谢亚芹
董雅洁 卢锴锋 高维娟 钱 涛 谢亚芹
(承德医学院病理生理学教研室,河北 承德 067000)
黄芪注射液减轻缺氧缺糖/复氧复糖大鼠海马神经元凋亡的机制
董雅洁 卢锴锋 高维娟1钱 涛2谢亚芹
(承德医学院病理生理学教研室,河北 承德 067000)
目的 探讨黄芪注射液减轻缺氧缺糖/复氧复糖大鼠海马神经元凋亡的作用机制。方法 取体外无血清原代培养8 d的大鼠海马神经元,采用随机数表法分为A组:正常对照组、B组:模型组(缺氧缺糖/复氧复糖组)、C组:黄芪注射液溶剂对照组、D组:黄芪注射液组、E组:二甲基亚砜(DMSO)组、F组:Bax抑制剂组、G组:Bax激动剂组、H组:Bax抑制剂+黄芪注射液组、I组:Bax激动剂+黄芪注射液组。各组除A组均经0.5 h缺氧缺糖,分别采用免疫组化法和RT-PCR法对复氧复糖后0、0.5、2、6、24、72、120 h的Bcl-2、Bax及Caspase-3 mRNA的表达进行检测和比较。结果 各组海马神经元除0 h外,其他时间点的Bcl-2水平均高于A组,且各组Bcl-2水平均随时间延长而增高,2 h达到顶峰。除0 h外,其他各时间点H组大鼠海马神经元的Bcl-2水平均显著高于其他组(P<0.05),其次为F组、D组、I组、G组、E组、B/C组、A组,且B组与C组无显著差异(P>0.05)。各组大鼠海马神经元除0 h外,其他各时间点的Bax水平均低于A、B组,且各组均随时间延长而增高,6 h达到顶峰,各组大鼠海马神经元除0 h外,其他各时间点的Caspase-3 mRNA阳性神经元百分率均高于A组,且各组均随时间延长而增高,24 h达到顶峰。除0 h外,其他各时间点B组Bcl-2水平和Caspase-3 mRNA阳性神经元百分率均显著高于其他组(P<0.05),其次为E组、G组、I组、D组、F组、H组,且B组与C组各时间点比较无显著差异(P>0.05)。结论 黄芪注射液能够抑制缺氧缺糖/复氧复糖大鼠海马神经元Bax蛋白的表达,提高Bcl-2蛋白表达,抑制缺氧缺糖/复氧复糖大鼠海马神经元凋亡;且Bax激动剂能够加速缺氧缺糖/复氧复糖大鼠海马神经元凋亡,Bax抑制剂能够减轻缺氧缺糖/复氧复糖大鼠海马神经元凋亡。
Bax;黄芪注射液;缺氧缺糖/复氧复糖;海马神经元;凋亡
临床上治疗缺血性脑损伤的有效途径之一为抑制细胞凋亡〔1〕。目前常将黄芪注射液作为治疗缺血性脑血管病的常用药物,其能够显著抑制全脑缺血再灌注大鼠海马神经元凋亡,但临床上并未明确黄芪注射液对缺血性脑血管病患者作用的具体靶点〔2〕。研究表明〔3〕,在脑缺血损伤中,神经元凋亡受多种相关基因及蛋白的调控,其中Bax是与细胞凋亡关系最密切的凋亡调控基因之一。本研究旨在探讨黄芪注射液减轻缺氧缺糖/复氧复糖大鼠海马神经元凋亡的作用机制。
1 材料与方法
1.1 动物 1~2 d SPF级SD大鼠20只,雌雄兼有。
1.2 方法
1.2.1 大鼠海马神经元原代培养、形态学观察和纯度鉴定 取新生24 h内的SD乳鼠,酒精消毒后迅速取出海马组织,采用浓度为0.125%的胰蛋白酶消化法加机械吹打法分离细胞,用无血清培养基进行细胞培养。采用细胞免疫化学法检测海马神经元特异性烯醇化酶(NSE)和胶质纤维酸性蛋白A(GFAP) 的表达,在显微镜下观察海马神经细胞的生长情况和纯度。
1.2.2 细胞分组及模型制备 取体外无血清原代培养8 d的大鼠海马神经元,随机分为正常对照组(A组)、缺氧缺糖/复氧复糖组(B组)、黄芪注射液溶剂对照组(C组)、黄芪注射液组(D组)、二甲基亚砜(DMSO)组(E组)、Bax抑制剂组(F组)、Bax激动剂组(G组)、Bax抑制剂+黄芪注射液组(H组)、Bax激动+黄芪注射液组(I组)。A组:不做任何特殊处理,正常培养;B组:加入与正常对照组培养基等量的无糖Earle液,将培养皿置于37℃温箱里的缺氧装置中,压紧、密闭,快速通入高纯氮气(N2)5 min,以尽快排尽空气,调分压至1.5 kPa,继续缓慢、匀速、连续通入,30 min后换正常无血清培养液,继续在37℃恒温、5%CO2饱和湿度培养箱中培养;C组:加入等量的pH7.4的黄芪注射液溶剂即无菌去离子水,处理方法与B组同;D组:加入终浓度为0.5 g生药/L的黄芪注射液,进行缺氧缺糖/复氧复糖造模制备,直至细胞培养结束;E组:加入等量的无菌DMSO,处理方法与B组同;F组:用Bax抑制剂Bax inhibitor peptide V5预处理后,再进行缺氧缺糖/复氧复糖,直至细胞培养结束;G组:用Bax激动剂(BAM7)预处理后,再进行缺氧缺糖/复氧复糖,直至细胞培养结束;H组:用Bax inhibitor peptide V5预处理,而后加入黄芪注射液,再进行缺氧缺糖/复氧复糖,直至细胞培养结束;I组:用BAM7预处理,而后加入黄芪注射液,再进行缺氧缺糖/复氧复糖,直至细胞培养结束。神经细胞氧糖剥夺30 min后,分别复氧0.5、2、6、24、48、72、120 h。
1.2.3 指标测定 分别采用免疫组化法和RT-PCR法对复氧复糖后0、0.5、2、6、24、72、120 h的Bcl-2、Bax及Caspase-3 mRNA的表达进行检测和比较。免疫组化SP法具体操作按照试剂盒说明书进行(试剂盒购于北京中杉金桥公司)。RT-PCR法:收集细胞,采用TRIzol一步法将RNA提取出来,依据ExscriptTM RT reagent kit说明将RNA逆转录为cDNA。Caspase-3 cDNA引物序列下游5′-CAAAGCCAGTGGCACTCATTCTC-3′,上游5′-TGCGGCGTTACACGACCTT-3′,扩增片段长度为200 bp。内参照物β-actin的引物序列下游5′-ACATCTGGTGGAAGGTGGAC-3′,上游5′-GGACTTCGAGCAAGAGATGG-3′,扩增片段长度为509 bp。按照PCR Amplificationkit说明进行反应,扩增条件:95℃预变性3 min,94℃ 40 s,54℃ 40 s,72℃ 40 s,循环30次,72℃终末延伸3 min。给予PCR产物采用质量分数1.5%的琼脂糖凝胶电泳进行鉴定,以β-actin为内参照重复试验6次。采用凝胶分析软件Quantity one进行半定量分析,目的条带在200 bp位置。兔抗大鼠NSE多克隆抗体依照1∶50的比例稀释,阳性细胞质和凸起呈棕黄色,胞核内含有少量黄色颗粒。使用M1VNT图像分析系统对免疫组化阳性结果进行半定量分析。
1.3 统计学方法 应用SPSS13.0软件进行方差分析法和LSD-t检验。
2 结 果
2.1 NSE蛋白的表达 A组大鼠海马神经胞体饱满,突起明显,且突起的末端分支形成相互支持生长的神经网络,神经胶质细胞数量较少,5个400倍视野中有72个阳性神经细胞,纯度为(91.48±0.72)%。见图1。
2.2 各组各时间点Bcl-2水平比较 0 h时点A、B、C、D、E、F、G、H、I组Bcl-2水平分别为0.368±0.04,0.370±0.03,0.365±0.02,0.369±0.03,0.382±0.04,0.369±0.04,0.371±0.03,0.382±0.04,0.368±0.03,组间比较差异无统计学意义(P>0.05)。各组除0 h各时间点的Bcl-2水平均高于A组,且各组均随时间延长而增高,2 h达到顶峰。除0 h各时间点H组Bcl-2水平均显著高于其他组(P<0.05),其次为F组、D组、I组、G组、E组、B/C组、A组,且B组与C组无显著差异(P>0.05)。见表1。

图1 NSE蛋白表达(×400)
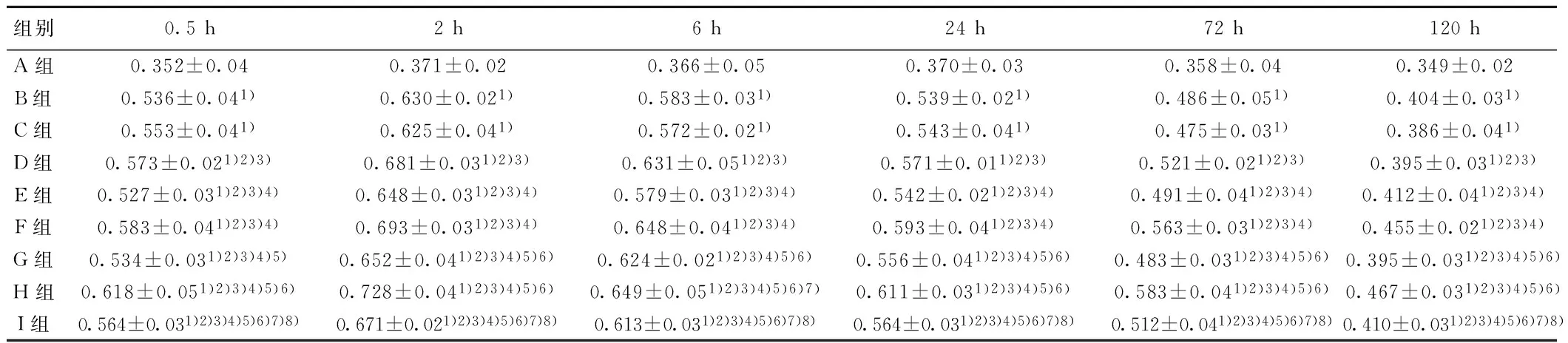
组别0.5h2h6h24h72h120hA组0.352±0.040.371±0.020.366±0.050.370±0.030.358±0.040.349±0.02B组0.536±0.041)0.630±0.021)0.583±0.031)0.539±0.021)0.486±0.051)0.404±0.031)C组0.553±0.041)0.625±0.041)0.572±0.021)0.543±0.041)0.475±0.031)0.386±0.041)D组0.573±0.021)2)3)0.681±0.031)2)3)0.631±0.051)2)3)0.571±0.011)2)3)0.521±0.021)2)3)0.395±0.031)2)3)E组0.527±0.031)2)3)4)0.648±0.031)2)3)4)0.579±0.031)2)3)4)0.542±0.021)2)3)4)0.491±0.041)2)3)4)0.412±0.041)2)3)4)F组0.583±0.041)2)3)4)0.693±0.031)2)3)4)0.648±0.041)2)3)4)0.593±0.041)2)3)4)0.563±0.031)2)3)4)0.455±0.021)2)3)4)G组0.534±0.031)2)3)4)5)0.652±0.041)2)3)4)5)6)0.624±0.021)2)3)4)5)6)0.556±0.041)2)3)4)5)6)0.483±0.031)2)3)4)5)6)0.395±0.031)2)3)4)5)6)H组0.618±0.051)2)3)4)5)6)0.728±0.041)2)3)4)5)6)0.649±0.051)2)3)4)5)6)7)0.611±0.031)2)3)4)5)6)0.583±0.041)2)3)4)5)6)0.467±0.031)2)3)4)5)6)I组0.564±0.031)2)3)4)5)6)7)8)0.671±0.021)2)3)4)5)6)7)8)0.613±0.031)2)3)4)5)6)7)8)0.564±0.031)2)3)4)5)6)7)8)0.512±0.041)2)3)4)5)6)7)8)0.410±0.031)2)3)4)5)6)7)8)
与A组比较:1)P<0.05;与B组比较:2)P<0.05;与C组比较:3)P<0.05;与D组比较:4)P<0.05;与E组比较:5)P<0.05;与F组比较:6)P<0.05;与G组比较:7)P<0.05;与H组比较:8)P<0.05,下表同
2.3 各组各时间点Bax水平比较 0 h时点A、B、C、D、E、F、G、H、I组Bax水平分别为0.443±0.04,0.430±0.06,0.432±0.05,0.429±0.03,0.428±0.05,0.419±0.04,0.419±0.04,0.421±0.04,0.427±0.05,组间比较差异无统计学意义(P>0.05)。各组除0 h各时间点的Bax水平均低于A、B组,且各组均随时间延长而增高,6 h达到顶峰。除0 h各时间点B组Bcl-2水平均显著高于其他组(P<0.05),其次为E组、G组、I组、D组、F组、H组,且B组与C组各时间点比较无显著差异(P>0.05)。见表2。
2.4 各组各时间点Caspase-3 mRNA阳性神经元百分率比较 0 h时点A、B、C、D、E、F、G、H、I组Caspase-3 mRNA阳性神经元百分率分别为(3.762±0.83)%,(3.479±0.83)%,(3.173±0.83)%,(3.249±0.74)%,(3.573±0.81)%,(3.482±0.39)%,(3.729±0.92)%,(3.684±0.84)%,(3.572±0.83)%,组间比较差异无统计学意义(P>0.05)。各组除0 h各时间点Caspase-3 mRNA阳性神经元百分率均高于A组,且各组均随时间延长而增高,24 h达到顶峰。除0 h各时间点B组Caspase-3 mRNA阳性神经元百分率均显著高于其他组(P<0.05),其次为E组、G组、I组、D组、F组、H组,且B组与C组各时间点比较无显著差异(P>0.05)。见表3。
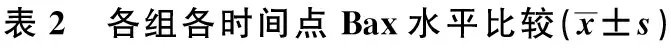

组别0.5h2h6h24h72h120hA组0.413±0.040.452±0.020.422±0.050.448±0.030.437±0.060.408±0.03B组0.730±0.041)0.880±0.031)0.965±0.021)0.795±0.051)0.644±0.061)0.514±0.021)C组0.728±0.061)0.875±0.041)0.972±0.031)0.810±0.021)0.639±0.051)0.621±0.041)D组0.655±0.041)2)3)0.735±0.031)2)3)0.802±0.041)2)3)0.693±0.031)2)3)0.576±0.041)2)3)0.468±0.051)2)3)E组0.718±0.051)2)3)4)0.894±0.041)2)3)4)0.973±0.021)2)3)4)0.782±0.041)2)3)4)0.652±0.041)2)3)4)0.521±0.031)2)3)4)F组0.628±0.031)2)3)4)5)0.714±0.051)2)3)4)0.784±0.041)2)3)4)5)0.671±0.041)2)3)4)5)0.609±0.031)2)3)4)5)0.439±0.041)2)3)4)5)G组0.703±0.041)2)3)4)5)6)0.884±0.051)2)3)4)5)6)0.961±0.031)2)3)4)5)6)0.773±0.051)2)3)4)5)6)0.638±0.051)2)3)4)5)6)0.517±0.041)2)3)4)5)6)H组0.601±0.041)2)3)4)5)6)7)0.702±0.041)2)3)4)5)6)7)0.749±0.031)2)3)4)5)6)7)0.654±0.031)2)3)4)5)6)7)0.584±0.051)2)3)4)5)6)7)0.417±0.031)2)3)4)5)6)7)I组0.692±0.031)2)3)4)5)6)7)8)0.871±0.041)2)3)4)5)6)7)8)0.948±0.021)2)3)4)5)6)7)8)0.751±0.021)2)3)4)5)6)7)8)0.618±0.041)2)3)4)5)6)7)8)0.502±0.031)2)3)4)5)6)7)8)

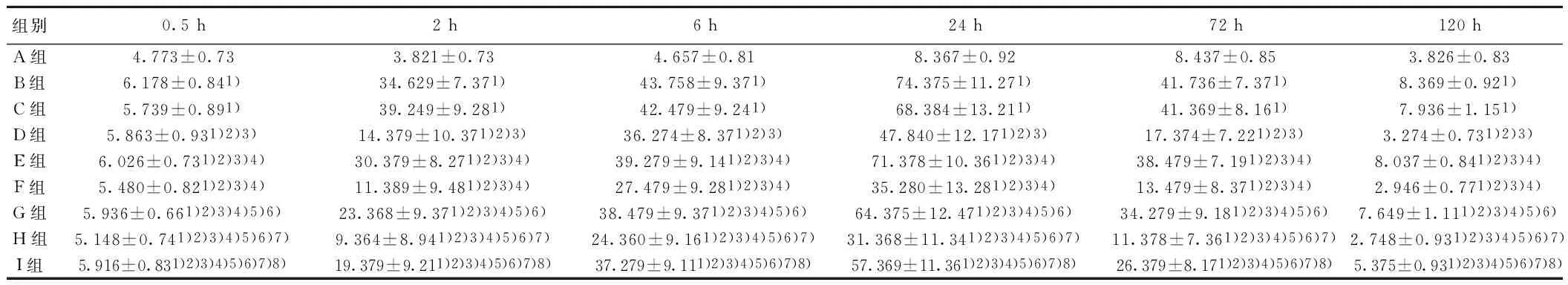
组别0.5h2h6h24h72h120hA组4.773±0.733.821±0.734.657±0.818.367±0.928.437±0.853.826±0.83B组6.178±0.841)34.629±7.371)43.758±9.371)74.375±11.271)41.736±7.371)8.369±0.921)C组5.739±0.891)39.249±9.281)42.479±9.241)68.384±13.211)41.369±8.161)7.936±1.151)D组5.863±0.931)2)3)14.379±10.371)2)3)36.274±8.371)2)3)47.840±12.171)2)3)17.374±7.221)2)3)3.274±0.731)2)3)E组6.026±0.731)2)3)4)30.379±8.271)2)3)4)39.279±9.141)2)3)4)71.378±10.361)2)3)4)38.479±7.191)2)3)4)8.037±0.841)2)3)4)F组5.480±0.821)2)3)4)11.389±9.481)2)3)4)27.479±9.281)2)3)4)35.280±13.281)2)3)4)13.479±8.371)2)3)4)2.946±0.771)2)3)4)G组5.936±0.661)2)3)4)5)6)23.368±9.371)2)3)4)5)6)38.479±9.371)2)3)4)5)6)64.375±12.471)2)3)4)5)6)34.279±9.181)2)3)4)5)6)7.649±1.111)2)3)4)5)6)H组5.148±0.741)2)3)4)5)6)7)9.364±8.941)2)3)4)5)6)7)24.360±9.161)2)3)4)5)6)7)31.368±11.341)2)3)4)5)6)7)11.378±7.361)2)3)4)5)6)7)2.748±0.931)2)3)4)5)6)7)I组5.916±0.831)2)3)4)5)6)7)8)19.379±9.211)2)3)4)5)6)7)8)37.279±9.111)2)3)4)5)6)7)8)57.369±11.361)2)3)4)5)6)7)8)26.379±8.171)2)3)4)5)6)7)8)5.375±0.931)2)3)4)5)6)7)8)
3 讨 论
缺血性脑血管疾病发病的重要病理生理缓解为脑缺血后的再灌注损伤,通过诱导细胞凋亡引起神经元死亡。临床上脑缺血/再灌注损伤的主要表现形式为缺氧缺糖/复氧复糖所造成的神经细胞损伤。有研究表明〔4〕,线粒体是有氧呼吸产生能量的主要场所,因而真核细胞凋亡的过程中线粒体发挥着枢纽作用,在神经细胞凋亡的控制中线粒体通路发挥着决定性作用。因而通过对分布在线粒体核膜、外膜、内质网膜上的Bcl-2家族蛋白的释放进行调控能够对细胞凋亡进行控制。
Bcl-2是Bcl基因家族中第一个被确认的能对抗细胞凋亡的基因,具有抑制细胞凋亡和延长细胞寿命的功能,经研究发现〔5〕,Bcl-2基因主要是通过阻断细胞凋亡的公共信号传导通路来实现抗细胞凋亡作用的。Bcl-2可通过阻滞线粒体释放细胞色素(Cyt)-C、凋亡诱导因子(AIF),或通过作用于聚二苯二甲酯酸(PTP)的有关蛋白阻止PTP的开放,维持线粒体内膜跨膜电位,发挥抑制细胞凋亡的功能〔5〕。Bax是 Bcl-2基因家族中最主要的促凋亡基因,多以非活性单体形式分布于胞质中,只有在接收到凋亡信号刺激后,发生分子构象改变,移位并插入线粒体外膜后形成Bax/Bax同源二聚体蛋白通道,破坏线粒体膜的完整性,致使Cyt-C释放入细胞中,与胞质内的凋亡蛋白酶活化因子(Apaf)-1和Caspase-9酶原形成复合物并相互作用,进而激活Caspase蛋白酶系统,引发一系列级联反应,产生凋亡信号,促进凋亡的发生〔6〕。Gibson等〔7〕发现,Bax基因能够促进凋亡蛋白的释放以及Caspase级联反应的激活,保护缺氧缺血的细胞。Hara 等〔5〕观察了沙土鼠短暂前脑缺血 5 min再灌注 48、72、96 h及7 d后,发现 Bax 的表达随再灌注时间的延长而增加,至 72 h达顶峰,96 h立即消失。Chen等〔8〕通过血管阻断法造成大鼠全脑缺血模型,在海马 CA1 区,Bax mRNA 和蛋白质表达均明显增多,由此可支持这样的假说:Bax 可能是导致神经元凋亡的原因。Bcl-2家族的促凋亡蛋白和抗凋亡蛋白,共同参与了Bax依赖性的线粒体细胞外膜通透性的调节,因而决定细胞存亡的关键是细胞内两种对立蛋白间的比率〔9〕。研究发现,通常情况下Bcl-2和Bax两种蛋白的表达量相对稳定,而当Bax在细胞内超表达时,Bax/Bax同源二聚体的数量明显增多,细胞对死亡信号的反应性增强,启动凋亡〔8〕;而当Bcl-2高表达时,则Bax/Bax二聚体大量解离,生成更为稳定的Bcl-2/Bax异源二聚体,对抗其诱导凋亡的作用,使细胞存活期延长。黄芪具有益气固表、补气生阳、抗毒生肌的功能,药理学研究结果显示,黄芪因其复杂的成分而具有多种多样的生理活性,其能够显著提高脑缺血/再灌注大鼠脑组织内超氧化物歧化酶、一氧化氮、一氧化氮合酶的含量,清除氧自由基,增加微循环灌注,进而减轻脑缺血/再灌注损伤。因而以黄芪提取液作为主要成分的黄芪注射液因其具有扶正祛邪、益气养元、健脾利湿、养心通脉的功效而被广泛应用于对缺血性脑血管疾病的治疗中〔10〕。本研究结果说明,黄芪注射液能够通过抑制Bax的表达来抑制缺氧缺糖/复氧复糖大鼠海马神经元的凋亡。因而推测,黄芪注射液对缺血性脑血管疾病作用的靶点为抑制Bax蛋白表达,但该推论仍需要进行进一步验证。
1 吕晋浩,马 宁,袁景林,等.高分辨率磁共振检测颅内动脉斑块预测缺血性脑血管事件的研究〔J〕.中华神经外科杂志,2015;31(5):444-7.
2 石景洋,付卫云,毛秉豫,等.缺血性脑血管病治疗中中药应用频次及临床分析〔J〕.时珍国医国药,2013;24(10):2464-7.
3 武登华,王光义.针刺结合亚低温对局灶性脑缺血再灌注大鼠Bcl-2及Bax蛋白表达的影响〔J〕.中国中西医结合杂志,2011;31(11):1506-9.
4 邢 菁,付 于.线粒体通透性转换孔与心脑血管缺血性疾病关系的研究进展〔J〕.中国老年学杂志,2014;34(2):265-7.
5 Hara A,Iwai T,Niwa M,etal.Immunohistochemical detection of Bax and Bcl-2 proteins in gerbil hippocampus following transient forebrain ischemia〔J〕.Brain Res,1996;711(1-2):249-53.
6 Reset R,Ortet L,Gomez G.Role of Bcl-2 family members on apoptosis:what we have learned from knock-out mice〔J〕.Front Biosci,2007;12(20):4722-30.
7 Gibson ME,Han BH,Choi J,etal.BAX contributes to apoptotic-like death following neonatal hypoxia-ischemia:evidence for distinct apoptosis pathways〔J〕.Mol Med,2001;7(9):644-55.
8 Chen J,Graham SH,Nakayama M,etal.Apoptosis repressor genes Bcl-2 and Bcl-x-long are expressed in the rat brain following global ischemia〔J〕.J Cereb Blood Flow Metab,1997;17(1):2-10.
9 王 彤,刘存志,刘玉珍,等.bcl-2/bax基因调控机体细胞凋亡的机制研究进展〔J〕.中国老年学杂志,2008;28(16):1658-60.
10 王 晶,蒋 璐,谭展鹏,等.黄芪注射液联合血必净注射液对缺血性脑卒中急性期神经保护作用的研究〔J〕.中西医结合心脑血管病杂志,2016;14(4):349-51.
〔2016-12-11修回〕
(编辑 袁左鸣)
河北省教育厅青年基金项目(No.Q2012002);承德医学院自然科学研究计划项目(No.Q201506);河北省高校重点学科建设项目资助(冀教高〔2013〕4号病理学与病理生理学)
1 河北中医学院 2 河北省人民医院
高维娟(1966-),女,教授,主要从事脑血管病发病机制及中医药防治。
董雅洁(1980-),女,主治医师,硕士,主要从事脑血管病发病机制及中医药防治。
R363
A
1005-9202(2017)07-1608-03;
10.3969/j.issn.1005-9202.2017.07.017
