肉桂酸对蚕豆枯萎病发生的影响及间作缓解机制*
2017-04-19艳董坤杨智仙朱锦惠汤利郑
董 艳董 坤杨智仙朱锦惠汤 利郑 毅,4†
(1 云南农业大学资源与环境学院,昆明 650201)
(2 云南农业大学食品科技学院,昆明 650201)
(3 云南大学图书馆,昆明 650091)
(4 西南林业大学国家高原湿地中心,昆明 650224)
肉桂酸对蚕豆枯萎病发生的影响及间作缓解机制*
董 艳1董 坤2杨智仙3朱锦惠1汤 利1郑 毅1,4†
(1 云南农业大学资源与环境学院,昆明 650201)
(2 云南农业大学食品科技学院,昆明 650201)
(3 云南大学图书馆,昆明 650091)
(4 西南林业大学国家高原湿地中心,昆明 650224)
采用盆栽试验,研究了肉桂酸不同浓度(C0(0.0 mg kg-1)、C1(14.0 mg kg-1)、C2(28.0 mg kg-1)和C3(56.0 mg kg-1))处理对蚕豆枯萎病发生的影响及小麦与蚕豆间作对肉桂酸自毒效应的缓解机制。结果表明:(1)蚕豆单作条件下,肉桂酸处理显著降低了根系的过氧化物酶(POD)活性并增加了丙二醛(MDA)含量,导致根系脂质过氧化伤害加剧;肉桂酸处理降低了根际微生物的活性(AWCD值)、香农(Shannon)多样性指数(H)和丰富度指数(S)并改变了微生物群落结构;肉桂酸处理显著增加蚕豆根际土壤中镰刀菌数量,提高了枯萎病病情指数并降低根系干重。(2)肉桂酸胁迫下,与单作蚕豆相比,小麦与蚕豆间作提高了蚕豆根系的POD活性,降低了MDA含量,提高了根际微生物对碳源的利用能力及根际微生物的H和S,明显改变了根际微生物群落结构;间作显著降低了蚕豆根际土壤中镰刀菌数量及枯萎病病情指数,显著增加了蚕豆地上部干重和根系干重。表明小麦与蚕豆间作一方面提高蚕豆对枯萎病菌的生理抗性,另一方面有效调节根际微生物活性和多样性,从而缓解了肉桂酸引起的枯萎病危害,促进了蚕豆生长,但间作减轻枯萎病危害的效果受肉桂酸处理浓度的影响。因此,利用非寄主作物小麦的化感效应而采取的间作模式是缓解蚕豆自毒效应的有效措施。
肉桂酸;蚕豆枯萎病;间作;微生物代谢功能多样性;抗氧化酶活性
连作障碍是长期以来困扰农业生产的复杂问题,作物连作障碍形成机理一直是国内外学者的研究热点[1-2]。连作土壤中酚酸类物质的累积是导致多种作物连作障碍发生的重要原因,目前研究者已从多种作物根系分泌物和连作土壤中检测出肉桂酸、对羟基苯甲酸、香草酸、丁香酸、香豆酸和阿魏酸等多种酚酸物质[3-4],其中肉桂酸是西瓜、黄瓜等作物连作土壤中常见的一种酚酸物质[1,5],且在黄瓜连作障碍中已经证明肉桂酸能显著促进黄瓜枯萎病的发生[6]。长期连作条件下,土壤中积累了大量的植物分泌物和腐解物,其释放的酚酸不断累积,极大地控制着土壤中优势微生物种群[1]。连作花生根系分泌物改变了花生根际土壤中微生物的群落结构,致使病原真菌富集,微生物群落结构恶化,使得土壤中的酚酸物质降解缓慢,造成酚酸物质积累,积累的酚酸不仅继续改变微生物群落结构,而且会抑制花生生长,提高花生发病率,如此恶性循环,产生花生连作障碍[7-8]。
蚕豆是典型的忌连作作物,近年来随着蚕豆生产的不断发展,主产区的连作障碍现象非常普遍且日益严重,造成蚕豆生长矮小、瘦弱、病害加重、结荚少、产量低,连作障碍已成为制约全球蚕豆可持续发展的重要因子[9]。枯萎病是蚕豆连作障碍中最主要的病害之一,该病在德国、日本和英国等均有报道,在中国蚕豆主产区发病非常普遍,云南是枯萎病发生最重的省份[10]。本课题组在前期研究中从蚕豆连作土壤中检测到肉桂酸,且其在连作土壤中含量最高[11],但肉桂酸是否是诱导蚕豆连作障碍发生的自毒物质尚不清楚。
间作是利用种间互作控制病虫害发生、提高粮食产量的传统农作措施。近年来研究者相继在旱作水稻与西瓜间作[5]、小麦与黄瓜间作[12]及大蒜与十字花科蔬菜[13]等体系发现间作缓解了作物连作障碍,并从间作系统中根际养分和微生物变化[13-14]、田间微气候改变[15]、病原菌的物理阻隔[16]以及非寄主间作作物根系分泌物中糖和氨基酸的变化[5]等方面开展了一些研究并取得了显著进展。最近,Dai等[17]在中药材茅苍术与花生间作系统的研究表明,间作缓解了花生连作障碍,原因是间作显著降低了花生根际土壤中对羟基苯甲酸、香草酸和香豆酸的含量,且茅苍术与花生间作时距离越近,降低花生根际酚酸含量的效果越好。小麦与蚕豆间作是云南乃至西南地区重要的间作种植模式,其具有显著的增产和控病优势,是农民增产增收的重要手段之一[11,14]。本课题组的前期研究表明,小麦与蚕豆间作改变了蚕豆根际土壤中酚酸的累积[18],减轻了枯萎病的发生,提高了产量[14],但有关肉桂酸胁迫下间作对蚕豆枯萎病发生的影响尚未见报道。本试验通过肉桂酸外源添加处理,研究其对蚕豆根系抗氧化酶活性、膜质过氧化、根际土壤微生物代谢功能多样性及病原菌生长的影响,从土壤微生物多样性和蚕豆生理抗性角度探讨肉桂酸促进蚕豆枯萎病发生的机制及间作减轻蚕豆枯萎病的机理。同时也为应用生物多样性持续控制作物病害、提高产量及实现农业可持续发展提供理论依据。
1 材料与方法
1.1 试验材料
供试蚕豆品种为89-147(Vicia faba L. cv. 89-147),小麦品种为云麦53(Triticum aestivum L. cv. Yunmai 53),均购于云南省农业科学研究院粮食作物研究所。
供试土壤采自云南省安宁市禄脿镇上村。土壤为水稻土(水耕人为土),有机质含量23.2 g kg-1,全氮1.90 g kg-1,碱解氮119.0 mg kg-1,有效磷56.5 mg kg-1,速效钾123.4 mg kg-1,pH 6.4。
尖孢镰刀菌菌种为尖孢镰刀菌蚕豆专化型Fusarium oxysporum f. fabae(FOF),由本实验室筛选和保存,在马铃薯葡萄糖琼脂培养基(PDA)平板上培养。
1.2 盆栽试验
盆栽试验于2014年10月至2015年2月在云南农业大学温室内进行。
试验为双因素设计,设2种种植模式(蚕豆单作、蚕豆与小麦间作)和肉桂酸4浓度处理(C0 (0.0 mg kg-1)、C1(14.0 mg kg-1)、C2(28.0 mg kg-1)和C3(56.0 mg kg-1)),组合为8个处理。每个处理均接种尖孢镰刀菌,分别为:单作接种镰刀菌不加肉桂酸,MFC0;间作接种镰刀菌不加肉桂酸,IFC0;单作接种镰刀菌+14.0 mg kg-1的肉桂酸,MFC1;间作接种镰刀菌+14.0 mg kg-1的肉桂酸,IFC1;单作接种镰刀菌+28.0 mg kg-1的肉桂酸,MFC2;间作接种镰刀菌+28.0 mg kg-1的肉桂酸,IFC2;单作接种镰刀菌+56.0 mg kg-1的肉桂酸,MFC3;间作接种镰刀菌+56.0 mg kg-1的肉桂酸,IFC3;每个处理3次重复,共计24盆。
从大田中采集蚕豆非连作土壤(即水稻土(水耕人为土)),去除杂质,过筛。每盆装入2.0 kg土壤,装盆之前先与肥料混和均匀。所施肥料为尿素、普钙和硫酸钾,各处理氮磷钾肥用量相同(N∶100 mg kg-1;P2O5∶100 mg kg-1;K2O∶100 mg kg-1)。将蚕豆和小麦种子消毒催芽后播种于盆钵中,单作条件下每盆播种蚕豆6株,间作条件下每盆播种蚕豆3株,小麦6株。待蚕豆幼苗生长至8 cm高时,向单作蚕豆和间作蚕豆的盆钵中浇灌不同浓度(0.0、50、100和200 mg L-1)的肉桂酸溶液,每盆每次浇灌80 ml溶液,每3 d浇灌1次,共计7次(相当于盆栽土壤中肉桂酸含量分别为0.0、14.0、28.0、56.0 mg kg-1)。待蚕豆长至12 cm高时,接种镰刀菌。设只接种镰刀菌而不加酚酸处理为对照(C0),接菌后进行正常管理。
接种尖孢镰刀菌30 d后采样,倒扣盆钵,小心取出小麦和蚕豆植株,抖掉与根系松散结合的土壤后,将与根系紧密结合的土壤用软刷子刷下来作为根际土壤样品,用于测定镰刀菌数量和微生物代谢功能多样性。
1.3 蚕豆枯萎病调查
蚕豆枯萎病发病程度分为5级:“0级”:茎基部及根无病斑,表观无症状;“1级”:茎基部或根的局部(除主根外)稍显病斑或稍变色;“2级”:茎基部或主侧根有病斑,但不连片;“3级”:1/3~1/2的茎基部或根部出现病斑、变色或腐烂,侧根明显减少;“4级”:茎基部被病斑环绕或根系大部分变色腐烂;“5级”:植株枯萎死亡。调查完成后计算病情指数。
病情指数= Σ(各级病株数×相应级值)/(最高级值×调查总株数)×100
1.4 根际镰刀菌数量测定
镰刀菌数量测定采用稀释平板法进行,所用培养基为尖孢镰刀菌的选择性培养基。具体配方为:KH2PO41.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,Fe-Na-EDTA 0.01 g,L-天门冬氨酸2.0 g,D-半乳糖20.0 g,蒸馏水1 000 ml(121℃灭菌20 min)。灭菌后加入:二硝基苯(75%WP)1.0 g,牛胆汁0.5 g,Na2B4O7·10H2O 1.0 g,硫酸链霉素0.3 g(培养基用10%磷酸调节pH至3.8 ± 0.2)。每平板涂布0.1 ml孢子悬液,28℃培养3 d后记录平板菌落数,每处理重复3次。
1.5 抗氧化酶活性和膜质过氧化程度测定
蚕豆根系过氧化物酶(POD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量测定参照李合生[19]的方法。
1.6 微生物代谢功能多样性测定
土壤微生物代谢功能多样性采用Biolog ECO板(ECO MicroPlate,美国)进行测定。称取10.0 g土壤加入90 ml无菌的0.85%的NaC1溶液中,在摇床上振荡30 min,将土壤样品稀释至10-3,吸取150 μl稀释液至ECO板的微孔中,接种好的板置于25℃恒温培养,每隔24 h在Biolog EmaxTM自动读盘机上用Biolog Reader 4.2软件(Biolog,Hayward,CA,美国)读取590 nm波长的光密度值,培养时间为168 h。以31个孔的平均光密度值(AWCD)作为整体活性的有效指标之一。
1.7 数据处理
采用培养96 h的数据计算香农(Shannon) 多样性指数(H)、丰富度指数(S),进行微生物碳源利用分析及主成分(PCA)分析。

式中,Ci为各反应孔在590 nm下的光密度值;R为ECO板对照孔的光密度值;Ci-R小于0的孔在计算中均记为零,即Ci-R的值均大于或等于0。
Shannon多样性指数(H)
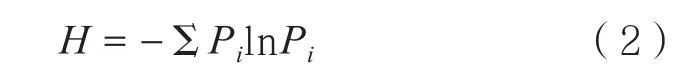
式中,Pi=(Ci-R)/Σ(Ci-R)。
群落丰富度指数(S)用碳源代谢孔的数目表示。
微生物碳源利用强度:Biolog ECO板中有31种碳源,可将31种碳源按功能团的不同分为六类:糖类10种、氨基酸类6种、羧酸类7种、聚合物4种、酚酸类2种以及胺类2种[14]。首先对六类碳源的C-R值分别进行求和,即可得到六类碳源的利用强度;对31种碳源的C-R值进行求和,即可得到碳源总利用强度。
采用Microsoft Excel 2003进行数据处理,采用SAS 9.0软件进行方差分析、主成分分析和相关分析,方差分析为单因素方差分析,最小显著差异法(LSD)检验各处理间的差异显著性。
2 结 果
2.1 肉桂酸对蚕豆生长的影响及间作效应
单作条件下,与不添加肉桂酸的对照(C0)相比,肉桂酸C3处理时,蚕豆幼苗地上部干重较对照降低40.2%(p<0.05)。蚕豆幼苗根系对肉桂酸处理较地上部敏感,肉桂酸C2和C3处理蚕豆根系干重较对照分别降低31.7%和54.1%(p <0.05),表明肉桂酸处理抑制了蚕豆幼苗生长,尤其对根系的抑制效应更为明显(图1)。
肉桂酸C0、 C1、 C2和C3浓度胁迫下,与单作蚕豆相比,间作使地上部干重分别增加32.5%、11.3%、23.6%和21.3%;使根系干重分别增加52.9%、72.9%、115.5%和154.9%,以上差异均达显著水平(p<0.05)。表明间作显著改善了蚕豆生长,缓解了肉桂酸对蚕豆生长的抑制效应(图1)。
2.2 肉桂酸对蚕豆枯萎病发生的影响及间作效应
单作条件下,与C0处理相比,肉桂酸C1处理对蚕豆枯萎病病情指数无显著影响,但C2和C3处理使枯萎病病情指数分别提高110.0%和180.0% (p<0.05),使蚕豆根际镰刀菌数量分别增加40.4%和108.1%(p<0.05)。表明肉桂酸能显著提高蚕豆枯萎病的发病严重程度,同时病情指数随肉桂酸处理浓度增加而显著提高(图2)。
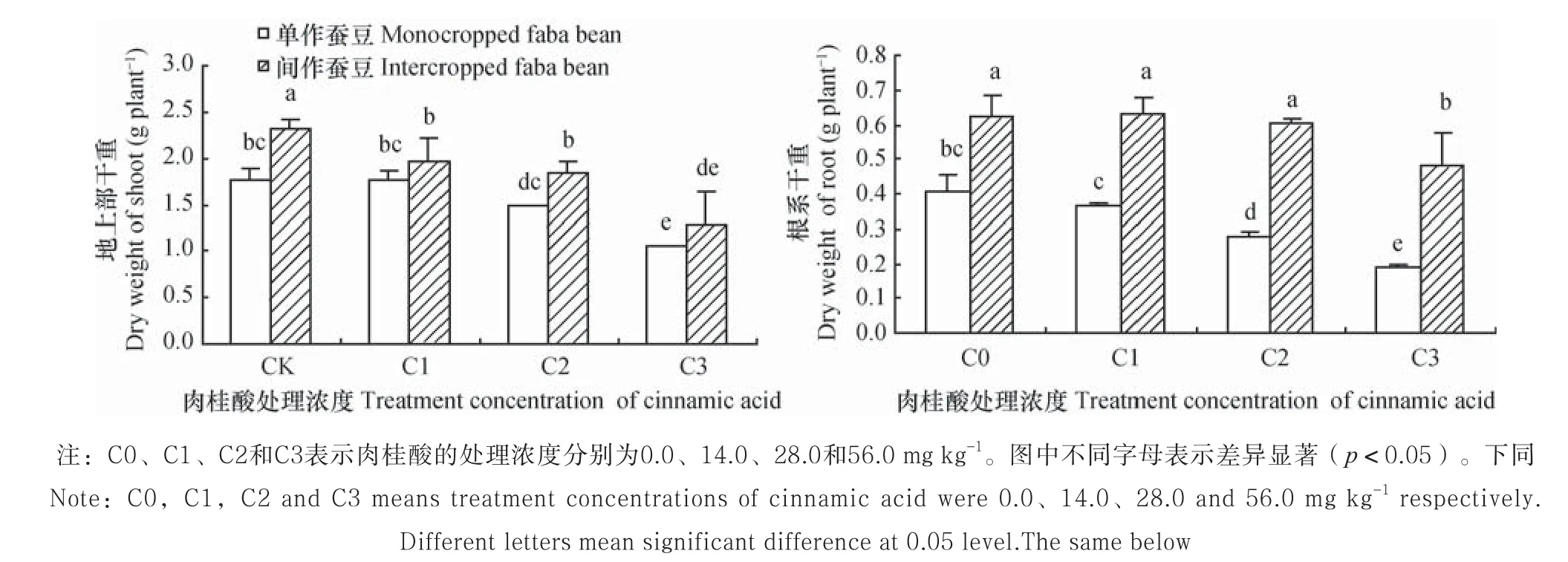
图1 肉桂酸胁迫下间作对蚕豆生长的影响Fig. 1 Effects of intercropping of wheat with faba bean on growth of faba bean under cinnamic acid stress
与单作相比,肉桂酸不同浓度处理下小麦与蚕豆间作均显著降低了蚕豆枯萎病的病情指数和根际镰刀菌数量。肉桂酸C0、C1、C2和C3处理下,与单作蚕豆相比,间作使蚕豆枯萎病病情指数分别降低50.5%、41.1%、42.9%和51.8% (p<0.05),使蚕豆根际镰刀菌数量分别降低24.2%、16.7%、11.5%和20.2%(p<0.05),表明间作能缓解由肉桂酸促进的蚕豆枯萎病的危害(图2)。

图2 肉桂酸胁迫下间作对蚕豆枯萎病病情指数和镰刀菌数量的影响Fig. 2 Effects of intercropping of wheat with faba bean on faba bean Fusarium wilt index and number of Fusarium oxysporum in soil under cinnamic acid stress
2.3 肉桂酸对蚕豆根系抗氧化酶和膜质过氧化的影响及间作效应
单作条件下,与C0处理相比,肉桂酸C1、C2 和 C3浓度处理下,蚕豆根系的POD活性分别降低19.0%、53.5%和61.5%(p<0.05),CAT活性与对照相比无显著差异(图3)。肉桂酸C1、 C2和C3处理下间作蚕豆根系的POD活性分别较单作提高22.4%、81.0%和100.0%(p<0.05),表明随肉桂酸处理浓度提高,间作对蚕豆根系POD活性的促进效应更大。肉桂酸各浓度处理下,间作均有提高蚕豆根系CAT活性的趋势,但单间作处理间CAT活性均无显著差异(图3)。
单作条件下,肉桂酸C1处理显著提高了蚕豆根系的MDA含量,且随肉桂酸处理浓度提高,MDA含量显著增加。与C0相比,肉桂酸C1、C2 和C3处理使蚕豆根系MDA含量分别提高45.1%、92.4%和145.1%(p<0.05)(图3)。与单作相比,肉桂酸C1、C2和C3浓度胁迫下,间作使蚕豆根系的MDA含量分别降低54.0%、62.7%和67.6% (p<0.05),表明小麦与蚕豆间作降低了蚕豆根系的膜质过氧化程度,提高了根系细胞膜的稳定性(图3)。
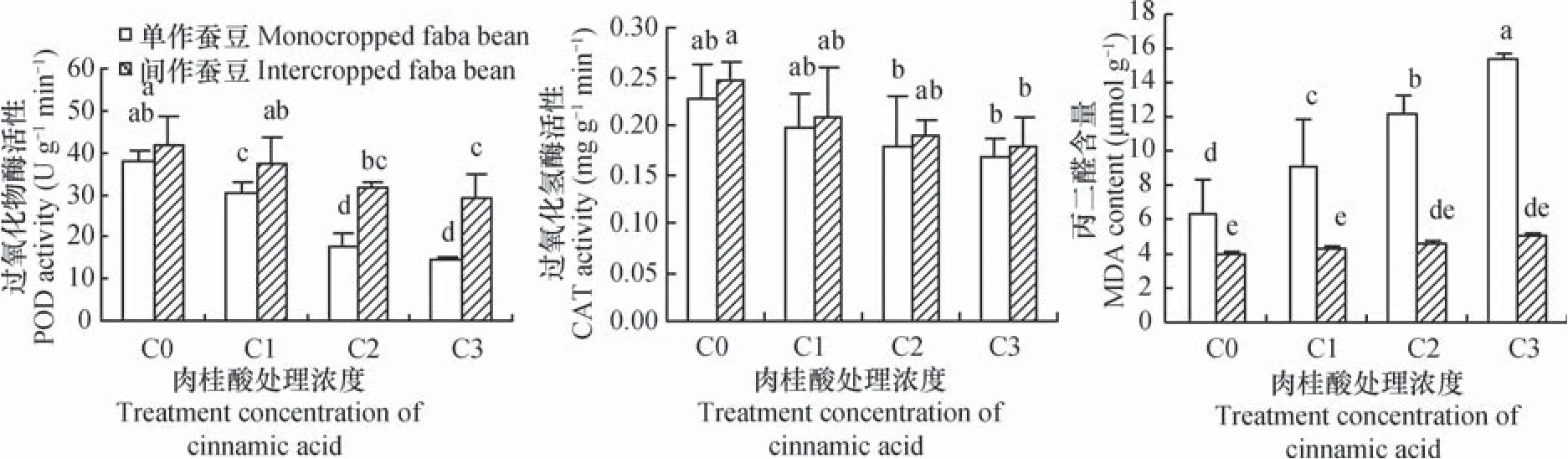
图3 肉桂酸胁迫下间作对蚕豆根系过氧化物酶、过氧化氢酶活性和丙二醛含量的影响Fig. 3 Effects of intercropping of wheat with faba bean on peroxidase(POD)and catalase(CAT)activities and malondialdehyde (MDA)content in faba bean roots under cinnamic acid stress
2.4 肉桂酸对蚕豆根际微生物活性(AWCD)的影响及间作效应
从图4可看出,随肉桂酸处理浓度增加,蚕豆根际微生物的活性(AWCD值)明显降低,表现为MFC0>MFC1>MFC2>MFC3的趋势,表明肉桂酸处理降低了蚕豆根际微生物的活性。培养96 h时,肉桂酸C0、C1、C2和C3浓度处理下,间作分别提高蚕豆微生物活性144.3%、44.4%、156.7%和75.3%。
2.5 肉桂酸对蚕豆根际微生物碳源利用强度的影响及间作效应
间作对蚕豆根际微生物的碳源利用强度有显著影响(p<0.05)。但肉桂酸不同浓度处理条件下间作效应不同,肉桂酸C0、C1和C2处理下,间作使蚕豆根际微生物对碳源的利用较单作分别提高了185.9%、110.5%和83.9%(p<0.05),C3处理下,间作蚕豆根际微生物对碳源的总利用强度与单作相比无显著差异(图5A)。
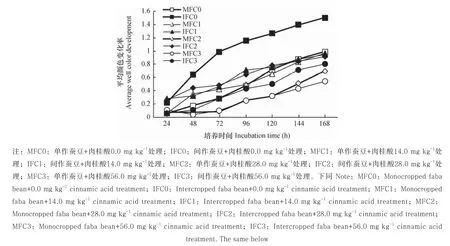
图4 肉桂酸胁迫下间作对蚕豆根际微生物平均颜色变化率的影响Fig. 4 Effects of intercropping of wheat with faba bean on AWCD in the rhizosphere soil of faba bean under cinnamic acid stress
从间作蚕豆根际微生物对Biolog ECO板中六类碳源的利用来看,肉桂酸C0、C1和C2处理下,与单作相比,间作使蚕豆根际微生物对糖(CH)类碳源的利用强度分别提高405.3%、309.6%和32.0%;对氨基酸(AA)类碳源的利用强度分别提高216.5%、52.7%和214.2%;对羧酸(CA)类碳源的利用强度分别提高206.2%、57.0%和43.2%,以C0浓度下间作对碳源利用的提高幅度最大。但C3处理下,间作蚕豆根际微生物对CH、AA和CA碳源的利用均无明显影响(图5B)。
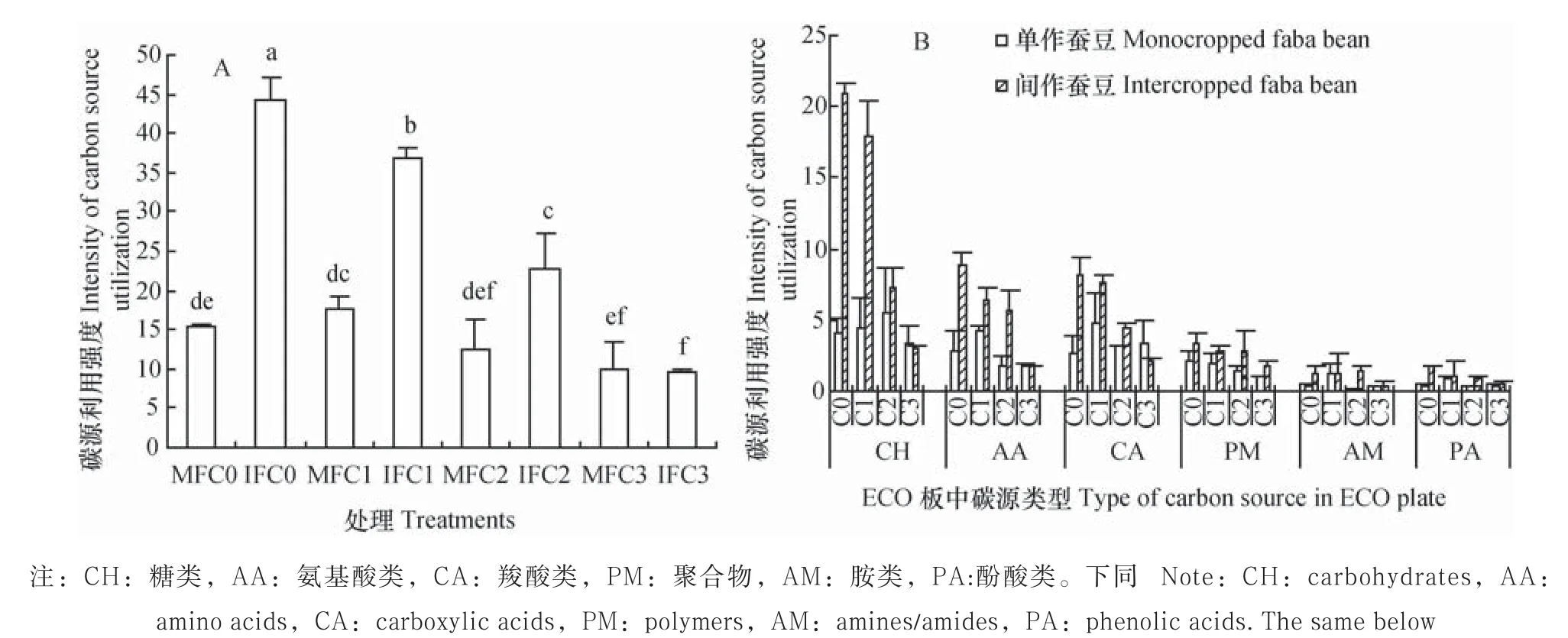
图5 肉桂酸胁迫下间作蚕豆根际微生物对碳源的利用强度Fig. 5 Carbon source utilization intensity of soil microbes in intercropped faba bean rhizosphere under cinnamic acid stress
2.6 肉桂酸对蚕豆根际微生物功能多样性指数的影响及间作效应
从表1可看出,单作条件下,肉桂酸处理降低了蚕豆根际微生物的Shannon多样性指数(H)和丰富度指数(S)。肉桂酸C2和C3处理时,蚕豆根际微生物的H较对照降低了5.1%和13.3% (p<0.05),S较对照降低了21.3%和36.2%(p <0.05)。肉桂酸不同浓度处理下间作较单作H提高2.7%~7.9%(p<0.05),S提高17.1%~27.0%(表1)。
2.7 肉桂酸和间作对蚕豆根际微生物群落碳源利用的主成分分析
从图6可看出,蚕豆单作条件下,C1、C2与C0在第1主成分(PC1)和第2主成分(PC2)上均无明显分离,表明肉桂酸C1和C2处理对蚕豆微生物群落结构无显著影响;而C3与C0、C1和C2在PC2上有一定的分离,表明C3浓度肉桂酸处理改变了根际微生物群落结构。
肉桂酸胁迫下,与单作相比,间作对蚕豆根际微生物具有重要的影响,但间作效果受肉桂酸处理浓度的调控。肉桂酸C1和C2处理下,间作蚕豆和单作蚕豆根际微生物群落在PC1上有较好的分离,表明肉桂酸胁迫下间作明显改变了蚕豆根际微生物的群落结构;当肉桂酸添加量达到C3浓度时,单间作蚕豆根际微生物在PC1和PC2上均无明显分离,表明高浓度肉桂酸处理下,间作对根际微生物群落结构的影响变小(图6)。
为了找到对PC1和PC2影响较大的碳源种类,进一步利用PC1和PC2得分系数与31种碳源的吸光度值进行主成分相关分析得到相关系数,相关系数绝对值越大,表示该碳源对主成分的影响越大。从表2可看出,与PC1有较高相关性的碳源有8个(相关系数︱r︱>0.6),主要包括糖类(2个) 、氨基酸类(3个)、羧酸类(1个)、聚合物类(1个)和胺类(1个);其中达到显著差异的碳源分别是糖类中的D-半乳糖酸-γ-内酯、氨基酸类碳源中的L-精氨酸和L-丝氨酸、聚合物碳源中的聚山梨醇酯40及胺类碳源中的腐胺。而与PC2具有较高相关性的碳源有5个,主要包括糖类(4个)和聚合物(1个)。以上分析表明,在PC1和PC2上相关性较高的碳源主要是糖类和氨基酸类碳源,这两类碳源是区分肉桂酸胁迫下单间作处理间差异的敏感碳源。
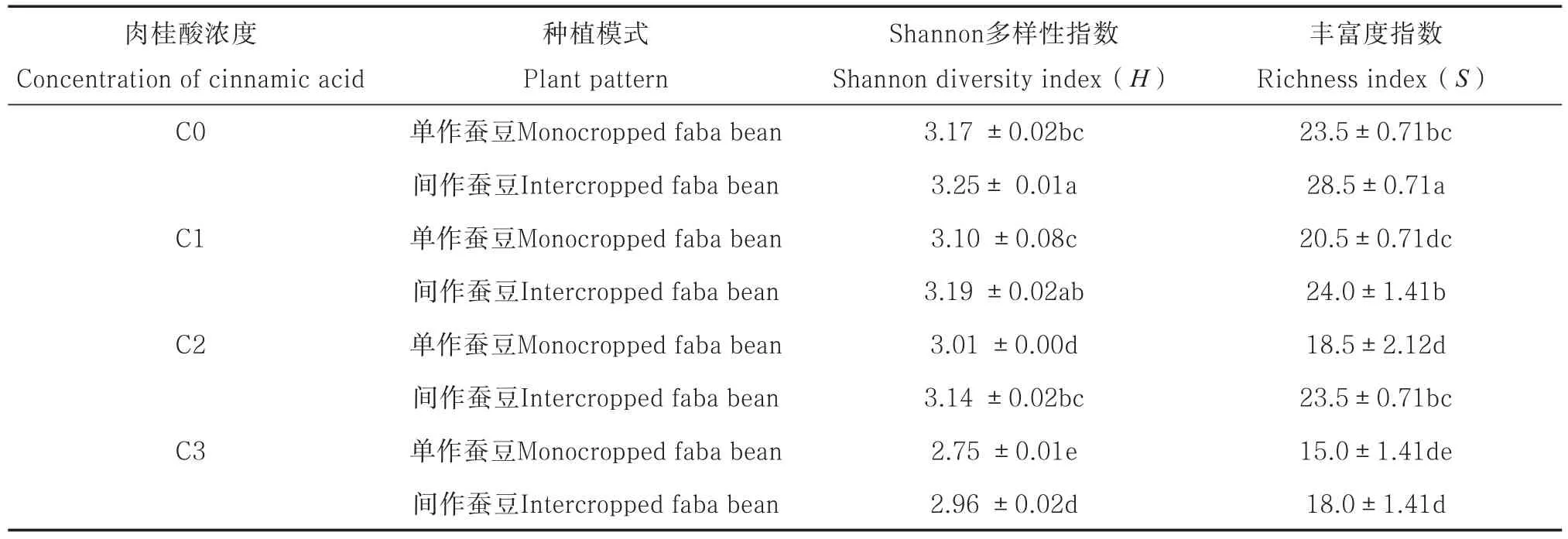
表1 肉桂酸胁迫下间作对蚕豆根际微生物多样性指数和丰富度指数的影响Table 1 Effects of intercropping on microbial diversity index and richness index in the rhizosphere soil of faba bean under cinnamic acid stress

图6 肉桂酸胁迫下单间作蚕豆根际微生物群落结构的主成分分析Fig. 6 Principal component analysis(PCA)of community structure of the soil microbes in the rhizosphere soil of monocropped and intercropped faba beans under cinnamic acid stress
肉桂酸不同浓度处理下蚕豆单间作处理间根际微生物群落功能多样性的改变主要是由微生物利用糖类碳源(D-半乳糖酸-γ-内酯、D-木糖)、氨基酸类碳源(L-精氨酸、L-丝氨酸和L-苏氨酸)、羧酸类碳源(D-半乳糖醛酸)、聚合物碳源(聚山梨醇酯40)和胺类碳源(腐胺)的差异引起的(表2和图6)。
3 讨 论
3. 1 肉桂酸对蚕豆枯萎病发生的助长效应
农业生产中,许多作物连作种植均导致土传病害严重发生,致使作物产量下降和品质变劣[1,8,10]。土传病害一直是连作障碍的研究重点,多年来被认为是大多数作物产生连作障碍的主要原因之一[20-21]。近年来的研究结果表明,凡容易引起自毒作用的作物一般也易引起土传病害产生而导致连作障碍,即化感自毒物质对土传病害发生具有重要影响[22]。自毒物质对羟基苯甲酸胁迫下,尖孢镰刀菌对草莓根系的感染率显著提高,枯萎病发生明显加重[23]。莴苣根系的渗出液可抑制莴苣种子发芽和幼苗生长,并可增强镰刀菌枯萎病菌的感染能力,二者的共同作用导致莴苣生长缓慢[24]。本研究结果表明,与不添加肉桂酸的对照(C0)处
理相比,肉桂酸中、高浓度处理分别使根际镰刀菌数量增加40.4%和108.1%(p<0.05),蚕豆枯萎病病情指数提高110.0%和180.0%(p<0.05)(图2),幼苗地上部和根系干重均低于对照(图1),证实了肉桂酸能促进土传病害发生而抑制蚕豆生长,加剧蚕豆连作障碍。

表2 31 种碳源与PC1、PC2 的相关系数(r>0.6或r<-0.6)Table 2 Pearson’s correlation coefficients of 31 types of carbon sources with PC1 and PC2(r>0.6 or r<- 0.6)
自毒物质助长土传病害发生的原因,一方面是化感自毒物质通过改变根际微生物区系组成等间接影响病原微生物生长繁殖[25-26]。自毒物质酚酸是土壤微生物群落演变的重要推动者,酚酸物质在土壤中表现出的化感作用是通过改变土壤微生物群落变化而实现的[7]。随着对根际微生态环境中植物―土壤―微生物相互作用各过程的深入了解,研究者认为土传病害的发生和植株发育不良是作物连作障碍的直观表象,但其致病的根本原因是作物根系分泌物和腐解物中酚酸类化感物质引起的根际微生物区系失衡和多样性下降,最终导致土壤中病原菌激增而引发严重的土传病害[1,4,25]。Zhou和Wu[27]通过外源添加黄瓜连作自毒物质——香豆酸至土壤中,发现香豆酸对土壤微生物群落结构产生显著影响,导致厚壁菌门和β变形菌门等细菌大量增加,而使拟杆菌门、δ变形菌门和浮霉菌门等细菌显著减少,同时还造成土壤中病原菌大量繁殖增长。土壤外源添加3 μg kg-1的苯甲酸或8 μg kg-1的3-苯丙酸时,土壤微生物功能多样性显著下降,病原菌对苯甲酸和3-苯丙酸的利用优于拮抗菌,这是烟草长期连作引起青枯病暴发流行的机理之一[28]。本研究结果表明,与不添加肉桂酸的对照相比,随肉桂酸处理浓度增加,蚕豆根际微生物活性、Shannon多样性指数和丰富度指数均显著下降(图4和表1),微生物群落结构发生明显变化(图6),表明肉桂酸降低蚕豆根际微生物活性和多样性从而降低其对根际能源和碳源的利用(图5);对病原菌而言可用的碳源较多而大量增殖(图2),最终促进镰刀菌的生长而加剧枯萎病的发生。表明,连作自毒物质是连作障碍产生的初始诱因,其通过改变根际微生物活性、多样性和群落结构而在连作障碍形成中发挥重要作用。
自毒物质助长土传病害发生的另一方面原因是,随着土壤中自毒物质的逐渐积累,达到一定量时就会对该作物产生自毒作用。POD和CAT等被认为是清除活性氧过程中最主要的抗氧化酶类,可帮助植物维持体内活性氧代谢平衡,增强抗性,因此CAT和POD活性可作为植物抗病的生理指标[29]。酚酸外源添加后,花生幼苗的细胞膜受到损伤,细胞内活性氧自由基增加,导致MDA含量增加,使连作土壤中的土传病原菌更容易入侵,造成花生发病率增加[8]。本研究中,与对照相比,肉桂酸处理下蚕豆根系的POD活性降低19.0%~61.5% (p<0.05),MDA含量提高45.1%~145.1%(p <0.05)(图3),表明肉桂酸处理降低了蚕豆根系的生理抗性并加速膜脂过氧化,不仅造成营养元素的泄漏,同时也刺激了病原菌,使其更易侵入蚕豆而促进枯萎病发生。本研究结果与下述结论相同:连作土壤上栽培的西瓜,由于受到土壤中尖孢镰刀菌等病原菌的侵害,膜系统的氧自由基升高,导致西瓜体内MDA含量上升,西瓜启动CAT和POD以抑制病原菌的破坏,保护自身生长和代谢[29]。
3.2 小麦与蚕豆间作对肉桂酸助长效应的缓解效果及机理
利用植物化感作用而采用的间作模式,是以植物为药源取代化学杀菌剂,去弊存利的植物保护措施,是解除连作障碍的有效手段[15,17,29]。小麦、毛苕子和三叶草分别与黄瓜间作均降低了黄瓜根际尖孢镰刀菌数量,降低了黄瓜枯萎病的病情指数并提高黄瓜产量[12]。西瓜与旱作水稻间作有效减轻了西瓜枯萎病的危害,改善了西瓜连作障碍[29]。本研究结果发现,肉桂酸胁迫下,小麦与蚕豆间作显著降低了蚕豆枯萎病的病情指数,表明小麦与蚕豆间作缓解了肉桂酸引起的蚕豆枯萎病危害。在菇菜套作体系也同样观察到套作可抑制某些病原菌(如稻黑孢菌、尖孢镰刀菌等)而降低了番茄土传病害的发病率[30]。
Bais等[31]的研究表明,根际微生物数量的富集和种群特征的显现是由根系分泌物启动和调节的,因此,间作改变根际微生物群落结构与间作系统根系分泌物密切相关。Biolog ECO微平板中的碳源利用了许多与生态有关的化合物,31种碳源中至少有9种是植物根系分泌物的组分,如精氨酸、苏氨酸、丝氨酸、苹果酸、2-羟基苯甲酸和4-羟基苯甲酸等,这在一定程度能够模拟根际微生物对根系分泌物的利用情况[32]。因此,深入分析根际微生物对Biolog ECO板中碳源利用情况对理解间作控制土传病害有重要意义。通过分析根际微生物对单一碳源的相对利用率及六类碳源的利用强度,发现肉桂酸胁迫下间作蚕豆根际微生物活性及根际微生物对碳源的总利用强度显著高于单作(图4和图5),表明肉桂酸胁迫下小麦与蚕豆间作系统根际微生物能够利用多种碳源且具有较高的利用效率(图5),可对根际能源和碳源进行迅速消耗而旺盛生长,与根际尖孢镰刀菌进行“营养竞争”,使镰刀菌因为可用碳源较少而不能大量增殖;尤其是糖类和氨基酸类碳源是区分蚕豆单间作处理间根际微生物群落结构差异的敏感碳源(表2),表明肉桂酸胁迫下间作对枯萎病的控制与糖类和氨基酸类碳源的利用密切相关,原因是作物根系分泌物中糖和氨基酸类物质对尖孢镰刀菌生长具有显著的促进作用,如西瓜根系分泌物中高糖和游离氨基酸供给可为其致病菌提供丰富的营养,利于其增殖而促进枯萎病发生[33]。综上,肉桂酸胁迫下小麦与蚕豆间作极大促进了以利用糖类和氨基酸为碳源的微生物繁殖而对其大量消耗,最终减轻糖和氨基酸对尖孢镰刀菌的刺激而减轻枯萎病发生。
除“营养竞争”外,根际酚酸的降解也是间作缓解连作障碍的重要原因。前期研究中发现间作蚕豆根际酚酸含量显著低于单作蚕豆[18]。本研究中,肉桂酸胁迫下间作蚕豆根际微生物活性高于单作,间作系统较高的微生物活性可能对连作蚕豆根际累积的肉桂酸具有降解效果,反映了间作系统较高的微生物活性在连作障碍缓解中发挥着重要的作用。间作系统较高的微生物活性形成原因是,间作系统中不同作物会产生不同的特异根系分泌物,并形成与之相适应的根际微生物群落,同时间作作物根系相互交错,产生了丰富多样的根际分泌物,从而提高土壤微生物的整体代谢活性,促进土壤微生物群落结构多样化的形成[34],但小麦与蚕豆间作究竟提高了哪些微生物的活性而缓解蚕豆连作障碍还需进一步研究。
菇菜套作不仅影响土壤微生物活性,对其群落结构也产生了影响,真菌群落结构出现较大差异而抑制了土壤中尖孢镰刀菌和稻黑孢菌的生长,降低了土传病害发病率而维系土壤健康,进而显著提高番茄地上和地下生物量[30]。本研究中,小麦与蚕豆间作明显改变了蚕豆根际土壤的微生物群落结构并降低了蚕豆根际尖孢镰刀菌数量(图6和图2),缓解了连作障碍而促进蚕豆生长(图1)。但肉桂酸高浓度处理下单间作处理间微生物群落结构的变化相对较小,表明间作对连作障碍的缓解效果受自毒物质浓度的影响,自毒物质浓度较高时,间作缓解连作障碍的效果不明显。本研究中小麦与蚕豆间作显著提高了蚕豆根际微生物的H和S,降低了蚕豆枯萎病的危害,该研究结果与微生物群落结构越丰富、多样性越高时对抗病原菌的综合能力就越强[35]的结论相同。因此,间作调控作物根际微生物的多样性和群落结构是减轻土传病害的关键。
从蚕豆生理抗性角度来看,小麦与蚕豆间作有效缓解了蚕豆植株所受到的连作胁迫程度,表现为蚕豆根系的CAT和POD活性显著高于单作,说明间作引起蚕豆根系内抗氧化酶类活性升高,同时显著降低根系的MDA含量,表明间作从生理上提高了蚕豆自身的抗性。
4 结 论
肉桂酸在根际土壤的累积加剧了土传枯萎病的发生并抑制了蚕豆生长,而肉桂酸胁迫下小麦与蚕豆间作可提高蚕豆根际微生物的活性和碳源的利用强度,改变根际微生物的群落结构,改善连作蚕豆的根际微生态环境而抑制尖孢镰刀菌的增殖。同时,间作还提高蚕豆根系的防御酶活性并降低膜脂过氧化程度,提高蚕豆植株抗性而减轻枯萎病的发生与危害,缓解蚕豆连作障碍,促进蚕豆生长。本研究结果可为选择合理间作模式以持续控制病害、提高作物产量、减少农药施用、实现土壤健康和环境友好的可持续农业生产提供科学理论依据。
[1]Huang L F,Song L X,Xia X J,et al. Plant-soil feedbacks and soil sickness:From mechanisms to application in agriculture. Journal of Chemical Ecology,2013,39(2):232—242
[2]Li X G,Zhang Y N,Ding C F,et al. Declined soil suppressiveness to Fusarium oxysporum by rhizosphere microflora of cotton in soil sickness. Biology and Fertility of Soils,2015,51(8):935—946
[3]Asaduzzaman M,Asao T. Autotoxicity in beans and their allelochemicals. Scientia Horticulturae,2012,134(2):26—31
[4]Tian G L,Bi Y M,Sun Z J,et al. Phenolic acids in the plow layer soil of strawberry fields and their effects on the occurrence of strawberry anthracnose. European Journal of Plant Pathology,2015,143(3):581—594
[5]Hao W Y,Ren L X,Ran W,et al. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f. sp. niveum. Plant and Soil,2010,336(1):485—497
[6]Ye S F,Zhou Y H,Sun Y,et al. Cinnamic acid causes oxidative stress in cucumber roots,and promotes incidence of Fusarium wilt. Environmental and Experimental Botany,2006,56(3):255—262
[7]Li X G,Ding C F,Hua K,et al. Soil sickness of peanuts is attributable to modifications in soil microbes induced by peanut root exudates rather than to direct allelopathy. Soil Biology & Biochemistry,2014,78:149—159
[8]李培栋,王兴祥,李奕林,等. 连作花生土壤中酚酸类物质的检测及其对花生的化感作用.生态学报,2010,30(8):2128—2134
Li P D,Wang X X,Li Y L,et al. The contents of phenolic acids in continuous cropping peanut and their allelopathy(In Chinese). Acta Ecologica Sinica,2010,30(8):2128—2134
[9]Stoddard F L,Nicholas A,Rubiales D,et al. Integrated pest,disease and weed management in faba bean. Field Crops Research,2010,115(3):308—318
[10]俞大绂. 蚕豆病害. 北京:科学出版社,1979
Yu D F. Faba bean diseases(In Chinese). Beijing:Science Press,1979
[11]董艳,董坤,杨智仙,等. 间作减轻蚕豆枯萎病的微生物和生理机制. 应用生态学报,2016,27(6):1984—1992
Dong Y,Dong K,Yang Z X,et al. Microbial and physiological mechanisms for alleviating Fusarium wilt of faba bean in intercropping system(In Chinese). Chinese Journal of Applied Ecology,2016,27(6):1984—1992
[12]吴凤芝,周新刚. 不同作物间作对黄瓜病害及土壤微生物群落多样性的影响. 土壤学报,2009,46(5):899—906
Wu F Z,Zhou X G. Effect of intercropping of cucumber with different crops on cucumber diseases and soil microbial community diversity(In Chinese). Acta Pedologica Sinica,2009,46(5):899—906
[13]Zewde T,Fininsa C,Sakhuja P K,et al. Association of white rot(Sclerotium cepivorum)of garlic with environmental factors and cultural practices in the North Shewa highlands of Ethiopia. Crop Protection,2007,26(10):1566—1573
[14]董艳,董坤,郑毅,等. 不同品种小麦与蚕豆间作对蚕豆枯萎病的防治及其机理.应用生态学报,2014,25 (7):1979—1987
Dong Y,Dong K,Zheng Y,et al. Faba bean Fusarium wilt(Fusarium oxysporum)control and its mechanism in different wheat varieties and faba bean intercropping system(In Chinese). Chinese Journal of Applied Ecology,2014,25(7):1979—1987
[15]Gómez-Rodrígueza O,Zavaleta-Mejíaa E,González-Hernándezb V A. Allelopathy and microclimatic modification of intercropping with marigold on tomato early blight disease development. Field Crops Research,2003,83(1):27—34
[16]张红骥,邵梅,杜鹏,等. 云南省魔芋与玉米多样性栽培控制魔芋软腐病. 生态学杂志,2012,31(2):332—336
Zhang H J,Shao M,Du P,et al. Effects of diversity cultivation of konjac and maize in controlling konjac’s soft rot disease in Yunnan Province,Southwest China (In Chinese). Chinese Journal of Ecology,2012,31 (2):332—336
[17]Dai C C ,Chen Y,Wang X X,et al. Effects of intercropping of peanut with the medicinal plant Atractylodes lancea on soil microecology and peanut yield in subtropical China. Agroforest System,2013,87(2):417—426
[18]肖靖秀,郑毅,汤利,等. 间作小麦蚕豆不同生长期根际有机酸和酚酸变化. 土壤学报,2016,53(3):685—693
Xiao J X,Zheng Y,Tang L,et al. Changes in organic and phenolic acids in rhizosphere of interplanted wheat and faba bean with growth stage(In Chinese). Acta Pedologica Sinica,2016,53(3):685—693
[19]李合生. 植物生理生化实验原理和技术. 北京:高等教育出版社,2000
Li H S. Experimental principle and technology for plant physiology and biochemistry(In Chinese). Beijing:High Education Press,2000
[20]王倩,李晓林. 苯甲酸和肉桂酸对西瓜幼苗生长及枯萎病发生的作用. 中国农业大学学报,2003,8(1):83—86
Wang Q,Li X L. Effects of benzoic and cinnamic acids on watermelon seedling growth and Fusarium wilt occurrence(In Chinese). Journal of China Agricultural University,2003,8(1):83—86
[21]Gil S V,Harob R,Oddinoc C,et al. Crop management practices in the control of peanut diseases caused by soil-borne fungi. Crop Protection,2008,27(1):1—9
[22]Wu H S,Raza W,Liu D Y,et al. Allelopathic impactof artificially applied coumarin on Fusarium oxysporum f.sp. niveum. World Journal of Microbiology and Biotechnology,2008,24(8):1297—1304
[23]齐永志,苏媛,王宁,等. 对羟基苯甲酸胁迫下尖孢镰刀菌侵染草莓根系的组织结构观察. 园艺学报,2015,42(10):1909—1918
Qi Y Z,Su Y,Wang N,et al. Observation on histological structure of strawberry roots after inoculating Fusarium oxysporum f. sp. fragariae under 4-hydroxybenzoic acid stress(In Chinese). Acta Horticulturae Sinica,2015,42(10):1909—1918
[24]李彦斌,刘建国,谷冬艳. 植物化感自毒作用及其在农业中的应用. 农业环境科学学报,2007,26(增刊):347—350
Li Y B,Liu J G,Gu D Y. Allelopathic autotoxicity of plants and its application in agriculture(In Chinese). Journal of Agro-Environment Science,2007,26 (Suppl):347—350
[25]Qu X H,Wang J G. Effect of amendments with different phenolic acids on soil microbial biomass,activity,and community diversity. Applied Soil Ecology,2008,39 (2):172—179
[26]Wu F Z,Wang X Z,Xue C Y. Effect of cinnamic acid on soil microbial characteristics in the cucumber rhizosphere. European Journal of Soil Biology,2009,45(4):356—362
[27]Zhou X,Wu F. p-Coumaric acid influenced cucumber rhizosphere soil microbial communities and the growth of Fusarium oxysporum f. sp. cucumerinum Owen. PLoS One,2012,7(10):1310—1315
[28]Liu Y X,Li X,Cai K,et al. Identification of benzoic acid and 3-phenylpropanoic acid in tobacco root exudates and their role in the growth of rhizosphere microorganisms. Applied Soil Ecology,2015,93:78—87
[29]Ren L X,Shi M S,Xing M Y,et al. Intercropping with aerobic rice suppressed Fusarium wilt in watermelon. Soil Biology & Biochemistry,2008,40(3):834— 844
[30]陈敏,王军涛,冯有智,等. 菇菜套作对土壤微生物群落的影响. 土壤学报,2015,52(1):145—153
Chen M,Wang J T,Feng Y Z,et al. Changes in soil microbial community in response to tomato-Agaricus bisporus interplanting(In Chinese). Acta Pedologica Sinica,2015,52(1):145—153
[31]Bais H P,Weir T L,Perry L G,et al. The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review in Plant Biology,2006,57(1):233—266
[32]Choi K H,Dobbs F C. Comparison of two kinds of Biolog microplates(GN and ECO)in their ability to distinguish among aquatic microbial communities. Journal of Microbiological Methods,1999,36(3):203—213
[33]郝文雅,沈其荣,冉炜,等. 西瓜和水稻根系分泌物中糖和氨基酸对西瓜枯萎病病原菌生长的影响. 南京农业大学学报,2011,34(3):77—82
Hao W Y,Shen Q R,Ran W,et al. The effects of sugars and amino acids in watermelon and rice root exudates on the growth of Fusarium oxysporum f. sp. Niveum(In Chinese). Journal of Nanjing Agricultural University,2011,34(3):77—82
[34]Xu W H,Liu D,Wu F Z,et al. Root exudates of wheat are involved in suppression of Fusarium wilt in watermelon in watermelon-wheat companion cropping. European Journal of Plant Pathology,2015,141 (1):209—216
[35]胡国彬,董坤,董艳,等. 间作缓解蚕豆连作障碍的根际微生态效应. 生态学报,2016,36(4):1010—1020
Hu G B,Dong K,Dong Y,et al. Effects of cultivars and intercropping on the rhizosphere microenvironment for alleviating the impact of continuous cropping of faba bean(In Chinese). Acta Ecologica Sinica,2016,36 (4):1010—1020
Effect of Cinnamic Acid on Incidence of Faba Bean Fusarium Wilt and Incidence-Mitigating Mechanisms of Wheat and Faba Bean Intercropping
DONG Yan1DONG Kun2YANG Zhixian3ZHU Jinhui1TANG Li1ZHENG Yi1,4†
(1 College of Resources and Environment,Yunnan Agricultural University,Kunming 650201,China)
(2 College of Food Science and Technology,Yunnan Agricultural University,Kunming 650201,China)
(3 The Library of Yunnan University,Kunming 650091,China)
(4 The National Center for Plateau Wetland of Southwest Forestry University,Kunming 650224,China)
【Objective】The aim of this work is to investigate 1)whether the amendment of cinnamic acid could mitigate the incidence of Fusarium wilt and 2)how wheat and faba bean intercropping alleviates cinnamic acid autotoxicity. 【Method】A pot experiment was conducted on wheat and faba bean intercropping and amendment of cinnamic acid at a varying rate(C0(0.0 mg kg-1),C1(14.0 mg kg-1),C2(28.0 mg kg-1) and C3(56.0 mg kg-1)). 【Result】1)In comparison with Treatment C0,amendment of cinnamic acid decreased the activity of peroxidase(POD),but significantly increased the content of malondialdehyde (MDA),thus leading to disorder of metabolic and physiological functions and aggravation of the damage of membrane lipid by peroxidation in the treatments under monocropping of faba bean.2)The amendment of cinn-acid amic decreased the average well color development(AWCD),Shannon-Wiener diversity index (H)and substrate richness(S),thus altering soil microbe community structure in faba bean rhizosphere,by increasing the number of Fusarium oxysporum;and increasing the incidence index of faba bean Fusarium wilt. As a result,dry weight of the root system of monocropped faba bean decreased. 3)Among the treatments amended with cinnamic acid at the rate of C1,C2 and C3,the treatments of mtercropped faba bean,were 22.4%,81.0% and 100.0% higher in POD activity of faba bean,and 45.1%,92.4% and 145.1% lower in MDA content than their corresponding ones of monocropped faba bean. 4)Treatments C1 and C2 of intercropped faba bean were 110.5% and 83.9% higher in total carbon utilization ability than their corresponding ones of monocropped faba bean,especially in utilization of carbohydrates,amino acids,and carboxylic acids. Besides,they were also much higher in Shannon-Wiener diversity index and substrate richness,had soil microbe community structure in the rhizosphere significantly changed by decreasing the population of Fusarium oxysporum in the faba bean rhizosphere by 16.7%~20.2% and 41.1%~51.8%,and increased root dry weight by 11.3%~23.6% and 72.9%~154.9%,respectively. 【Conclusion】Intercropping of faba bean with wheat significantly increases physiological resistance of faba bean to Fusarium oxysporum f. fabae,and significantly lowers the incidence of Fusarium wilt on one hand and effectively regulates soil microbial activity and diversity in the faba bean rhizosphere soil,on the other,thus alleviating the harm of Fusarium wilt caused by cinnamic acid and promoting growth of the crop. However,the effect is affected by concentration of cinnamic acid. By making use of the allelopathic effect of wheat as non-host crop,the intercropping of faba bean with wheat is an effective measure to alleviate autotoxicity of cinnamic acid.
Cinnamic acid;Faba bean wilt disease;Intercropping;Metabolic functional diversity of microbial community;Antioxidant enzymes activity
S643.6
A
10.11766/trxb201605030043
(责任编辑:陈荣府)
* 国家自然科学基金项目(31360507,31560586,31460551)资助 Supported by the National Natural Science Foundation of China(Nos. 31360507,31560586 and 31460551)
† 通讯作者 Corresponding author,E-mail:zhengyi-64@163.com
董 艳(1975—),女,云南安宁人,博士,副教授,主要研究方向为间作系统根际微生态与病害控制。E-mail:dongyanyx@163.com
2016-05-03;
2016-09-27;优先数字出版日期(www.cnki.net):2016-11-21
