雷公藤红素对体外人肝癌HepG2细胞增殖、凋亡的影响及机制研究Δ
2017-04-19祝晨蔯广州中医药大学临床药理研究所广州510405
张 彦,祝晨蔯(广州中医药大学临床药理研究所,广州 510405)
雷公藤红素对体外人肝癌HepG2细胞增殖、凋亡的影响及机制研究Δ
张 彦*,祝晨蔯#(广州中医药大学临床药理研究所,广州 510405)
目的:研究雷公藤红素对体外人肝癌HepG2细胞增殖、凋亡的影响,并探讨其作用机制。方法:采用CCK-8法测定2、5、10 μmol/L雷公藤红素分别作用24、48、72 h后的细胞活性,并计算增殖抑制率和半数抑制浓度(IC50);采用流式细胞术检测2、5、10 μmol/L雷公藤红素分别作用24 h后细胞的凋亡率及周期变化,并以二甲基亚砜(DMSO)为阴性对照;采用罗丹明123染色法测定2、5、10 μmol/L雷公藤红素分别作用48 h后的细胞线粒体膜电位,并以DMSO为阴性对照;采用Western blot法检测5 μmol/L雷公藤红素作用0、12、24、36 h后细胞中促凋亡相关基因Bax和B淋巴细胞瘤2(Bcl-2)的蛋白表达。结果:2、5、10 μmol/L雷公藤红素均可抑制细胞的增殖,IC50为5.834 μmol/L。2、5、10 μmol/L雷公藤红素均可诱导细胞凋亡。5、10 μmol/L雷公藤红素可阻滞细胞于G0/G1、S期,并可降低线粒体膜电位,较阴性对照差异均有统计学意义(P<0.05或P<0.01),且以上作用均具有浓度依赖性。5 μmol/L雷公藤红素作用12、24、36 h后可上调细胞中Bax蛋白表达、下调Bcl-2蛋白表达,并呈现一定的时间依赖性,较0 h时差异有统计学意义(P<0.05或P<0.01)。结论:雷公藤红素可明显抑制体外人肝癌HepG2细胞的增殖并诱导其凋亡,其机制可能与增强线粒体通透性、促使凋亡诱导因子释放有关。
雷公藤红素;人肝癌HepG2细胞;增殖;凋亡;线粒体通透性;体外
肝癌是世界上最常见的五大恶性肿瘤之一,而我国是原发性肝癌高发的国家,其发病率、病死率均较高[1]。虽然目前针对肝癌的诊断及治疗手段不断发展,但其总体治疗效果仍达不到患者的期望[2]。肝切除等外科治疗手段往往只能是姑息治疗,传统化疗和放疗等方法难以耐受的毒副作用也限制了其应用。目前越来越多的研究发现植物来源的天然产物在癌症治疗方面发挥着重要作用。雷公藤红素是从雷公藤的根皮当中提取出的一种三萜类天然产物,是雷公藤的活性成分之一[3]。其作为一种天然蛋白酶体抑制剂,能有效抑制蛋白酶体活性和诱导细胞凋亡,对癌症有潜在的预防和治疗作用[4-9]。然而,关于其对肝癌细胞的抑制作用及机制的研究还未见报道。因此,笔者以人肝癌HepG2细胞为研究对象,从雷公藤红素对人肝癌HepG2细胞增殖及凋亡的影响、细胞线粒体膜电位变化以及细胞中促凋亡相关基因Bax和B淋巴细胞瘤2(Bcl-2)蛋白表达水平的影响,并初步探讨其抗肝癌作用和机制,为将其开发为肝癌治疗药物提供实验参考。
1 材料
1.1 仪器
FACS Calibur流式细胞仪、垂直凝胶电泳及蛋白印迹转膜仪(美国Bio-Rad公司);EON酶标仪(美国Biotek公司)。
1.2 药品与试剂
雷公藤红素(上海晨易生物科技有限公司,批号:120910,纯度:>98%);CCK-8试剂盒(碧云天生物科技有限公司,批号:C13212);胎牛血清、青霉素-链霉素溶液(批号:J150010)、磷脂酰丝氨酸蛋白抗体-荧光素/碘化丙啶(AnnexinⅤ-FITC/PI)凋亡检测试剂盒(批号:H503007)均购自美国Gibco公司;非必需氨基酸(美国Thermo公司,批号:1620946);兔抗人 Bax、Bcl-2、甘油醛-3-磷酸脱氢酶(GAPDH)抗体均购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的羊抗兔免疫球蛋白G(IgG)抗体(美国Cell Signaling Technology公司)。
1.3 细胞
人肝癌HepG2细胞购于中国科学院上海细胞生物学研究所。
2 方法
2.1 细胞培养
将HepG2细胞置于含10%胎牛血清、100 u/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基中,然后于37℃、5%CO2的恒温细胞培养箱中进行培养。待细胞生长至单层约80%时,采用0.25%胰蛋白酶将细胞吹打消化为单细胞悬液,然后按1∶3的比例进行细胞传代,细胞平均2~3 d传代1次,取对数生长期细胞进行试验。
2.2 细胞活性检测
用培养基调整细胞密度为5×104mL-1后,将细胞接种于96孔板的中间孔中,每孔100 μL,边缘孔用无菌磷酸盐缓冲液(PBS)填充。培养24 h待细胞贴壁生长后,分别加入浓度为2、5、10 μmol/L的雷公藤红素培养液,作为实验组;同时设置阴性对照组[加入二甲基亚砜(DMSO)和等体积的培养基]和空白对照组(不进行任何处理),每个浓度设5个复孔。分别于培养24、48、72 h后,每孔加入10 μL CCK-8溶液,继续培养4 h,然后采用酶标仪测定450 nm波长处各孔的吸光度(A)值,计算细胞增殖抑制率[增殖抑制率=(1-实验组A平均值/阴性对照组A平均值)×100%],并计算半数抑制浓度(IC50)。
2.3 细胞凋亡检测
分别用DMSO(阴性对照)和2、5、10 μmol/L雷公藤红素培养细胞24 h后,用0.25%胰酶消化细胞,悬浮细胞后离心,收集细胞并加入到预冷PBS中(4℃),再次离心,PBS洗涤细胞,加入300 μL的结合缓冲液(Binding buffer)悬浮细胞,然后加入5 μL的AnnexinⅤ-FITC,混匀,在避光、室温条件下孵育15 min,流式细胞仪检测细胞凋亡情况,上机检测前5 min加入5 μL PI染色。
2.4 细胞周期检测
分别用DMSO(阴性对照)和2、5、10µmol/L雷公藤红素培养细胞24 h后,用PBS清洗细胞2次,然后用低渗溶液[含0.1%Triton X-100、1 mmol/L Tris-HCl(pH 8.0)、3.4 mmol/L柠檬酸钠、0.1 mmol/L乙二胺四乙酸(EDTA)和50 μg/mL的PI]悬浮细胞,然后加入50 μg/ mL PI。采用流式细胞仪对DNA含量进行分析,处于各个细胞周期的细胞数量用Cell ModiFit软件(BD公司)进行统计。
2.5 线粒体跨膜电位检测
分别用DMSO(阴性对照)和0、2、5、10 μmol/L雷公藤红素培养细胞48 h后,每孔均加入罗丹明123染液至终浓度为1 nmol/L,然后于37℃、5%CO2的恒温细胞培养箱中避光孵育20 min。采用多功能酶标仪,以507 nm为激发波长、529 nm为发射波长检测各孔细胞的荧光强度,据此来反映线粒体跨膜电位的变化。
2.6 凋亡相关蛋白的检测
分别用5 μmol/L雷公藤红素培养细胞0、12、24、36 h后,0.25%胰蛋白酶消化,重悬细胞,以7 000 r/ min离心10 min收集细胞,然后采用RIPA裂解液于4℃裂解细胞15 min;采用二喹啉甲酸(BCA)试剂盒对经雷公藤红素处理的裂解后细胞悬液进行蛋白含量测定。取30µg蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)电泳并转移至聚偏氟乙烯(PVDF)膜,以封闭液(5%BSA/TBST)封闭1.5 h,加入Bax、Bcl-2、GAPDH一抗 (1∶1 000),4℃孵育过夜;用TBST(杂交膜清洗液)洗膜3次,加入二抗(1∶1 000),室温下孵育1 h;用TBST洗膜3次,加入ECL(电化学发光试剂)进行发光反应,暗室X胶片显影,拍照。使用Image J软件进行灰度分析,以Bax、Bcl-2蛋白灰度值与内参GAPDH灰度值比值表示目的蛋白的相对表达量。
2.7 统计学方法
采用SPSS 13.0统计软件进行数据分析。数据结果均以s表示,组间比较采用单因素方差分析,若方差齐,则采用LSD法进行组间的两两比较;若方差不齐,则采用Dunnett’s T3法。柱状图采用GraphPad Prism 5软件绘制。P<0.05表示差异有统计学意义。
3 结果
3.1 雷公藤红素对HepG2细胞增殖的影响细胞凋亡率为0.35%;而2、5、10 μmol/L雷公藤红素组细胞的凋亡率明显升高,分别为35.48%、54.09%、66.88%,差异均有统计学意义(P<0.01)。细胞凋亡率测定的流式细胞图见图2。一定的时间和浓度依赖性。当雷公藤红素的浓度为5、10 μmol/L时,其抑制作用明显。作用24、48、72 h后,雷公藤红素对HepG2细胞的IC50分别为5.834、4.494、2.778 μmol/L。细胞增殖抑制率测定结果见图1。
雷公藤红素对HepG2细胞的增殖有抑制作用,且呈

图1 细胞增殖抑制率测定结果Fig 1 Determination results of cell proliferation inhibition rate
3.2 雷公藤红素对HepG2细胞凋亡的影响
雷公藤红素可诱导HepG2细胞凋亡。阴性对照孔

图2 细胞凋亡率测定的流式细胞图Fig 2 Flow cytometry graphs of determining cell apoptosis rate
3.3 雷公藤红素对HepG2细胞周期的影响
雷公藤红素可诱导HepG2细胞凋亡并出现G0/G1期和S期阻滞,且具有浓度依赖性,其在浓度为5、10 μmol/L时较阴性对照差异有统计学意义(P<0.05或P<0.01)。细胞周期检测的流式细胞图见图3、测定结果见表1。
3.4 雷公藤红素对HepG2细胞线粒体跨膜电位的影响
雷公藤红素可降低HepG2细胞线粒体跨膜电位,并具有浓度依赖性。2、5、10 μmol/L雷公藤红素作用48 h后,细胞线粒体跨膜电位分别为83.33%、64.58%、 44.79%。与阴性对照(100%)比较,5、10 μmol/L雷公藤红素作用后细胞跨膜电位差异有统计学意义(P<0.01)。
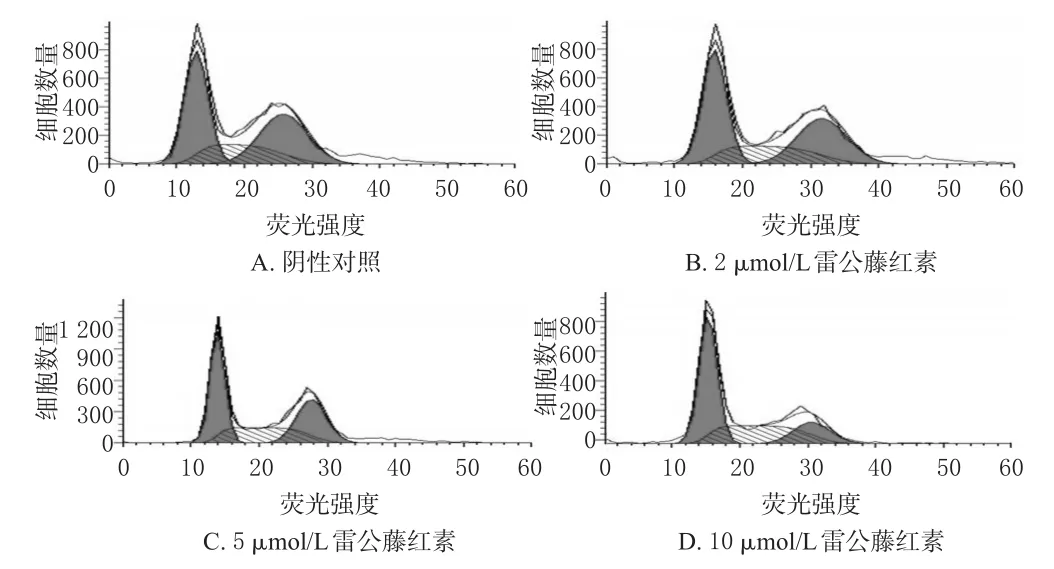
图3 细胞周期检测的流式细胞图Fig 3 Flow cytometry graphs of detecting cell cycle
表1 细胞周期测定结果(s,n=3)Tab 1 Determination results of cell cycle(s,n=3)

表1 细胞周期测定结果(s,n=3)Tab 1 Determination results of cell cycle(s,n=3)
注:与阴性对照比较,*P<0.05,**P<0.01Note:vs.negative control,*P<0.05,**P<0.01
S 样品DMSO溶液(阴性对照)2 μmol/L雷公藤红素5 μmol/L雷公藤红素10 μmol/L雷公藤红素20.38±1.24 21.25±2.31 27.11±1.52*31.25±0.43**G0/G140.27±1.61 42.38±1.45 44.68±2.41*52.31±2.78**G2/M 36.83±2.71 33.29±0.69 30.74±1.92*16.22±1.17**
3.5 雷公藤红素对HepG2细胞Bax、Bcl-2蛋白表达的影响

图4 细胞中Bax、Bcl-2蛋白表达的测定结果(s,n=3)Fig 4 Determination results of Bax,Bcl-2 protein expressions in cells(s,n=3)
雷公藤红素可上调HepG2细胞中Bax的表达,下调Bcl-2表达,且具有时间依赖性。与0 h比较,雷公藤红素作用12、24、36 h后细胞中Bax蛋白表达水平明显升高,Bcl-2蛋白表达水平明显降低,差异均有统计学意义(P<0.05或P<0.01),结果见图4。
4 讨论
雷公藤红素作为一种天然的蛋白酶体抑制剂,当浓度为0.5~10 μmol/L时对多种肿瘤细胞具有较强的抑制增殖和促凋亡作用[10-12],故本研究选取2、5、10 μmol/L这3个浓度进行试验。本研究通过细胞毒性试验,证实雷公藤红素可呈时间和浓度依赖性地抑制人肝癌HepG2细胞的增殖;并且通过检测细胞凋亡情况及细胞周期的变化,证明雷公藤红素可以诱导HepG2细胞凋亡并出现G0/G1期阻滞。
随着细胞凋亡机制研究的不断深入,线粒体在细胞凋亡中发挥的作用受到人们关注。线粒体不仅是生命活动的控制中心,而且是细胞凋亡的调控中心。研究发现,细胞在早期凋亡中线粒体跨膜电位下降,与膜通透性(PT)改变及PT孔的开放有关[13-14]。线粒体跨膜电位作为早期凋亡的指标,能够较灵敏地显示出药物对细胞的凋亡作用。本研究结果显示,随着雷公藤红素浓度的增加,细胞线粒体跨膜电位明显下降,且当浓度为5、10 μmol/L时作用显著,提示雷公藤红素诱导HepG2细胞凋亡与膜通透性改变有关。
Bcl-2家族蛋白是调节细胞凋亡的一类重要蛋白质,通过与其他凋亡蛋白的协同作用,发挥着细胞凋亡“主开关”的作用。Bcl-2家族蛋白可促进线粒体PT孔开放,然后释放一系列凋亡因子到细胞质中,激活下游的半胱氨酸天冬氨酸特异性蛋白酶(Caspase)家族,从而促使细胞凋亡的发生[15-16]。在本研究中,5 μmol/L雷公藤红素作用于HepG2细胞不同时间后,细胞中Bcl-2家族中Bax蛋白表达明显上调,而Bcl-2蛋白表达却显著下调,提示雷公藤红素诱导细胞凋亡可能与其调节细胞中凋亡相关蛋白的表达有关。
综上所述,雷公藤红素可能是通过调节人肝癌HepG2细胞的Bcl-2家族蛋白的表达,使线粒体膜的通透性增强,促使凋亡诱导因子释放,从而发挥其抑制细胞增殖并诱导细胞凋亡的作用。本研究初步证实了雷公藤红素对人肝癌HepG2细胞具有一定杀伤作用及可能机制,为进一步动物实验以及临床试验的开展提供了数据支持。
[1] 王英,李文英.肝癌干细胞与肝癌的研究进展[J].中国癌症杂志,2011,21(9):735-738.
[2] Balunas MJ,Kinghorn AD.Drug discovery from medicinal plants[J].Life Sci,2005,78(5):431-441.
[3] 丁海鹏,李相鹏,张伟,等.雷公藤红素药理作用分子靶点的研究进展[J].中国药理学与毒理学杂志,2012,26(4):570-576.
[4] Yang H,Chen D,Cui QC,et al.Celastrol,a triterpene extracted from the Chinese“Thunder of God Vine,”is a potent proteasome inhibitor and suppresses human prostate cancer growth in nude mice[J].Cancer Res,2006,66(9):4758-4765.
[5] Ji N,Li J,Wei Z,et al.Effect of celastrol on growth inhibition of prostate cancer cells through the regulation of hERG channel in vitro[J].Biomed Res Int,2015,doi:1155/2015/308475.
[6] Li PP,He W,Yuan PF,et al.Celastrol induces mitochondria-mediated apoptosis in hepatocellular carcinoma Bel-7402 cells[J].Am J Chin Med,2015,43(1):137-148.
[7] Nabekura T,Hiroi T,Kawasaki T,et al.Effects of natural nuclear factor-kappa B inhibitors on anticancer drug efflux transporter human P-glycoprotein[J].Biomed Pharmacother,2015,70(5):140-145.
[8] 季秀海,钱晓萍,刘宝瑞.中药有效成分抗肿瘤血管生成研究进展[J].现代肿瘤医学,2010,18(3):594-597.
[9] 姜华,孙成法,褚荣涛,等.雷公藤红素对荷瘤裸鼠移植瘤生长及血管生成的影响[J].中国实用神经疾病杂志,2014,17(24):1-3.
[10] 李晶埈.雷公藤红素对人肝癌细胞Hep3B中HIF-1α表达的影响[J].延边大学学报(自然科学版),2011,37(2):171-175.
[11] 陈国柱,徐元基,杜芝燕,等.雷公藤红素对非小细胞肺癌细胞株H1299增殖与凋亡的影响[J].生物技术通讯,2008,19(6):826-829.
[12]潘太彬.汉防己甲素诱导人肝癌SMMC7721细胞凋亡的机制研究[J].中国药房,2015,26(19):2648-2651.
[13] Burbulla LF,Krebiehl G,Krüger R.Balance is the challenge:the impact of mitochondrial dynamics in Parkinson’s disease[J].Eur J Clin Invest,2010,40(11):1048-1060.
[14] Kim H,Rafiuddin-Shah M.Hierarchical regulation of mitochondrion-dependent apoptosis by BCL-2 subfamilies [J].Nat Cell Biol,2006,8(12):1348-1358.
[15] Du Y,Yin F,Liu C,et al.Depression of MAD2 inhibits apoptosis of gastric cancer cells by upregulating Bcl-2 and interfering mitochondrion pathway[J].Biochem Biophys Res Commun,2006,345(3):1092-1098.
[16] Katoh I,Sato S,Fukunishi N,et al.Apaf-1-deficient fog mouse cell apoptosis involves hypo-polarization of the mitochondrial inner membrane,ATP depletion and citrate accumulation[J].Cell Res,2008,18(12):1210-1219.
Study on the Effects and Mechanism of Celastrol on Proliferation and Apoptosis of Human Hepatoma HepG2 Cells in vitro
ZHANG Yan,ZHU Chenchen(Institute of Clinical Pharmacology,Guangzhou University of Chinese Medicine,Guangzhou 510405,China)
OBJECTIVE:To study the effects of celastrol on the proliferation and apoptosis of human hepatoma HepG2 cells,and investigate its mechanism.METHODS:CCK-8 method was used to determine the cell activity 24,48,72 h after treated by 2,5,10 μmol/L celastrol,and the proliferation inhibition rate and half inhibitory concentration(IC50)were calculated;flow cytometry was conducted to detect the cell apoptosis rate and cycle change 24 h after treated by 2,5,10 μmol/L celastrol,and the DMSO was used as negative control;rhodamine 123 staining method was used to determine the mitochondrial membrane potential 48 h after treated by 2,5,10 μmol/L celastrol,and the DMSO was used as negative control;Western blot was adopted to detect the pro-apoptotic related genes Bax and B lymphoma 2(Bcl-2)protein expressions 0,12,24,36 h after treated by 5 μmol/L celastrol.RESULTS:2,5,10 μmol/L celastrol can inhibit cell proliferation,IC50was 5.834 μmol/L.2,5,10 μmol/L celastrol can induce apoptosis;5,10 μmol/L celastrol can block cell in G0/G1,S phases,compared with negative control group,with significant differences(P<0.05 or P<0.01),and the above effects all showing certain concentration-dependent manner.5 μmol/L celastrol can increase Bax protein expression and decrease Bcl-2 protein expression after cultured for 12,24,36 h,showing certain time-dependent manner;compared with 0 h,there was significant difference(P<0.05 or P<0.01).CONCLUSIONS:Celastrol can obviously inhibit the proliferation of human hepatoma HepG2 cells and induce their apoptosis,and the mechanism may be related with strengthening mitochondrial permeability and promoting the release of apoptosis-inducing factor.
Celastrol;Human hepatoma HepG2 cells;Proliferation;Apoptosis;Mitochondrial permeability;in vitro
R961
A
1001-0408(2017)10-1342-04
2016-09-22
2017-02-13)
(编辑:林 静)
广东省普通高校“青年创新人才”资助项目(No.2015KQNCX077)
*博士研究生,副研究员。研究方向:中药新药研究。电话:020-39352369。E-mail:13826279389@139.com
#通信作者:教授,博士。研究方向:中药新药研究。电话:020-39358047。E-mail:zhuchenchen@vip.sina.com
DOI10.6039/j.issn.1001-0408.2017.10.12
