一种植物乳杆菌缓释微胶囊的体外稳定性分析
2017-04-18王长远冯玉超陈光辉于长青李志江钱丽丽
王长远,冯玉超,陈光辉,于长青,徐,姚 笛,李志江,钱丽丽
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.黑龙江农垦英博华威乳业有限公司,黑龙江伊春 153000)
一种植物乳杆菌缓释微胶囊的体外稳定性分析
王长远1,冯玉超1,陈光辉2,于长青1,徐1,姚 笛1,李志江1,钱丽丽1
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.黑龙江农垦英博华威乳业有限公司,黑龙江伊春 153000)
检测一种自行制备的植物乳杆菌缓释微胶囊的体外稳定性。模拟胃肠液环境分析其耐受性,并比较不同温度下的贮藏稳定性及降胆固醇性能。经人工胃液处理3 h后,冻干微胶囊中的活菌数达到75%;经人工肠液处理3 h后,微胶囊中活菌数仍有70%;于-20℃条件下贮藏的微胶囊活菌数量最多,6个月后仍可达5.8×108CFU/g;包埋后植物乳杆菌的胆固醇降解率为25.73%。结果表明,微胶囊化的壁材对植物乳杆菌起到了很好的保护作用,体外稳定性较好。
植物乳杆菌;缓释微胶囊;稳定性分析;胆固醇
随着膳食结构的改变,过量摄入食物中胆固醇所导致的心脑血管疾病已成为人们关注的重要问题[1]。近年来,人们对益生菌的认识不断加深,而作为益生菌的一种,以降低胆固醇作用为主的植物乳杆菌所具有的保健作用也逐步得到认可,相关植物乳杆菌产品的开发和应用也同样受到食品行业的广泛关注[2-4]。
但是,植物乳杆菌随口进入机体后,在体内会经受消化道的胃酸、胆汁酸及消化酶等因素的影响,大大降低了能够进入肠道内定植并发挥其益生功效的活菌数。微胶囊技术被广泛用于生产益生菌制剂,将乳酸菌包埋能够在一定程度上提高乳酸菌对外界不利条件的耐受性,使其能够顺利通过胃部到达肠道,并在肠道内发挥功效[5-7]。微胶囊技术可以增强物质的稳定性,并能很好地改善微生物在食品和肠道内的生存能力[8]。试验以海藻酸钠-壳聚糖作为壁材对植物乳杆菌进行包埋[9],并对所制备的植物乳杆菌缓释微胶囊模拟胃肠液耐受性,以及不同温度下的贮藏稳定性、降胆固醇性能进行研究,为实际生产应用提供一定的技术参考。
1 材料与方法
1.1 材料
1.1.1 菌种
植物乳杆菌M1-UVs29,由黑龙江八一农垦大学食品学院微生物实验室选育和保藏,经试验证实该菌株具有降胆固醇能力[10]。
1.1.2 试剂
MRS液体培养基、MRS固体培养基、胆固醇、猪胆盐,购自北京奥博星生物技术有限责任公司;胃蛋白酶,购自美国Sigma公司;硫酸铁铵,购自沈阳市华东试剂厂;胰蛋白酶,购自深圳恒生生物科技有限公司;其他试剂均为分析纯。
1.1.3 仪器设备
Specord210 plus型紫外分光光度仪,德国耶拿分析仪器股份公司产品;TD5A型灭菌锅,长沙英泰仪器有限公司产品;Forma-86c型超低温冰箱,美国Thermo公司产品;HZQ-F160型全温振荡培养箱,哈尔滨市东联电子技术开发有限公司产品;Alpha 1-2 LDplus型真空冷冻干燥机,德国Christ公司产品;DZG-6000型真空干燥箱,上海森信实验仪器有限公司产品。
1.1.4 主要溶液配制
人工胃液、人工肠液、胆固醇标准使用液等溶液,按照参考文献[10]中方法配制。
1.2 方法
1.2.1 植物乳杆菌缓释微胶囊的制备
按照参考文献[9]中方法制备。
1.2.2 胃液耐受性试验
按照不同制备工艺条件制备的新鲜微胶囊和冻干微胶囊,并利用实验室自制的菌粉为对照,分别称取1 g加入到装有人工胃液的试管中,置于37℃,转速100 r/min水浴摇床中恒温振荡培养,分别在0,1,2,3 h后取出,以转速4 000 r/min离心5 min,弃上清液,收集沉淀物,放入pH值为7.4的PBS缓冲溶液中,于37℃条件下振荡至完全崩解,进行菌落计数。
1.2.3 肠液耐受性试验
将经人工胃液处理3 h后的未溶解微胶囊过滤洗涤,收集微胶囊,分别加入到装有人工肠液的试管中,置于37℃,转速100 r/min的水浴摇床中恒温振荡培养,同胃液耐受性试验方法。
1.2.4 贮藏稳定性试验
将制备好的微胶囊装于小玻璃瓶中,密封,分别放置于-20,4,25℃环境中,分别于0,1,2,3,4,5,6个月取样,测定其活菌数。
1.2.5 37℃贮藏性试验
将制备好的微胶囊装于小玻璃瓶中,密封,放置于37℃条件下贮藏,分别于0,15,30,45,60 d取样,测定其活菌数,与密封同时制备好的菌粉作对照。
1.2.6 降胆固醇性能测定
(1)胆固醇标准曲线的绘制。吸取胆固醇标准使用液0,0.2,0.4,0.6,0.8,1.0,1.2 mL分别置于10 mL试管内,在各试管内加入冰乙酸使总体积达4 mL。加入2 mL铁矾显色液,注意要延管壁缓慢加入。加完后再充分振摇混匀,在15~90 min内,于波长560 nm处测比色。以胆固醇质量浓度为横坐标、吸光度为纵坐标制作标准曲线。
(2)胆固醇降解率的测定方法。将菌粉和制备好的微胶囊接种到20 mL MRS液体培养基中,于37℃条件下静置培养20 h。将活化好的菌种以质量分数为2%的接种量接种到20 mL高胆固醇MRSO-CHOL培养基中,在37℃条件下恒温培养24 h。经降解后的液体以转速4 000 r/min离心10 min,得到的上清液用于测定胆固醇含量,计算胆固醇降解率。

式中:M0——对照液中胆固醇质量浓度,μg/mL;
M1——试验上清液的胆固醇质量浓度,μg/mL。
1.2.7 人工胃肠液处理后菌体存活率的测定
测定微胶囊经人工胃肠液处理前后的活菌总数,并计算存活率。
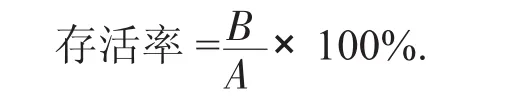
式中:A——人工胃肠液处理前1 g样品的活菌数,CFU/g;
B——人工胃肠液处理后1 g样品的活菌数,CFU/g。
2 结果与分析
2.1 胃液耐受性试验
植物乳杆菌进入人体后,胃部的高酸性环境会导致植物乳杆菌死亡,植物乳杆菌要想在人体中发挥益生作用,就必须要能够抵抗胃部的恶劣环境,顺利进入肠道内。由于食物的成分和食入量的不同,人体胃液通常会发生波动。试验选择pH值为1.5的人工胃液来模拟胃部环境,以考察植物乳杆菌缓释微胶囊对植物乳杆菌的保护效果。人体胃部消化食物的过程为2~3 h,所制备的微胶囊应该在这段时间内有效保护植物乳杆菌抵御胃部恶劣环境的伤害,使其顺利通过胃部,进入肠道发挥益生作用。因此,试验选择将微胶囊放于人工胃液中处理3 h。
微胶囊在人工胃液中的耐受性见图1。
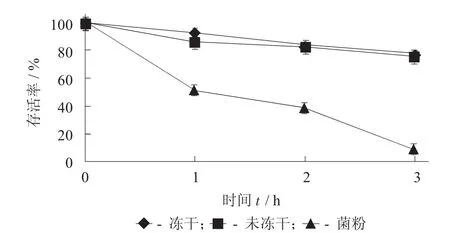
图1 微胶囊在人工胃液中的耐受性
由图1可知,随着时间的延长,各样品的菌体存活率均有所下降,经人工胃液处理3 h后,未微胶囊化的植物乳杆菌菌体数量快速下降,活菌数明显减少。而包埋后的新鲜微胶囊和冻干微胶囊在人工胃液处理后,植物乳杆菌的存活率仍保持较高的水平,均达到75%,活菌数分别可达到1.75×109CFU/g和1.52×109CFU/g。这说明,微胶囊化能够帮助植物乳杆菌抵抗胃酸的伤害,微胶囊化的壁材对菌株起到了良好的保护作用,这与Chandramouli V等人的研究结果相似。分析其原因,可能是由于微胶囊中海藻酸钠在低pH值下比较稳定,能够很好地保护菌体免受胃酸的伤害。结果说明,制备的微胶囊能够顺利进入肠道内。
2.2 肠液耐受性试验
微胶囊在人工肠液中的耐受性见图2。
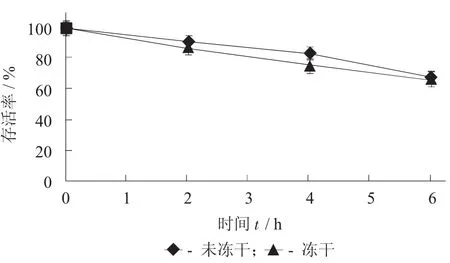
图2 微胶囊在人工肠液中的耐受性
由图2可知,随时间的延长,经人工肠液处理后的微胶囊中活菌数逐渐下降,3 h后微胶囊中活菌数仍能达到70%。结果说明,制备的植物乳杆菌缓释微胶囊能够抵抗人工肠液的破坏。
2.3 贮藏稳定性试验
植物乳酸菌经微胶囊化后,受到壁材的保护,能够有效避免外界温度对菌体的伤害。因此,选择合适的贮藏温度对于提高菌体存活率、提高贮藏稳定性至关重要。
不同贮藏温度对微胶囊化植物乳杆菌存活率的影响见图3。
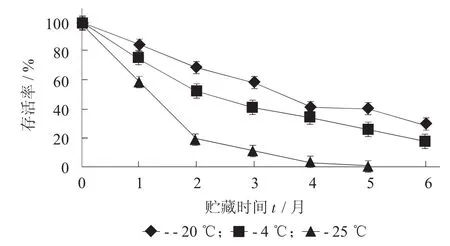
图3 不同贮藏温度对微胶囊化植物乳杆菌存活率的影响
由图3可知,随着贮藏时间的延长,微胶囊中植物乳杆菌的存活率逐渐下降;随着贮藏温度的降低,活菌数逐渐升高。其中,在-20℃条件下贮藏微胶囊活菌数最高,贮藏6个月活菌数仍达5.8× 108CFU/g;而在25℃条件下贮藏的微胶囊随着贮藏时间的延长,活菌数大大下降,可见在25℃条件下不利于贮藏微胶囊。因此,-20℃条件下贮藏微胶囊效果较佳。
2.4 37℃贮藏性试验
37℃对微胶囊化植物乳杆菌存活率的影响见图4。
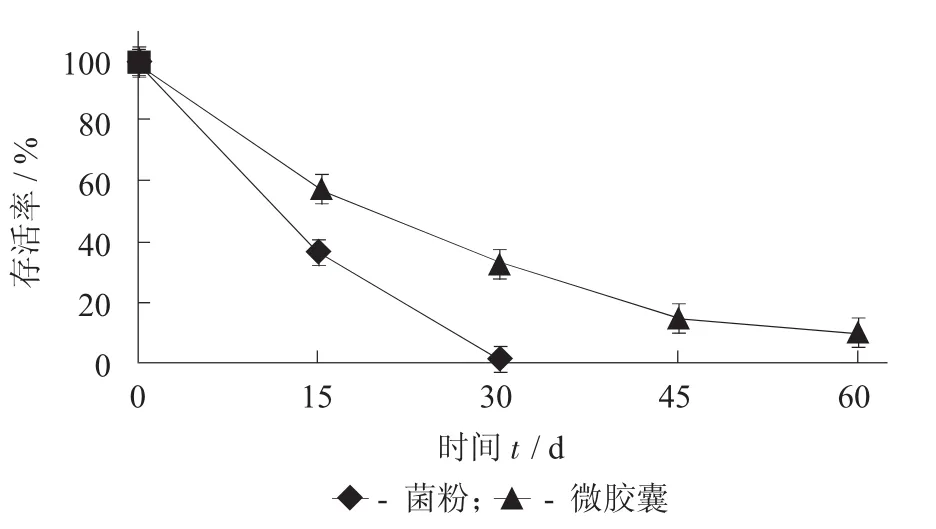
图4 37℃对微胶囊化植物乳杆菌存活率的影响
由图4可知,37℃条件下贮藏的菌粉在30 d后仅能够检测出少量活菌,而经包埋后的植物乳杆菌在60 d时活菌数仍能达到1.9×108CFU/g,说明微胶囊化的壁材对植物乳杆菌起到了很好的保护作用,较好地隔绝了外部热量。
2.5 降胆固醇性能测定
2.5.1 胆固醇标准曲线
胆固醇标准曲线见图5。
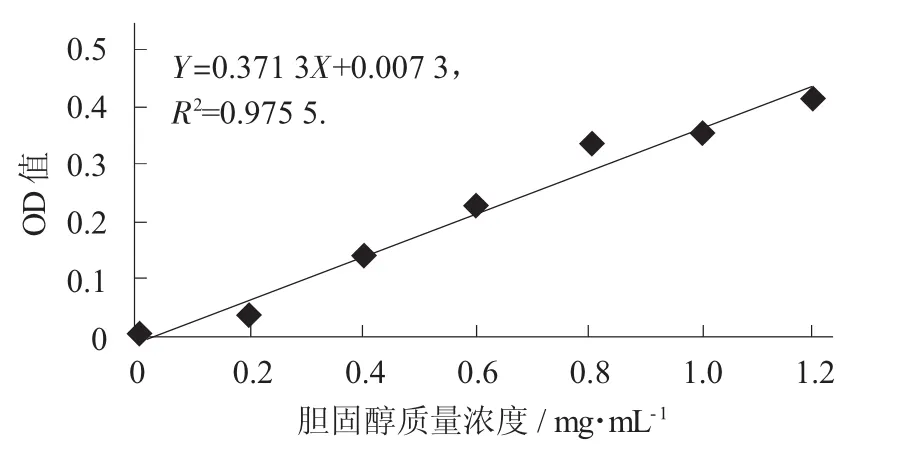
图5 胆固醇标准曲线
由图5可知,采用国标法绘制胆固醇标准曲线,测定体系的曲线拟合后相关性很好(R2=0.975 5),可用于待测菌株的胆固醇降解能力评价。
2.5.2 胆固醇降解率的测定
植物乳杆菌菌粉和微胶囊的降胆固醇性能见表1。
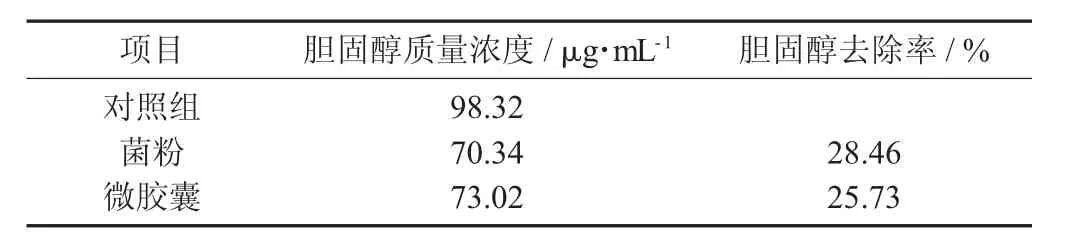
表1 植物乳杆菌菌粉和微胶囊的降胆固醇性能
由表1可知,经包埋后的植物乳杆菌对胆固醇的降解率要低于未被包埋植物乳杆菌对胆固醇的降解率,但仍表现出较好的降解效果,说明微胶囊化并没有影响植物乳杆菌发挥其对胆固醇的降解能力,这与文献研究结果一致。
3 结论
对实验室自行制备的植物乳杆菌缓释微胶囊进行人工胃液和肠液的处理,并研究了微胶囊的贮藏稳定性及降胆固醇性能。结论如下:①经人工胃液处理3 h,包埋后的新鲜微胶囊和冻干微胶囊在人工胃液处理后,植物乳杆菌的存活率仍保持较高的水平,均可达到75%,说明所制备的植物乳杆菌缓释微胶囊对人工胃液有很好的耐受性。②将经过人工胃液处理后的植物乳杆菌微胶囊放入人工肠液中处理3 h后,测得微胶囊中活菌数仍有70%,证实植物乳杆菌缓释微胶囊对人工肠液有很好的耐受性。③放于-20℃贮藏的微胶囊活菌数量在6个月后仍可达5.8×108CFU/g。经包埋后的植物乳杆菌在37℃条件下贮藏,2个月时活菌数仍能达到1.9×108CFU/g,说明微胶囊化的壁材对植物乳杆菌起到了很好的保护作用。④未包埋植物乳杆菌的胆固醇降解率为28.46%,而包埋后植物乳杆菌的胆固醇降解率为25.73%。虽然包埋后的植物乳杆菌对胆固醇的降解率要低于未包埋植物乳杆菌对胆固醇的降解率,但仍表现出较好的降解效果,说明微胶囊化并没有显著影响植物乳杆菌发挥其对胆固醇的降解能力。
[1]Francesca G,Diana D G,Loredana B,et al.The role of protective and probiotic cultures in food and feed and their impact in food safety[J].Trends in Food Science&Technology,2011,22(1):58-66.
[2]吕利军,季海峰,单达聪,等.乳酸菌类微生物制剂微胶囊化的研究进展 [J].黑龙江畜牧兽医,2008,51(8):17-19.
[3]马千里,刘冬,顾瑞霞.植物乳杆菌的益生特性及其在乳制品中的应用 [J].中国奶牛,2014(1):36-40.
[4]陈曦.乳杆菌属的益生菌保健功能及研究进展 [J].中国乳品工业,2011,39(7):40-43,49.
[5]Anal A K,Singh H.Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery[J].TrendsinFoodScience&Technology,2007(18):240-251.
[6]熊涛,冯超,谢明勇.植物乳杆菌NCU116微胶囊制备工艺的优化设计 [J].食品科学,2012,33(1):152-156.
[7]Nazzaro F,Fratianni F,Coppola R,et al.Fermentative ability of alginate-prebiotic encapsulated Lactobacillus acidophilus and survival under simulated gastrointestinal conditions[J].Journal of Functional Foods,2009,3(1):319-323.
[8]Kailasapathy K,Chin J.Survival and therapeutic poten-tial of probiotic organisms with reference to Lactobacillus acidophilus and Bifidobacterium spp[J].Immunol Cell Biol,2000,78(1):80-88.
[9]徐旻,李琳,于长青.植物乳杆菌M1-UVs29缓释微胶囊的制备及其缓释性能分析 [J].中国生物制品学杂志,2015,28(7):723-728.
[10]郭峰,樊磊,于长青,等.植物乳杆菌M1-UVs29体外降解胆固醇的作用 [J].中国生物制品学杂志,2014,27(6):803-806.
Stability Analysis of a Plant Lactobacillus Microcapsule in Vitro
WANG Changyuan1,FENG Yuchao1,CHEN Guanghui2,YU Changqing1,XU Min1,YAO Di1,LI Zhijiang1,QIAN Lili1
(1.College of Food Science,Heilongjiang Bayi Agricultural University,Daqing,Heilongjiang 163319,China;2.Heilongjiang Reclamation Yingbohuawei Dairy Industry Co.,Ltd.,Yichun,Heilongjiang 153000,China)
To measure the control-released microcapsules stability in vitro of plant Lactobacillus which are made by themselves. Analyzes its tolerability by simulating the gastric and intestinal environment and then compared the storage stability and cholesterol lowering properties under different temperature.The viable count of plant Lactobacillus in freeze-drying microcapsules can reach to 75%and 70%after treated by artificial gastric juice and intestinal juice for 3 h respectively.Microcapsules put in-20℃had the most viable count and still reach 5.8×108CFU/g after 6 months.Cholesterol removal efficiency of post embedding plant Lactobacillus can reach to 25.73%.The micro-encapsulated wall material has a good protective effect on plant Lactobacillus,and its stability is good in vitro.
plant Lactobacillus;control-released microcapsule;stability measure;cholesterol
TS202.3
A
10.16693/j.cnki.1671-9646(X).2017.02.041
1671-9646(2017)02b-0048-04
2016-12-20
黑龙江省高校科技成果产业化前期研发培育项目(1254CGZH33)。
王长远(1976— ),男,博士,教授,研究方向为粮食油脂及植物蛋白。
