贵州鼠尾草组织培养育苗技术
2017-04-18魏宇昆奉树成
高 燕,魏宇昆,奉树成*
(1.上海植物园 上海城市植物资源开发应用工程技术研究中心,上海 200231; 2.上海辰山植物园,上海 201602)
贵州鼠尾草组织培养育苗技术
高 燕1,魏宇昆2,奉树成1*
(1.上海植物园 上海城市植物资源开发应用工程技术研究中心,上海 200231; 2.上海辰山植物园,上海 201602)
以贵州鼠尾草为试验材料,探讨以种子和茎基部为外植体的组织培养过程。结果表明:以种子为外植体时,75%乙醇消毒30 s,然后2%次氯酸钠(含吐温- 80)消毒7 min为最佳灭菌方法,此时1 mg·L-16- BA和0.1 mg·L-1NAA诱导率可以达到90%,且诱导出的小苗生长健康、发育较快;以茎基部为外植体时,75%乙醇消毒30 s,然后0.1%氯化汞(含吐温- 80)消毒10 min为最佳灭菌方法,此时2 mg·L-16- BA和0.2 mg·L-1NAA诱导率可以达到75%,诱导出的小苗比较健康。在增殖过程中,以种子和茎基部为外植体诱导的植株没有表现出差异,最佳培养基为MS+ 0.6 mg·L-16- BA +0.05 mg·L-1NAA,生根培养基为1/2 MS。
贵州鼠尾草; 种子; 茎基部; 组织培养; 快繁
唇形科(Lamiaceae)鼠尾草属(Salvia)是一年或多年生草本或小灌木,药用芳香植物,原产于欧洲南部与地中海沿岸地区,阿拉伯、美国、加拿大等国和我国均有栽培[1]。中国植物志记录我国有78种,24变种,8变型,分布于全国各地,尤以西南地区为最多[2]。鼠尾草叶对生,椭圆形,香味浓郁,夏季开紫色花,生长强健,耐病虫害。近些年,由于其品种繁多,花色鲜艳,又为芳香植物,在园林绿化中得到了一定的应用。
贵州鼠尾草(SalviacavalerieiLévl.)又名紫背鼠尾草、朱砂草、血盆草、叶下红等。一方面,贵州鼠尾草可以作为园林绿化植物,另外一方面由于全草可入药,具有凉血解毒、散瘀止血的功效,用于肺结核咳血、衄血、血痢、血崩、刀伤出血、月经过多、胃脘痛的治疗,外用治疗跌打损伤,疖肿等[3]。本文通过组织培养的方式实现贵州鼠尾草的快速繁殖,不仅为快速获得大量鼠尾草优质苗木提供可能,也为后期贵州鼠尾草遗传转化奠定基础。
1 材料与方法
1.1 材料
试验于2014—2015年在上海植物园进行。供试材料为上海辰山植物园魏宇昆博士提供的贵州鼠尾草种子和1年生贵州鼠尾草植株。4月初,分别用种子和植株茎基部作为外植体,尝试鼠尾草组织培养诱导。
1.2 方法
取鼠尾草茎基部,去除上部的茎和下部的根,保留1~1.5 cm,洗洁精清洗干净。分别将种子和茎基部放置在玻璃瓶中,纱布封口,流水冲洗1 h。准备75%乙醇、0.1%氯化汞、2%次氯酸钠溶液、0.5%(V/V)吐温80、灭菌水、100 mL无菌三角瓶、无菌镊子、无菌滤纸备用。
超净工作台中,先用无菌水冲洗种子和茎基部2次,75%乙醇震荡浸泡30 s,无菌水冲洗3遍,后用消毒液消毒,消毒液中加入0.5%(V/V)吐温- 80,无菌水冲洗5遍,滤纸吸去外植体表面水分。
1.2.1 灭菌方法
鼠尾草种子和鼠尾草茎基部分别用0.1%氯化汞或2%次氯酸钠溶液消毒。种子消毒时间和茎基部消毒时间不同,比较不同时间和不同消毒液对外植体污染率的影响,确定不同外植体的最佳消毒方法。
1.2.2 诱导培养基
以MS为基本培养基,添加不同浓度的细胞分裂素6- BA和生长素NAA。其中,细胞分裂素6- BA 0~4 mg·L-1,生长素NAA 0~0.4 mg·L-1。根据不同激素配比的培养基下鼠尾草的生长状态确定最适合的激素含量。
1.2.3 增殖培养基
诱导鼠尾草出芽后,以MS为基本培养基,添加不同浓度的细胞分裂素6- BA和生长素NAA调节芽增殖。其中,细胞分裂素6- BA 0~1.2 mg·L-1,生长素NAA 0~0.1 mg·L-1。根据不同激素配比的培养基中鼠尾草的生长状态确定最适合的激素含量。
1.2.4 不定根诱导及驯化移栽
以1/2 MS为基本培养基,观察鼠尾草生根情况。完成生根后,在培养室揭开瓶盖,室温下放置3 d。取出组培苗,清洗附着在组培苗上的培养基,整理根并种植于配好的基质中。
2 结果与分析
2.1 灭菌方法
起始材料是鼠尾草种子和茎基部2种。初期用流水冲洗1 h后,后续操作在超净工作台中进行。选择2%次氯酸钠溶液和0.1%氯化汞溶液,各加入1滴0.5%(V/V)吐温80,分别对种子和茎基部进行消毒处理。如表1所示,每个起始材料每种灭菌方式都分别用3种灭菌时间处理。

表1 不同灭菌液和灭菌时间对鼠尾草种子和茎基部诱导脱菌的影响
以种子为起始材料时,2%次氯酸钠溶液4 min和0.1%氯化汞溶液2 min灭菌处理后污染率较高,分别是80.0%和73.3%,对应的出芽率分别是13.3%和6.7%。随着灭菌时间的增加,污染率降低,2%次氯酸钠溶液和0.1%氯化汞溶液分别处理7和5 min后污染率降为6.7%和13.3%,对应的出芽率分别为86.7%和63.3%。采用2%次氯酸钠溶液和0.1%氯化汞溶液分别处理10和8 min后污染率均为0,而出芽率分别为33.3%和0。综上,以鼠尾草种子作为起始材料,2%次氯酸钠溶液消毒7 min或0.1%氯化汞溶液消毒5 min为最佳灭菌方法;从污染率和出芽率来看,2%次氯酸钠溶液消毒7 min效果更优。
以鼠尾草茎基部为起始材料时,因为茎基部与土壤接触,土壤中携带的菌类会影响茎基部的灭菌时间和灭菌程度,因此,设置灭菌时间相较于种子略长。2%次氯酸钠溶液处理10 min和0.1%氯化汞溶液处理5 min,污染率较高,分别是86.7%和83.3%,对应的出芽率分别为6.7%和13.3%。2%次氯酸钠溶液消毒20 min和0.1%氯化汞溶液消毒10 min,污染率分别为40.0%和13.3%,对应出芽率分别为53.3%和66.7%。当2%次氯酸钠溶液和0.1%氯化汞溶液的处理时间分别达到30和15 min时,污染率分别为20.0%和3.3%,对应出芽率分别为36.7%和20.0%。综上,以鼠尾草茎基部为起始材料,2%次氯酸钠溶液消毒20 min或0.1%氯化汞溶液消毒10 min为最佳灭菌方法;从污染率和出芽率来看,0.1%氯化汞溶液消毒10 min效果更优。
2.2 诱导培养基
以MS为基本培养基,添加生长素和细胞分裂素。植物细胞中生长素和细胞分裂素是启动细胞分化、脱分化和再分化的关键因素。
从表2看出,以种子为起始材料时,1 mg·L-16- BA+0.1 mg·L-1NAA是最佳诱导激素配比,诱导率可以达到90%,最快7 d就可以诱导出2片子叶的无菌幼苗(图1)。一般情况下,20 d左右可以诱导出苗,出苗后,子叶快速长大,茎伸长,个别幼苗在接触培养基的部位长出细弱的根。当激素浓度低时,未能生长出幼苗或者诱导率低,幼苗生长缓慢。而激素浓度过高,可能会导致玻璃化。

图1 鼠尾草种子诱导的无菌苗
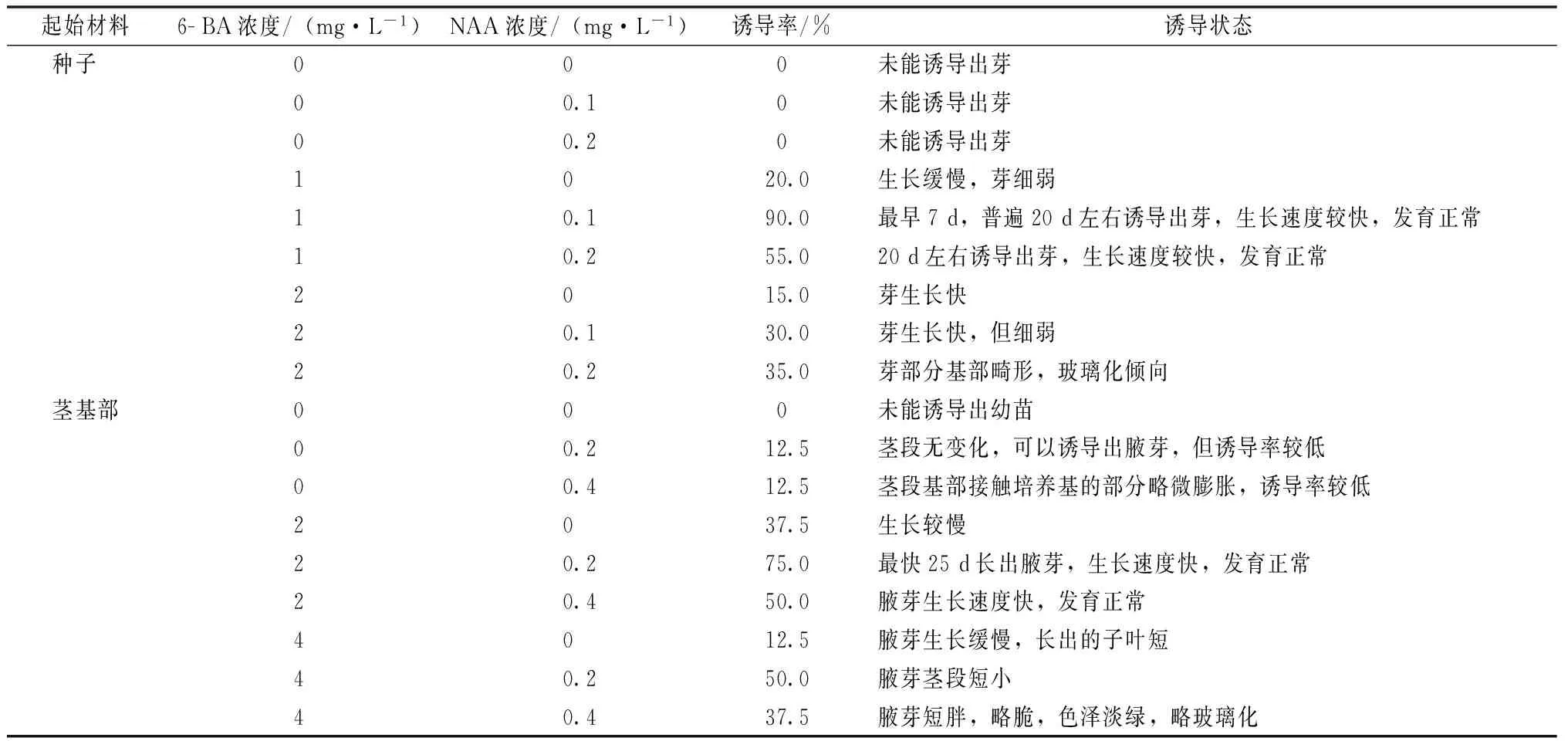
表2 不同激素含量对鼠尾草诱导的影响
以茎段为起始材料时,2 mg·L-16- BA+0.2 mg·L-1NAA是最佳诱导激素配比,诱导率可以达到75%,最快的出苗时间是25 d,从茎基部长出腋芽并成长迅速。普遍的出苗时间为30~40 d。在此浓度配比下,腋芽生长健壮。待腋芽生长至1~2 cm,更换至增殖培养基。
2.3 增殖培养基
幼苗生长至2 cm左右,从茎基部切下,接至增殖培养基中。以种子和茎段为起始材料,在增殖过程中没有发现明显差异。在不同6- BA和NAA激素配比的培养基中继代1个月,观察伸长倍率和增殖倍率。如表3所示,0.6 mg·L-16- BA+0.05 mg·L-1NAA培养基中,伸长倍率为3.24倍,而增殖倍率可以达到4.62倍,芽生长迅速并且粗壮,适合后期持续扩大培养。0.6 mg·L-16- BA+0.1 mg·L-1NAA培养基中,增值倍率和伸长率均达到最大值,且芽生长迅速,但出现个别畸形现象,芽下端有部分连接在一起,因此不予考虑。6- BA达到1.2 mg·L-1时,芽比较细弱,且芽的生长量差异较大,长势不整齐。NAA的浓度达到0.1 mg·L-1时,经过几次继代后,玻璃化现象比较严重,芽脆,含水较高,并逐渐透明化。

表3 继代1个月时不同激素含量对鼠尾草增殖的影响
2.4 生根培养基及试管苗移栽
以1/2 MS为基本培养基,含蔗糖20%,30 d后生根率可以达到100%,根长约4.23 cm,生根均匀,根白绿色,平均每株生根数为4.23条(图2)。
在培养基上生根1个月后,在培养间揭去瓶盖2~3 d,后用清水冲洗根部,去除黏附的培养基。在穴盘中装入泥炭和蛭石体积比1∶1的混合土。整理鼠尾草根部并种植于混合土中,浇透水并加盖穴盘。上方安置遮光网,放置于大棚内,湿度保持在85%左右。生长2个月后,鼠尾草成活率90%以上。每半个月浇水时混用0.1%多菌灵溶液可以在一定程度上杀菌。另外,每半个月施加薄肥(1/1 000氮磷钾肥)以促进鼠尾草生长。

图2 鼠尾草的生根培养
3 小结与讨论
植物组织培养技术是指在无菌条件下,将离体的植物器官、组织、细胞以及原生质体,在人工配制的环境里培养成完整的植株。植物组织培养的依据是植物细胞全能性及植物的再生作用[4]。高度分化的植物细胞具有全能性。植物细胞在离体条件时,在一定的营养物质、激素和适当的外部环境下能够表现出全能性。植物体分生能力强的部位,例如植物根尖、茎尖,在无机盐、糖类、激素、酵母提取物等配置成的培养基中,能够分化成具有根、茎、叶的完整植株。鼠尾草培养过程中,采用种子和茎基部2种外植体进行培养,在适当的激素调节下,可以形成完整植株。
组培过程初期,要获得完全无菌的接种材料,一方面可以选取植物组织内部无菌的材料,另一方面,可以通过消毒处理杀死植物材料表面存在的各种微生物,根据不同材料选用不同的消毒剂及适合的浓度和处理时间,运用不同的消毒方法。常常使用5~10%漂白粉、70~75%乙醇、0.1~0.2%氯化汞及2~10%次氯酸钠等灭菌液脱毒[5]。鼠尾草外植体脱毒培养时,首先用75%乙醇浸泡30 s,随后对比氯化汞和次氯酸钠消毒液的脱毒效果。鼠尾草不同的外植体部位适用的灭菌剂和灭菌时间略有不同。鼠尾草种子用2%次氯酸钠溶液(含0.5%吐温- 80)灭菌7 min,污染率为6.7%,出芽率为86.7%,是比较适合的灭菌方法。以鼠尾草茎基部为外植体时,0.1%氯化汞溶液(含0.5%吐温80)灭菌10 min,污染率为13.3%,出芽率为66.7%。由此可见,针对不同的外植体,不同的灭菌剂和灭菌时间会有不同的灭菌效率。灭菌时间较短,灭菌不完全,污染率大幅度提高;灭菌时间过长,污染率虽然大幅度降低,但对植物造成不可逆转的伤害,极大地影响鼠尾草的出芽率。另外,消毒完成后,鼠尾草种子在浸涨后,有胶质包裹。在接种过程中,需要用解剖刀在种子一端轻戳破,可以显著提高种子的萌发率。
脱分化和再分化的过程都需要在培养基中添加适当比例的生长素和细胞分裂素,以诱导细胞的脱分化和再分化。生长素和细胞分裂素的合理配比在组培过程中具有调控细胞分裂、芽生长、愈伤形成等功能。在植物组织培养中生长素的主要作用是促进细胞生长与分裂,用于诱导愈伤组织形成、根分化以及细胞分裂。细胞分裂素可以促进植物细胞的分裂和分化,在诱导芽分化、叶绿体发育、运输和分配养分、植物抗衰老等方面都扮演了重要角色[6]。组培中大多情况下两者同时施用,通过调节两者的浓度和比例实现理想的生长与繁殖效果。一般来说,当细胞分裂素与生长素的比值较大时,可以促进芽的形成;当细胞分裂素与生长素的比值较小时,有利于根的分化[7]。在鼠尾草生长素和细胞分裂素配比研究中,发现生长素和细胞分裂素的合适比例非常重要。当细胞分裂素和生长素比例较低时,鼠尾草可能出现愈伤,或者部分生根。而当细胞分裂素和生长素过高时,鼠尾草细弱,生长缓慢,或者增殖率较高,但个体生长势差异较大,部分出现玻璃化倾向。植物组织玻璃化即植物结构发育畸形,是一种生理失调或生理病变,很难继续用于继代培养和扩繁材料[4]。报道指出,激素种类和浓度对玻璃苗的发生有重要影响,但激素对玻璃苗的影响程度随外植体种类和琼脂浓度的不同而异[8]。Leshem等[9]发现,过量的NAA使培养物内源细胞分裂素浓度过高而造成玻璃化。而培养基中外源细胞分裂素供应过多同样容易导致组培苗玻璃化。例如在重瓣丝石竹的组培过程中,高浓度的细胞分裂素,尤其6- BA为5.0 mg·L-1,是导致玻璃苗发生的主要原因[10]。根据本试验目的,为了鼠尾草诱导及繁殖最大化,且器官发生的繁殖正常,合理浓度的生长素和细胞分裂素至关重要。在鼠尾草的诱导过程中,以种子为外植体时,1 mg·L-16- BA+0.1 mg·L-1NAA具有较好的诱导效果;而以茎基部为外植体时,2 mg·L-16- BA+0.2 mg·L-1NAA具有较好的诱导效果。在增殖过程中,0.6 mg·L-16- BA+0.05 mg·L-1NAA最适合鼠尾草正常芽的生长发育,并保证繁殖的快速高效。
比较鼠尾草增殖和生根情况,以鼠尾草种子和茎基部为外植体的起始材料对后期植物增殖和成活没有太大影响,而鼠尾草种子从灭菌效率和诱导效率上来看,都明显高于鼠尾草茎基部,因此,可优先选用鼠尾草种子为外植体。
利用1/2 MS培养基进行鼠尾草生根培养。培养基中生根培养1个月,生根率达到100%。继续在培养基中生长,根可以延续伸长,但根继续培养对后期炼苗没有更多优势,过长的根进入培养土中会腐烂枯萎。生根培养1个月后,开启瓶盖3 d左右,即可开始炼苗。将适应环境的贵州鼠尾草转至泥炭和蛭石体积比为1∶1的混合土中,放入大棚,培养温度20 ℃,湿度85%以上。移栽开始2个月,鼠尾草种植于带盖子的穴盘中,减少水分散失。如果光线比较强,可以在上方安置遮光网。高湿度可能会造成杂菌滋生,2个月后开盖培养,每半个月用0.1%多菌灵溶液喷洒。另外,每半个月施加薄肥(1/1 000氮磷钾肥)以促进鼠尾草生长。鼠尾草长大后,可以转移到较大的营养钵或者盆中生长,以保证足够的土壤空间和肥力。
[1] 魏宇昆, 王琦, 黄艳波. 唇形科鼠尾草属的物种多样性与分布[J]. 生物多样性, 2015, 23(1): 3- 10.
[2] 孙雄才. 中国植物志[M]. 北京: 科学出版社, 1998.
[3] 何可群, 卢文芸, 李相兴, 等. 贵州鼠尾草的总黄酮含量测定[J]. 贵州农业科学, 2013, 41(1): 77- 79.
[4] 胡彦, 赵艳. 植物组织培养技术的应用以及在培养过程中存在的问题[J]. 陕西师范大学学报(自然科学版), 2004, 32(增1): 130- 134.
[5] 杨海莲, 孙晓潞, 宋未. 植物内生细菌的研究[J]. 微生物学通报, 1998, 25(4): 224- 227.
[6] 柴娟. 细胞分裂素的生物合成及信号途径的研究进展[J]. 安徽农业科学, 2008, 36(10): 3985- 3989.
[7] 沈逢源, 李高燕, 刘思琪. 植物组织培养过程中的影响因素[J]. 现代园艺, 2011 (4): 12.
[8] 叶添谋. 植物组织培养过程中的常见技术难题研究进展[J]. 韶关学院学报, 2010, 31(3): 84- 90.
[9] LESHEM B, WERKER E, SHALEV D P. The effect of cytokinins on vitrification in melon and carnation [J]. Annals of Botany, 1988, 62(3): 271- 276.
[10] 刘非燕, 郭达初. 重瓣丝石竹试管苗玻璃化发生原因初探[J].杭州大学学报, 1996, 23(4): 382- 387.
(责任编辑:侯春晓)
2016- 12- 09
高 燕(1982—),女,江苏盐城人,高级工程师,博士,从事植物细胞生物学和细胞工程研究工作,E- mail:gaoyan106@126.com。
奉树成(1966—),男,湖南娄底人,高级工程师,硕士,从事植物学研究工作,E- mail:shbg2009@126.com。
10.16178/j.issn.0528- 9017.20170313
S567.53
A
0528- 9017(2017)03- 0407- 05
文献著录格式:高燕,魏宇昆,奉树成. 贵州鼠尾草组织培养育苗技术[J].浙江农业科学,2017,58(3):407- 411.
