恩替卡韦治疗后e抗原阳性慢性乙型肝炎患者Treg/Th17比率的变化及其与疗效的关系
2017-04-18李成伟卢丹那妍李岩王本鑫娄宪芝
李成伟,卢丹,那妍,李岩,王本鑫,娄宪芝
(沈阳医学院附属中心医院1.感染科;2.呼吸科;3.检验科,沈阳110024)
恩替卡韦治疗后e抗原阳性慢性乙型肝炎患者Treg/Th17比率的变化及其与疗效的关系
李成伟1,卢丹2,那妍1,李岩1,王本鑫3,娄宪芝1
(沈阳医学院附属中心医院1.感染科;2.呼吸科;3.检验科,沈阳110024)
目的研究恩替卡韦治疗乙型肝炎病毒e抗原(HBeAg)阳性慢性乙型肝炎(CHB)患者过程中调节性T细胞(Treg)与Th17细胞比率的变化及其与病毒学应答和血清学应答的关系。方法应用恩替卡韦治疗27例HBeAg阳性CHB患者,在治疗前及治疗4、12、24、36、48周时分别检测乙肝标志物、HBV DNA、肝功、Treg细胞频数、Th17细胞频数。选择20名健康人作为对照组。结果Treg/Th17比率在第4周开始下降,至第12周达到最低值。发生早期病毒学应答及HBeAg消失患者的Treg/Th17比率(12周)低于未发生早期病毒学应答及HBeAg消失的患者,差异有统计学意义(P<0.05)。结论恩替卡韦治疗慢性乙型肝炎患者过程中,Treg/Th17比率呈动态变化,12周时Treg/Th17比率与HBeAg消失、早期病毒学应答密切相关,可能成为疗效预测的指标。
慢性乙型肝炎;恩替卡韦;调节性T细胞;Th17细胞
慢性乙型肝炎(chronic hepatitis B,CHB)仍是世界范围内亟待解决的严重公共卫生问题[1],恩替卡韦为鸟嘌呤核苷类似物,是治疗CHB首选的药物之一,抗病毒治疗效果好,耐药率低。影响抗病毒疗效的因素主要包括宿主和病毒两方面因素,研究表明宿主的免疫状态是预测疗效的关键因素[2],调节性T细胞(T regulatory cell,Treg)与Th17细胞的比率可以反映CHB患者体内免疫状态的变化[3]。本研究探讨了恩替卡韦治疗CHB过程中Treg/Th17比率的变化与疗效的关系,并评价其临床意义。
1 材料与方法
1.1 研究对象
选择2013年1月至2014年12月沈阳医学院附属中心医院感染科诊治的27例乙型肝炎病毒e抗原(hepatitis B e antigen,HBeAg)阳性CHB患者,平均年龄(38.7±12.2)岁,其中男17例,女10例,均符合《慢性乙型肝炎防治指南》(2010)[4]的诊断标准,患者HBV DNA≥5 lg(copies/mL),HBeAg阳性,丙氨酸转移酶(alanine aminotransferase,ALT)≥2 ULN,至少半年内未进行抗病毒或免疫调节治疗。给予恩替卡韦(博路定)0.5 mg每日1次口服;肝功异常者给予保肝药物治疗。选择20名健康人(男10名,女10名)作为对照组,所有健康对照者排除自身免疫性肝病等肝脏疾病,排除人类免疫缺陷病毒、乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒等病毒感染。
1.2 检测指标
CHB患者在应用恩替卡韦治疗前及治疗4、12、24、36、48周时采集外周静脉血,测定Treg细胞(Foxp3+T细胞)比例、Th17细胞(IL⁃17+T细胞)比例、HBV DNA水平(HBV DNA阴转标准为HBV DNA<103copies/mL)、HBV血清标志物、ALT水平。健康对照组仅采血1次,测定Treg细胞(Foxp3+T细胞)和Th17细胞(IL⁃17+T细胞)比例。
1.3 方法
1.3.1 Th17细胞检测:实验前应用肝素抗凝管分别取实验组及对照组每人全血5 mL。取新试管孵育细胞,肝素抗凝全血500 μL,加刺激剂500 μL后放入37℃的CO2恒温箱中孵育5 h。再取一新试管,加入CD3、CD4抗体各10 μL,刺激后血样用移液器取上清500 μL弃去,混匀,取100 μL放入加好抗体的试管,放置15 min(室温避光)。加入1 mL溶血素(溶血素∶蒸馏水=1∶9)放置10 min(室温避光)。低速离心5 min(1 500 r/min)弃去上清。加入1 mL破膜液放置30 min(室温避光)。加入1 mL破膜buffer放置20 min(室温避光)。低速离心5 min(1 500 r/min)弃去上清。加17 μL IL⁃17抗体,混匀后放置30 min(室温避光)。加入1 mL PBS混匀后低速离心弃去上清。加300 μL PBS后混匀进行流式检测(美国BD Biosciences流式细胞仪)。
1.3.2 Treg细胞检测:另取新试管,加CD4抗体、CD25抗体各10 μL,加未孵育全血100 μL,混匀,放置15 min(室温避光)。加入1 mL破膜液,放置30 min(室温避光)。加入1 mL破膜buffer放置20 min(室温避光)。低速离心5 min(1 500 r/min)弃上清。加2.5 μL Foxp3抗体,放置2 h(室温避光)。加入PBS 1 mL,混匀,低速离心5 min(1 500 r/min)弃上清。加300 μL PBS,应用流式细胞仪(美国BD Bio⁃sciences流式细胞仪)进行检测。
1.4 统计学分析
采用SPSS 17.0统计软件进行统计学处理,组间均值比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 恩替卡韦治疗前后Treg细胞和Th17细胞频数的变化
如表1所示,应用恩替卡韦治疗后,CHB组患者Treg细胞在第4周开始下降,至12周达到最低点,之后逐渐升高,至48周接近治疗前水平。CHB组患者Th17细胞频数的均数在各时间点均明显高于对照组(P<0.05),CHB组患者Th17细胞频数先升高后下降,第12周改变最显著。CHB组患者Treg/Th17比率在治疗过程中呈动态变化,治疗4周时开始下降,至12周达到最低值,后逐渐升高,在48周时与治疗前水平相近。CHB组患者Treg/Th17比率在治疗前及治疗中各时间点均明显低于对照组(P<0.05)。
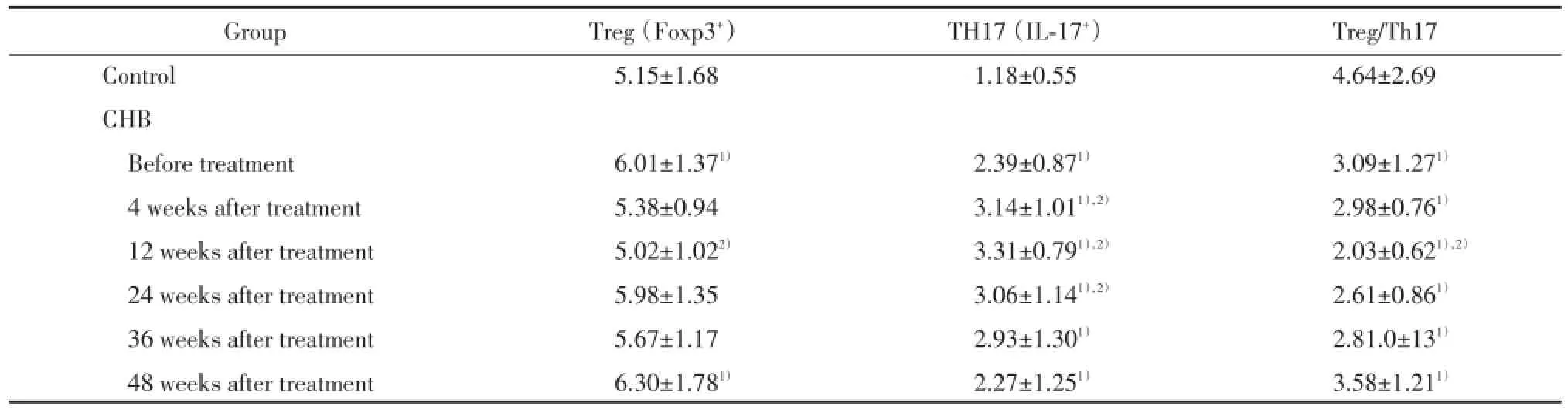
表1 恩替卡韦治疗CHB患者Treg细胞和Th17细胞频数的变化Tab.1Changes of Treg/Th17 ratio in HBeAg positive CHB patients receiving entecavir
2.2 Treg/Th17比率变化与HBV DNA变化的相关性
27例HBeAg阳性的CHB患者应用恩替卡韦治疗后,HBV DNA于第4周时开始下降,12周时患者HBV DNA阴转率为62.96%(17/27),24周时患者HBV DNA阴转率为96.29%(26/27),48周时患者HBV DNA阴转率为100%(27/27)。
Treg/Th17比率在12周时改变最明显,分析12周时Treg/Th17比率与早期病毒学应答(12周)的关系,发生早期病毒学应答的17例患者Treg/Th17比率均数(1.79±0.62)较未发生病毒学早期应答的10例患者Treg/Th17比率均数(2.43±0.36)明显降低,差异有统计学意义(P<0.05)。
2.3 Treg/Th17比率变化与HBeAg消失的关系
入组时所有患者均为HBeAg阳性,24周时HBeAg阴转率为11.11%(3/27),48周时累计HBeAg阴转率为37.04%(10/27)。发生HBeAg消失(12周)的10例患者Treg/th17比率(1.45±0.51)与未发生HBeAg消失的17例患者的Treg/th17比率(2.37± 0.37)的差异有统计学意义(P<0.05)。
3 讨论
HBV持续复制及机体的免疫反应是CHB进展的重要原因[5],持续抑制病毒是治疗CHB的重要措施,恩替卡韦具有强效抗HBV作用,经治疗患者HBV DNA载量迅速下降,并且在治疗过程中表现出较高的HBeAg清除率,而Treg/Th17比率可以提示患者体内免疫功能的变化,研究Treg/Th17比率与HBeAg清除的关系对指导临床治疗有重要意义。
Treg细胞是以免疫抑制活性为特征的T细胞,可抑制HBV特异性免疫反应,是导致免疫耐受的主要细胞[6]。而且HBV能够诱导Treg的产生,维持免疫耐受[7]。核苷(酸)类似物治疗可能使刺激Treg细胞增多的因素减少,Treg细胞比例明显降低,抑制HBV特异性免疫反应的作用减弱,体内免疫反应增强,免疫功能得到改善。Th17细胞产生的白细胞介素17A等效应因子可增强组织炎症反应,有研究[8]表明免疫介导的肝脏损伤与Th17细胞相关,考虑为Th17细胞表达增加,增强和参与了因HBV特异性免疫应答而引起的肝脏炎症反应。Treg细胞抑制炎症反应,而Th17细胞促进炎症反应,Treg/Th17的动态平衡是慢性炎症持续及进展等变化的重要因素[9]。CHB患者多处于Th17细胞增加的免疫失衡状态,Treg/Th17比率可以提示患者体内免疫功能的变化[10]。
本研究中,经恩替卡韦治疗后,Treg/Th17比率呈现动态变化,表现为先下降后升高,且CHB患者的Th17细胞在各个时间点均明显高于健康对照者,导致Treg/Th17比率降低,各个时间点均低于健康对照者。恩替卡韦治疗使HBV DNA载量迅速降低,改善了机体免疫状态,使Th17细胞增多,Treg/Th17比率降低。而后Treg/Th17比率逐渐升高的机制可能为体内免疫系统为减轻炎症反应,使CD4+T细胞向Treg细胞分化[11],从而Th17细胞减少。也有研究[12]表明,当HBV DNA明显下降、HBeAg转阴或发生血清学转换及ALT恢复正常时,Th17细胞及其相关细胞因子的分泌均呈明显下降趋势,Treg细胞与Th17细胞进入新的平衡状态,Treg/Th17比率升高。本研究观察到,第12周时Treg/Th17比率的变化在早期病毒学应答及HBeAg消失的患者中表现更明显,差异有统计学意义,提示Treg/Th17比率的变化与早期病毒学应答及HBeAg消失相关。
Treg/Th17比率在接受恩替卡韦治疗的HBeAg阳性CHB患者中呈波动性改变,与疗效具有相关性,但其波动机制及预测疗效的作用及程度还需要进一步观察。
[1]徐晓雪,房凯,钟连声,等.乙型肝炎病毒基因生物信息学分析及特异片段的制备[J].中国医科大学学报,2008,37(5):583-585. DOI:10.3969/j.issn.0258⁃4646.2008.05.003.
[2]ZEUZEM S,GANE E,LIAW YF,et al.Baseline characteristics and early on⁃treatment response predict the outcomes of 2 years of telbi⁃vudine treatment of chronic hepatitis B[J].J Hepatol,2009,51(1):11-20.DOI:10.1016/j.jhep.2008.12.019.
[3]ZHANG GL,XIE DY,LIN BL,et al.Imbalance of interleukin⁃17⁃producing CD4 T cells/regulatory T cells axis occurs in remission stage of patients with hepatitis B virus⁃related acute⁃on⁃chronic liv⁃er failure[J].J Gastroen Hepataol,2013,28(3):513-521.DOI:10.1111/jgh.12082.
[4]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].肝脏,2011,16(1):2-16.DOI:10.14000/J.cnki.issn.1008⁃1704.2011.01.001.
[5]穆桂玲,王玉梅.慢性乙型肝炎患者细胞免疫功能和细胞因子的变化及意义[J].中国医科大学学报,2002,31(1):32-34.DOI:10.3969/j.issn.0258⁃4646.2002.z1.015.
[6]余灵祥,李志伟,张培瑞,等.Treg细胞在慢性乙肝患者外周血中的表达及其对DC细胞的抑制作用[J].现代生物医学进展,2015,15(11):2053⁃2055.DOI:10.13241/j.cnki.pmb.2015.11.014.
[7]贾志荣,杨勇,季晖.乙肝免疫耐受分子机制的研究进展[J].抗感染药学,2014,11(2):93-97.DOI:10.13493/j.issn.1672⁃7878.2014.02⁃002.
[8]GE J,WANG K,MENG QH,et al.Implication of Th17 and Th1 cells in patients with chronic active hepatitis B[J].J Clin Immu⁃nol,2010,30(1):60-67.DOI:10.1007/s10875⁃009⁃9328⁃2.
[9]HANIDZIAR D,KOULMANDA M.Inflammation and the balance of Treg and Th17 cells in transplant rejection and tolerance[J].Curr Opin Organ Tran,2010,15(4):411-415.DOI:10.1097/MOT.0b013 e32833b7929.
[10]SU ZJ,YU XP,GUO RY,et al.Changes in the balance between Treg and Th17 cells in patients with chronic hepatitis B[J].Diagn Micr Infec Dis,2013,76(4):437-444.DOI:10.1016/j.diagmicro⁃bio.2013.04.026.
[11]BETTLLI E,CARRIER Y,GAO W,et al.Reciprocal developmen⁃tal patyways for the generation of pathogenic effector Th17 and reg⁃ulatory T cells[J].Nature,2006,441(7090):235-238.DOI:10.1038/nature04753.
[12]申红玉,杭双熊,钱梅云,等.抗病毒治疗对慢性乙型肝炎患者外周血中Th17细胞及其相关细胞因子的影响[J].实用医学杂志,2016,32(9):1425-1427.DOI:10.3969/j.issn.1006⁃5725.2016.09.015.
(编辑陈姜)
Relationship between Changes of Treg/Th17 Ratio and Curative Effect in Patients with HBeAg⁃positive Chronic Hepatitis B after Receiving Entecavir
LI Chengwei1,LU Dan2,NA Yan1,LI Yan1,WANG Benxin3,LOU Xianzhi1
(1.Department of Infectious Disease,The Affiliated Central Hospital of Shenyang Medical College,Shenyang 110024,China;2.Department of Respiration,The Affili⁃ated Central Hospital of Shenyang Medical College,Shenyang 110024,China;3.Clinical Laboratory,The Affiliated Central Hospital of Shenyang Medical College,Shenyang 110024,China)
ObjectiveTo investigate whether there are correlation among changes of Treg/Th17 ratio with virological response and serological re⁃sponse in patients with hepatitis B e antigen(HBeAg)⁃positive chronic hepatitis B(CHB)after receiving entecavir.Methods27 patients with HBeAg⁃positive CHB were enrolled for the study.Peripheral blood Treg cell frequency and Th17 cell frequency,HBV DNA,alanine aminotransfer⁃ase levels,hepatitis B virus marker were detected before and after entecavir treatment at 4,12,24,36,and 48 weeks.Peripheral blood Treg cell frequency and Th17 cell frequency of 20 healthy volunteers were detected as well.ResultsTreg/Th17 ratio of patients decreased from 4 week and reached the lowest point at 12 weeks.Treg/Th17 ratio(12 weeks)of the patients who got the early virological response and HBeAg disappeared was lower than others,and the difference was statistical significant.ConclusionTreg/Th17 ratio changes in HBeAg⁃positive CHB patients receiv⁃ing entecavir antiviral treatment.Treg/Th17 ratio(12 weeks)showed significant correlation with early virological response and HBeAg disappear⁃ance.The changes of Treg/Th17 ratio may provide a reference of curative effect.
chronic hepatitis B;entecavir;T regulatory cell;Th17 cell
R512.6
A
0258-4646(2017)01-0033-04
10.12007/j.issn.0258⁃4646.2017.01.007
辽宁省科学技术计划(2013225086);沈阳市卫生局科研课题(2012)
李成伟(1975-),男,副主任医师,硕士.
娄宪芝,E-mail:grk8@163.com
2016-05-19
网络出版时间:
