Tubastatin A Hcl对慢性支气管哮喘小鼠的治疗作用
2017-04-18任媛苏新明李孟露赵萱康健
任媛,苏新明,李孟露,赵萱,康健
(中国医科大学附属第一医院呼吸疾病研究所,沈阳110001)
Tubastatin A Hcl对慢性支气管哮喘小鼠的治疗作用
任媛,苏新明,李孟露,赵萱,康健
(中国医科大学附属第一医院呼吸疾病研究所,沈阳110001)
目的探讨组蛋白去乙酰化酶6抑制剂(Tubastatin A Hcl)对慢性支气管哮喘小鼠气道炎症、气道重塑和气道高反应的影响。方法将BALB/C小鼠分为正常组、哮喘组、地塞米松组和Tubastatin A Hcl组。测定气道阻力,计数支气管肺泡灌洗液(BALF)中细胞总数和分类细胞数,ELISA检测白细胞介素(IL)4、IL⁃5和转化生长因子(TGF)β1。HE、AB⁃PAS和Masson染色观察气道炎症、气道重塑。免疫组化和Western blotting测定α⁃平滑肌肌动蛋白(α⁃SMA)和TGF⁃β1表达。结果药物治疗后气道阻力降低,BALF中IL⁃4、IL⁃5和TGF⁃β1表达下降,炎症细胞总数和嗜酸性粒细胞数减少;肺组织气道周围炎症减轻,杯状细胞化生降低,胶原沉积减少,且地塞米松治疗效果优于Tubastatin A Hcl。药物治疗后肺组织中α⁃SMA和TGF⁃β1表达下降,且Tubastatin A Hcl治疗效果略优于地塞米松。结论Tubastatin A Hcl能够有效缓解慢性支气管哮喘小鼠气道炎症、气道重塑和气道高反应,其抗炎效果略差于激素,但在抗气道重塑方面略优于激素治疗。
哮喘;组蛋白去乙酰化酶;气道炎症;气道重塑;气道高反应
近年来,许多研究[1⁃4]表明广谱组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)在抑制肿瘤细胞增生的同时,还具有抗炎、抗纤维化和抗血管再生的潜能,这有望为哮喘治疗尤其是抑制重塑方面提供新方法。据文献[5⁃8]报道,组蛋白去乙酰化酶(histone deacetylase,HDAC)6作为HDACs家族的重要成员,参与调控了炎症反应、成纤维细胞增殖分化、平滑肌细胞增殖迁移以及胶原分泌等诸多病理过程,在抑制纤维化和血管再生方面表现出了独特的作用效果。因此,本研究选取特异性HDAC6抑制剂Tubastatin A Hcl,观察其对慢性支气管哮喘小鼠气道炎症、气道重塑和气道高反应的治疗作用。
1 材料与方法
1.1 哮喘模型制备及分组
SPF级6~8周龄雌性BALB/C小鼠,分为正常组、哮喘组、地塞米松组和Tubastatin A Hcl组,每组12只,于实验第0、7、14天,分别予以哮喘组、地塞米松组和Tubastatin A Hcl组小鼠卵蛋白OVA(20 μg)和氢氧化铝凝胶(2 mg)致敏。末次致敏7 d后,行OVA(20 mg·mL-1)超声雾化(3 mL·min-1),30 min/次,3次/周,共8周。每次激发实验前30 min,Tubastatin A Hcl(0.5 mg·kg-1)和地塞米松(2.0 mg·mL-1)腹腔注射给药。正常组小鼠的各处理因素均以生理盐水代替。
1.2 小鼠气道反应性测定
末次激发实验24 h后,应用emka动物无创肺功能系统测定气道阻力。将小鼠放入密闭的体描箱中,给予不同浓度的乙酰甲胆碱(0、3.125、6.25、12.5、25、50 mg·mL-1)激发,采集Penh值3 min,用于反应气道阻力。
1.3 支气管肺泡灌洗液(bronchoalveolar lavage flu⁃id,BALF)细胞计数与分类计数
各组小鼠肺功能检测结束后,水合氯醛麻醉,行支气管肺泡灌洗,回收BALF并记录回吸收量,回吸收量>1.2 mL为合格标本。BALF离心取上清,保存在-80℃冰箱。沉淀细胞重悬混匀后,在显微镜下计数细胞总数。并进行瑞氏-吉姆萨染色计数分类细胞数,每张涂片计数200个细胞,记录各种细胞数目。
1.4 白细胞介素(interleukin,IL)4、IL⁃5和转化生长因子(transforminggrowthfactor,TGF)β1细胞因子测定
ELISA法检测BALF中IL⁃4、IL⁃5和TGF⁃β1水平。操作方法按试剂盒说明书操作(CUSABIO,USA)。
1.5 肺组织炎症、胶原沉积和杯状细胞观察
取左侧肺组织,10%甲醛固定,石蜡包埋并切片后,行HE、AB⁃PAS和Masson染色。采用半定量法评估HE染色中气道周围炎症细胞浸润程度:(1)0分,支气管周围无炎症细胞;(2)1分,少量炎症细胞;(3)2分,较多炎症细胞,分布不均匀,未聚集成团;(4)3分,大量炎症细胞,分布较均匀,少见聚集成团;(5)4分,大量炎症细胞,并聚集成团。计数气道周围单位基底膜面积内的炎症细胞数。AB⁃PAS染色结果行半定量分析观察气道上皮杯状细胞增生改变及黏液分泌情况,计算杯状细胞占上皮细胞百分比。Masson染色观察胶原沉积,以固定颜色定义胶原,测定单位长度基底膜的气道壁胶原沉积面积(胶原面积/基底膜周径,WAc/Pbm,μm2·μm-1)。以上所有分析每组至少测定20个气道。
1.6 肺组织中α⁃平滑肌肌动蛋白(α⁃smooth muscle actin,α⁃SMA)和TGF⁃β1的表达
1.6.1 α⁃SMA和TGF⁃β1半定量检测:采用SP法行肺组织α⁃SMA和TGF⁃β1免疫组织化学染色。石蜡切片脱蜡水化后,H2O2孵育5 min,微波炉抗原修复4次,6 min/次,10%BSA室温封闭30 min,α⁃SMA和TGF⁃β1一抗(1∶1 000)4℃孵育过夜。二抗(1∶500)孵育60 min,显微镜下控制DAB显色,复染,脱水,透明,封片。随机选取20个直径为200~400 μm支气管壁,采用Image⁃Pro Plus 6.0软件分析免疫组化结果。α⁃SMA结果以单位长度气道平滑肌面积(WAc/Pbm,μm2·μm-1)表示,TGF⁃β1以单位长度气道上皮阳性信号IOD值(IOD/Pbm)表示。
1.6.2 α⁃SMA和TGF⁃β1 Western blotting定量检测:右侧肺组织30~50 mg加入RIPA裂解液150 μL(含10%PMSF),冰上剪碎,匀浆,超声粉碎后,4℃12 000g离心30 min。取上清后,BCA法测定蛋白浓度,调整蛋白浓度,并变性。选用12%SDS聚丙烯酞胺凝胶电泳(80 V,30 min;120 V,90 min)分离。将凝胶上的蛋白转印到PVDF膜上(0.25 mA,60 min)。脱脂奶粉封闭液中室温封闭2 h,4℃孵育一抗α⁃SMA和TGF⁃β1(1∶1 000)过夜。二抗室温孵育1 h。ECL发光法检测蛋白质表达,UVP成像系统成像,结果用Gel⁃Pro analyzer凝胶定量分析软件分析。
1.7 统计学分析
2 结果
2.1 Tubastatin A Hcl抑制慢性哮喘气道高反应性
小鼠气道阻力与乙酰胆碱间具有浓度依赖性。相比于哮喘组,Tubastatin A Hcl治疗后,小鼠气道阻力明显降低,效果与地塞米松组相似,说明Tu⁃bastatin A Hcl能够有效的缓解哮喘小鼠的气道高反应性,见表1。
2.2 Tubastatin A Hcl抑制BALF中细胞总数及嗜酸性粒细胞数
表1 不同浓度的乙酰胆碱刺激后各组小鼠的Penh值Tab.1The Penh values of different mice groups following stimulation with acetylcholine
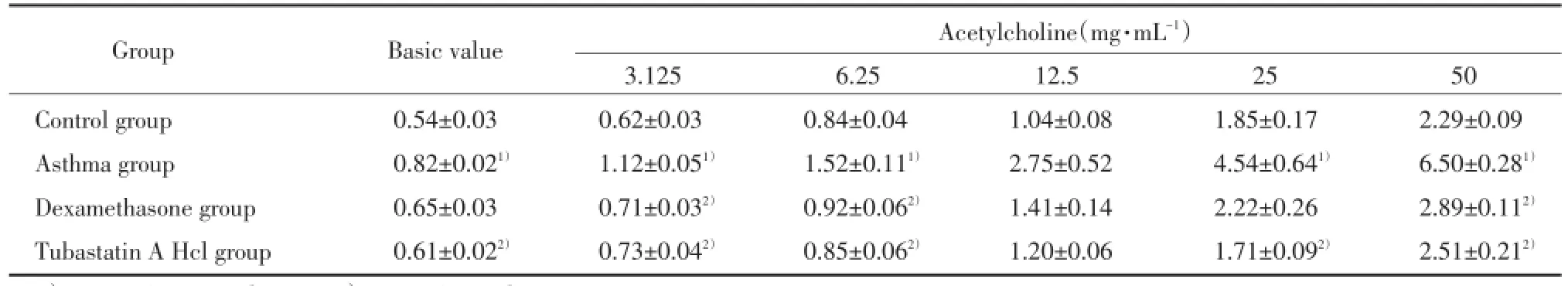
表1 不同浓度的乙酰胆碱刺激后各组小鼠的Penh值Tab.1The Penh values of different mice groups following stimulation with acetylcholine
1)P<0.05 vs control group;2)P<0.05 vs asthma group.
GroupBasic valueAcetylcholine(mg·mL-1)3.1256.2512.52550 Control group0.54±0.030.62±0.030.84±0.041.04±0.081.85±0.172.29±0.09 Asthma group0.82±0.021)1.12±0.051)1.52±0.111)2.75±0.524.54±0.641)6.50±0.281)Dexamethasone group0.65±0.030.71±0.032)0.92±0.062)1.41±0.142.22±0.262.89±0.112)Tubastatin A Hcl group0.61±0.022)0.73±0.042)0.85±0.062)1.20±0.061.71±0.092)2.51±0.212)
哮喘组BALF中细胞总数和嗜酸性粒细胞数显著增加。地塞米松和Tubastatin A Hcl治疗能够显著减少BALF中细胞总数和嗜酸性粒细胞数,地塞米松治疗效果明显优于Tubastatin A Hcl,2组间差异有统计学意义,见表2。
2.3 Tubastatin A Hcl抑制BALF中IL⁃4、IL⁃5和 TGF⁃β1水平
表2 BALF中细胞总数及细胞分类计数(,n=6)Tab.2 The total and differential cell count in BALF(,n=6)

表2 BALF中细胞总数及细胞分类计数(,n=6)Tab.2 The total and differential cell count in BALF(,n=6)
1)P<0.05 compared with control group;2)P<0.05 compared with asthma group;3)P<0.05 compared with dexamethasone group.
GroupTotal cell numberMacrophagesEosinophilsLymphocytesNeutrophils Control group13.42±4.2811.23±3.920.61±0.280.88±0.300.72±0.26 Asthma group98.04±9.271)25.10±4.201)37.64±6.981)23.57±6.081)11.73±3.431)Dexamethasone group27.67±6.531),2)10.62±2.522)7.16±1.982)5.14±2.042)4.75±1.772)Tubastatin A Hcl group73.75±9.261),2),3)27.70±5.001),3)27.33±4.511),3)11.48±4.321),2)10.02±5.111)
哮喘组小鼠BALF中IL⁃4、IL⁃5和TGF⁃β1水平显著升高。地塞米松和Tubastatin A Hcl能够明显抑制BALF中IL⁃4、IL⁃5和TGF⁃β1水平,且2治疗组间差异无统计学意义,见图1。
2.4 Tubastatin A Hcl影响肺组织气道炎症和气道重塑
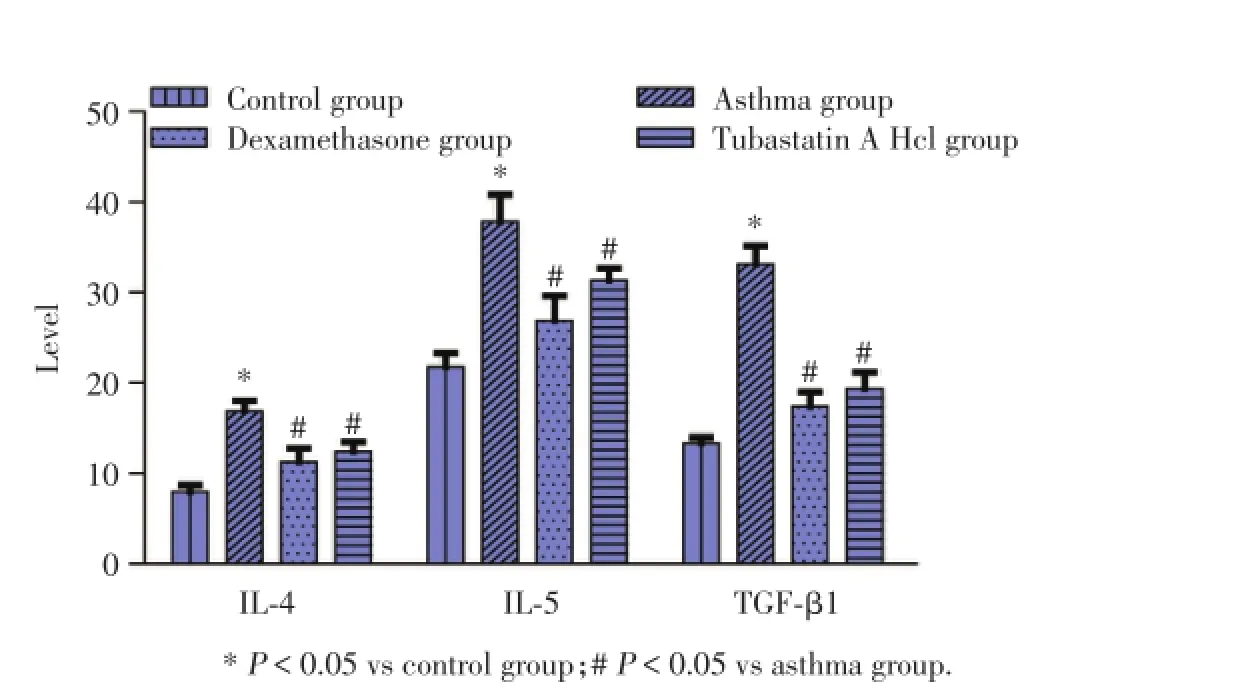
图1 BALF中IL⁃4、IL⁃5和TGF⁃β1水平Fig.1The levels of IL⁃4,IL⁃5,and TGF⁃β1 in the BALF
2.4.1 Tubastatin A Hcl抑制哮喘肺组织炎症水平:HE染色显示哮喘组小鼠气道及血管周围可见大量炎症细胞浸润,气道上皮脱落,平滑肌增厚,气道周围炎症细胞浸润评分和炎症细胞数显著高于正常小鼠。与哮喘组相比,地塞米松和Tubastatin A Hcl治疗后,气道和血管周围炎症细胞浸润明显减少,平滑肌增厚减轻,且地塞米松治疗效果略优于Tu⁃bastatin A Hcl,2组间无统计学差异,见图2,表3。
2.4.2 Tubastatin A Hcl抑制哮喘气道黏液高分泌:AB⁃PAS染色显示,正常组小鼠气道上皮PAS阳性细胞极少;哮喘组PAS阳性染色显著增加,气道粘液分泌增多;地塞米松和Tubastatin A Hcl治疗后杯状细胞化生减轻,且Tubastatin A Hcl治疗效果略差于激素治疗,但2者间差异无统计学意义,见图2,表3。
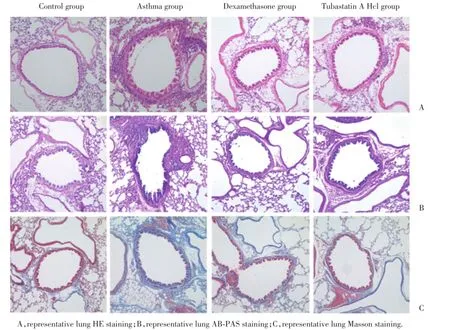
图2 各组小鼠肺组织病理染色×200Fig.2The pathological staining of lung tissue of mice in each group×200
表3 肺组织病理改变Tab.3The pathological changes of lung tissue
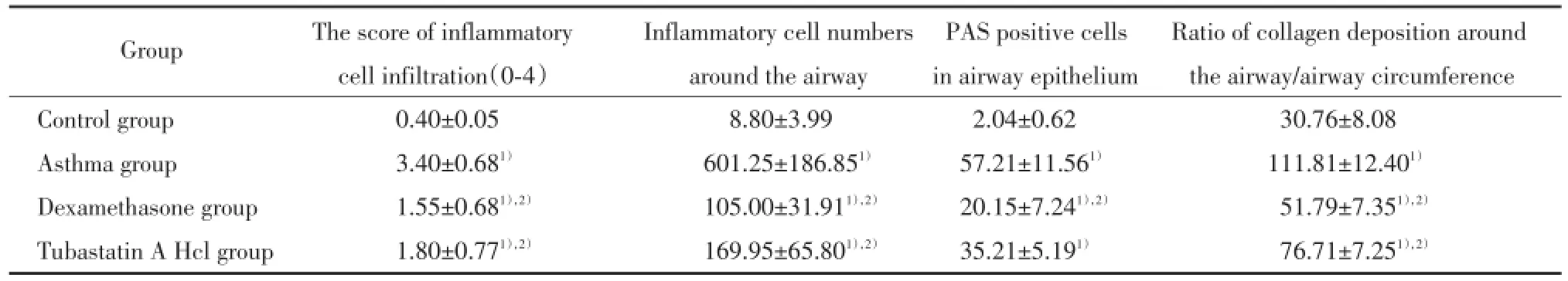
表3 肺组织病理改变Tab.3The pathological changes of lung tissue
1)P<0.05 vs control group;2)P<0.05 vs asthma group.
GroupThe score of inflammatoryInflammatory cell numbersPAS positive cellsRatio of collagen deposition around cell infiltration(0⁃4)around the airwayin airway epitheliumthe airway/airway circumference Control group0.40±0.058.80±3.992.04±0.6230.76±8.08 Asthma group3.40±0.681)601.25±186.851)57.21±11.561)111.81±12.401)Dexamethasone group1.55±0.681),2)105.00±31.911),2)20.15±7.241),2)51.79±7.351),2)Tubastatin A Hcl group1.80±0.771),2)169.95±65.801),2)35.21±5.191)76.71±7.251),2)
2.4.3 Tubastatin A Hcl抑制哮喘胶原沉积:Masson染色显示OVA雾化8周后,哮喘组气道周围可见大量胶原沉积,上皮下纤维化增加;相比于哮喘组,地塞米松和Tubastatin A Hcl治疗后有效缓解上皮下纤维化,气道壁周围胶原沉积,且两治疗组间差异无统计学意义,见图2,表3。
2.5 Tubastatin A Hcl抑制肺组织中α⁃SMA和TGF⁃β1的表达
2.5.1 Tubastatin A Hcl抑制肺组织中α⁃SMA的表达:免疫组化和Western blotting结果显示,哮喘小鼠气道平滑肌层α⁃SMA表达显著增加,平滑肌明显增厚;地塞米松和Tubastatin A Hcl治疗后,α⁃SMA表达减少,且Tubastatin A Hcl抑制平滑肌增厚效果明显优于地塞米松组,见图3A、3C、4A。
2.5.2 Tubastatin A Hcl抑制肺组织中TGF⁃β1的表达变化:免疫组化和Western blotting结果显示,TGF⁃β1主要表达在气道上皮细胞胞质中,且在正常小鼠气道上皮中表达量极少。OVA雾化8周后哮喘小鼠气道上皮TGF⁃β1表达量显著增多,地塞米松和Tu⁃bastatin A Hcl治疗后,TGF⁃β1表达量显著减少,且2组间差异无统计学意义,见图3B、3D、4B。
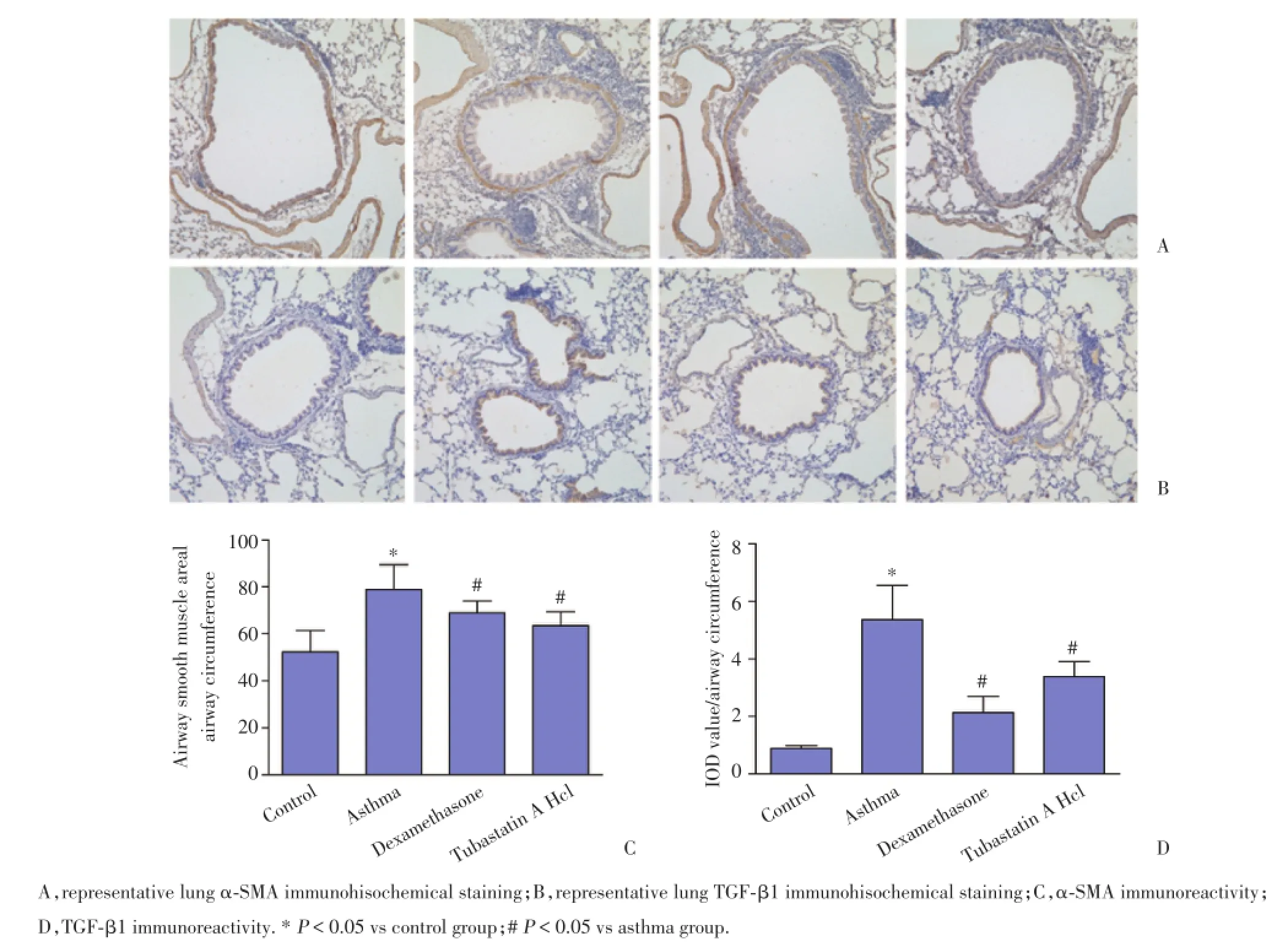
图3 肺组织α⁃SMA和TGF⁃β1免疫组化染色×200Fig.3The immunohistochemical staining of α⁃SMA and TGF⁃β1 in the lung tissue×200
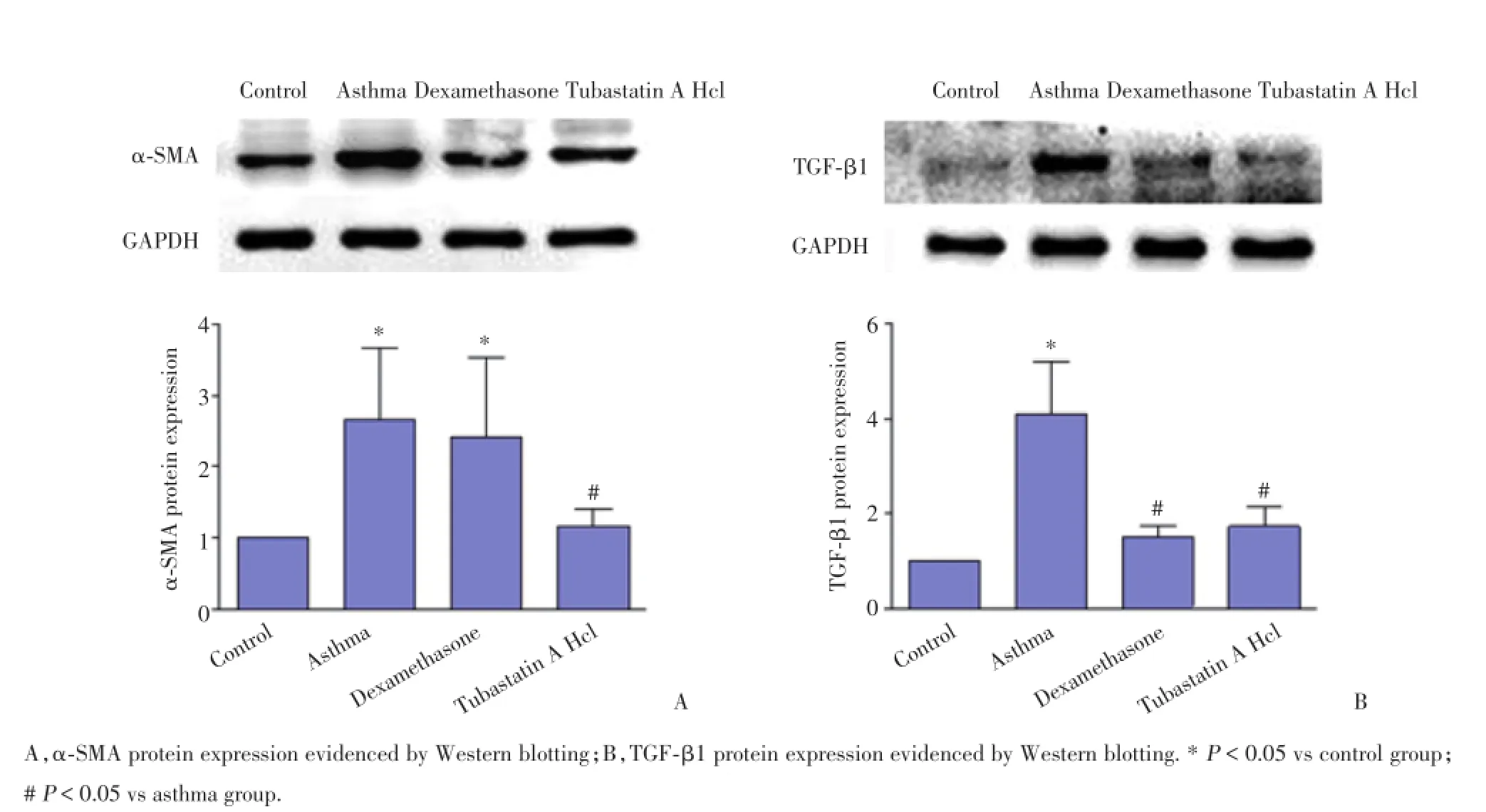
图4 肺组织α⁃SMA和TGF⁃β1表达量Fig.4The protein expression of α⁃SMA and TGF⁃β1 in the lung tissue
3 讨论
支气管哮喘主要是由多种细胞和细胞组分参与的慢性炎性疾病,长期反复的炎症刺激,会导致气道重塑或塌陷,出现不可逆性气流受限[9]。HDAC6是组蛋白去乙酰化酶家族中研究最为广泛的一员,主要分布在细胞质内,通过调控组蛋白和一些非组蛋白底物的乙酰化修饰,参与调控细胞的诸多生物过程[10],如炎症反应,癌细胞转移,损伤修复等[11]。本研究发现Tubastatin A Hcl治疗后,在一定程度上缓解了哮喘嗜酸粒细胞性炎症,表现为BALF中细胞总数和EOS数明显降低,炎性细胞因子分泌减少,肺组织中气道血管周围炎症浸润减轻,黏液分泌以及上皮下纤维化减轻。但在与地塞米松组比较时,发现其上述效果并不如地塞米松组理想,说明Tubastatin A Hcl在治疗哮喘时其抗炎作用是有限的。然而在比较气道重塑和气道高反应的结果时,发现Tubastatin A Hcl组小鼠肺组织中TGF⁃β1和α⁃SMA表达减弱,平滑肌增厚减轻,气道高反应性明显降低,而且其作用效果反而略优于地塞米松组,说明Tubastatin A Hcl在缓解哮喘气道重塑和气道高反应方面具有独特的疗效。
哮喘气道重构主要与持续存在的炎症和反复的气道上皮损伤修复有关。HDAC6作为Ⅱ类HDACs成员,具有2个高度同源性的催化区,能够去乙酰化修饰组蛋白的同时,还能够去乙酰化修饰许多非组蛋白底物,如α⁃tubulin、HSP90和皮质肌动蛋白等。研究[12]表明抑制HDAC6表达,能够促使HSP90高乙酰化修饰,促使HSP90客户蛋白失活并快速降解。最新研究[13⁃14]发现抑制HSP90,能够通过多个环节抑制NF⁃κB介导的炎症反应,同时抑制TGF⁃β介导的胶原沉积、成纤维细胞分化、以及平滑肌细胞增殖等重塑性过程[15⁃17]。而既往研究[18]也已经证实,HDAC6与HDAC4和HDAC8一起调节TGF⁃β1介导的平滑肌α⁃SMA的表达,参与平滑肌细胞形态维持和组织修复。因此推测HDAC6特异性抑制剂Tubastatin A Hcl缓解慢性哮喘小鼠气道炎症、气道重塑和气道高反应的作用,很可能与HDAC6特异性抑制剂促使其底物蛋白HSP90高乙酰化修饰,进而抑制哮喘致病过程中NF⁃κB相关的炎症反应的激活和转录,以及TGF⁃β介导的成纤维细胞增殖分化、胶原蛋白分泌、平滑肌细胞增殖等的重塑性改变相关,而为了验证这一推测仍需进一步深入研究。值得注意的是,Tubastatin A Hcl治疗哮喘可能并不是单纯的通过抗炎作用实现的,其在缓解哮喘气道重塑方面的疗效有望打破目前哮喘激素治疗的不足,为哮喘的临床治疗提供新的靶向药物。
[1]ROYCE SG,KARAGIANNIS TC.Histone deacetylases and their role in asthma[J].J Asthma,2012,49(2):121-128.DOI:10.3109/ 02770903.2011.648298.
[2]BANERJEE A,TRIVEDI CM,DAMERA G,et al.Trichostatin A ab⁃rogates airway constriction,but not inflammation in mouse and hu⁃man asthma models[J].Am J Respir Cell Mol Biol,2012,46(2):132-138.DOI:10.1165/rcmb.2010⁃0276OC.
[3]ROYCE SG,DANG W,VERVERIS K,et al.Protective effects of valproic acid against airway hyperresponsiveness and airway remod⁃eling in a mouse model of allergic airways disease[J].Epienetics,2011,6(12):1463-1470.DOI:10.4161/epi.6.12.18396.
[4]ROYCE SG,DANG W,YUAN G,et al.Effects of the histone deacet⁃ylase inhibitor,Trichostatin A,in a chronic allergic airways disease model in mice[J].Arch Immunol Ther Exp,2012,60(4):295-306.DOI:10.1007/s00005⁃012⁃0180⁃3.
[5]HAGGARTY SJ,KOELLER KM,WONG JC,et al.Domain⁃selec⁃tive small⁃molecule inhibitor of histone deacetylase 6(HDAC6)⁃mediated tubulin deacetylation[J].Proc Natl Acad Sci USA,2003,100(8):4389-4394.DOI:10.1073/pnas.0430973100.
[6]KOVACS JJ,MURPHY PJ,GAILLARD S,et al.HDAC6 regulates Hsp90 acetylation and chaperone⁃dependent activation of glucocorti⁃coid receptor[J].Mol Cell,2005,18(5):601-607.DOI:10.1016/j. molcel.2005.04.021.
[7]REN Y,SU X,KONG L,et al.Therapeutic effects of histone deacet⁃ylase inhibitors in a murine asthma model[J].Inflamm Res,2016,65(12):995-1008.DOI:10.1007/s00011⁃016⁃0984⁃4.
[8]RAN J,YANG Y,LI D,et al.Deacetylation of α⁃tubulin and cortac⁃tin is required for HDAC6 to trigger ciliary disassembly[J].Sci Rep,2015,5:12917.DOI:10.1038/srep12917.
[9]POON AH,EIDELMAN DH,MARTIN JG,et al.Pathogenesis of se⁃vere asthma[J].Clin Exp Allergy,2012,42(5):625-637.DOI:10.1111/j.1365⁃2222.2012.03983.x.
[10]VALENZUELA FA,CABRERO JR,SERRADOR JM,et al. HDAC6:a key regulator of eytoskeleton,cell migration and cell⁃cell interactions[J].Trends Cell Biol,2008,18(6):291-297. DOI:10.1016/j.tcb.2008.04.003.
[11]LI M,ZHUANG Y,SHAN B.Analysis of expression and functions of histone deacetylase6(HDAC6)[J].Methods Mol Biol,2016,1436:85-94.DOI:10.1007/978⁃1⁃4939⁃3667⁃0_6.
[12]KEKATPURE VD,DANNENBERG AJ,SUBBARAMAIAH K. HDAC6 modulates Hsp90 chaperone activity and regulates activa⁃tion of aryl hydrocarbon receptor signaling[J].J Biol Chem,2009,284(12):7436-7445.DOI:10.1074/jbc.M808999200.
[13]THANGJAM GS,BIRMPAS C,BARABUTIS N,et al.Hsp90 inhi⁃bition suppresses NF⁃κB transcriptional activation via Sirt⁃2 in hu⁃man lung microvascular endothelial cells[J].Am J Physiol Lung Cell Mol Physiol,2016,310(10):L964-974.DOI:10.1152/aj⁃plung.00054.2016.
[14]THANGJAM GS,DIMITROPOULOU C,JOSHI AD,et al.Novel mechanism of attenuation of LPS⁃induced NF⁃κB activation by the heat shock protein 90 inhibitor,17⁃N⁃allylamino⁃17⁃demethoxygel⁃danamycin,in human lung microvascular endothelial cells[J]. Am J Respir Cell Mol Biol,2014,50(5):942-952.DOI:10.1165/ rcmb.2013⁃0214OC.
[15]LIU Q,WANG X,JIA Y.Heat shock protein 90 inhibitor decreas⁃es collagen synthesis of keloid fibroblasts and attenuates the extra⁃cellular matrix on the keloid spheroid model[J].Plast Reconstr Surg,2016,137(4):759e-760e.DOI:10.1097/PRS.00000000000 02039.
[16]GARCÍA R,MERINO D,GÓMEZ JM,et al.Extracellular heat shock protein 90 binding to TGFβ receptorⅠparticipates in TGFβ⁃mediated collagen production in myocardial fibroblasts[J].Cell Signal,2016,28(10):1563-1579.DOI:10.1016/j.cellsig.2016. 07.003.
[17]WANG GK,LI SH,ZHAO ZM,et al.Inhibition of heat shock pro⁃tein 90 improves pulmonary arteriole remodeling in pulmonary arte⁃rial hypertension[J].Oncotarget,2016.DOI:10.18632/oncotar⁃get.10855.
[18]DESKIN B,LASKY J,ZHUANG Y,et al.Requirement of HDAC6 for activation of Notch1 by TGF⁃β1[J].Sci Rep,2016,6:31086. DOI:10.1038/srep31086.
(编辑于溪)
Therapeutic Effects of Tubastatin A Hcl in Chronic Murine Asthma Model
REN Yuan,SU Xinming,LI Menglu,ZHAO Xuan,KANG Jian
(Institute of Respiratory Disease,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the effects of Tubastatin A Hcl,a selective HDAC6 inhibitor,on the development of chronic asthmatic mice with airway inflammation,airway remodeling and airway hyperresponsiveness.MethodsBALB/C mice were randomly divided into control group,asthma group,dexamethasone group and Tubastatin A Hcl group.The airway resistance,total cells and different cells in BALF,IL⁃4,IL⁃5,TGF⁃β1 were detected by ELISA.HE、AB⁃PAS and Masson trichrome staining were carried out to assess the airway inflammation and remodeling.Immuno⁃histochemical staining and western blotting were adopted to determine the expression of α⁃SMA and TGF⁃β1.ResultsAfter drugs treatment,air⁃way resistance decreased,and levels of IL⁃4,IL⁃5,TGF⁃β1,total inflammatory cells and eosinophils in BALF were relieved.Meanwhile,inflamma⁃tory cells infiltration,goblet cells metaplasia and collagen deposition in lung tissue were also reduced,but all of above the effects of dexamethasone were better than Tubastatin A Hcl.The expression of α⁃SMA and TGF⁃β1 in the lung tissue decreased significantly after treatment,in which Tu⁃bastatin A Hcl were slightly better than dexamethasone treatment.ConclusionTubastatin A Hcl can effectively relieve airway inflammation,air⁃way remodeling and airway hyperresponsiveness in chronic asthmatic mice,but its effect of anti⁃inflammatory is worse than dexamethasone treat⁃ment,while it is better than dexamethasone in the effect of relief airway remodeling.
asthma;histone deacetylase;airway inflammation;airway remodeling;airway hyperresponsiveness
R562.25
A
0258-4646(2017)01-0017-07
10.12007/j.issn.0258⁃4646.2017.01.004
国家自然科学基金(81300024);辽宁省科学技术计划(2013225049);辽宁省教育厅创新团队(LT2013015)
任媛(1989-),女,博士研究生.
苏新明,E-mail:xinming_s@163.com
2016-06-29
网络出版时间:
