叶酸抑制血小板源生长因子诱导的血管平滑肌细胞去分化
2017-04-17潘孙雷林辉孟立平周昌钻季政池菊芳郭航远
潘孙雷,林辉,孟立平,周昌钻,季政,池菊芳,郭航远
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.绍兴市人民医院 浙江大学绍兴医院 心内科,浙江 绍兴 312000)
・论 著・
叶酸抑制血小板源生长因子诱导的血管平滑肌细胞去分化
潘孙雷1,2,林辉1,2,孟立平2,周昌钻1,2,季政2,池菊芳2,郭航远1,2
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.绍兴市人民医院 浙江大学绍兴医院 心内科,浙江 绍兴 312000)
目的:探究叶酸是否通过哺乳动物雷帕霉素靶蛋白(mTOR)/P70S6K信号通路抑制血小板源生长因子(PDGF)-BB诱导的血管平滑肌细胞(VSMCs)的去分化。方法:取SD大鼠的主动脉VSMCs原代细胞进行培养鉴定,第3~第7代细胞用于实验。VSMCs分为5组:Control组、PDGF-BB(浓度为10 ng/mL)组、PDGF-BB+ 1 μmol/L叶酸组、PDGF-BB+10 μmol/L叶酸组、PDGF-BB+100 μmol/L叶酸组。用MTT法检测各组VSMCs的增殖情况;划痕法和Transwell法用于检测各组VSMCs的迁移情况;用Western blot法检测各组VSMCs中α平滑肌肌动蛋白(α-SMA)、调宁蛋白(Cal)、骨桥蛋白(OPN)以及mTOR、p-mTOR、P70S6K和p-P70S6K的表达情况。结果:与Control组相比,PDGF-BB组的VSMCs的增殖和迁移能力增加(P<0.05),OPN、p-mTOR、p-P70S6K的表达增加,α-SMA、Cal表达减少(P<0.05)。与PDGF-BB组相比,叶酸+PDGF-BB组的VSMCs的增殖和迁移能力减小(P<0.05),OPN、p-mTOR、p-P70S6K的表达减少,α-SMA、Cal表达增加(P<0.05),叶酸浓度越高抑制去分化作用越强。结论:叶酸可能通过抑制mTOR/P70S6k信号通路抑制PDGF-BB诱导的VSMCs的去分化。
平滑肌细胞;叶酸;去分化;mTOR信号通路;大鼠
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)在成熟的动物体内仍保持显著的可塑性,在受到外界环境刺激后能进行可逆的从收缩型(分化状态)到合成型(去分化状态)的表型变化。其特征是VSMCs增殖和迁移能力增强,以及细胞外基质蛋白沉积导致内膜增生,并且收缩特异性蛋白表达降低[1]。VSMCs是血管中一类重要的细胞,异常的增殖和迁移与多种心血管疾病,如动脉粥样硬化、血管再狭窄等的发生发展有关。血小板源生长因子(platelet-derived growth factor,PDGF)-BB
是血管损伤后主要由血管内皮细胞和血小板释放,现已被证实是促进VSMCs增殖和迁移的强有力的刺
激因子[2]。因此,本研究中我们用PDGF-BB诱导VSMCs
去分化。近来,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamy-cin,mTOR)信号通路被报道调节许多细胞过程和参与多种疾病的病理生理过程,如癌症、肥胖和2型糖尿病等[3]。mTOR在调节细胞增殖和自噬中扮演重要角色。HUO等[4]报道在高血压患者中,使用叶酸能显著减少第一次中风的发生。叶酸能否抑制PDGF-BB诱导的平滑肌细胞去分化及其确切机制目前仍未清楚。本研究旨在探究叶酸是否能抑制PDGF-BB诱导的VSMCs去分化,并初步探究是否通过mTOR/P70S6K信号通路。
1 材料和方法
1.1 材料
1.1.1 动物:SPF级SD大鼠,雌雄不限,6周龄左右,体质量150~180 g,由浙江省医学科学院实验动物中心提供,动物合格证号:SYXK(浙)2011-0166,饲养于绍兴市人民医院实验动物中心。本研究实验方案通过绍兴市人民医院动物实验中心伦理委员会批准。
1.1.2 试剂:DMEM高糖培养基、PBS、0.25%胰蛋白酶-EDTA、青霉素和链霉素(杭州吉诺生物医药技术有限公司),PDGF-BB(美国Sigma公司),胎牛血清(美国Gibco公司),MTT(美国Emresco公司),DAPI(瑞士Rcohe公司),兔来源α平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)单克隆抗体、兔来源调宁蛋白(calponin,Cal)、骨桥蛋白(osteopontin,OPN)、p-mTOR、mTOR、p-P70S6K、P70S6K多克隆抗体、GAPDH抗体(英国Abcam公司),辣根过氧化酶标记的山羊抗兔二抗、FITC标记的山羊抗兔IgG(美国Jackson公司)。
1.2 方法
1.2.1 VSMCs原代细胞的培养及鉴定:采用改良的组织贴块法培育大鼠胸主动脉VSMCs,采用形态学观察和细胞免疫荧光检测α-SMA鉴定VSMCs,通过α-SMA与DAPI核染之间的关系鉴定VSMCs的纯度[5]。取第3~第7代细胞用于实验,细胞加干预因素时用含2.5%胎牛血清的培养基。
1.2.2 分组及干预:细胞实验分为5组,分别为Control组(不加任何干预因素)、PDGF-BB(浓度为10 ng/mL)组、PDGF-BB+1 μmol/L叶酸组(1 μmol/L叶酸组)、PDGF-BB+10 μmol/L叶酸组(10 μmol/L叶酸组)、PDGF-BB+100 μmol/L叶酸组(100 μmol/L叶酸组)。
1.2.3 MTT法检测VSMCs增殖:用0.25%的胰蛋白酶消化第3~第7代对数生长期的VSMCs,用含10%胎牛血清的DMEM高糖培养基制成细胞悬液,以每孔5×103个细胞密度接种于96孔培养板中。细胞贴壁后用无血清培养基培养24 h使细胞同步化。各组细胞按上述分组加入对应浓度的干预因子,每组设置5个复孔,2个不加细胞的空白对照孔。用37 ℃、5% CO2孵箱培养细胞12、24、48、72、96 h。培养结束后,每孔加入MTT液20 μL,37 ℃继续孵育4~6 h终止培养,小心弃去培养上清,每孔加入150 μL DMSO,震荡10 min,选择490 nm波长于酶联免疫检测仪测定各孔吸光度(OD)值并记录。以时间为横轴,OD值为纵轴绘制VSMCs生长曲线。
1.2.4 细胞划痕实验检测VSMCs迁移:用0.25%的胰蛋白酶消化第3~第7代对数生长期的VSMCs,用含10%胎牛血清的DMEM高糖培养基配成细胞悬液并计数,以每孔1×105个细胞密度接种于6孔培养板中,每孔体积为2 mL。当细胞铺满板底后,用无血清培养基培养24 h使细胞同步化,加入1.8 mmol/L羟基脲作用12 h抑制细胞增殖。用100 μL黄色枪头垂直于孔板制造细胞划痕,吸去细胞培养液,用PBS冲洗孔板3次,洗去划痕产生的细胞碎片。加入各组相应的干预因子,拍照记录0、12、24、48 h图片,用Image Pro Plus6.0软件分析计算细胞迁移的面积,细胞迁移的面积与最开始的划痕面积之间的比值来表示迁移的多少。
1.2.5 Transwell法检测VSMCs迁移:用第3~第7代对数生长期的VSMCs,血清饥饿使细胞同步化,0.25%胰蛋白酶消化单层VSMCs,用含有各组干预因子的DMEM高糖培养基(无血清)配成细胞悬液并计数(3×104个/mL)。各组24孔板配套的Transwell小室(8 μm)上室加入200 μL细胞悬液,下室加入含有10%胎牛血清的DMEM高糖培养基500 μL,培养24 h。干预结束后以棉签轻轻擦去上层未穿透膜的VSMCs,取下Transwell半透膜,TBS洗涤3次,4%多聚甲醛室温固定5 min,流水冲洗后,用5 mg/L的DAPI染核,PBS冲洗后,荧光显微镜下随机取5个视野计数穿膜细胞数并记录。
1.2.6 Western blot检测:各组在相应的干预因子干预24 h之后,裂解VSMCs提取蛋白,BCA法进行蛋白定量,SDS-PAGE胶每孔加入25 μL样品,80 V 30 min进行蛋白浓聚,120 V 2 h进行凝胶电泳,并用孔径0.45 μm硝酸纤维素膜250 mA 90 min进行转膜。转膜完毕后常温下TBST洗膜3次、脱脂奶粉封闭2 h后,以1:1 000浓度加入α-SMA一抗(或抗Cal、OPN以及p-mTOR、mTOR、p-P70S6k、P70S6K、GAPDH一抗),在4 ℃孵育过夜,常温下TBST洗膜3次,辣根过氧化物酶标记的二抗孵育后用ECL化学发光法检测目标蛋白和内参。于暗室柯达胶片显影,用Quantity one软件定量分析。
1.3 统计学处理方法 采用SPSS19.0统计软件进行统计分析。实验数据以±s表示,多组间比较用单因素方差分析,各组均数间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 VSMCs原代培养及鉴定 用组织贴块法培养大鼠胸主动脉VSMCs,7 d左右组织块周围有细胞爬出,14 d左右细胞融合可以传代。传代后细胞呈典型“峰谷”状排列生长,用α-SMA细胞免疫荧光鉴定VSMCs,DAPI核染之后将2组照片融合,鉴定细胞纯度在99%以上,见图1。
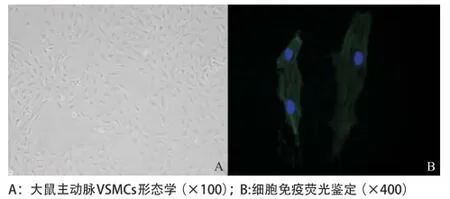
图1 主动脉VSMCs原代培养
2.2 MTT法检测VSMCs的增殖情况 加入各组干预因素,12 h后各组之间的OD值并无明显差异。从24 h开始,与Control组相比,PDGF-BB组的OD值明显升高(P<0.05);与PDGF-BB组相比,1 μmol/L叶酸组、10 μmol/L叶酸组和100 μmol/L叶酸组的OD值均明显下降(P<0.05),并且随叶酸浓度增加,OD值下降更明显。该实验表明PDGF-BB具有促进VSMCs增殖的作用;叶酸具有抑制PDGF-BB诱导VSMCs增殖的作用,并且随叶酸的浓度增加,抑制作用增强,见图2。
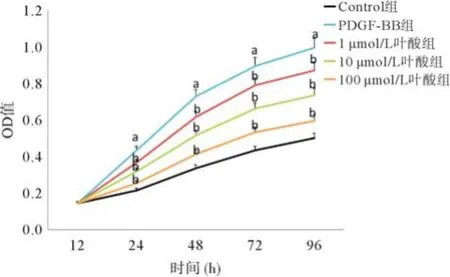
图2 VSMCs在各组干预因素干预下不同时间的增殖
2.3 细胞划痕实验检测VSMCs迁移 细胞划痕之后,加入各组干预因素干预12、24、48 h,在光学显微镜下观察VSMCs的迁移,从24 h开始,与Control组相比,PDGF-BB组的VSMCs的迁移距离明显增加(P<0.05);与PDGF-BB组相比,1 μmol/L叶酸组、10 μmol/L叶酸组、100 μmol/L叶酸组的VSMCs的迁移距离减少(P<0.05),且随叶酸浓度增加,VSMCs的迁移距离明显减少,见表1。该实验表明PDGF-BB具有促进VSMCs迁移的作用;叶酸具有抑制PDGF-BB诱导VSMCs迁移的作用,并且随叶酸的浓度增加,抑制作用增强,见图3。
表1 VSMCs在各组干预因素干预下不同时间的迁移面积/划痕面积(%,n=5,±s)

表1 VSMCs在各组干预因素干预下不同时间的迁移面积/划痕面积(%,n=5,±s)
与Control组比:aP<0.05;与PDGF-BB组比:bP<0.05
2.4 Transwell法测VSMCs迁移 24 h后100倍显微镜下1个视野内VSMCs穿透Transwell小室进入下室的细胞数PDGF-BB组(579±7.5)与Control组(114± 5.6)相比明显增多(P<0.05);与PDGF-BB组相比,1 μmol/L叶酸组(385±4.2)、10 μmol/L叶酸组(291±5.8)、100 μmol/L叶酸组(165±6.9)穿透细胞数减少(P<0.05),并且随叶酸浓度增加,VSMCs的穿透明显减少,见图4。
2.5 Western blot检测VSMCs中α-SMA、Cal、OPN的表达 干预24 h之后,与Control组比,PDGFBB组α-SMA、Cal的表达明显下降(P<0.05),OPN的表达明显上升(P<0.05);与PDGF-BB组相比,1 μmol/L叶酸、10 μmol/L叶酸、100 μmol/L叶酸组的α-SMA、Cal的表达上升(P<0.05),OPN的表达下降(P<0.05),并且随叶酸浓度增加,α-SMA、Cal的表达明显上升,OPN的表达明显下降。表明PDGFBB具有诱导VSMCs去分化的作用;叶酸具有抑制PDGF-BB诱导VSMCs去分化的作用,并且随叶酸的浓度增加,抑制去分化作用增强,见图5。

图3 VSMCs在各组干预因素干预24 h后的迁移

图4 24 h后荧光显微镜1个视野内VSMCs穿透Transwell小室的数量(×100)
2.6 Western blot检测VSMCs中p-mTOR、mTOR、p-P70S6k、P70S6K的表达 干预24 h之后,与Control组相比,PDGF-BB组p-mTOR、p-P70S6K的表达明显上升(P<0.05);与PDGF-BB组相比,1 μmol/L叶酸、10 μmol/L叶酸、100 μmol/L叶酸组的p-mTOR、p-P70S6K的表达下降(P<0.05),并且随叶酸浓度增加,p-mTOR、p-P70S6K的表达明显下降。表明PDGF-BB具有激活mTOR/P70S6K信号通路的作用;叶酸具有抑制PDGF-BB激活VSMCs的mTOR/P70S6K信号通路的作用,并且随着叶酸浓度的增加,抑制PDGFBB激活VSMCs的mTOR/P70S6K信号通路的作用越强,见图6-7。
3 讨论
VSMCs在成熟动物体内是一种高度分化的细胞,其主要功能是收缩、调节血管直径和血压以及血流分布。与骨骼和心肌等终末分化细胞不同,VSMCs在成熟动物体内仍保持显著的可塑性,在受到外界环境刺激后能进行可逆的表型变化。在正常情况下,平滑肌细胞保持静止和非迁移状态,在各种生长因子和细胞因子的刺激下,平滑肌细胞去分化,其增殖和迁移能力增强[6]。VSMCs的表型改变与多种心血管疾病包括动脉粥样硬化、高血压、血管狭窄相关,在心血管疾病的发生发展中起重要作用[7]。多种治疗心血管疾病的药物机制之一就是抑制平滑肌细胞的去分化[8]。本实验探究叶酸是否能抑制PDGF-BB诱导的平滑肌细胞去分化,并初步探究叶酸抑制PDGF-BB诱导的平滑肌细胞去分化的可能机制。
叶酸是一种水溶性维生素,是机体细胞生长和繁殖的必需物质。GUO等[9]报道叶酸可以降低同型半胱氨酸诱导的VSMCs MMP2和MMP9的表达降低。HAN等[10]报道叶酸可以拮抗同型半胱氨酸诱导的平滑肌增殖和异常的PDGF甲基化。在本研究中,我们通过MTT、划痕实验及Transwell实验发现叶酸能够抑制PDGF-BB诱导的VSMCs增殖和迁移,并随着叶酸的浓度增加,抑制作用增加。在Western blot中,我们发现叶酸能升高由PDGF-BB诱导VSMCs去分化所致的降低的α-SMA和Cal蛋白表达,和降低由PDGF-BB诱导VSMCs去分化所致的升高的OPN蛋白表达。
PDGF家族由PDGF-A,-B,-C,-D 4种组成。PDGF可以和受体PDGFR-a和PDGFR-b相互作用,并存在受体依赖性和细胞特异性[2]。PDGF-BB是VSMCs重要的一种促细胞分裂素和趋化因子,在各种心血管疾病的发生和发展中扮演重要角色。PDGF-BB启动多种生物学效应的细胞内信号转导通路,促进VSMCs表型转化,活化增殖、迁移[11]。RANI等[12]报道鞣花酸能抑制PDGF-BB诱导的VSMCs增殖和迁移。CHEN等[13]报道阿托伐他汀钙抑制PDGF-BB诱导的VSMCs去分化。在本研究中同样发现,PDGF-BB能促进VSMCs的增殖和迁移,并增加去分化型蛋白OPN的表达,降低分化型特异性的收缩蛋白α-SMA和Cal,与上述文献报道一致,表明本实验用PDGF-BB成功诱导VSMCs去分化。

图5 各组干预因素干预24 h α-SMA、Cal、OPN的表达

图6 各组干预因素干预24 h p-mTOR、mTOR的表达

图7 各组干预因素干预24 h p-P70S6k、P70S6K的表达
mTOR是一种非典型的丝氨酸/苏氨酸蛋白激酶,属于磷脂酰肌醇3-激酶(PI3K)相关的激酶家族,在调控许多通路的信号传导中发挥着重要作用,包括胰岛素信号、营养传感信号和有丝分裂信号[3]。mTOR是一种广泛表达的蛋白激酶,通过P70S6K和4E-BP1/ eIF4E信号通路调节特异性生长相关的mRNA翻译起始因子。mTOR信号通路通过氨基酸反应合成蛋白,通过PI3K通路协同调控蛋白质的合成,细胞周期进程和增殖[14]。OSMAN等[15]报道吡格列酮可以降低PDGF-BB诱导的mTOR活化和降低P70S6K的磷酸化,从而抑制平滑肌细胞增殖。在本研究中,我们发现叶酸能够抑制PDGF-BB诱导的VSMCs的mTOR和P70S6K磷酸化。猜测叶酸可能通过抑制mTOR/P70S6K信号通路抑制PDGF-BB诱导的VSMCs的去分化。
本实验通过PDGF-BB诱导VSMCs去分化,证实叶酸能够抑制PDGF-BB诱导的VSMCs去分化,并随叶酸浓度的增加抑制作用增强。在此基础上,初步推测叶酸可能是通过抑制mTOR/P70S6K通路实现这一作用,接下来我们将进一步用雷帕霉素抑制mTOR/ P70S6K信号通路和MHY-1485激活mTOR/P70S6K信号通路与叶酸进行对比,来证实叶酸是否通过抑制mTOR/P70S6K通路从而抑制PDGF-BB诱导的VSMCs去分化。
[1] DORAN A C, MELLER N, MCNAMARA C A. Role of smooth muscle cells in the initiation and early progression of atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2008, 28(5): 812-819.
[2] RAINES E W. PDGF and cardiovascular disease[J]. Cytokine Growth Factor Rev, 2004, 15(4): 237-254.
[3] LAPLANTE M, SABATINI D M. mTOR signaling in growth control and disease[J]. Cell, 2012, 149(2): 274-293.
[4] HUO Y, LI J, QIN X, et al. Efficacy of folic acid therapy in primary prevention of stroke among adults with hypertension in China: the CSPPT randomized clinical trial[J]. JAMA, 2015, 313(13): 1325-1335.
[5] 孟立平, 蒋承建, 赵飞, 等. 大鼠胸主动脉血管平滑肌细胞原代培养方法的改进[J]. 温州医科大学学报, 2015, 45(8): 593-596.
[6] MILLETTE E, RAUCH B H, KENAGY R D, et al. Plateletderived growth factor-BB transactivates the f broblast growth factor receptor to induce proliferation in human smooth muscle cells[J]. Trends Cardiovasc Med, 2006, 16(1): 25-28.
[7] LIU R, LESLIE K L, MARTIN K A. Epigenetic regulation of smooth muscle cell plasticity[J]. Biochim Biophys Acta, 2015, 1849(4): 448-453.
[8] SHI N, CHEN S Y. Mechanisms simultaneously regulate smooth muscle proliferation and differentiation[J]. J Biomed Res, 2014, 28(1): 40-46.
[9] GUO H, LEE J D, UZUI H, et al. Effects of folic acid and magnesium on the production of homocysteine-induced extracellular matrix metalloproteinase-2 in cultured rat vascular smooth muscle cells[J]. Circ J, 2006, 70(1): 141-146.
[10] HAN X B, ZHANG H P, CAO C J, et al. Aberrant DNA methylation of the PDGF gene in homocysteinemediated VSMC proliferation and its underlying mechanism[J]. Mol Med Rep, 2014, 10(2): 947-954.
[11] YAN G, WANG Q, HU S, et al. Digoxin inhibits PDGF-BB-induced VSMC proliferation and migration through an increase in ILK signaling and attenuates neointima formation following carotid injury[J]. Int J Mol Med, 2015, 36(4): 1001-1011.
[12] RANI U P, KESAVAN R, GANUGULA R, et al. Ellagic acid inhibits PDGF-BB-induced vascular smooth muscle cell proliferation and prevents atheroma formation in streptozotocin-induced diabetic rats[J]. J Nutr Biochem, 2013, 24 (11): 1830-1839.
[13] CHEN S, LIU B, KONG D, et al. Atorvastatin calcium inhibits phenotypic modulation of PDGF-BB-induced VSMCs via down-regulation the Akt signaling pathway[J]. PLoS One, 2015, 10(4): e0122577.
[14] MARTIN K A, RZUCIDLO E M, MERENICK B L, et al. The mTOR/p70 S6K1 pathway regulates vascular smooth muscle cell differentiation[J]. Am J Physiol Cell Physiol, 2004, 286(3): C507-517.
[15] OSMAN I, SEGAR L. Pioglitazone, a PPARgamma agonist, attenuates PDGF-induced vascular smooth muscle cell proliferation through AMPK-dependent and AMPK-independent inhibition of mTOR/p70S6K and ERK signaling[J]. Biochem Pharmacol, 2016, 101: 54-70.
(本文编辑:赵翠翠)
Folic acid inhibits platelet-derived growth factor-induced vascular smooth muscle cell dedifferentiation
PAN Sunlei1,2, LIN Hui1,2, MENG Liping2, ZHOU Changzuan1,2, JI Zheng2, CHI Jufang2, GUO Hangyuan1,2.
1.The First Clinical Medical College, Wenzhou Medical University, Wenzhou, 325035; 2.Department of Cardiology, Shaoxing People’s Hospital, Shaoxing Hospital of Zhejiang University, Shaoxing, 312000
Objective:To explore whether folic acid through the mammalian target of rapamycin (mTOR)/ P70S6K signaling pathway to inhibit platelet derived growth factor (PDGF-BB) induced vascular smooth muscle cells (VSMCs) dedifferentiate.Methods:SD rats aortic VSMCs primary cells were cultured and identif ed, and the 3-7th generations of cells were used for the experiment. The VSMCs were divided into 5 groups: control, PDGF-BB (10 ng/mL), PDGF-BB+1 μmol/L folic acid, PDGF-BB+10 μmol/L folic acid, PDGF-BB+100 μmol/L folic acid. MTT method was used to detection the proliferation of VSMCs in each group. The migratory ability of VSMCs were determined by Wound-Healing assay and Transwell chambers assay. Western blot was used to investigated the expressions of alpha-smooth muscle actin (α-SMA), calponin (Cal), osteopontin (OPN), mTOR, p-mTOR, P70S6K and p-P70S6K in each group.Results:Compared with the control group, the proliferation, migration and the expression of OPN, p-mTOR and p-P70S6K were increased signif cantly in the VSMCs of PDGF-BB group (<0.05), and the expression of α-SMA and Cal significantly decreased in the VSMCs of PDGF-BB group (P<0.05). Compared with the PDGF-BB group, the proliferation, migration and the expression of OPN, p-mTOR and p-P70S6K were decressed signif cantly in the VSMCs of each folic acid group (P<0.05), and the expression of α-SMA and Cal signif cantly increased in the VSMCs of each folic acid group (P<0.05). Folic acid inhibited the PDGF-BB induceing VSMCs dedifferentiation in a dose-dependent manner.Conclusion:Folic acid may inhibit the differentiation of VSMCs induced by PDGF-BB through suppression mTOR/P70S6k signaling pathway.
vascular smooth muscle cells; folic acid; dedifferentiation; mTOR signaling pathway; rats
R363.2;R543.3
A
10.3969/j.issn.2095-9400.2017.03.002
2016-06-22
浙江省自然科学基金资助项目(LY14H020002,Y14H020009);浙江省科技厅公益项目(2016C33227)。
潘孙雷(1992-),男,浙江温州人,硕士生。
郭航远,主任医师,教授,博士生导师,Email:ghangyuan@hotmail.com。
