脂肪干细胞与不同脱细胞基质的组织相容性研究*
2017-04-17凯赛尔阿吉乔炳璋王玉杰木拉提热夏提
白 勇,武 阳,凯赛尔·阿吉,乔炳璋,王玉杰,木拉提·热夏提
(1.新疆医科大学第一附属医院 泌尿外科,新疆 乌鲁木齐 830054;2.中国人民解放军第747医院普外泌外科,新疆 乌鲁木齐 830000)
脂肪干细胞与不同脱细胞基质的组织相容性研究*
白 勇1,武 阳2,凯赛尔·阿吉1,乔炳璋1,王玉杰1,木拉提·热夏提1
(1.新疆医科大学第一附属医院 泌尿外科,新疆 乌鲁木齐 830054;2.中国人民解放军第747医院普外泌外科,新疆 乌鲁木齐 830000)
目的 研究SD大鼠脂肪干细胞与不同脱细胞膀胱基质(BAMG)的体外生物相容性,为进一步把细胞支架复合物回植动物体内提供有利的实验基础。方法 取SD大鼠双侧腹股沟处脂肪组织经过相应处理后得到原代脂肪组织,进行成骨、成脂诱导染色及流式细胞术检测CD29、CD34、CD44及CD45,对脂肪干细胞进行鉴定,同时制备鼠及新西兰兔BAMG,采用2次沉淀法将脂肪干细胞静态接种于不同BAMG表面,观察细胞在材料表面的生长状况,并绘制细胞生长曲线。结果 细胞材料体外复合培养5 d后行HE染色后观察可见SD大鼠脂肪干细胞在SD大鼠BAMG表面生长状态较其在新西兰兔BAMG表面生长状态好,且细胞形态舒展成长梭形,细胞生长曲线与SD大鼠原代脂肪干细胞基本一致。结论 SD大鼠脂肪干细胞接种于SD大鼠BAMG复合物表面生长状况相比于其接种于新西兰兔BAMG复合物表面更加良好,具有更好的生物相容性。为进一步把细胞支架复合物回植动物体内提供有利的实验基础。
脂肪干细胞;脱细胞膀胱基质;组织相容性;修复
目前各种类型的膀胱疾病均可能导致膀胱组织、结构或功能的丧失,经过传统方法治疗很难完全替代原组织器官功能,并可能会产生一系列并发症。近年来,应用组织工程学相关方法修复损伤膀胱成为一种新的趋势,脂肪干细胞是一种具有多种分化潜能、可作为组织工程修复的种子细胞,具有来源丰富、取材容易等优点,应用前景广泛。膀胱黏膜下脱细胞基质(bladder acellular matrix graft,BAMG)是指仅保留细胞外基质成分,而将同种或异种膀胱组织去除细胞、抗原等成分,具有较好的生物相容性,修复膀胱组织时有优势,是较为理想的天然生物支架[1-7]。本实验选用具有多种分化潜能的SD大鼠脂肪干细胞作为种子细胞,体外分别接种于SD大鼠和新西兰兔的脱细胞膀胱基质构建细胞-支架复合物,为SD大鼠脂肪干细胞和不同异种脱细胞膀胱基质复合物修复膀胱缺损提供实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD大鼠35只,雌雄不限,出生6~8周,体重200 g左右,5只用于培养SD大鼠脂肪干细胞,30只用于制备SD大鼠BAMG;新西兰兔30只,雌雄不限,出生3~5个月左右,体重2 500 g左右,用于制备兔BAMG。以上实验动物均由新疆医科大学动物中心提供,并通过新疆医科大学第一附属医院伦理委员会的批准。
1.1.2 试剂 高糖DMEM细胞培养液(美国Gibco公司),磷酸盐缓冲液(PBS)(美国Gibco公司),0.25%胰蛋白酶(北京索莱宝科技有限公司),叠氮化钠及脱氧胆酸钠(美国Sigma公司),胎牛血清(FBS)(美国Gibco公司),I型胶原酶(美国Roche公司),CD抗体(美国BD公司)。
1.2 方法
1.2.1 SD大鼠脂肪干细胞分离培养及鉴定 将SD大鼠断颈处死后使用碘伏消毒皮肤2遍后,再用75%酒精进行脱碘处理,严格无菌条件下收集SD大鼠双侧腹股沟处脂肪组织。将其剪碎后置于50 ml的离心管内,PBS冲洗3遍,转速为1 500 r/min离心5 min后弃上清液,加入0.1%的Ⅰ型胶原酶在37℃、5%二氧化碳CO2细胞培养箱内消化1 h,并且每隔15 min振荡1次,200目无菌网筛滤去未被消化的残余组织。转速为1 500 r/min离心5 min处理后将细胞计数并按1×105个/cm2的密度,种植于细胞培养瓶内,置于37℃、5%CO2培养箱中培养,每3天换液1次,待细胞生长达到80%融合时消化传代。用0.25%胰蛋白酶消化后接种于新的细胞培养瓶,按1∶3传代培养。
1.2.2 脂肪干细胞成骨、成脂诱导分化 取第3代脂肪干细胞进行成脂、成骨诱导分化。①成骨诱导以3×103/cm2的密度接种于6孔板中,24 h后换成骨诱导液(生长培养液,0.01μmol/L 1,25-dihydroxyvitamin D3,50μmol/L ascorbate-2-phosphate,10 mmol/L β-glycerophosphate)进行培养,每周换液2次。诱导21 d后进行茜素红染色,倒置相差显微镜对染色结果进行观察、拍照。②成脂诱导:以3× 103/cm2的密度接种于6孔板中,24 h后换成脂诱导液 [生长培养液,0.5 mmol/L isobutylmethylxanthine(IBMX),1μmol/L地 塞 米 松 ,10μmol/Linsulin,200μmol/L indomethacin]进行培养。每周换液2次,成脂诱导14 d后进行油红O染色,倒置相差显微镜对染色结果进行观察、拍照。
1.3 SD大鼠及兔膀胱BAMG的复制及鉴定
1.3.1 制备方法 分别脱颈处死SD大鼠及空气栓塞法处死新西兰兔,纵行剖开膀胱组织,将膀胱壁黏膜面朝上固定于自制泡沫板上,仔细刮除黏膜层,显微分离去除浆肌层组织,置于100 ml PBS(含0.1%叠氮化钠)混合液中37℃搅拌10~12 h;PBS冲洗后加入100 ml 0.5 mmol/L EDTA+0.4%胰蛋白酶溶液中37℃搅拌5~6 h;PBS再次冲洗后置于100 ml 1 mol/L氯化钠(含DNase-I 4 000 kU)溶液中37℃浸泡搅拌6~8 h,使细胞彻底溶解,细胞组分完全释放。置于100 ml含4%脱氧胆酸钠和0.1%叠氮化钠的混合液中搅拌6~8 h,使细胞膜脂质双层和细胞内的膜脂质溶解。制备好的BAMG浸泡于含10%青链霉素溶液中4℃保存。
1.3.2 鉴定 抽取制备好的BAMG行HE染色及Masson染色后光学显微镜观察,同时制备电镜标本行扫描电子显微镜观察。
1.4 BAMG细胞毒性的测定
将制备好的BAMG用无菌PBS液漂洗3遍,冷冻干燥仪内冷冻干燥5 h后称重,按0.2 g/ml置入含10%FBS的高糖DMEM培养基内,在37℃、5%CO2培养箱培养48 h制备浸提液。取第3代SD大鼠脂肪干细胞,按1×104个/孔接种于24孔板中,含10%FBS的高糖DMEM培养基为对照组,含10%、20%和50%不同浓度浸提液为实验组,从第2天开始,每隔1天利用CCK-8法测定各组吸光度(A)值,计算细胞相对增殖率(相对增殖率=A实验/A对照),并对材料毒性分级。相对增殖率≥100%、80%、50%、30%及0%,分别为0、1、2、3、4级。根据国家医疗器械生物学评价标准,材料的毒性分为0级或1级时表面材料无细胞毒性。
1.5 脂肪干细胞与BAMG的复合物培养
将制备好的BAMG修剪成1 cm×1 cm,平铺于无菌24孔板中,其中8孔放入SD大鼠BAMG,8孔放入新西兰兔BAMG,余下8孔为空白组,每孔中都加入高糖DMEM培养液,置于37℃、5%CO2培养箱中,放置24 h后吸去培养液,并且保持支架材料的平铺状态,再次加入培养液,培养基浸润、预湿2 h备用。将第3代脂肪干细胞(1×106个/ml)轻铺于支架上及空白孔中,每天换液,5 d后扫描电镜下观察脂肪干细胞与胶原支架的相容性,同时将细胞-支架复合物体外复合培养自第2天开始每天每组随机抽2孔,将其中的细胞-支架复合物剪碎后用0.25%胰蛋白酶消化离心处理后连续10 d进行细胞计数并绘制细胞生长曲线,然后将3组细胞生长曲线进行对比。
1.6 主要观察指标
脂肪干细胞的形态学、体外增殖传代能力、免疫表型的检测结果;脂肪干细胞成脂及成骨分化鉴定;脂肪干细胞与胶原支架材料的相容性生长情况同时绘制生长曲线。
1.7 统计学方法
采用SPSS17.0统计软件进行数据分析,所得数据以均数±标准差(x±s)表示。两组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 脂肪干细胞的形态学观察
原代培养细胞贴壁后伸展成长梭形或成纤维样,2 d后细胞扩增速度加快,呈密集生长。8 d时,细胞可达到80%以上融合状态。传代培养细胞的生长速度较原代细胞略快,至第3代细胞仍然保持长梭形。见图1。
2.2 脂肪干细胞的免疫表型检测结果
利用流式细胞术检测脂肪干细胞表面标志,结果显示第 4代脂肪干细胞表面 CD44表达为81.7%,CD29表达为80.3%,而CD34表达为6.2%,CD45表达仅为2.6%。见图2。
2.2.1 脂肪干细胞的成脂肪分化 经成脂肪诱导液培养14 d后,可在多数脂肪干细胞胞质内见到圆形的小脂滴,有些小脂滴可相互融合成较大的脂滴。经过油红O染色后,脂滴可被染成红色。
2.2.2 脂肪干细胞的成骨分化 经成骨诱导液培养21 d后,在脂肪干细胞生长密集的区域内可见很多细胞间界限不清楚、细胞结构模糊,在该部位可见折光率较强的颗粒状物质沉积。经茜素红染色后,可见较多大小不一的颗粒状结构。

图1 鼠脂肪干细胞形态
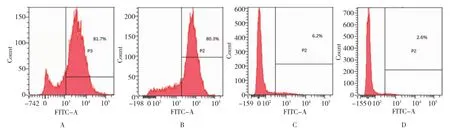
图2 SD大鼠脂肪干细胞表面标志物表达
2.2.3 脂肪干细胞与BAMG的相容性 扫描电子显微镜下可见BAMG呈多孔网状结构,脂肪干细胞附着于BAMG支架上生长,细胞铺展好。见图3、4。
2.3 BAMG细胞毒性测定结果
加入10%、20%和50%不同浓度培养液1、2、3、4、5 d后利用CCK-8法测定各组吸光度(A)值,结果显示计算出的相对细胞增殖率均大于80%,材料毒性分级为0或1级,证明材料无毒。
2.4 绘制SD大鼠原代脂肪干细胞及SD大鼠脂肪干细胞分别接种鼠BAMG、兔BAMG复合物的生长曲线
3组细胞经过测定,SD大鼠脂肪干细胞接种于SD大鼠BAMG复合物与SD大鼠原代脂肪干细胞生长曲线基本一致,均于培养7~8 d进入平台期,而SD大鼠脂肪干细胞接种于新西兰兔BAMG复合物细胞计数量较少,见图5。进一步表明,SD大鼠脂肪干细胞接种于SD大鼠BAMG复合物表面生长状况相比于 SD大鼠脂肪干细胞接种于新西兰兔BAMG复合物更加良好,具有更好的生物相容性。

图3 不同异种BAMG电镜图

图4 脂肪干细胞与不同BAMG体外培养结果

图5 细胞生长曲线
3 讨论
近年来,组织工程的发展为膀胱重建提供了新的有效的选择,目前在膀胱损伤的修复过程中主要涉及平滑肌细胞(smooth muscle cell,SMC)和尿路上皮细胞(urothelial cell,UC)。JACK等[8]将经绿色荧光蛋白标记的脂肪干细胞注入大鼠膀胱壁内,4周后发现经标记的脂肪干细胞长入膀胱壁的平滑肌内,12周后表达c-平滑肌肌动蛋白等平滑肌特异性标记物,因此SD大鼠脂肪干细胞也能通过相关诱导向SMC分化,同时表达平滑肌特异性的标志物,并最终具备SMC相应的收缩和舒张功能,在膀胱损伤的修复过程中用于修复膀胱缺损的肌层[9-16]。目前以脂肪组织作为种子细胞为来源的主要原因包括来源丰富、取材方便及损伤小等优势。同时目前较为良好的膀胱修复材料不仅需要良好的生物相容性,而且还要具备良好的收缩能力,这样就可以使其抵抗腹膜内外的感染,不影响正常肾功能,同时还可以依靠神经和平滑肌使其具有自主排尿功能[17]。脱细胞膀胱基质表面有多种生物活性因子,可以为种子细胞生长、增殖提供良好的微环境;脱细胞膀胱基质不仅具有良好的生物相容性,而且其所具有的特殊的机械特性能够支持帮助上皮细胞更好地生长[18-20],以上事实充分说明SD大鼠脂肪干细胞及脱细胞膀胱基质在膀胱缺损修复中是很好的种子细胞和支架材料。
本实验在进行SD大鼠脂肪干细胞与脱细胞膀胱基质制备细胞-支架复合物时,采用了2次沉淀法,该方法不仅可以使SD大鼠脂肪干细胞均匀地接种到脱细胞膀胱基质制备细胞-支架表面,而且还可以使SD大鼠脂肪干细胞更好地与脱细胞膀胱基质制备细胞-支架黏附向支架内渗透,最终使SD大鼠脂肪干细胞分布更加接近正常组织[21]。通过相应扫描电镜可以看到,经过2次沉淀法接种SD大鼠脂肪干细胞后,虽然大量的接种SD大鼠脂肪干细胞仍主要集中在支架材料表面,但有部分SD大鼠脂肪干细胞体外共培养早期即可渗透到脱细胞膀胱基质制备细胞-支架内部。因此采用了2次沉淀法可以更好地使SD大鼠脂肪干细胞与脱细胞膀胱基质结合。
本实验研究SD大鼠脂肪干细胞与不同脱细胞膀胱基质的组织相容性,将制备好的不同细胞-支架复合物进行实时观察,发现SD大鼠脂肪干细胞与SD大鼠脱细胞膀胱基质复合物较SD大鼠脂肪干细胞与新西兰兔脱细胞膀胱基质复合物组织相容性要好,实验发现SD大鼠脱细胞膀胱基质制备的细胞-支架复合物5 d后在显微镜下可见SD大鼠脂肪干细胞基本上已经附着于SD大鼠异种脱细胞膀胱基质上,同时SD大鼠脂肪干细胞生长良好,细胞量较同时接种的新西兰兔异种脱细胞膀胱基质细胞-支架复合物明显增多,细胞形态舒展成长梭形,扫描电镜下观察SD大鼠脂肪干细胞与SD大鼠脱细胞膀胱基质复合物在接种5 d后SD大鼠脂肪干细胞已经基本渗入支架材料内部。而SD大鼠脂肪干细胞与新西兰兔脱细胞膀胱基质复合物在扫描电镜下观察发现渗入到支架材料内部较前者数量减少。且通过SD大鼠脂肪干细胞分别与SD大鼠及新西兰兔脱细胞膀胱基质复合物细胞生长曲线的比较可以发现,SD大鼠脂肪干细胞与SD大鼠脱细胞膀胱基质复合物细胞计数生长曲线与原代SD大鼠脂肪干细胞计数的生长曲线基本相近,且较SD大鼠脂肪干细胞与新西兰兔脱细胞膀胱基质复合物的细胞计数量明显增多,因此可以进一步说明SD大鼠脂肪干细胞接种于SD大鼠脱细胞膀胱基质复合物有更好的生物相容性。
本实验结果表明,SD大鼠脂肪干细胞与SD大鼠脱细胞膀胱基质复合物较SD大鼠脂肪干细胞与新西兰兔脱细胞膀胱基质复合物组织相容性要更好,这为进一步把细胞支架复合物回植动物体内提供有利的实验基础。
[1]ZHU W D,XU Y M,FENG C,et al.Bladder reconstruction with adipose-derived stem cell-seeded bladder acellular matrix grafts improve morphology composition[J].World J Urol,2010,28 (4):493-498.
[2]ZHU W D,XU Y M,FENG C,et al.Different bladder defects reconstructed with bladder cellular matrix grafts in a rabbit model[J].Urologe A,2011,50(11):1420-1425.
[3]SONG L,MURPHY S V,YANG B,et al.Bladder acellular matrix and its application in bladder augmentation[J].Tissue Eng Part B Rev,2014,20(2):163-172.
[4]CHUN S Y,LIM G J,KWON T G,et al.Identification and characterization of bioactive factors in bladder submucosa matrix[J]. Bioma Terials,2007,28(29):4251-4256.
[5]SETH A,CHUNG Y G,GIL E S,et al.The performance of silk scaffolds in a rat model of augmentation cystoplasty[J].Biomaterials,2013,34(20):4758-4765.
[6]TU D D,CHUNG Y G,GIL E S,et al.Bladder tissue regeneration using acellular bi-layer silk scaffolds in a large animal modelofaugmentation cystoplasty[J].Biomaterials,2013,34: 8681-8689.
[7]KRUEGER H,NOONAN V K,TRENAMAN L M,et al.The economic burden of traumatic spinal cord injury in Canada[J]. Chronic Diseases and Injuries in Canada,2013,33(3):113-122. [8]JACKG S,ALMEIDAFG,ZHANGR,etal.Processed lipoaspirate cells for tissue engineering of the lower urinary tract: implication for the treatment of stress urinary incontinence and bladder reconstruction[J].J Urol,2005,174(5):2041-2045.
[9]ATALA A,BAUER S B,SOKER S,et al.Tissue-engineered autologous bladders for patients needing oystoplasty[J].Lancet, 2006,367(9518):1241-1246.
[10]YOO J J,MENG J,OBERPENNING F,et a1.Bladder augrnentation using allogenic bladder submucosa seeded with cells V[J].Urology,1998,51(2):22l-225.
[11]ZHANG Y,LIN H K,FRIMBERGER D,et al.Growth of bone marrow stromal cells on small intestinal submucosa:an altemative cell source for tissue engineered bladder[J].BJU Int,2005,96 (7):1120-1125.
[12]YOKOYAMA T,HUARD J,PMCHNIC R,et al.Muscle-de-rived cell transplantation and differentiation into lower urinary tract smooth muscle[J].Umlogy,2001,57(4):826-831.
[13]ZHOU L H,YANG B,SUN C,et al.Coadministrationof platelet-derived growth factor-bb and vascular endothelial growth factor with bladder acellular matrix enhances smooth muscle regeneration and vascularization for bladder augmentation in a rabbit model[J].Tissue Engineering Part A,2013,19 (1-2):264-275.
[14]ZAMBON J P,DE SA BARRETTO L S,NAKAMURA A N,et al.Histological changes induced by Polyglycolic-Acid (PGA) scaffoldsseeded with autologousadiposeormuscle-derived stem cells when implanted on rabbit bladder[J].Organogenesis, 2014,10(2):278-288.
[15]MAYA H,VINCENT M,NOTZLI S,et al.Increased porosity of electrospun hybrid scaffolds improved bladder tissue regeneration[J].Journal of biomedical materials research Part A,2014, 102(7):2116-2124.
[16]CONSOLO F,BRIZZOLA S,TREMOLADA G,et al.A dynamic distention protocol for whole-organ bladder decellularization: histological and biomechanical characterization of the acellular matrix[J].JournalofTissue Engineering and Regenerative Medicine,2013,10(2):DOI:10.1002.
[17]MAURER S,FEIL G,STENZL A.In vitor stratified uroththelium and its relevance in reconstructive urology[J].Urologe A, 2005,44(7):738-742.
[18]FARHAT W A,CHEN J,HAIG J,et al.Porcine bladder acellular matrix (ACM):protein expression,mechanical properties[J]. Biomed Mater,2008,3(2):191-196.
[19]ROSARIO D J,REILLY G C,ALI SALAH E,et al.Decellularization and sterilization of porcine urinary bladder matrix for tissue engineering in the lower urinary tract[J].Regen Med, 2008,3(2):145-156.
[20]DAVIS N F,CALLANAN A,MCGUIRE B B,et al.Evaluation of viability and proliferative activity of human urothelial cells cultured onto xenogenic tissue-engineered extracellular matrices[J]. Urology,2011,77(77):e1-7.
[21]徐明曦,周哲,张明,等.人脂肪来源干细胞与胶原支架共培养的实验研究[J].组织工程与重建外科杂志,2012,8(4):189-194.
(张蕾 编辑)
Histocompaticblity research of adipose stem cells with different acellular bladder matrix*
Yong Bai1,Yang Wu2,Kaisaier Aji1,Bing-zhang Qiao1,Yu-jie Wang1,Muratrixat1
(1.Department of Urology,the First Affiliated Hospital of Xinjiang Medical University,Urumqi, Xinjiang 830054,China;2.Department of General Surgery,the 747th Hospital of the Chinese People's Liberation Army,Urumqi,Xinjiang 830000,China)
Objective To study thein vitrobiocompatibility of SD rat adipose stem cells with different acellular bladder matrix(bladder acellular matrix graft,BAMG),and provide favorable experimental basis to further implantation into animals.Methods In the bilateral inguinal adipose tissue of SD rats,the primary fat cells were obtained after treatment.CD29,CD34,CD44 and CD45 were used to identify adipose derived stem cells by staining and flow cytometry.BAMG of SD rats and New Zealand rabbits were prepared.Using secondary precipitation method,adipose stem cells were inoculated on different BAMG surface,cell growth on the surface of the materials was observed,and cell growth curve was drawn.Results Afterin vitroculture of the cellular materials for 5 days, HE staining revealed the adipose derived stem cells of SD rats grew better on the surface of SD rat BAMG than on the surface of New Zealand rabbit BAMG,the cells grew into spindle cells,and the cell growth curve was consistent with that of the primary fat cells of SD rats.Conclusions Adipose stem cells of SD rats grow better on the surface of SD rat BAMG complex than on the surface of New Zealand rabbit BAMG complex,it has better biological compatibility.Our result provides favorable experimental basis for further implantation of the cell scaffold complex into animals.
adipose stem cell;bladder acellular matrix graft;tissue compatibility;repair
R-332
A
10.3969/j.issn.1005-8982.2017.04.002
1005-8982(2017)04-0007-06
2016-08-10
国家自然科学基金(No:81160088)
木拉提·热夏提,E-mail:muratrixat@126.com
