MicroRNA-150-5p对肝细胞癌细胞增殖、凋亡和周期的影响
2017-04-17赵月秋张正宝郭红霞詹传飞钱晓峰
赵月秋,张正宝,郭红霞,詹传飞,鲁 皓,钱晓峰
MicroRNA-150-5p对肝细胞癌细胞增殖、凋亡和周期的影响
赵月秋1,张正宝1,郭红霞1,詹传飞2,鲁 皓2,钱晓峰2
(1.江苏联合职业技术学院南京卫生分院,江苏 南京 210038;2.江苏省人民医院 肝脏外科,江苏 南京 210029)
目的 研究microRNA-150-5p(miR-150-5p)在人正常肝细胞和肝细胞癌细胞中的表达,及其对肝细胞癌细胞增殖、凋亡和周期的影响及潜在机制。方法 通过实时荧光定量聚合酶链反应(qRT-PCR)检测各处理组细胞中的miR-150-5p的表达水平;MTT法检测miR-150-5p对肝细胞癌细胞增殖的影响;流式细胞术检测miR-150-5p对肝细胞癌细胞凋亡和周期的影响;荧光素酶报告基因实验检测锌指蛋白609是否为miR-150-5p的直接靶基因。结果 miR-150-5p在肝细胞癌细胞系中的表达较人正常肝细胞细胞系降低,miR-150-5p可抑制肝细胞癌细胞的增殖,促进肝细胞癌细胞的凋亡,并阻滞细胞周期于G1期。miR-150-5p在肝细胞癌中发挥肿瘤抑制分子作用的潜在机制为直接靶向抑制ZNF609的表达。结论 miR-150-5p在肝细胞癌细胞中表达降低,并可通过调控ZNF609的表达而调控肝细胞癌细胞增殖、凋亡和周期。
MicroRNA-150-5p;增殖;凋亡;周期;ZNF609
在全球范围内,肝细胞癌发病率高居所有恶性肿瘤的第5位,值得注意的是,近年来肝细胞癌在东亚和发展中的发病率正逐步上升[1-2]。尽管在过去数10年间,肝细胞癌的治疗手段取得巨大的进步,但大多数患者术后发生复发或远处转移,导致肝细胞癌的致死率仍居高不下[3]。截止目前,肝细胞癌发生、进展中的分子机制仍不完全清楚。因此,寻找与肝细胞癌发生及进展相关的分子,对提高肝细胞癌患者术后生存率至关重要。
MicroRNA(miRNA)是一类可在转录后水平调控基因表达的18-22个核苷酸大小的非编码小分子。miRNA在进化过程中发育相近的物种之间高度保守,被视为细胞增殖、细胞分化和肿瘤发生的关键调控分子[4-6]。在肝细胞癌中,多种miRNA被发现可作为癌基因或抑癌基因参与调控肝细胞癌的发生、进展,如miR-214[7]、miR-182[8]、miR-29b[9]、miR-7等[10]。研究发现,miR-150-5p在肝细胞癌组织中表达下调,并可抑制肝细胞癌细胞的侵袭和转移[11],但miR-150-5p对肝细胞癌细胞增殖、凋亡和周期的影响及潜在分子机制,目前尚不清楚。本研究拟采用实时荧光定量聚合酶链反应(quantitative real-time polymerasechainreaction,qRT-PCR)方法检测miR-150-5p在正常肝细胞系和肝细胞癌细胞系中的表达差异,及其对肝细胞癌细胞增殖、凋亡和周期的影响。
1 材料与方法
1.1 一般资料
培养细胞总RNA提取试剂盒购自天根生化科技(北京)有限公司,Quant一步法逆转录-荧光定量试剂盒购自天根生化科技(北京)有限公司,miR-150-5p正常对照(normal control,NC)和miR-150-5p类似物(Mimics)由上海吉玛公司设计并合成,脂质体2000(LipofectamineTM2 000)试剂购于美国Invitrogen公司,MTT试剂盒购自美国Promega公司,流式细胞术所用FITC标记的Annexin-V及PI试剂购自美国BioLegend公司,人正常肝细胞系QZG细胞和HL-7702细胞,肝细胞癌细胞系HepG2细胞和SMMC-7221细胞均购自中国科学院上海细胞库。
1.2 方法
1.2.1 细胞培养和转染 人正常肝细胞和肝细胞癌细胞系用含100 ml/L胎牛血清的1 640培养液,置于温度37℃,50 ml/L二氧化碳CO2细胞培养箱中培养。当肝细胞癌细胞密度达到约70%后,将miR-150-5p NC和miR-150-5p类似物经LipofectamineTM2 000转入细胞中,具体操作步骤参见脂质体2000(LipofectamineTM2 000)试剂说明书。
1.2.2 qRT-PCR 按照培养细胞总RNA提取试剂盒说明书所述方法提取各实验组细胞,而后采用Quant一步法逆转录-荧光定量试剂盒所述方法行qRT-PCR,具体步骤如下:按说明书所述依次加入试剂后行一步法qRT-PCR。qRT-PCR反应条件为:50℃30 min,95℃2 min,35个循环94℃20 s,60℃20 s,65℃20 s。
1.2.3 MTT 细胞转染48 h后,取对数生长期的肝细胞癌细胞,制备单细胞悬液,以5.0×103个/孔细胞密度接种于96孔板,每组设8个复孔,分别培养1~5 d,每孔加入20 μl浓度为1.5 g/L的MTT,培养4 h后每孔加入150 μl DMSO,读取吸光度值,绘制细胞生长曲线。
1.2.4 流式细胞术 细胞周期检测方法简述如下,取转染48h后的各组细胞,5ml PBS洗涤,1 000 r/min离心5 min,5 ml PBS洗涤3次后,弃上清液;加入100μl流式洗液,PI(50μg/ml)10μl,避光反应10 min后,加入400μl流式洗液,200目尼龙膜过滤细胞,立即利用流式细胞仪上机检测。如检测细胞凋亡,加入抗体步骤时同时加入FITC标记的Annexin-V和PI各10μl及同型对照抗体,其余步骤同检测细胞周期。细胞周期和细胞凋亡数据后期均采用Flowjo 7.2软件进行分析。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(x±s)表示,各组间的数据比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 肝细胞癌细胞和正常肝细胞中miR-150-5p的表达差异
为研究人正常肝细胞系与肝癌细胞系中miR-150-5p的表达情况,分别提取人正常肝细胞系QZG和 HL-7702细胞和肝细胞癌细胞系HepG2和SMMC-7221细胞的总RNA,采用一步法qRT-PCR检测各细胞中miR-150-5p的相对表达量,经方差分析,4组细胞中miR-150-5p表达差异有统计学意义(F=9.125,P=0.018),提示miR-150-5p在4组细胞系中表达差异有统计学意义。进一步t检验分析两两细胞系中miR-150-5p的表达差异,结果显示肝细胞癌细胞系中的miR-150-5p的表达水平较正常肝细胞降低(QZG vs HL-7702,t=0.324,P=0.419;QZG vs HepG2,t=7.748,P=0.031;QZG vs SMMC-7221,t= 5.197,P=0.039),结果提示,miR-150-5p在肝细胞癌中表达降低,是潜在的肿瘤抑制分子。见图1。
2.2 miR-150-5p mimics上调肝细胞癌细胞中的miR-150-5p的表达
为研究miR-150-5p对肝细胞癌增殖、凋亡、周期的影响,合成miR-150-5p mimics,并转染至细胞中观察miR-150-5p mimics是否可以上调肝细胞癌细胞中的miR-150-5p的表达水平。转染miR-150-5p NC的肝细胞癌细胞命名为miR-150-5p NC组,转染miR-150-5p mimics的肝细胞癌细胞命名为miR-150-5p mimics组。转染48 h后,分别提取各组细胞总RNA,采用一步法qRT-PCR检测各组细胞中miR-150-5p的相对表达量,结果显示miR-150-5p mimics组的miR-150-5p的相对表达量较miR-150-5p NC组上调(HepG2细胞:t=5.114,P=0.017;SMMC-7221细胞:t=3.716,P=0.032),结果提示miR-150-5p可上调肝细胞癌细胞中miR-150-5p的表达水平。见图2。

图2 miR-150-5p在miR-150-5p NC组和miR-150-5p mimics组肝细胞癌细胞中的表达水平
2.3 miR-150-5p对肝细胞癌细胞增殖的影响
为研究miR-150-5p对肝细胞癌细胞增殖能力的影响,利用MTT实验检测转染miR150-5p-NC与miR-150-5p mimics的肝细胞癌 HepG2细胞和SMMC-7221细胞的细胞增殖的差异。结果显示,从检测后第2天开始,miR-150-5p mimics组的肝细胞癌细胞增殖较miR-150-5p NC组出现明显的生长抑制(HepG2细胞:t=4.146,P=0.022;SMMC-7221细胞:t=3.193,P=0.041),结果提示,提高肝细胞癌细胞中miR-150-5p的表达可抑制肝细胞癌细胞的增殖。见图3。
2.4 miR-150-5对肝细胞癌细胞凋亡的影响
为研究miR-150-5p对肝细胞癌细胞凋亡水平的影响,利用流式细胞术检测转染miR150-5p-NC与miR-150-5p mimics的肝细胞癌HepG2细胞和SMMC-7221细胞的细胞凋亡的差异。结果显示,在HepG2细胞中,miR-150-5p NC组细胞凋亡率为(2.146±0.327),miR-150-5p mimics组细胞凋亡率为(7.335±1.714),经t检验,差异有统计学意义(t= 10.332,P=0.012)。在SMMC-7221细胞中,miR-150-5p NC组细胞凋亡率为(3.159±0.273)%,miR-150-5p mimics组细胞凋亡率为(14.719±3.154)%,经t检验,差异有统计学意义(t=11.415,P=0.009)。与miR-150-5pNC组比较,miR-150-5p mimics组的肝细胞癌细胞的细胞凋亡率升高。以上结果提示,上调肝细胞癌细胞中miR-150-5p的表达水平可促进肝细胞癌细胞的凋亡,进一步证实miR-150-5p是潜在的肿瘤抑制分子。见图4。

图3 miR-150-5p对肝细胞癌细胞增殖的影响
2.5 miR-150-5对肝细胞癌细胞周期的影响
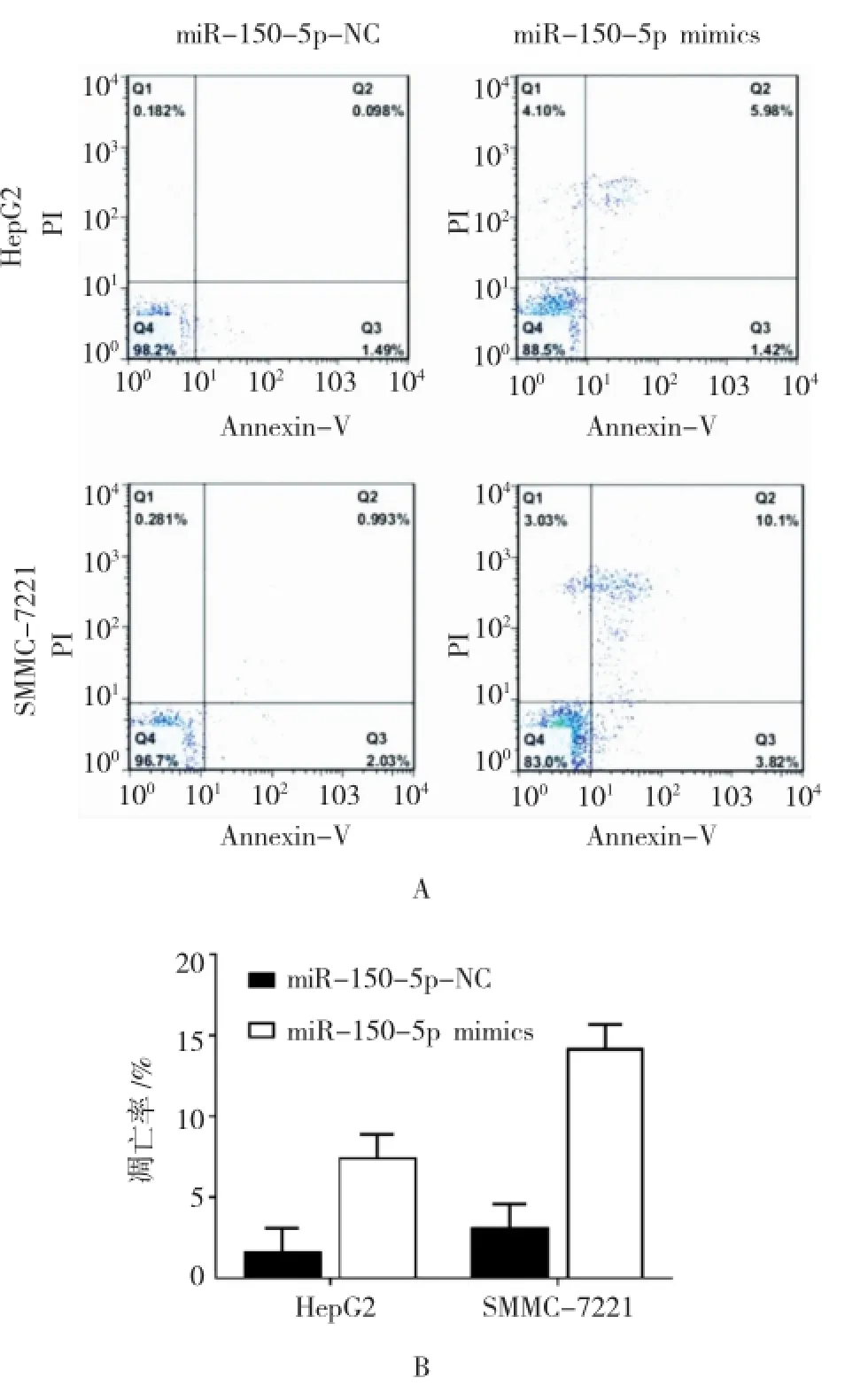
图4 miR-150-5p对肝细胞癌细胞凋亡的影响
为研究miR-150-5p对肝细胞癌细胞周期的影响,利用流式细胞术检测分别转染miR-150-5p NC与miR-150-5p的肝细胞癌HepG2细胞和SMMC-7221细胞的细胞周期的差异。结果显示,在HepG2细胞中,miR-150-5p NC组细胞合成期(synthesis phase,S期)细胞比率为(21.324±4.718)%,miR-150-5p mimics组S期细胞比率为(11.674±4.120)%,经t检验,差异有统计学意义(t=8.416,P=0.021)。在SMMC-7221细胞中,miR-150-5p NC组S期细胞比率为(29.728±5.723)%,miR-150-5p mimics组S期细胞比率为(18.344±4.115)%,经t检验,差异有统计学意义(t=7.195,P=0.034)。与miR-150-5p NC组比较,miR-150-5pmimcs组的肝细胞癌细胞的S期细胞的细胞比率降低,细胞周期被阻滞于第一间隙期(gap phase 1,G1期)。以上结果提示,上调肝细胞癌细胞中miR-150-5p的表达,可是细胞周期阻滞于G1期,增殖期S其细胞数目减少,细胞增殖收到抑制。见图5。
2.6 miR-150-5p在肝细胞癌细胞系中靶向抑制ZNF609
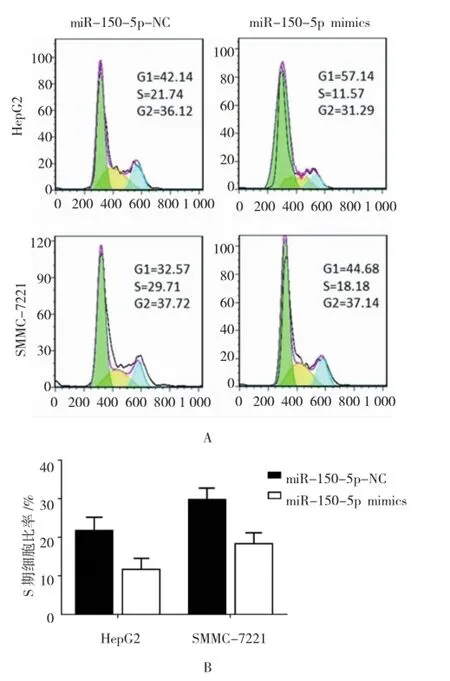
图5 miR-150-5p对肝细胞癌细胞周期的影响
为进一步研究miR-150-5p在肝细胞癌中发挥抑癌作用的机制,综合分析Target Scan 6.2和miRBse数据库中miR-150-5p的潜在靶分子。生物信息学提示锌指蛋白609(Zinc finger protein 609,ZNF609)为miR-150-5p新的潜在靶分子。Luciferase结果显示,在肝细胞癌细胞系中ZNF609为miR-150-5p直接靶基因(P=0.031)(见图6A)。进一步实验结果显示,转染miR-150-5p-mimics的肝细胞癌HepG2细胞和SMMC-7721中ZNF609的mRNA表达水平降低(P=0.015)(见图6B),以上结果提示,ZNF609为miR-150-5p在肝细胞癌细胞中的直接靶分子,miR-150-5p可直接抑制肝细胞癌细胞中ZNF609的表达水平。因此,miR-150-5p在肝细胞癌中发挥肿瘤抑制分子作用的潜在机制为直接靶向抑制ZNF609的表达。
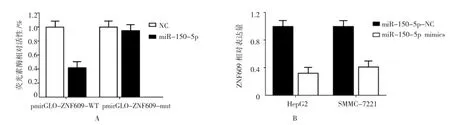
图6 miR-150-5P在肝细胞癌细胞系中靶向抑制ZNF609的表达
3 讨论
既往研究发现,miR-150-5p在多种肿瘤中异常表达并参与调控肿瘤细胞的恶性表型。研究发现,miR-150在结肠癌组织中表达下调,miR-150-5p低表达的结肠癌患者的总体生存率缩短,对化疗的反应较miR-150高表达组也下降[12]。此外,miR-150可通过靶向抑制MUC4的表达而抑制结肠癌细胞的侵袭和转移[13]。在食管鳞状细胞癌中组织中,miR-150表达较正常食管黏膜下降[14]。miR-150可通过抑制ZEB1的表达而抑制食管鳞状细胞癌细胞和卵巢癌细胞的侵袭能力[14-15]。相反,也有研究发现,miR-150在肺癌中表达上调,并可通过靶向抑制SRC激酶信号通知抑制分子1的表达而促进肺癌细胞的增殖和转移[16]。关于miR-150-5p在肝细胞癌中的表达及功能的研究尚不多,研究发现miR-150-5p在肝细胞癌组织中表达下调[17],并可通过靶向调控MMP14分子而抑制肝细胞癌细胞的侵袭和转移能力[11]。但目前尚无研究关注,miR-150-5p对肝细胞癌细胞增殖、凋亡和周期的影响。
本研究采用qRT-PCR法检测人正常肝细胞系和肝细胞癌细胞系中miR-150-5p的表达差异,并利用 miR-150-5p mimics提高肝细胞细胞系中miR-150-5p的表达,而后采用MTT和流式细胞术等方法检测miR-150-5p对肝细胞癌细胞增殖、凋亡和周期的影响。与既往文献相符,研究发现,miR-150-5p在肝细胞癌细胞系HepG2和SMMC-7221中的表达较人正常肝细胞细胞系QZG和HL-7702中的表达降低。上调肝细胞癌细胞中miR-150-5p的表达后,肝细胞癌系细胞的增殖受到抑制,而细胞凋亡比率则升高。此外,细胞周期也被阻滞于G1期。进一步的机制研究发现,miR-150-5p在肝细胞癌中发挥肿瘤抑制分子作用的潜在机制为直接靶向抑制ZNF609的表达。
多项研究表明,miRNA在肝细胞癌的发生及进展中扮演着重要的角色。例如,miR-195在肝细胞癌组织中表达下调,并与肝细胞癌的血管生成、远处转移和无病生存期呈负相关[18]。MiR-195发挥抑癌作用的潜在机制为其通过靶向抑制血管内皮生长因子(VEGF)和促转移因子VAV2和CDC42的表达而抑制肝细胞癌细胞的侵袭和转移[18]。MiR-140-5p在肝细胞癌中同样表达下调,其表达水平与肝细胞癌多发结节、静脉侵犯程度、囊形成、细胞核分化水平和总体积无病生存期密切相关[19]。本研究证实,miR-150-5p在肝细胞癌细胞中表达下调并在肝细胞癌中发挥肿瘤抑制分子的作用,其可通过调控ZNF609的表达水平而参与调控肝细胞癌细胞增殖、凋亡和周期。
综上所述,本研究发现miR-150-5p在肝细胞癌细胞系中的表达较人正常肝细胞系下降,提高miR-150-5p在肝细胞癌细胞中的表达,可抑制肝细胞癌细胞的增殖能力,并促进肿瘤细胞的凋亡率。此外,与NC组比较,miR-150-5p mimics组细胞周期中S期细胞所占比例也降低。进一步的研究显示,miR-150-5p在肝细胞癌细胞中发挥抑癌分子作用的潜在机制为其靶向抑制ZNF609的表达。本研究进一步揭示,miR-150-5p在肝细胞癌中的表达及其对肝细胞癌细胞增殖、凋亡和周期的作用,为肝细胞癌的治疗提供潜在的分子靶点。
[1]CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2015[J]. CA Cancer J Clin,2015,65(1):5-29.
[3]XIA L,HUANG W,TIAN D,et al.Overexpression of forkhead box C1 promotes tumor metastasis and indicates poor prognosis in hepatocellular carcinoma[J].Hepatology,2013,57(2):610-624.
[4]HWANG H W,MENDELL J T.MicroRNAs in cell proliferation, cell death,and tumorigenesis[J].Br J Cancer,2006,94(6):776-780.
[5]SAITO Y,SUZUKI H,TSUGAWA H,et al.Chromatin remodeling at Alu repeats by epigenetic treatment activates silenced microRNA-512-5p with downregulation of Mcl-1 in human gastric cancer cells[J].Oncogene,2009,28(30):2738-2744.
[6]BAO B,ALI S,KONG D,et al.Anti-tumor activity of a novel compound-CDF is mediated by regulating miR-21,miR-200, and PTEN in pancreatic cancer[J].PLoS One,2011,6(3):e17850.
[7]WANG J,LI J,WANG X,et al.Downregulation of microRNA-214 and overexpression of FGFR-1 contribute to hepatocellular carcinoma metastasis[J].Biochem Biophys Res Commun, 2013,439(1):47-53.
[8]WANG J,LI J,SHEN J,et al.MicroRNA-182 downregulates metastasis suppressor 1 and contributes to metastasis of hepatocellular carcinoma[J].BMC Cancer,2012,12(1):227.
[9]FANG J H,ZHOU H C,ZENG C,et al.MicroRNA-29b suppresses tumor angiogenesis,invasion,and metastasis by regulating matrix metalloproteinase 2 expression[J].Hepatology,2011,54(5): 1729-1740.
[10]FANG Y,XUE J L,SHEN Q,et al.MicroRNA-7 inhibits tumor growth and metastasis by targeting the phosphoinositide 3-kinase/Akt pathway in hepatocellular carcinoma[J].Hepatology, 2012,55(6):1852-1862.
[11]LI T,XIE J,SHEN C,et al.miR-150-5p inhibits hepatoma cell migration and invasion by targeting MMP14[J].PLoS One, 2014,9(12):e115577.
[12]MA Y,ZHANG P,WANG F,et al.miR-150 as a potential biomarker associated with prognosis and therapeutic outcome in colorectal cancer[J].Gut,2012,61(10):1447-1453.
[13]WANG W H,CHEN J,ZHAO F,et al.MiR-150-5p suppresses colorectal cancer cell migration and invasion through targeting MUC4[J].Asian Pac J Cancer Prev,2014,15(15):6269-6273.
[14]YOKOBORI T,SUZUKI S,TANAKA N,et al.MiR-150 is associated with poor prognosis in esophageal squamous cell carcinoma via targeting the EMT inducer ZEB1[J].Cancer Sci,2013, 104(1):48-54.
[15]JIN M,YANG Z,YE W,et al.MicroRNA-150 predicts a favorable prognosis in patients with epithelial ovarian cancer,and inhibits cell invasion and metastasis by suppressing transcriptional repressor ZEB1[J].PLoS One,2014,9(8):e103965.
[16]CAO M,HOU D,LIANG H,et al.miR-150 promotes the proliferation and migration of lung cancer cells by targeting SRC kinase signalling inhibitor 1[J].Eur J Cancer,2014,50(5): 1013-1024.
[17]SHI K Q,LIN Z,CHEN X J,et al.Hepatocellular carcinoma associated microRNA expression signature:integrated bioinformatics analysis,experimental validation and clinical significance [J].Oncotarget,2015,6(28):25093-25108.
[18]WANG R,ZHAO N,LI S,et al.MicroRNA-195 suppresses angiogenesis and metastasis of hepatocellular carcinoma by inhibiting the expression of VEGF,VAV2,and CDC42[J].Hepatology,2013,58(2):642-653.
[19]YANG H,FANG F,CHANG R,et al.MicroRNA-140-5p suppresses tumor growth and metastasis by targeting transforming growth factor beta receptor 1 and fibroblast growth factor 9 in hepatocellular carcinoma[J].Hepatology,2013,58(1):205-217.
(张西倩 编辑)
Effects of miR-150-5p on proliferation,apoptosis and cell cycle of hepatocellular carcinoma cells
Yue-qiu Zhao1,Zheng-bao Zhang1,Hong-xia Guo1,Chuan-fei Zhan2,Hao Lu2,Xiao-feng Qian2
(1.Nanjing Health School,Jiangsu Union Technical Institute,Nanjing,Jiangsu 210038,China;2. Department of Liver Surgery,Jiangsu Provincial Hospital,Nanjing,Jiangsu 210029,China)
Objective To investigate the expression and effect of miR-150-5p on cell proliferation,cell apoptosis and cell cycle in human hepatocellular carcinoma cells.Methods The expression of miR-150-5p in hepatocellular carcinoma cells and normal human liver cells was detected by quantitative real-time polymerase chain reaction (qRT-PCR).Proliferation of hepatocellular carcinoma cells was analyzed by MTT.Cell apoptosis and cell cycle of hepatocellular carcinoma cells were analyzed by flow cytometry.Luciferase assay was performed to detect whether ZNF609 was the direct target of miR-150-5p in the hepatocellular carcinoma cells.Results The expression of miR-150-5p was significantly down regulated in the hepatocellular carcinoma cells compared to the normal human liver cells.Proliferation of the hepatocellular carcinoma cells was significantly inhibited by miR-150-5p,but cell apoptosis was significantly promoted.Cell cycle of the hepat ocellular carcinoma cells was arrested at G1 phage after transfection of miR-150-5p mimics.Further investigation proved ZNF609 was the direct target of miR-150-5p in hepatocellular carcinoma cells.Conclusions miR-150-5p may function as tumor suppressor and play important roles in cell proliferation,cell apoptosis and cell cycle in hepatocellular carcinoma cells by directly targeting ZNF609.
miR-150-5p;cell proliferation;cell apoptosis;cell cycle;ZNF609
临床研究·论著
R735
A
10.3969/j.issn.1005-8982.2017.04.006
1005-8982(2017)04-0027-06
2016-07-13
