人胎盘间充质干细胞微环境对心肌细胞增殖的影响
2017-04-15章毅陈亮李萍许惠利王哲伍婷张澄宇
章毅,陈亮,李萍,许惠利,王哲,伍婷,张澄宇
人胎盘间充质干细胞微环境对心肌细胞增殖的影响
章毅,陈亮,李萍,许惠利,王哲,伍婷,张澄宇
目的观察胎盘间充质干细胞微环境对心肌细胞增殖的影响。
肌细胞,心脏; 细胞微环境; 胎盘间充质干细胞
随着人类对间充质干细胞的生物学特性及研究进一步加深,已从骨髓、外周血、脂肪等组织中成功分离鉴定出间充质干细胞。胎盘作为胚胎发育期间维系母体和胎儿营养物质交换和氧气运输的重要临时性器官,富含大量的间充质干细胞,其在胎儿娩出时即完成最后使命,成为“医疗废弃物”,对其研究和临床应用不涉及任何伦理道德问题,目前已经成为寻找人间充质干细胞的新来源,并成为临床应用效果研究的新热点。利用人胎盘间充质干细胞(placenta derived mesenchymal stem cell,pMSC)增殖分化这一潜能,进行心肌细胞再生修复,心肌细胞损伤修复并进一步修复心脏功能,也已成为心脏病等心血管疾病治疗的一种新医疗手段。人胎盘间充质干细胞为再生受损组织器官提供了巨大的希望,但受其有效性、尚不清楚的机制、缺血环境中移植细胞的生存问题等诸多因素的阻碍。因此,开发无细胞组分如人胎盘间充质干细胞微环境制剂部分替代干细胞治疗显得尤为重要。本文从胎盘组织绒毛膜中分离鉴定获得间充质干细胞,采用人胎盘间充质干细胞培养基上清模拟胎盘间充质干细胞微环境,观察人胎盘间充质干细胞微环境对心肌细胞的影响。
1 材料与方法
1.1 材料
胎盘采集于足月健康新生儿,符合国家相关法律和伦理委员会规定,经产妇或家属签署知情同意书后获得。成脂、成软骨、成骨诱导套装购自美国Gibco 公司;CCK8 试剂盒购自碧云天公司;PI、RNase A 购自美国 Sigma 公司;MSC Phenotyping kit(CD105-PE、CD90-FITC、CD73-APC、CD14-/CD19-/CD34-/CD45-PerCP) 购 自 德 国Miltenyi Biotec 公司;油红 O 染液、Masson 染液、茜素红 S 染液购自南京建成公司;H9C2 细胞购自中科院细胞库;transwell 小室购自美国Thermofisher 公司。
1.2 方法
1.2.1 pMSC 的分离培养 无菌条件下剪取胎盘绒毛膜组织,剪成约 5 mm3的碎块,加入 II 型胶原酶恒温消化 1.5 h,室温 2000 r/min 离心 10 min,加入含 10% FBS 的培养液重悬细胞,置于 37 ℃、5% CO2恒温培养箱内进行培养,在倒置相差显微镜下观察细胞形态和生长情况,待细胞融合度达到80%~90% 时,胰酶消化传代,每 2~3 天传代1 次,倒置显微镜下观察 pMSC 形态并拍照记录。
1.2.2 pMSC 表面抗原检测 取 pMSC,用1 ml PBS 调整细胞总数为 5×106,分别加入标记抗体 CD90-FITC、CD105-PE、CD73-APC、CD14-/CD19-/CD34-/CD45-PerCP,以鼠抗人的IgG1-FITC、IgG1-PE、IgG1-APC、IgG1-PerCP、IgG2a-PerCP 作为同型对照,室温避光孵育 30 min,流式细胞仪检测。
1.2.3 pMSC 三向分化检测 取对数生长期的pMSC,以 1×105/ml 密度接种于 6 孔板中,置于37 ℃、体积分数为 5% 的 CO2恒温培养箱中培养24 h,待细胞融合度达到 60%~70% 时,分别更换为成脂、成软骨及成骨诱导分化培养基,每 3 天换液。诱导 14 d 后,成脂诱导、成软骨诱导、成骨诱导分别用油红 O 染液、Masson 染液、茜素红S 染液染色,倒置相差显微镜下观察并拍照。
1.2.4 pMSC 培养基上清收集及与心肌细胞共培养 选择对数期生长的 pMSC 进行消化传代,于10 mm×10 mm 的细胞培养皿中培养,每 2 天换液,观察细胞生长形态,待细胞生长密度达到 80%~ 90% 收集细胞培养基上清待用。
1.2.5 Transwell 共培养及 H9C2 生长状态观察 将对数生长期 H9C2 细胞以 5×104/ml 密度接种于 6 孔 transwell 板下室中,上室处理共分6 组,分别加入 2 ml 10% FBS 的 DMEM 培养基、2 ml pMSC-CM、2 ml 5×104/ml 的 pMSC;4 ml 10% FBS 的 DMEM 培养基、4 ml pMSC-CM、4 ml 1×105/ml 的 pMSC。每个处理设置 3 个重复。共培养 72 h,倒置显微镜下观察 transwell 下室心肌细胞生长状态并拍照记录。
1.2.6 细胞增殖检测 将上述 6 组共培养处理72 h 后的心肌细胞分别计数处理,以 5×104/ml密度种于 96 孔细胞培养板(100 μl/孔)中,每个处理设置 6 个复孔,在 37 ℃,5% CO2恒温细胞培养箱中连续培养 24、48 h,每孔加入 10 μl CCK8工作液,置于 37 ℃,5% CO2恒温细胞培养箱反应 2 h,在酶联免疫检测仪检测 450 nm 处各孔吸光值(A)。心肌细胞增殖率=(A实验组/A对照组– 1)×100%。
1.3 统计学处理
流式检测结果采用 FlowJo 7.6.1 软件分析结果。采用 GraphPad Prism 5.0 软件进行作图、统计学分析,实验数据用±s表示,组间比较采用one-way ANOVA 分析。以 P<0.05 为差异具有统计学意义。
2 结果
2.1 pMSC 形态及表面抗原鉴定
倒置相差显微镜下观察,原代培养的 pMSC接种 48 h 后,大部分细胞贴壁,形态为典型成纤维细胞样,3~5 d 可发现贴壁细胞增殖形成细胞岛,6~9 d 后所有细胞岛汇合成单细胞层铺满全皿,均为长梭形,细胞排列紧密,成旋涡状或放射状生长,中间散在些透亮圆形杂细胞(图 1)。
间充质干细胞表型抗原标志物流式细胞术检测结果发现,本实验原代分离获得的 pMSC 表面标记物 CD14+/CD19+/CD34+/CD45+细胞数百分比含量为 0.13%;同时间充质干细胞相关抗原CD73、CD90、CD105 阳性细胞数百分比表达率分别为 99.86%、99.87%、99.71%。提示本实验分离获得了高纯度的人胎盘间充质干细胞,可用于后续实验(图 2)。
2.2 pMSC 三向分化鉴定
pMSC 成脂诱导 14 d,油红 O 染色结果显示,细胞胞浆周围均含有大小不等的脂滴,脂滴被染成红色。随着诱导天数的增加,细胞形态未发生改变,仍为梭形,诱导成脂肪细胞的数目增多;pMSC 成骨诱导 14 d 结果显示,茜素红 S 染色结果显示,细胞出现大量橘红色沉淀,呈圆形或类圆形或堆积成片状,有明显的“矿化”结节形成且数量上呈递减趋势。pMSC 成软骨诱导 14 d,倒置相差显微镜下观察细胞贴壁良好,细胞扁平伸展,由长梭形变成多边多角形态,具有软骨细胞样的形态,Masson 染色结果显示细胞胶原纤维呈现蓝紫色(图 3)。
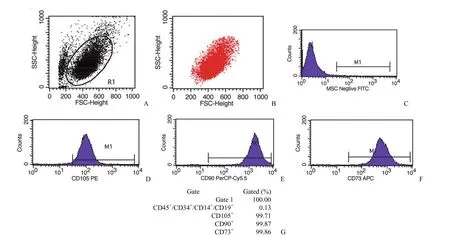
图2 人胎盘间充质干细胞流式鉴定(A:总颗粒散点分布图;B:活细胞;C:阴性对照染色;D~F:CD105+、CD90+、CD73+细胞比例;G:细胞比例统计)Figure 2 Characterization of pMSC phenotype through flow cytometry (A:Total particles scatter diagram; B:Alive cells; C:Negative staining; D-F:CD105+,CD90+,CD73+cells ratio; G:Cell ratio analysis)

图3 人胎盘间充质干细胞成脂(油红 O 染色)、成骨(茜素红 S 染色)、成软骨(Masson 染色)分化鉴定Figure 3 Adipogenic,osteogenic and chondrogenic differentiation of pMSC characterized by oil red O staining,alizarin red S and Masson staining,respectively
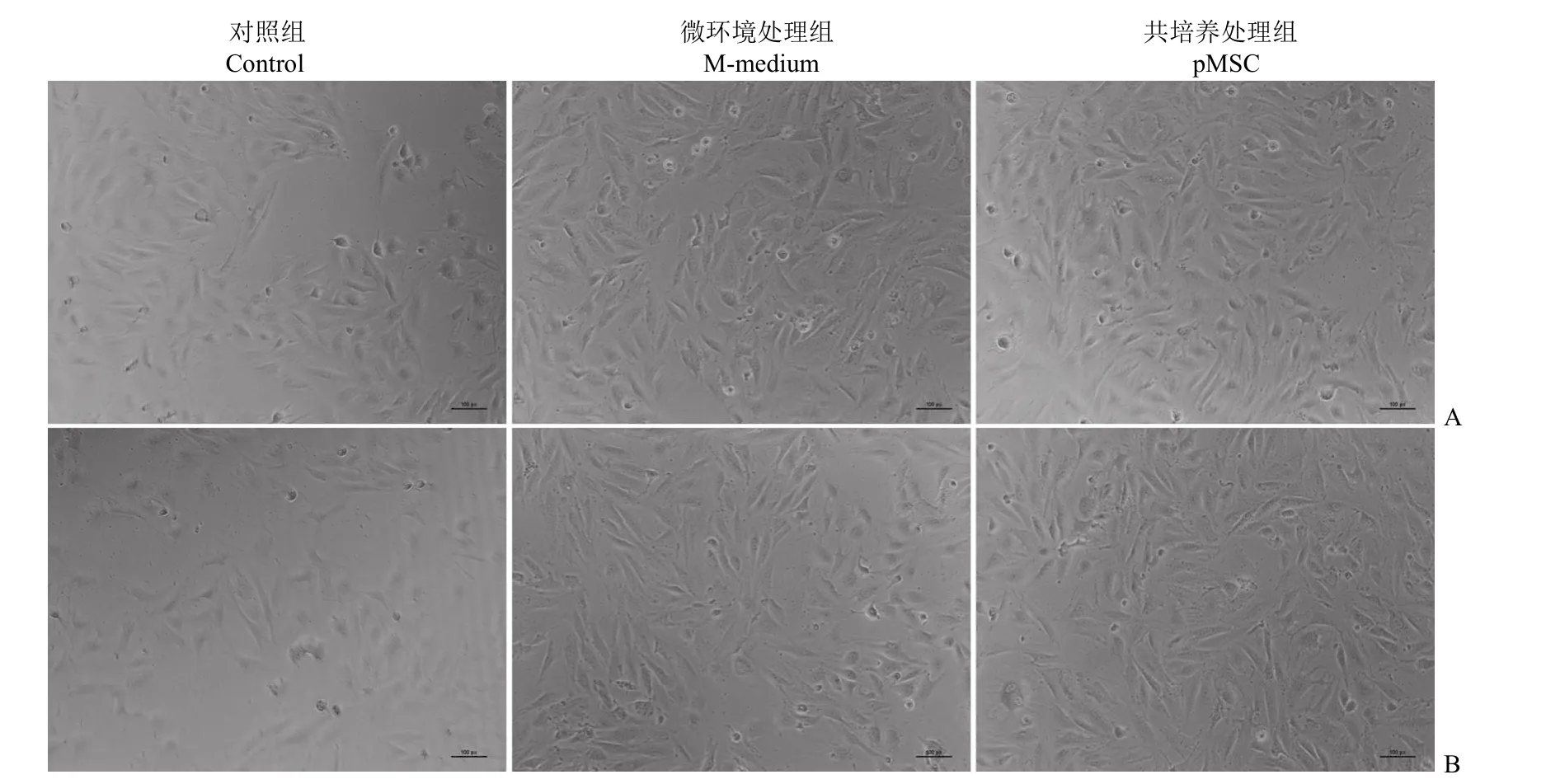
图4 pMSC 微环境及 pMSC 对 H9C2 心肌细胞生长状态的影响(A:上室/下室 pMSC 细胞数量或培养基体积比为 1∶1;B:上室/下室 pMSC 细胞数量或培养基体积比为 2∶1)Figure 4 Effects of pMSC conditioned medium on the growth of H9C2 (A:Ratio of pMSC quantity/medium created by pMSC ∶ up chamber vs down chamber=1∶1; B:Ratio of pMSC quantity/medium created by pMSC ∶ up chamber vs down chamber=2∶1)
上下室培养基体积 1∶1 和 2∶1 中对照组H9C2 细胞生长速度均相对缓慢,培养 24 h 后汇合率为 50% 左右,上下室培养基体积 1∶1 和 2∶1胎盘间充质干细胞微环境处理组,H9C2 心肌细胞与对照组相比,细胞汇合率显著增加,汇合率达80%~90%,与胎盘间充质干细胞共培养处理组无显著差异。结果显示,胎盘间充质干细胞微环境与胎盘间充质干细胞一样,显著促进了 H9C2 心肌细胞的增殖,同时,微环境添加比例 1∶1 效果最佳(图 4)。
2.4 CCK8 法检测心肌细胞增殖
进一步 CCK8 细胞增殖检测结果显示(图 5和表 1),微环境干预组,当上室培养基体积与下室培养基体积比例为 1∶1 时,与对照组相比,胎盘间充质干细胞微环境显著促进了 H9C2 细胞增殖(图 5),干预后培养 24 和 48 h 后增殖率分别增加 17.99%(P < 0.001)和 15.37%(P < 0.001);当上室培养基体积与下室培养基体积比例为 2∶1时,24 和 48 h 增殖率相比对照组仅分别增加10.87%(P < 0.05)和 10.28%(P < 0.001);胎盘间充质干细胞干预组,上室胎盘间充质干细胞与下室 H9C2 心肌细胞按 1∶1 共培养时,与对照组相比,24 和 48 h 增殖率分别增加 26.23%(P < 0.01)和 15.97%(P < 0.01),上室胎盘间充质干细胞与下室 H9C2 心肌细胞按 2∶1 共培养时,24 和48 h 增殖率与对照组相比分别增加 20.13%(P <0.001)和 8.49%(P < 0.001)。由结果可看出,胎盘间充质干细胞微环境能显著促进 H9C2 心肌细胞的增殖,与胎盘间充质干细胞作用相当,且胎盘间充质干细胞微环境干预处理有最优剂量选择。本实验结果提示,胎盘间充质干细胞微环境干预处理体积与 H9C2 培养体积为 1∶1 对心肌细胞增殖的促进作用显著优于体积比为 2∶1 的干预体系;胎盘间充质干细胞和胎盘间充质干细胞微环境对心肌细胞促增殖作用具有一定的时间效应,处理 24 h时,胎盘间充质干细胞的促心肌细胞增殖作用高于胎盘间充质微环境,但在处理 48 h 时,两者无显著差异。提示,随着干预时间的增加,胎盘间充质干细胞微环境的促心肌细胞增殖作用与胎盘间充质干细胞达到相同水平。

图5 H9C2 心肌细胞 CCK8 增殖检测结果(A:上室 pMSC∶下室 H9C2 细胞数量或培养基体积比为 1∶1,24 h;B:上室 pMSC∶下室 H9C2 细胞数量或培养基体积比为 1∶1,48 h;C:上室 pMSC∶下室 H9C2 细胞数量或培养基体积比为 2∶1,24 h;D:上室 pMSC∶下室 H9C2 细胞数量或培养基体积比为 2∶1,48 h;*P< 0.05,**P< 0.01,***P< 0.001,nsP> 0.05)Figure 5 H9C2 cell proliferation detection by CCK8 method (A:Ratio of pMSC quantity/medium created by pMSC ∶ up chamber vs down chamber=1∶1,24 h; B:Ratio of pMSC quantity/medium created by pMSC :up chamber vs down chamber=1∶1,48 h; C:Ratio of pMSC quantity/medium created by pMSC ∶ up chamber vs down chamber=2∶1,24 h; D:Ratio of pMSC quantity/medium created by pMSC ∶ up chamber vs down chamber=2∶1,48 h;*P< 0.05,**P< 0.0l ,***P< 0.001,nsP> 0.05)

表1 H9C2 心肌细胞增殖率结果分析(%)Table 1 H9C2 cell proliferation rate analysis (%)
3 讨论
在心肌损伤修复的研究中,心肌细胞增殖及再生是心肌损伤修复的关键。间充质干细胞是一种具有高度自我更新能力与多向分化潜能的多能干细胞,目前已应用于临床治疗自身免疫性疾病、心肌损伤性疾病、神经损伤性疾病等,然而其治疗机制尚不明确。细胞移植是一种有希望的组织再生的治疗手段。多种类型的细胞已经用于动物心肌损伤的修复中,包括胚胎干细胞、胚胎和新生动物的心肌细胞、骨骼肌成肌细胞、骨髓干细胞、脂肪来源的干细胞、可诱导的多能干细胞等。但是,这些用于移植的细胞对机体环境具有一定的限制性要求,当在低氧低血环境中就存在成活率低、在心脏局部存留少、与宿主心肌细胞不能整合和免疫排斥等问题,这些问题限制了它们的应用。
现已明确,间充质干细胞对创伤皮肤、脊髓损伤、软骨损伤、神经元损伤、血管内皮损伤等具有修复功能。Rasulov 等[1]2005 年首次采用异体骨髓MSC 移植治疗 1 例大面积深度灼伤皮肤损伤,并于细胞移植后 4 d 实施自体皮肤移植术。结果发现,骨髓间充质干细胞可以促进创面愈合过程中血管的生成,缩短患者的康复时间。MSC 不仅可通过促血管生成作用加速创伤皮肤的愈合,同时可以大大降低创伤面炎症反应,促进新生皮肤细胞募集。2014 年,Liu 等[2]利用间充质干细胞对皮肤灼伤小鼠进行移植,移植后创伤皮肤中 IL-1、IL-6、TNF-α 等促炎因子显著降低,同时抑炎因子 IL-10和 TSG-6 显著升高,皮肤愈合速度大大提升。不仅如此,MSC 对慢性难愈性伤口或迁延不愈的伤口也有很好的疗效[3-5]。除了直接将 MSC 以不同方式输注进行治疗外,将 MSC 培养于一些支架材料上后移植到创伤部位,也具有较好的疗效[6-7]。此外,根据现有研究报道,不仅骨髓来源的 MSC 具有促进皮肤创伤愈合的作用,其他来源的 MSC,如脐带间充质干细胞[2,8-10]、脐带血间充质干细胞[10-11]、脂肪间充质干细胞[12-13]、胎盘间充质干细胞[14]、羊水间充质干细胞[15-16]等也具有较好的治疗作用,且在不同个体甚至不同物种间移植时没有明显的限制。另有研究人员通过鞘内注射方法对脊髓损伤患者进行了自体骨髓间充质干细胞移植,术后移植患者在术后神经功能得到改善[17-19]。软骨损伤修复研究表明,植入间充质干细胞后兔子缺损处软骨和软骨下骨修复良好[20-22]。且间充质干细胞对人骨、软骨、肌腱等的损伤修复临床应用已经广泛开展,并取得不俗效果,被广泛报道。体外培养的 MSC 能够分化为血管内皮细胞这一特定功能已多次被科研工作者证实,并且发现移植的 MSC 能够向血管损伤部位募集,并进一步分化为内皮细胞,修复损伤血管[23-25]。经耳缘静脉注射间充质干细胞,能有效抑制椎动脉血管炎症反应,修复受损椎动脉血管[26-27]。
然而,以往认为间充质干细胞治疗潜能是由于MSC 归巢并分化、代替损伤组织。后来观察到移植的 MSC 大部分都停留在肝、脾和肺,到达损伤部位的数量小于 1%。在到达靶组织的 MSC 中,大部分几天后消失,只有少量的 MSC 长期停留在损伤部位。用基因命运图谱技术显示再生的细胞来自于模型中存活的固有细胞。这些信息提示,MSC对组织的修复作用可能不是由于其分化能力。另有研究者发现,MSC 的条件培养基(CM)能模拟MSC 修复组织的功能。因此推测 MSC 可能是通过分泌营养因子以内分泌和旁分泌的方式促进组织修复。间充质细胞可以自分泌和(或)旁分泌脑源性神经营养因子、神经生长因子、血管内皮生长因子等多种神经保护性营养因子,这些因子表达上调,可以促进局部微血管再生、神经再生和重构,从而使损伤细胞得以修复。赵贵芳[28]通过实验发现,间充质干细胞分泌的外泌体可以促进 HaCaT 细胞的增殖及迁移,抑制 caspase 非依赖的线粒体凋亡信号通路,即 AIF-PARP 信号通路促进皮肤创面的修复,在皮肤创伤修复机制上形成了新的突破。
综上,我们的研究提示,胎盘源间充质干细胞微环境具有心肌损伤修复调节功能。这可能是由于其分泌的营养因子或外泌体所发挥作用,胎盘间充质干细胞培养基上清对心肌细胞增殖的分子机制有待进一步研究,其后期开发较之 MSC 的直接输注,去除活细胞的培养基上清的应用更为安全,更为高效,可望成为未来细胞治疗的新手段,更好发挥 MSC 的临床治疗价值。
[1]Rasulov MF,Vasilchenkov AV,Onishchenko NA,et al.First experience of the use bone marrow mesenchymal stem cells for the treatment of a patient with deep skin burns.Bull Exp Biol Med,2005,139(1):141-144.
[2]Liu L,Yu Y,Hou Y,et al.Human umbilical cord mesenchymal stem cells transplantation promotes cutaneous wound healing of severe burned rats.PLoS One,2014,9(2):e88348.
[3]Kwon DS,Gao X,Liu YB,et al.Treatment with bone marrow-derived stromal cells accelerates wound healing in diabetic rats.Int Wound J,2008,5(3):453-463.
[4]Rodriguez-Menocal L,Shareef S,Salgado M,et al.Role of whole bone marrow,whole bone marrow cultured cells,and mesenchymal stem cells in chronic wound healing.Stem Cell Res Ther,2015,6:24.
[5]Mehanna RA,Nabil I,Attia N,et al.The Effect of bone marrow-derived mesenchymal stem cells and their conditioned media topically delivered in fibrin glue on chronic wound healing in rats.Biomed Res Int,2015,2015:846062.
[6]Shishatskaya EI,Nikolaeva ED,Vinogradova ON,et al.Experimental wound dressings of degradable PHA for skin defect repair.J Mater Sci Mater Med,2016,27(11):165.
[7]Wang H,Yan X,Shen L,et al.Acceleration of wound healing in acute full-thickness skin wounds using a collagen-binding peptide with an affinity for MSCs.Burns Trauma,2014,2(4):181-186.
[8]Yang S,Huang S,Feng C,et al.Umbilical cord-derived mesenchymal stem cells:strategies,challenges,and potential for cutaneous regeneration.Front Med,2012,6(1):41-47.
[9]Azari O,Babaei H,Derakhshanfar A,et al.Effects of transplanted mesenchymal stem cells isolated from Wharton's jelly of caprine umbilical cord on cutaneous wound healing; histopathological evaluation.Vet Res Commun,2011,35(4):211-222.
[10]Luo G,Cheng W,He W,et al.Promotion of cutaneous wound healing by local application of mesenchymal stem cells derived from human umbilical cord blood.Wound Repair Regen,2010,18(5):506-513.
[11]Tark KC,Hong JW,Kim YS,et al.Effects of human cord blood mesenchymal stem cells on cutaneous wound healing in leprdb mice.Ann Plast Surg,2010,65(6):565-572.
[12]Liu X,Wang Z,Wang R,et al.Direct comparison of the potency of human mesenchymal stem cells derived from amnion tissue,bone marrow and adipose tissue at inducing dermal fibroblast responses to cutaneous wounds.Int J Mol Med,2013,31(2):407-415.
[13]Heo SC,Jeon ES,Lee IH,et al.Tumor necrosis factor-alpha-activated human adipose tissue-derived mesenchymal stem cells accelerate cutaneous wound healing through paracrine mechanisms.J Invest Dermatol,2011,131(7):1559-1567.
[14]Abd-Allah SH,El-Shal AS,Shalaby SM,et al.The role of placenta-derived mesenchymal stem cells in healing of induced full-thickness skin wound in a mouse model.IUBMB Life,2015,67(9):701-709.
[15]Jun EK,Zhang Q,Yoon BS,et al.Hypoxic conditioned medium from human amniotic fluid-derived mesenchymal stem cells accelerates skin wound healing through TGF-β/SMAD2 and PI3K/Akt pathways.Int J Mol Sci,2014,15(1):605-628.
[16]Lazzarini R,Sorgentoni G,Caffarini M,et al.New miRNAs network in human mesenchymal stem cells derived from skin and amniotic fluid.Int J Immunopathol Pharmacol,2016,29(3):523-528.
[17]Bhasin A,Srivastava MV,Mohanty S,et al.Stem cell therapy:a clinical trial of stroke.Clin Neurol Neurosurg,2013,115(7):1003-1008.
[18]Karamouzian S,Nematollahi-Mahani SN,Nakhaee N,et al.Clinical safety and primary efficacy of bone marrow mesenchymal cell transplantation in subacute spinal cord injured patients.Clin Neurol Neurosurg,2012,114(7):935-939.
[19]Li ZM,Zhang ZT,Guo CJ,et al.Autologous bone marrow mononuclear cell implantation for intracerebral hemorrhage-a prospective clinical observation.Clin Neurol Neurosurg,2013,115(1):72-76.
[20]Wu CC,Sheu SY,Hsu LH,et al.Intra-articular Injection of platelet-rich fibrin releasates in combination with bone marrow-derived mesenchymal stem cells in the treatment of articular cartilage defects:An in vivo study in rabbits.J Biomed Mater Res B Appl Biomater,2016 Apr 29.[Epub ahead of print]
[21]Wang Z,Liang DC,Bai JY,et al.Overexpression of Sox9 gene by the lentiviral vector in rabbit bone marrow mesenchymal stem cells for promoting the repair of cartilage defect.China J Orthop Traumatol,2015,28(5):433-440.(in Chinese)王震,梁大川,白洁玉,等.慢病毒介导的Sox9基因在兔骨髓间充质干细胞的过表达促进软骨损伤修复.中国骨伤,2015,28(5):433-440.
[22]Zhu S,Zhang B,Man C,et al.Combined effects of connective tissue growth factor-modified bone marrow-derived mesenchymal stem cells and NaOH-treated PLGA scaffolds on the repair of articular cartilage defect in rabbits.Cell Transplant,2014,23(6):715-727.
[23]Ma XW,Cui DP,Zhao DW.Vascular endothelial growth factor/bone morphogenetic protein-2 bone marrow combined modification of the mesenchymal stem cells to repair the avascular necrosis of the femoral head.Int J Clin Exp Med,2015,8(9):15528-15534.
[24]Zhu K,Lai H,Guo C,et al.Novel vascular endothelial growth factor gene delivery system-manipulated mesenchymal stem cells repair infarcted myocardium.Exp Biol Med (Maywood),2012,237(6):678-687.
[25]Wu X,Huang L,Zhou Q,et al.Effect of paclitaxel and mesenchymal stem cells seeding on ex vivo vascular endothelial repair and smooth muscle cells growth.J Cardiovasc Pharmacol,2005,46(6):779-786.
[26]Liu J,Han Z,Han Z,et al.Mesenchymal stem cell-conditioned media suppresses inflammation-associated overproliferation of pulmonary artery smooth muscle cells in a rat model of pulmonary hypertension.Exp Ther Med,2016,11(2):467-475.
[27]Ebrahimi B,Eirin A,Li Z,et al.Mesenchymal stem cells improve medullary inflammation and fibrosis after revascularization of swine atherosclerotic renal artery stenosis.PLoS One,2013,8(7):e67474.
[28]Zhao GF.Study on the mechanism of repairing skin injury of umbilical cord mesenchymal stem cells and their progeny.Changchun:Jilin University,2016.(in Chinese)赵贵芳.脐带间充质干细胞及其来源外泌体修复皮肤损伤的机制研究.长春:吉林大学,2016.
Effects of microenvironment produced by human pMSC on the proliferation of cardiomyocytes
ZHANG Yi,CHEN Liang,LI Ping,XU Hui-li,WANG Zhe,WU Ting,ZHANG Cheng-yu
ObjectiveTo investigate the effect of microenvironment created by human placental mesenchymal stem cells (pMSC) on the proliferation of cardiomyocytes.MethodsThe cultured medium of pMSC was used to simulate the microenvironment produced by pMSC and co-culture with cardiomyocytes (H9C2) through the method of transwell experiment (the microenvironment group).At the same time,the DMEM medium containing 10% FBS and pMSC/H9C2 transwell group were treated as blank and positive control,respectively.After 72 h,the cell proliferation and morphology were observed under microscope.Then H9C2 cells were digested by trypsin to plant 96-well plate with cell concentration of 5×106/ml.CCK8 test was carried out at 24 and 48 h after cell seeding,respectively.ResultsCompared with the control group,H9C2 cells grew more rapidly in the microenvironment group after 72 h of co-culture.The density of H9C2 reached 80%,significantly higher than that in the control group.There was no significant difference between the medium group and pMSC group.CCK8 cell proliferation assay at 24 and 48 h showed that the values of the microenvironment group and the pMSC group were significant higher than that in the control (P < 0.01).Significant difference was observed betweenthe microenvironment group and pMSC group at 24 h (P < 0.01),while no difference observed between the two groups at 48 h (P >0.05).ConclusionBoth microenvironment and pMSC can promote the cell proliferation of H9C2.The results imply that the microenvironment of pMSC is expected to partly take place of the repair function of pMSC in the myocardial injury field.
Myocytes,cardiac; Cellular microenvironment; Placental mesenchymal stem cells
WU Ting,Email:wuting@shanghaicordblood.org
上海市自然科学基金(16ZR1429200);上海市科委研发平台专项(16DZ2293000);嘉定区工程技术研究中心项目;2016 年上海市专利试点企业项目
200051 上海市脐带血造血干细胞库/上海市干细胞技术有限公司/中国干细胞集团有限公司
伍婷,Email:wuting@shanghaicordblood.org
2016-12-02
10.3969/j.issn.1673-713X.2017.02.009
方法用胎盘间充质干细胞培养基上清模拟胎盘间充质干细胞微环境,与 H9C2 心肌细胞 transwell 共培养(微环境组),观察其对 H9C2 细胞的生长状态、细胞增殖影响情况。同时设置 10% FBS 的 DMEM 为空白对照、pMSC/H9C2 transwell 共培养为阳性对照(pMSC 组),倒置显微镜观察心肌细胞增殖状态;共培养 72 h 后将 H9C2 胰酶消化按5×106/ml 每孔进行 96 孔板铺板,分别在 24 和 48 h 进行 CCK8 细胞增殖检测。
结果与对照组相比,胎盘间充质干细胞培养基上清与心肌共培养 72 h 后心肌细胞密度达到 80% 以上,显著高于对照组,与 pMSC 组无明显差异。共培养处理后的心肌细胞培养 24 和 48 h 增殖结果均显示,微环境组与 pMSC 组心肌细胞增殖高于对照组,差异极显著(P < 0.01),24 h 增殖结果显示 pMSC 组与微环境组心肌细胞增殖差异极显著(P < 0.01),而 48 h 增殖结果显示 pMSC 组与微环境组心肌细胞增殖差异不显著(P > 0.05)。
结论胎盘间充质干细胞微环境与胎盘间充质干细胞对心肌细胞的增殖均具有显著的促进作用,提示胎盘间充质干细胞微环境有望部分替代胎盘间充质干细胞的心肌损伤修复治疗功能。
Author Affiliation:Shanghai Cord Blood Bank/Shanghai Stem Cell Technology Co.,Ltd./China Stem Cell Group Co.,Ltd.,Shanghai 200051,China
