辛烯基琥珀酸多糖酯的制备、性质及在食品工业中的应用
2017-04-14孟凡冰李云成刘达玉张盛林
孟凡冰,李云成,钟 耕,刘达玉,*,张盛林,张 崟
(1.成都大学药学与生物工程学院,四川成都 610106;2.食品加工与应用四川省高校重点实验室,四川成都 610106;3.西南大学食品科学学院,重庆 400715;4.重庆西大魔芋科技开发有限公司,重庆 400715)
辛烯基琥珀酸多糖酯的制备、性质及在食品工业中的应用
孟凡冰1,2,李云成1,2,钟 耕3,刘达玉1,2,*,张盛林4,张 崟1,2
(1.成都大学药学与生物工程学院,四川成都 610106;2.食品加工与应用四川省高校重点实验室,四川成都 610106;3.西南大学食品科学学院,重庆 400715;4.重庆西大魔芋科技开发有限公司,重庆 400715)
在众多的多糖类高分子表面活性剂中,以辛烯基琥珀酸酐(Octenyl Succinic Anhydride,OSA)为酯化剂,对高分子多糖进行疏水改性,得到的辛烯基琥珀酸多糖酯(OS-多糖酯)具有优良的乳化、增稠及成膜性能,因而受到研究者的广泛关注,特别是作为乳化稳定剂、增稠剂、微胶囊壁材,在食品工业中具有广阔的应用前景。本文就OS-多糖酯制备、结构测定、理化与功能性质及其应用展开了论述,并对未来研究方向进行了展望。
辛烯基琥珀酸多糖酯,表面活性剂,制备,性质,应用
高分子多糖具有来源丰富、安全、可再生等特点,也是食品中十分常见的一种成分。高分子多糖具有很好的亲水性,通过疏水改性后可赋予其良好的亲脂性。与其他高分子表面活性剂(polymeric surfactants)相比,多糖类高分子表面活性剂(polysaccharide surfactants)不但具有较好的表面活性,同时在较低浓度水溶液中能呈现出较高的粘度,可以形成一定程度的不可逆吸附界面。除此之外,多糖类高分子表面活性剂还具有生物相容性、可降解性、可再生性、来源广泛、价格低廉等特点,因而越来越受到研究者的青睐,也已经广泛的应用于食品、化妆品、制药等领域。
在众多的多糖类高分子表面活性剂中,以辛烯基琥珀酸酐(Octenyl Succinic Anhydride,OSA)为酯化剂,对高分子多糖进行疏水改性,得到的辛烯基琥珀酸多糖酯(OS-多糖酯)具有优良的乳化、增稠、及成膜性能,因而受到研究者的广泛关注。辛烯基琥珀酸酐是一种是链式烯基琥珀酸(图1),工业上主要由石油裂解的烯烃和顺丁烯二酸酐在一定的条件下反应制得[1]。其分子链上含有羧酸酐基团以及碳碳双键,其化学反应活性很高,可发生酯化、取代、还原、加成、聚合等反应。
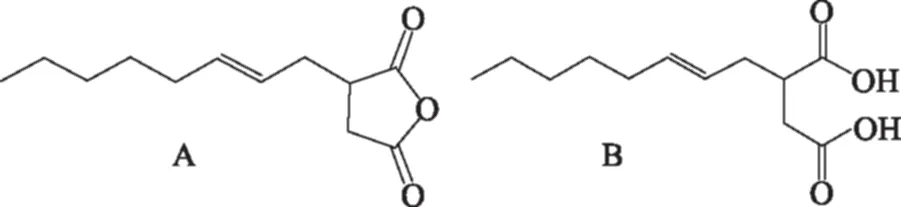
图1 辛烯基琥珀酸酐(A)和辛烯基琥珀酸(B)的结构[1]Fig.1 The structure of octenyl succinic anhydride(A)and octenylsuccinate(B)[1]
1 辛烯基琥珀酸多糖酯的制备
高分子多糖中含有大量的羟基,可与OSA分子上的羧基发生脱水缩合而生成多糖酯。由于OSA具有疏水性基团,引入到亲水性的多糖后,可使产物具有两亲性,在O/W乳液的两相界面上形成一层厚而坚韧的连续界面,表现出良好的乳化性能及乳化稳定性。例如研究表明,辛烯基土豆淀粉酯能够吸收40 mg/m2的阳离子油滴[2],辛烯基玉米淀粉酯可吸收370 mg/m2的薰衣草精油[3]。
目前,利用OSA改性的多糖包括淀粉[4-6]、糊精[7]、果胶[8]、瓜尔胶[9-10]、阿拉伯胶[10]、魔芋葡甘聚糖[11]、燕麦葡聚糖[12]、透明质酸[13]、纤维素[14]、菊粉多糖[15]、植物多糖[16]等。其中,以辛烯基琥珀酸淀粉酯(Octenyl Succinic Anhydride Modified Starch,OSAS)的研究居多[6]。以辛烯基琥珀酸酐(OSA)为酯化剂,通过其羧基与多糖分子的羟基发生脱水缩合反应形成酯键从而得到OS-多糖酯,该反应也属于可逆反应,酯化反应的同时伴随有水解反应。以淀粉为例,在碱性条件下,OSA的环被打开,一端的酯键与羟基结合,另一端生成羧酸[6]。生成的羧酸致使反应体系的pH下降,为了使反应持续进行,需向体系中不断的加入碱液(见图2)。多糖的分子结构以及反应条件直接影响OSA取代度,进而影响OS-多糖酯的表面性能[5,18]。常用的OS-多糖酯的合成方法包括水相法、干法、有机溶剂法。
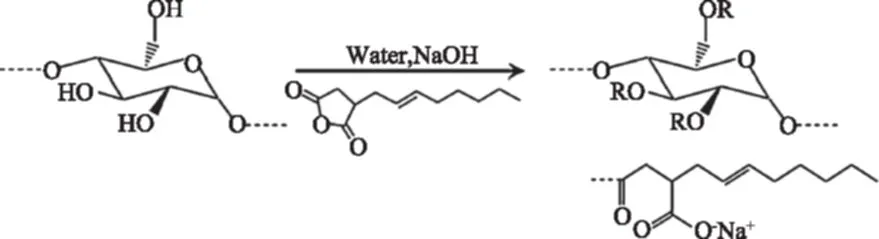
图2 辛烯基琥珀酸淀粉酯的制备原理[6]Fig.2 Preparation of the OSAS[6]
1.1 水相法
水相法是制备食品级OS-多糖酯的常用方法,该方法以水为介质,又称湿法。在水相法制备过程中,需用NaOH或Na2CO3将反应体系的pH调至8~10,然后在一定温度下向体系中缓慢加入OSA,同时用NaOH或Na2CO3中和产生的酸,以保持反应体系微碱性。反应完成后,用酸调节反应体系的pH至6.5左右,然后经过滤、洗涤、干燥即得到产品[7,19]。影响水相法酯化反应效率的因素主要包括OSA的用量、体系pH、反应温度、反应时间等。不同来源的多糖对这些反应条件的需求有所差异。据文献报道,辛烯基琥珀酸淀粉酯的最适反应温度为35 ℃左右,辛烯基琥珀酸糊精酯的最适反应温度在40 ℃左右,而辛烯基琥珀酸豆渣膳食纤维酯的最适反应温度在45~55 ℃[19]。
由于酸酐及一些多糖(如淀粉)多不溶或难溶于水,因此水相法制备OS-多糖酯的反应较缓慢[20]。研究者们试图通过改变一些工艺条件,以提高OSA多糖酯的合成效率。例如将淀粉适度降解后制成糊精,然后利用OSA改性生成OSA糊精酯,该方法既可一定程度上解决原料溶解性的问题,同时还能改善因OSA淀粉酯粘度过高而带来的活性成分微胶囊效率低等问题[7]。Xu等[21]利用脂肪酶催化OSA淀粉酯的酯化反应过程,所得产物的性质与普通水相法获得的产物的性质几乎没差异,但其反应时间由原来的数小时缩短至30 min。淀粉在经OSA改性前,通过物理方法将其颗粒结晶度适度破坏,可增加OSA与淀粉的接触面积,从而提高酯化反应的效率[22]。Chen等[23]研究表明,利用水热预处理淀粉后,可显著提升OSA与淀粉的反应效率,主要是因为水热预处理后,淀粉的晶态与非晶态发生一定程度的转变,从而使淀粉颗粒的溶胀性、溶解性、糊化特性、颗粒形貌等发生改变。Wang等[20]利用高速剪切的方法促进OSA与淀粉的反应,在高速剪切条件下,淀粉颗粒表面结构受到破坏,同时OSA液滴变小[24],故OSA更易进入淀粉颗粒内部,从而使酯化反应更易均匀的发生。超声处理虽不能对淀粉的晶型造成影响,但能够促进OSA向淀粉内部的扩散,因此也能极大的提高酯化反应效率[25]。
1.2 干法
目前文献报道的干法主要用来制备辛烯基琥珀酸淀粉酯,将淀粉与一定量的碱(如磷酸钠、碳酸钠等)混合,然后处理至水分含量为5%~25%,喷入事先用有机溶剂稀释好的OSA,混匀后加热反应;另外一种操作方式是先将原料悬浮于质量分数为1%的NaOH溶液中,过滤后将淀粉干燥至一定的含水量,然后喷入OSA,混匀并加热进行反应。与湿法制备相比,干法制备反应过程更加的简便和节能。Kim等[26]在高温(130~150 ℃)、低pH(3~5)以及较低水分含量(7%~10%)条件下对淀粉进行OSA改性,改性后的产品被开发成脂肪替代品。然而,由于该方法的制备条件比较苛刻,例如温度较高、pH较低等,原料不可避免会发生降解,这也是干法的一个缺点。最近Chen等[27]在常温下利用干法制备OSA淀粉酯的方法,虽避免了高温对原料的损害,但该方法反应时间较长(约20 h)。另外,在干法制备过程中,还需注意原料的混合要均匀,这样才能保证反应充分。近年来,随着合成技术发展,国内外出现了利用微波辅助半干法法合成OSA淀粉酯的报道。微波法辅助最大的优点就是反应速度快、合成效率高,因此具有极大的开发价值。Rivero等[28]利用微波半干法进行制备OSA淀粉酯,反应仅需5~7 min就能获得理想取代度的OSA淀粉酯。Meng等[11]利用微波半干法制备辛烯基琥珀酸魔芋葡甘聚糖酯(KGOS),反应时间为22 min,得到的KGOS具有比OSAS更好的乳化能力和乳化稳定性。
1.3 有机溶剂法
有机溶剂法与水相法相似,但它是以惰性有机溶剂(丙酮、苯等)作为反应介质,加入原料和OSA进行反应,同时加入嘧啶等碱性有机溶剂或者无机碱性溶液来维持反应体系的碱性,反应到一定程度后,再经过中和、洗涤、干燥即可得到产品。Bhandari等[29]利用吡啶回流法制备OSA玉米淀粉酯,反应中有机溶剂吡啶还可以活化淀粉分子,起到催化剂的作用,加速酯化反应的进行;该反应过程不会造成淀粉分子的降解。有机溶剂法的酯化效率和所得产品的取代度较高,但该过程成本较高,同时有机溶剂会对环境造成污染。另外,有机溶剂大多有毒性,从而限制了其产品在食品、医药、化妆品等领域的应用。最近Wang等[30]以5∶1的比例加入吡啶和淀粉于250 mL锥形瓶中边搅拌边加入OSA,调节pH,在85 ℃保持2 h,制得不同取代度的淀粉酯,然后将其用超纯水和70%的乙醇进行洗涤,最后得到的产品用于结肠靶向给药。但该研究并未关注有机溶剂残留等带来的安全问题。
2 辛烯基琥珀酸多糖酯的结构测定
2.1 支链度的测定
多糖支链度(degree of branching,DB)是指多糖分子中分支点占总糖苷键的百分数[6]。多糖分子结构复杂,一般分支较多。支链度和支链的长度对OS-多糖酯的胶体稳定性有着极大的影响[31]。不同来源多糖的支链度不同,在酯化改性过程中,操作方式对产物的支链度影响也较大。目前大多利用核磁共振法(nuclear magnetic resonance,NMR)来测定物质的支链度[6]。对于OS-多糖酯而言,该方法也存在很多局限。其中最主要的就是溶解性的问题,在进行NMR测定时,如果物质能够很好地溶解于重水(D2O)中,得到的NMR图谱才更清晰,才能更准确的计算支链度。然而,大多数淀粉类多糖在水中的溶解度较差,这就为支链度的确定带来了难度。因此科研工作者们对NMR溶剂的使用做了研究[32-33]。由于二甲亚砜(DMSO-d6)对淀粉具有很好的溶解性,因此通常选择它作为溶剂。Hernandez等[33]利用80/20的DMSO-d6/D2O混合溶剂对辛烯基琥珀酸淀粉酯进行溶解,然后利用NMR进行支链度的测定,该方法的关键在于确定DMSO-d6与重水的比例,如果重水没有准确的比例,就会出现溶解度小、图谱不清晰等问题。Tizzotti等[32]利用三氟乙酸(TFA-d1)来溶解辛烯基琥珀酸淀粉酯,该方法快速简单,且1HNMR图谱清晰,可用于支链度的测定。
2.2 取代度的测定
常规的取代度测定方法为滴定法,该方法已经广泛的应用于辛烯基琥珀酸淀粉酯[34]、辛烯基琥珀酸糊精酯[7]等物质的取代度测定上。然而,滴定法的精确性一直备受质疑,其中一个主要原因是多糖分子量大,往往以聚合物的形式存在,从而很难准确判定滴定终点。另外,物质本身的性质,如溶解性、增稠性、易降解性等也会在很大程度上影响滴定法的适用性和准确性。
随着现代仪器分析方法的发展,一些新的仪器分析手段逐渐应用于OS-多糖酯取代度的测定上,其中常用的方法有变换红外光谱法(FTIR)、液相色谱法(HPLC)、核磁共振法(NMR)等。多糖经酯化改性后,分子的红外光谱图上出现C=O的伸缩振动峰和羧基振动峰,理论上,C=O伸缩振动峰与取代度成线性关系,可用于取代度的计算。然而,FTIR只适合取代度较高(DS≥3)的多糖酯取代度的计算[35],对于低取代度物质不适用。HPLC法在近年来被开发出来用于测定辛烯基琥珀酸淀粉酯的取代度,首先测定出改性物质中游离的辛烯基琥珀酸根含量,然后将改性物质通过水解释放出酸根,测定出总酸根的含量,最后通过计算得出取代度[36]。该方法最大的优点就是避免了未洗除的OSA对结果的影响。利用NMR进行OS-多糖酯取代度测定,主要是通过分析OS内部质子的信号强度估算DS。NMR法分析时所需样品用量少(2~5 mg),同时还可进行DB的测定。同样,其使用范围与淀粉的溶解度有关。同时,OS-多糖酯的两亲性使其容易在溶液中形成自聚集结构,从而影响NMR图谱的峰面积,使DS计算错误[37]。
2.3 分子量的测定
高分子多糖及其改性物的分子结构测定是一个复杂的过程,需要若干的参数才能对其结构进行预测,其中分子量测定是最重要的参数。Chung等[38]报道了用分子聚合度来估算分子平均质量的方法,其原理是利用强碱将多糖进行完全水解,然后测定单糖的含量,从而计算出平均分质量。但对于OSA改性多糖而言,游离的OSA和分子上的OS基团会影响单糖的测定,从而使结果不准确。除此之外,光散射、尺寸排阻色谱(size exclusion chromatography,SEC)等方法也广泛的应用于多糖分子量的测定。SEC法是利用了聚合物大小不同,通过凝胶色谱柱的时间不同将物质进行分离,然后利用分子量不等的、单分散的试样作为标准品,从而计算出物质的分子质量分布。由于SEC法所使用的色谱柱不具普适性,从而限制了该方法的应用。另外,非对称流场流技术(asymmetric flow field-flow fractionation,AF4)等其他用于聚合物结构分析的技术,也逐渐应用与OSA改性多糖酯结构的预测上[2]。相信随着这些技术的发展及推广,未来在多糖及其改性物分子结构的表征方面,会越来越简单易行。
3 辛烯基琥珀酸多糖酯的理化性质
与蛋白类高分子表面活性剂相比,OS-多糖酯的表面活性受pH和离子的影响较小,Charoen等[39]对比了乳清蛋白和OSAS与乳清蛋白对米糠油的乳化效果,结果表明辛烯基琥珀酸淀粉酯乳液对pH、盐离子、温度更稳定。冯韬霖等[40]研究表明,经辛烯基琥珀酸改性后的羟乙基纤维素较原料本身的乳化能力以及冻融稳定性均得到有效提高,且其乳化性质不受pH的影响。正是由于OS-多糖酯具有优良的乳化能力及乳化稳定性,因此也应用于疏水化合物的固体微胶囊领域,如药物及营养物质的缓释[6,40-41]。经OSA改性后的淀粉酯,对挥发性肉类香气成分的包裹能力要优于β-环糊精[42];辛烯基琥珀酸羟乙基纤维素酯对大豆油的包埋率能超过93%[40];而辛烯基琥珀酸β-葡甘聚糖酯可显著提高姜黄素在水溶液中的溶解度[43]。另外,经辛烯基改性后的多糖酯,其粘度可得到一定程度的改善,产物经糊化后不易回生,粘度也较稳定[1],因此OS-多糖酯也常作增稠剂使用。经改性后,辛烯基琥珀酸羟乙基纤维素酯的表观粘度可提高1.6倍[40]。
4 辛烯基琥珀酸多糖酯的营养与安全
有关OS-多糖酯的安全性研究主要集中在OSAS上,OSAS也是目前唯一实现工业化生产的OS-多糖酯。美国食品药品管理局(Foodand Drug Administration,FDA)规定在OSAS的制备过程中,OSA的反应量不能超过干淀粉重量的3%(w/w)。OSAS呈白色粉末状,无毒无异味[6],已被美国、欧洲及亚太地区的主要国家批准使用。联合国粮农组织和世界卫生组织(FAO/WHO)评价其日允许摄入量无需特殊规定,可将其用于食品,使用范围没有限制。欧盟还允许将OSA改性淀粉添加到婴幼儿食品中[44]。我国政府于1997年批准OSAS可作为食品添加剂使用,2001年进一步扩大了该产品在食品中使用的范围,其用量可按需添加。Mahadevan等[44]利用新生仔猪研究了OSA改性淀粉毒性,经过三周饲喂含OSA改性淀粉的饲料,发现并没有对仔猪的生长和临床病理参数造成影响。
经辛烯基琥珀酸酐改性后,淀粉的消化性及功能性可能会发生改变。与淀粉的其他改性(如羟丙基化、乙酰化、交联化)相比,经OSA改性后的淀粉的在消化系统中的消化速率减慢,且取代度越高,消化速率越慢[39]。而慢消化淀粉和抗消化淀粉对人体健康有益,如预防便秘、直肠癌、糖尿病、肥胖症等。体外实验表明,经OSA改性后的蜡质玉米淀粉比原淀粉更抗消化,同时体内血糖反应实验证明,高取代度的H-OSAS具有延迟血糖峰值、降低葡萄糖峰值浓度的功能[45]。Heacoc等[46]通过人体实验进一步证明了OSA改性淀粉具有延迟血糖的功能,该研究表明,OSA改性淀粉能降低血浆葡萄糖和胰岛素的峰值浓度,在对照组中,氢呼吸实验呈阳性的样本增多,故推测OSA改性淀粉在小肠中能抗消化。
对于其他OSA改性多糖酯的安全性及营养功能研究目前报道较少,而这些多糖可能比淀粉更适合于开发高分子表面活性剂,或具有更高的利用价值。例如杨静等[47]开发出一种辛烯基琥珀酸大蒜多糖酯,其产品具有较好的乳化效果,同时也保持了大蒜多糖的一些功能性质,但大蒜多糖原料价格较高,故使用范围受到一定限制。Zhang等[15]利用OSA改性菊粉多糖,其产品具有很好的抗金黄色葡萄球菌和大肠杆菌的功能。
5 辛烯基琥珀酸多糖酯在食品工业中的应用
食品的成分十分复杂,通常含有大量的水分、蛋白质、碳水化合物、脂肪,以及一些盐离子等,因此体系较难达到稳定。另外,由于天然食品的质地参差不齐,而一些表面活性剂,如一些天然多糖及蛋白质等,兼有改变和调节食品品质的作用,例如改变食品的流变学性质、纹理、泡沫、结晶现象等。因此,表面活性剂在食品工业上受到广泛的应用。OSA改性多糖酯主要是作为乳化剂、增稠剂和微胶囊壁材加以应用,尤其是OSAS已经被广泛地应用于食品、医药、化妆品等诸多领域[6]。
5.1 用作乳化稳定剂
由于高分子表面活性剂具有疏水基团和亲水基团,易在油/水界面上形成吸附层,降低各体系的表面张力,使之呈分散体或乳化体。OS-多糖酯为非离子型表面活性剂,其在溶液中具有较高的乳化稳定性。同时,OS-多糖酯亲水与疏水基团较多,能够在油/水界面上形成一层厚厚的不规则吸附层,从而进一步增强了乳液的稳定性[6]。OS-多糖酯的乳化稳定性与OSA的取代度和多糖自身的分子结构有着密切关系。一般情况下,取代度越高,其乳化能力和乳化稳定性越好[6,49]。在取代度相近的情况下,多糖分子量越大,支链越复杂,其改性物的乳化稳定性越好。Meng等[11]研究了辛烯基琥珀酸魔芋葡甘聚糖酯(KGOS)对玉米油乳液的乳化稳定性(贮藏后乳液的高度与贮藏前乳液的高度比),结果表明,当KGOS的添加量分别为0.5 g和1 g时,经过90 d贮藏,其乳化稳定性分别为98.14%和100%。与添加相同量的OSAS样品相比,KGOS乳液的稳定性要明显好于OSAS乳液,这可能就是因为魔芋葡甘聚糖自身分子结构较淀粉更加复杂。Mao等[48]将OSAS应用于制备β-胡萝卜素乳液,与乳清蛋白相比,OSAS具有更优良的乳化稳定性且对环境条件影响更小。Charoen等[39]研究了不同乳化剂对米糠油的乳化稳定性影响。结果表明,乳清蛋白所形成的乳液稳定性最差,瓜尔豆胶乳液稳定性较好,高取代度的OSAS乳液稳定性最好。
5.2 用作增稠剂
增稠剂的添加主要用于改善和增加食品的粘稠度,保持流态食品、胶冻食品的色、香、味及稳定性;改善食品物理性状,赋予食品黏润、适宜的口感,并兼有乳化、稳定或使呈悬浮状态的作用。除此之外,增稠剂在特殊食品加工中也发挥了重要作用,例如有吞咽困难病人的食物制作过程中,增稠剂的加入可使流体食物保持“丝滑”,从而利于病人对食物的吞咽[51]。目前我国批准使用的增稠剂有近40个品种,其中高分子多糖及其衍生物是使用最多的增稠剂之一。高分子多糖经OSA改性后,增稠性往往有一定程度的提升[10,52]。Sarkar等[10]研究表明,阿拉伯胶经OSA改性后,其表观粘度较阿拉伯胶提高了1.12倍;Wang等[20]研究表明,经OSA改性后,OS-玉米淀粉酯的表观粘度显著升高,且在相同反应条件下,取代度越高,产物的粘度越大。正是由于淀粉经OSA改性后其粘度显著升高,因此常用在色拉油调味品中,替换常规增稠剂(如淀粉和树胶)和乳化剂,为体系提供一定粘度,同时还能使油形成稳定的乳液,利于长期贮存[53]。
5.3 用作微胶囊壁材
在食品工业中,微胶囊技术主要用于保护活性成分免受环境(如光、温度、pH、氧等)的破坏,改变目标组分的理化性质(如颜色、溶解度、反应特性等),控制活性物质的释放,屏蔽不良气味等。例如,脂肪氧化会产生诸如醛、酮等对人体有害的物质,利用表面活性剂对脂肪进行封装,可有效地防止脂肪的氧化[18]。OSAS已经广泛的应用于鱼油、β-胡萝卜素、精油等活性成分的包裹[6]。Liang等[54]通过OSAS乳化包埋β-胡萝卜素和薄荷油,制备成的纳米乳液具有较好的稳定性和生物利用率。Cheuk等[41]利用OSAS封装辅酶Q10,并将其冷冻干燥,所得产品具有较好的耐热和酸的能力。然而,目前有关其他OS-多糖酯的应用研究关注较少,Liu等[12]制备出OS-β-燕麦葡聚糖酯荷载姜黄素的纳米乳液,增加了姜黄素在溶液中的溶解度,进一步的研究发现,姜黄素在到达结肠时的释放速度最快,有一定的结肠靶向酶解性。Sarkar等[9]利用OSA改性阿拉伯胶并用于封装薄荷油,经过8周的贮存,薄荷油的保留率为64.33%,比未经改性阿拉伯胶的保留率提高约1.1倍。
6 展望
与其他高分子表面活性剂相比,OS-多糖酯具有极大的优越性,因此也受到研究者的广泛关注,特别是作为乳化稳定剂、增稠剂、微胶囊壁材,在食品工业中具有广阔的应用前景。虽然目前对于OS-多糖酯的研究报道很多,但仍有一些不足之处。首先,大多数研究集中在传统合成工艺的优化上,而一些现代合成工艺的研究较少(如微波半干法、超声辅助法、高速剪切法等),但这些工艺较传统工艺合成效率更高,得到的产品稳定性和均一性更好。其次,对于产品的安全性及功能性关注较少,仅有少数的文献研究了OSAS应用于食品及医药领域的毒理学性质以及功能特性,而其他OS-多糖酯产品安全性及营养功能特性的相关报道还极少。第三,对于多糖改性前后的分子结构变化,以及这些变化影响理化及功能性质的机制,仍是目前的研究难点,未来需加大研究。最后,对于辛烯基琥珀酸改性多糖酯的研究主要以淀粉为原料。然而,一些其他的功能性多糖可能比淀粉更适合用于开发高分子表面活性剂,或具有更高的利用价值,因此值得研究和开发。
[1]田李嘉. 维生素E辛烯基琥珀酸酯的分析和合成研究[D]. 太原:太原理工大学,2013.
[2]Nilsson L,Bergenståhl B. Emulsification and adsorption properties of hydrophobically modified potato and barley starch[J]. Journal of Agricultural and Food Chemistry,2007,55(4):1469-1474.
[3]Varona S,Martín,Cocero M J. Formulation of a natural biocide based on lavandin essential oil by emulsification using modified starches[J]. Chemical Engineering and Processing:Process Intensification,2009,48(6):1121-1128.
[4]Jiang S,Dai L,Qin Y,et al. Preparation and characterization of octenyl succinic anhydride modified taro starch nanoparticles[J]. PLoS One,2016,11(2):e0150043.
[5]Whitney K,Reuhs B L,Ovando Martinez M,et al. Analysis of octenylsuccinate rice and tapioca starches:Distribution of octenylsuccinic anhydride groups in starch granules[J]. Food Chemistry,2016,211:608-15.
[6]Sweedman M C,Tizzotti M J,Schäfer C,et al. Structure and physicochemical properties of octenyl succinic anhydride modified starches:A review[J]. Carbohydrate Polymers,2013,92(1):905-920.
[7]Lei D,Liu J,Ye F,et al. Synthesis,characterization and aqueous self-assembly of octenylsuccinic corn dextrin ester with high molecular weight[J]. Food Hydrocolloids,2014,41:250-256.
[8]Chen HM,Fu X,Luo ZG. Esterification of sugar beet pectin using octenyl succinic anhydride and its effect as an emulsion stabilizer[J]. Food Hydrocolloids,2015,49:53-60.
[9]Sarkar S,Gupta S,Variyar P S,et al. Hydrophobic derivatives of guar gum hydrolyzate and gum Arabic as matrices for microencapsulation of mint oil[J]. Carbohydrate Polymers,2013,95(1):177-182.
[10]Sarkar S,Singhal R S. Esterification of guar gum hydrolysate and gum arabic with n-octenyl succinic anhydride and oleic acid and its evaluation as wall material in microencapsulation[J]. Carbohydrate Polymers,2011,86(4):1723-1731.
[11]Meng F B,Zheng L J,Wang Y H,et al. Preparation and properties of konjac glucomannan octenyl succinate modified by microwave method[J]. Food Hydrocolloids,2014,38(4):205-210.
[12]Liu J,Chen F,Tian W,et al. Optimization and characterization of curcumin loaded in octenylsuccinate oat beta-glucan micelles with an emphasis on degree of substitution and molecular weight[J]. Journal of Agricultural and Food Chemistry,2014,62(30):7532-40.
[13]Eenschooten C,Guillaumie F,Kontogeorgis G M,et al. Preparation and structural characterisation of novel and versatile amphiphilic octenyl succinic anhydride-modified hyaluronic acid derivatives[J]. Carbohydrate Polymers,2010,79(3):597-605.
[14]Liu CF,Zhang AP,Li WY,et al. Homogeneous modification of cellulose in ionic liquid with succinic anhydride using N-bromosuccinimide as a catalyst[J]. Journal of Agricultural and Food Chemistry,2009,57(5):1814-1820.
[15]Zhang X,Zhang Y W,Zhang H,et al. Preparation,characterization and antibacterial activity of octenyl succinic anhydride modified inulin[J]. International Journal of Biological Macromolecules,2015,78:79-86.
[16]Scheffler S L,Huang L,Bi L,et al.InVitroDigestibility and emulsification properties of phytoglycogen octenyl succinate[J]. Journal of Agricultural and Food Chemistry,2010,58(8):5140-5146.
[17]Imamura K,Kimura Y,Nakayama S,et al. Characteristics of amorphous matrices composed of different types of sugars in encapsulating emulsion oil droplets during freeze-drying[J]. Food Research International,2013,51(1):201-207.
[18]Sweedman M C,Schafer C,Gilbert R G. Aggregate and emulsion properties of enzymatically-modified octenylsuccinylated waxy starches[J]. Carbohydrate Polymers,2014,111(20):918-927.
[19]杨婧,郑为完,高媛媛,等. 辛烯基琥珀酸豆渣膳食纤维素酯的合成及应用[J]. 食品科学,2013,34(12):86-89.
[20]Wang C,He X,Fu X,et al. High-speed shear effect on properties and octenylsuccinic anhydride modification of corn starch[J]. Food Hydrocolloids,2015,44:32-39.
[21]Xu J,Zhou CW,Wang RZ,et al. Lipase-coupling esterification of starch with octenyl succinic anhydride[J]. Carbohydrate Polymers,2012,87(3):2137-2144.
[22]Zhang Z M,Zhao S M,Xiong S B. Synthesis of octenyl succinic derivative of mechanically activated indica rice starch[J]. Starch-Starke,2010,62(2):78-85.
[23]Chen X,He X,Huang Q. Effects of hydrothermal pretreatment on subsequent octenylsuccinic anhydride(OSA)modification of cornstarch[J]. Carbohydrate Polymers,2014,101:493-8.
[24]Wang C,He X,Huang Q,et al. Distribution of octenylsuccinic substituents in modified A and B polymorph starch granules[J]. Journal of Agricultural and Food Chemistry,2013,61(51):12492-8.
[25]Chen HM,Huang Q,Fu X,et al. Ultrasonic effect on the octenyl succinate starch synthesis and substitution patterns in starch granules[J]. Food Hydrocolloids,2014,35:636-643.
[26]Kim HN,Sandhu K S,Lee J H,et al. Characterisation of 2-octen-1-ylsuccinylated waxy rice amylodextrins prepared by dry-heating[J]. Food Chemistry,2010,119(3):1189-1194.
[27]Chen M,Yin T,Chen Y,et al. Preparation and characterization of octenyl succinic anhydride modified waxy rice starch by dry media milling[J]. Starch-Starke,2014,66(11-12):985-991.
[28]Rivero I E,Balsamo V,Müller A J. Microwave-assisted modification of starch for compatibilizing LLDPE/starch blends[J]. Carbohydrate Polymers,2009,75(2):343-350.
[29]Bhandari P N,Singhal R S. Effect of succinylation on the corn and amaranth starch pastes[J]. Carbohydrate Polymers,2002,48(3):233-240.
[30]Wang X Y,Li X X,Chen L,et al. Preparation and characterisation of octenyl succinate starch as a delivery carrier for bioactive food components[J]. Food Chemistry,2011,126(3):1218-1225.
[31]Sweedman M C,Hasjim J,Schafer C,et al. Structures of octenylsuccinylated starches:Effects on emulsions containing beta-carotene[J]. Carbohydrate Polymers,2014,112:85-93.
[32]Tizzotti M J,Sweedman M C,Tang D,et al. New1H NMR procedure for the characterization of native and modified food-grade starches[J]. Journal of Agricultural and Food Chemistry,2011,59(13):6913-6919.
[33]Hernández J M,Gaborieau M,Castignolles P,et al. Mechanistic investigation of a starch-branching enzyme using hydrodynamic volume SEC analysis[J]. Biomacromolecules,2008,9(3):954-965.
[34]Zhang B,Huang Q,Luo FX,et al. Effects of octenylsuccinylation on the structure and properties of high-amylose maize starch[J]. Carbohydrate Polymers,2011,84(4):1276-1281.
[35]Biswas A,Shogren R,Kim S,et al. Rapid preparation of starch maleate half-esters[J]. Carbohydrate Polymers,2006,64(3):484-487.
[36]Qiu D,Bai Y J,Shi Y C. Identification of isomers and determination of octenylsuccinate in modified starch by HPLC and mass spectrometry[J]. Food Chemistry,2012,135(2):665-671.
[37]Tizzotti M,Creuzet C,Labeau M-P,et al. Synthesis of temperature responsive biohybrid guar-based grafted copolymers by click chemistry[J]. Macromolecules,2010,43(16):6843-6852.
[38]Chung HJ,Lee SE,Han JA,et al. Physical properties of dry-heated octenyl succinylated waxy corn starches and its application in fat-reduced muffin[J]. Journal of Cereal Science,2010,52(3):496-501.
[39]Charoen R,Jangchud A,Jangchud K,et al. Influence of biopolymer emulsifier type on formation and stability of rice bran oil-in-water emulsions:whey protein,gum arabic,and modified starch[J]. Journal of Food Science,2011,76(1):E165-E172.
[40]冯韬霖,郑为完,薛军,等. 辛烯基琥珀酸羟乙基纤维素酯的性质及应用研究[J]. 食品工业科技,2012,33(15):289-292.
[41]Cheuk S Y,Shih F F,Champagne E T,et al. Nano-encapsulation of coenzyme Q10using octenyl succinic anhydride modified starch[J]. Food Chemistry,2015,174:585-590.
[42]Jeon YJ,Vasanthan T,Temelli F,et al. The suitability of barley and corn starches in their native and chemically modified forms for volatile meat flavor encapsulation[J]. Food Research International,2003,36(4):349-355.
[43]Liu J,Li J,Ma Y,et al. Synthesis,characterization,and aqueous self-assembly of octenylsuccinate oatβ-glucan[J]. Journal of Agricultural and Food Chemistry,2013,61(51):12683-12691.
[44]Mahadevan B,Thorsrud B A,Brorby G P,et al. A 3-week dietary safety study of octenyl succinic anhydride(OSA)-modified starch in neonatal farm piglets[J]. Food and Chemical Toxicology,2014,72:83-89.
[45]He J,Liu J,Zhang G. Slowly digestible waxy maize starch prepared by octenyl succinic anhydride esterification and heat-moisture treatment:Glycemic response and mechanism[J]. Biomacromolecules,2007,9(1):175-184.
[46]Heacock P M,Hertzler S R,Wolf B. The glycemic,insulinemic,and breath hydrogen responses in humans to a food starch esterified by 1-octenyl succinic anhydride[J]. Nutrition Research,2004,24(8):581-592.
[47]杨静,王洋,孔祥智,等. 辛烯基琥珀酸大蒜多糖酯的制备[J]. 食品研究与开发,2008,29:184-187.
[48]Mao L K,Yang J,Xu D X,et al. Effects of Homogenization Models and Emulsifiers on the Physicochemical Properties ofβ-Carotene Nanoemulsions[J]. Journal of Dispersion Science and Technology,2010,31(7):986-993.
[49]Bello-Pérez LA,Bello-Flores CA,Nuez-Santiago Mdel C,et al. Effect of the degree of substitution of octenyl succinic anhydride-banana starch on emulsion stability[J]. Carbohydrate Polymers,2015,132:17-24.
[50]Xu Y,Huang Q,Fu X,et al. Modification of starch octenylsuccinate byβ-amylase hydrolysis in order to increase its emulsification properties[J]. Food Hydrocolloids,2015,48:55-61.
[51]Mackley M,Tock C,Anthony R,et al. The rheology and processing behavior of starch and gum-based dysphagia thickeners[J]. Journal of Rheology,2013,57(6):1533-1553.
[52]Mohammadi S,Abbasi S,Scanlon M G. Development of emulsifying property in Persian gum using octenyl succinic anhydride(OSA)[J]. International Journal of Biological Macromolecules,2016,89:396-405.
[53]宋广勋,冯光炷,李和平,等. 辛烯基琥珀酸酐淀粉修饰物的研究进展[J]. 食品研究与开发,2006,27(10):154-157.
[54]Liang R,Shoemaker C F,Yang X,et al. Stability and bioaccessibility of beta-carotene in nanoemulsions stabilized by modified starches[J]. Journal of Agricultural and Food Chemistry,2013,61(6):1249-57.
Preparation,characterization and application of octenyl succinic anhydride modified polysaccharide
MENG Fan-bing1,2,LI Yun-cheng1,2,ZHONG Geng3,LIU Da-yu1,2,*,ZHANG Sheng-lin4,ZHANG Yin1,2
(1.School of Pharmacy and Bioengineering,Chengdu University,Chengdu 610106,China;2.Key Laboratory for Food Processing and Application of Sichuan Colleges,Chengdu 610106,China;3.College of Food Science Southwest Univerdity,Chongqing 400715,China;4.Chongqing Xi Da Konjac Science and Technology Development Co.,Ltd.,Chongqing 400715,China)
Among the polysaccharide surfactants,octenyl succinic polysaccharide esters were received widely attention for researchers due to its excellent emulsifying,thickening,and film forming properties,and broadlyapplicated in the food industry as emulsion stabilizer,thickener,and encapsulating agent. In this paper,the preparation,structure determination,physicochemical and functional properties,and applications in food industrial were reviewed. Moreover,the prospects of further study on octenyl succinic polysaccharide esters were discussed.
octenyl succinic polysaccharide esters;surfactant;preparation;characterization;application
2016-09-02
孟凡冰(1985-),女,博士,讲师,研究方向:碳水化合物资源开发及利用,E-mail:mfb1020@163.com。
*通讯作者:刘达玉(1964-),男,硕士,教授,研究方向:现代食品加工理论与技术,E-mail:liudy1014@163.com。
国家自然科学基金(31601427);重庆市前沿与应用基础研究计划一般项目(cstc2014jcyjA80040);成都大学2016年校青年基金项目(2080516003);肉类加工四川省重点实验室2016年度开放基金项目(16R-9)。
TS207.53
A
1002-0306(2017)06-0363-07
10.13386/j.issn1002-0306.2017.06.061
