微波辅助提取酸浆籽植物甾醇及细胞微观形态观察
2017-04-14葛阳阳
徐 伟,杜 娇,葛阳阳
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076)
微波辅助提取酸浆籽植物甾醇及细胞微观形态观察
徐 伟,杜 娇,葛阳阳
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076)
酸浆甾醇大量存在于酸浆籽油中,采用微波辅助法从其中提取籽油,再皂化、萃取得到酸浆甾醇。响应面法优化酸浆甾醇提取条件,结果表明:在无水乙醇为提取剂条件下,液料比11∶1 mL/g、提取时间7 min、提取温度51 ℃、微波功率500 W,酸浆甾醇得率为1.771 mg/g。将原酸浆籽、乙醇微波辅助提取酸浆籽进行扫描及透射电镜结构观察,可见,酸浆原籽细胞有大量的脂肪颗粒在表面,颗粒饱满;乙醇微波辅助提取酸浆籽细胞壁完全破碎,细胞膜通透性增大,可见大量籽油从细胞中浸出,微波辅助法对酸浆籽甾醇提取效果好。
酸浆籽,植物甾醇,微波辅助提取
植物甾醇(phytosterol or plant sterol)是植物中一种具有多种生理功能的活性成分,主要包括豆甾醇、菜油甾醇、谷甾醇、菜籽甾醇等,其化学结构与胆固醇非常相似[1]。在果蔬类食物、豆类食物、坚果食物中含量较高,主要集中在种子部分[2],植物甾醇可以使血液中总胆固醇(TC)和低密度脂蛋白(LDL)的浓度降低,还具有抗氧化、消炎、抗肿瘤、抑制血小板凝聚以及调节动物生长等功能,在食品、保健品、医药等领域广泛应用[3-5]。人每天从食物中获取的植物甾醇摄入量约为0.31 g,美国食品与药物管理局(FDA)认为,每天摄入1.3 g以上植物甾醇,即可达到降低胆固醇的目的[6-7],由此看来仅从食物中获取不能达到此量,需要额外补充一定量的植物甾醇。
酸浆(Physalisalkekengil),又称红菇娘,黑龙江、吉林、辽宁为主要生长地区[8]。酸浆含有酸浆苦素类、黄酮类、甾醇类等功能成分[9-10],具有清热解毒、利咽化痰、利尿、降血糖等作用[11-13]。近年来,酸浆果汁饮品逐渐被市场认可[14],酸浆籽约占全果重量的20%,酸浆籽有丰富的蛋白质、多糖、必需脂肪酸、维生素等营养成分,还含有环木菠萝烷醇、钝叶醇、禾本甾醇等多种植物甾醇[15-17]。但在酸浆果汁饮品的生产过程中,通常将产生的大量酸浆籽作为废弃物处理[18]。
微波辅助萃取是目前发展迅速的植物天然产物有效成分提取技术[19-20],具有提取效率高、提取速度快等优点,已广泛应用于黄酮、多糖和植物甾醇等有效成分的辅助提取中[21-23]。有关酸浆方面的研究报道主要集中在宿萼和果实方面,对于酸浆籽的研究开发报道较少[24-25]。目前,植物甾醇主要从玉米油、花生油、大豆油中获得,本文是采用废弃资源酸浆籽,利用微波辅助提取的方法,研究酸浆甾醇的最佳提取条件,为酸浆籽开发利用提供一定的技术参考。
1 材料与方法
1.1 材料与仪器
酸浆籽 采自黑龙江依兰县红菇娘基地,酸浆果去宿萼榨汁,过滤出果籽,置于50 ℃恒温鼓风干燥箱中干燥至质量恒定,粉碎过60目筛后备用;胆甾醇标准品 纯度>98%,上海金穗生物有限公司;无水乙醇 天津市西尔斯化工有限公司;氢氧化钾 山东浩中化工科技有限公司;冰乙酸 优品级,天津基准化学试剂有限公司;浓硫酸 衡阳凯信有限公司。
XH-MC-1实验室微波合成(萃取)仪 北京祥鹄科技发展有限公司;FEI Sirion 200型场发射扫描电镜 荷兰FEI公司;723N可见分光光度计 上海精密科学仪器有限公司;R-201旋转蒸发仪 上海申胜生物技术有限公司;HKO4B型摇摆粉碎机 上海市新亚有限公司。
1.2 实验方法
1.2.1 酸浆甾醇的提取 称取6 g的酸浆籽粉末于三口瓶中,加入一定量的提取溶剂,在微波萃取仪上进行提取,提取完毕后,旋转蒸发溶剂,得黄色酸浆籽油;加入浓度为1.5 mol/L的KOH乙醇溶液皂化1 h,用石油醚萃取,旋转蒸发石油醚萃取液至完全蒸干,溶剂回收,得到酸浆甾醇粗提取物,用冰乙酸定容,取一定量样品液进行测定,计算酸浆甾醇的含量,每个样品平行三次取平均值。
1.2.2 酸浆甾醇含量的测定 胆甾醇和植物甾醇均为甾醇类化合物,结构类似,其显色基团在发生颜色反应时是一致的,显色后具有相似的吸收光谱,相近的最大吸收波长,因此选择胆甾醇作为标准品[26-28]。胆甾醇标准储备液的配制:准确称取胆甾醇标准品100 mg,冰乙酸用定容至100 mL;胆甾醇标准使用液的配制:吸取10 mL储备液,用冰乙酸定容至100 mL。准确量取胆甾醇标准使用液0.0、0.5、1.0,1.5、2.0 mL分别置于10 mL试管内,在各管内加入冰乙酸使总体积达到4 mL。沿管壁加入2 mL铁矾显色液,混匀,在20 min内,在575 nm波长下比色,以胆甾醇标准浓度为横坐标,吸光值为纵坐标绘制标准曲线[29]。按照公式计算酸浆甾醇的得率:
式中:Y为酸浆甾醇的得率(mg/g);C为提取样液的浓度(mg/mL);V为提取样液的体积(mL);N为稀释倍数;M为称取酸浆籽的质量(g)。
1.2.3 最佳提取溶剂的确定 取酸浆籽粉末每份6g,以丙酮、无水乙醇、乙酸乙酯、正己烷、石油醚为溶剂,固定条件:液料比10∶1、提取温度50 ℃、提取时间6min、微波功率500W,确定最佳的提取溶剂。
1.2.4 酸浆甾醇提取单因素实验
1.2.4.1 液料比对酸浆甾醇得率的影响 准确称取酸浆籽粉末6g,以1.2.3确定的最佳溶剂为提取剂,固定条件:微波功率500W、提取时间6min、提取温度50 ℃,考察不同液料比(6∶1、8∶1、10∶1、12∶1、14∶1mL/g)对酸浆甾醇得率的影响。
1.2.4.2 提取时间对酸浆甾醇得率的影响 固定条件:液料比10∶1、提取温度50 ℃、微波功率500W,考察不同提取时间(2、4、6、8、10min)对酸浆甾醇得率的影响。
1.2.4.3 提取温度对酸浆甾醇得率的影响 固定条件:液料比10∶1、提取时间6min、微波功率500W,考察提取不同提取温度(30、40、50、60、70 ℃)对酸浆甾醇得率的影响。
1.2.4.4 微波功率对酸浆甾醇得率的影响 固定条件:液料比10∶1、提取时间6min、提取温度50 ℃,考察不同微波功率(300、400、500、600、700W)对酸浆甾醇得率的影响。
1.2.5 响应曲面实验优化 根据Box-Behnken实验设计,在微波辅助提取酸浆甾醇单因素基础上,选取液料比、提取时间、提取温度、微波功率4个影响因素,以酸浆甾醇的得率为考察指标,采用四因素三水平的响应曲面分析方法,并用多元回归分析,拟合二次多项回归模型的Box-Behnken设计。
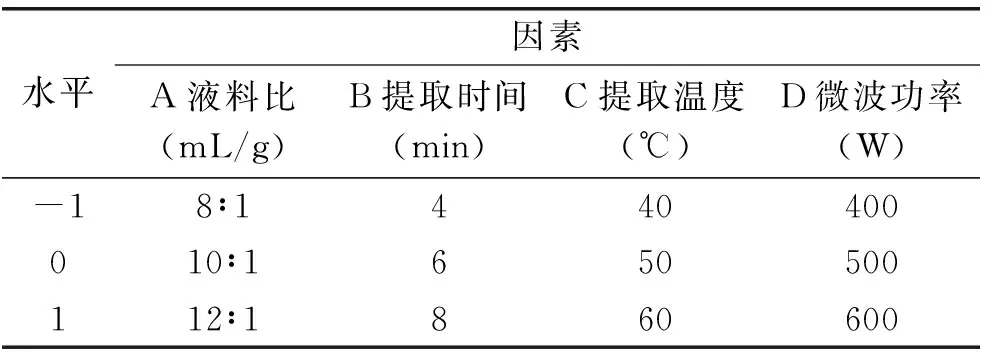
表1 响应面实验因素与水平
1.3 酸浆籽植物细胞电镜观察
取原酸浆籽及乙醇微波辅助提取后酸浆籽粉末,样品经过低温干燥、喷金、抽真空,选用FEI Sirion 200型场发射扫描电镜(加速电压20.0 kV、分辨率为5 nm,放大倍数为1000×)观察酸浆籽表面细胞结构。
取原酸浆籽及乙醇微波辅助提取后酸浆籽粉末,经过2.5%戊二醛前固定、1%锇酸后固定、乙醇脱水、浸透、包埋、聚合等过程制成包埋块,透射显微镜(加速电压:100 kV,放大倍数为1500×)下,观察酸浆籽细胞内部结构。
1.4 数据处理
2 结果与分析
2.1 胆固醇标准曲线的绘制
由图1得到回归方程为:y=3.696x-0.0024,相关系数R2=0.9991,根据方程可知胆甾醇标准曲线的回归性较好,可进行定量分析。
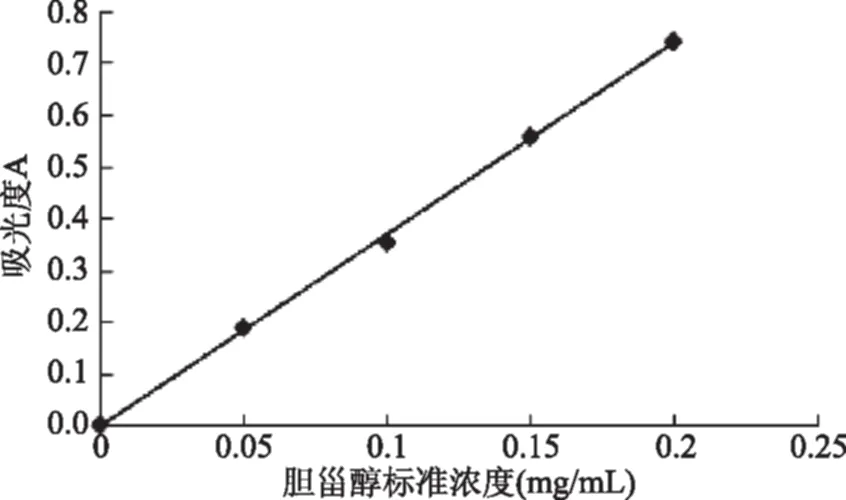
图1 胆甾醇标准曲线Fig.1 Standard curve of cholesterol
2.2 最佳提取溶剂的选择
由图2可知,乙醇和乙酸乙酯的提取率较大,其次是石油醚、丙酮,正己烷的提取效果最差,但实验过程中发现乙酸乙酯溶剂蒸干需要时间较长,因此选择乙醇作提取溶剂。
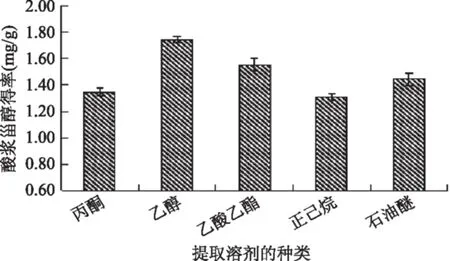
图2 溶剂对酸浆甾醇得率的影响Fig.2 Effect of solvent on extraction efficiency of Physalis alkekengi phytosterol
2.3 单因素实验
2.3.1 液料比对酸浆甾醇得率的影响 由图3所示,液料比达到10∶1之前,酸浆甾醇得率随液料比的增大呈上升趋势,在液料比为10∶1时已达到了提取酸浆甾醇的饱和点,增加溶剂酸浆籽细胞中的其他物质也相继溶出,又影响了酸浆甾醇的溶出。因此,从节省溶剂等因素考虑,液料比应该选择为10∶1。
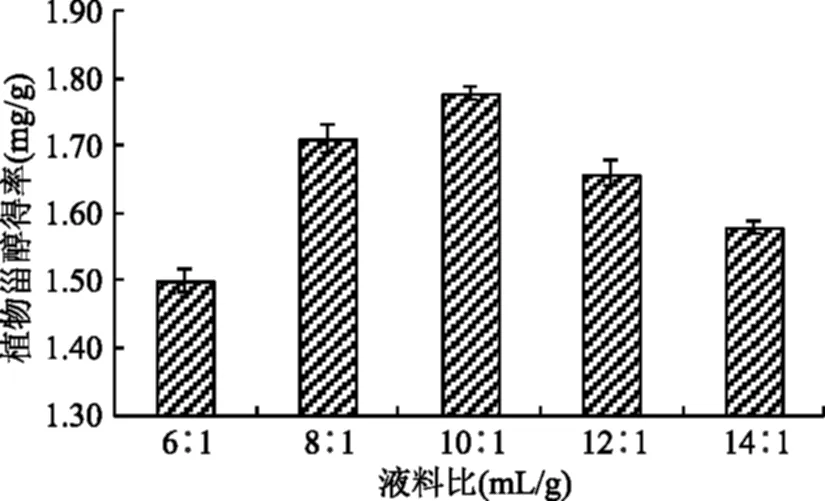
图3 液料比对酸浆甾醇得率影响Fig.3 Effect of solid/solvent ratio on extraction efficiency of Physalis alkekengi phytosterol
2.3.2 提取时间对酸浆甾醇得率的影响 由图4所示,酸浆甾醇得率随时间的增加而产生的变化不同,在6 min之前酸浆甾醇得率随时间的增加而增加,在提取时间为6 min达到最大,这是因为当微波提取时间较短时,酸浆籽细胞内极性分子振动时间较短,导致酸浆甾醇不能完全被萃取出来,因此酸浆甾醇的得率低;增加微波辐射的时间对细胞膜有严重的破碎作用,增加酸浆籽油的溶出,所以酸浆甾醇得率上升较快;当微波辐照时间大于6 min时开始呈下降的趋势,可能是因为酸浆籽长时间进行微波辐射,其籽细胞内的酸浆甾醇被破坏,同时随着其他杂质的溶出,得率不再增加反而呈降低趋势,因此选择提取时间6 min为最佳提取酸浆甾醇的时间。
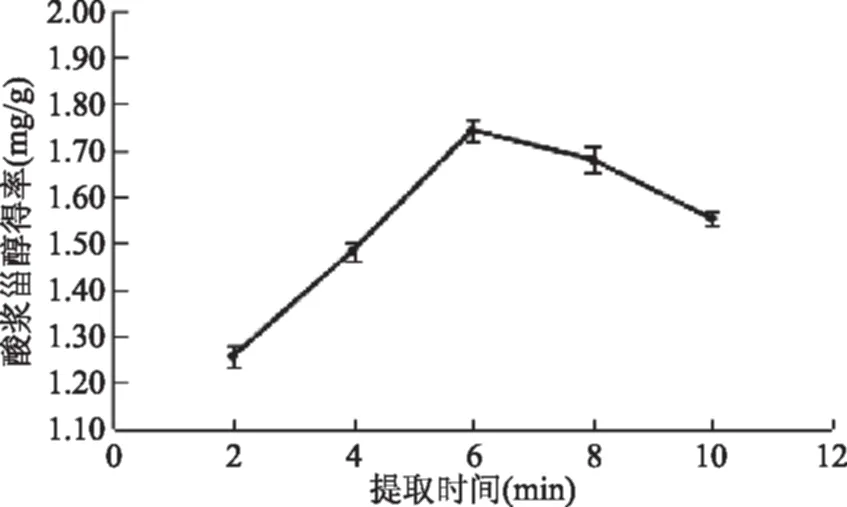
图4 提取时间对酸浆甾醇得率影响Fig.4 Effect of extraction time on extraction efficiency of Physalis alkekengi phytosterol
2.3.3 提取温度对酸浆甾醇得率的影响 由图5可知,酸浆甾醇得率随温度上升而呈明显上升趋势,在提取温度30~40 ℃条件,提取温度低,仅靠微波辐射效应,酸浆籽植物细胞壁破坏程度不大,在提取温度50 ℃时酸浆甾醇得率达到最大,这是因为随着提取溶剂乙醇温度的上升,微波的热效应与辐射效应同时存在,导致细胞结构被破坏,有利于酸浆甾醇的溶出;继续升高加热温度,酸浆甾醇的得率反而降低,是因为温度过高使无水乙醇溶剂汽化,减少了乙醇溶剂与酸浆籽的接触,同时温度较高对酸浆甾醇有一定的破坏作用,从而降低其得率,因此选择提取温度为50 ℃为宜。
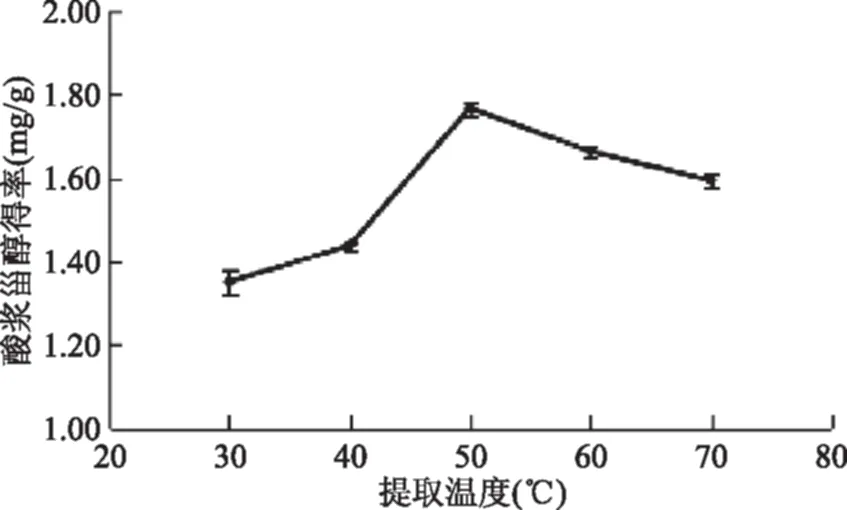
图5 提取温度对酸浆甾醇得率影响Fig.5 Effect of temperature on extraction efficiency of Physalis alkekengi phytosterol
2.3.4 微波功率对酸浆甾醇得率的影响 由图6可知,当微波功率在500 W之前,酸浆甾醇的得率随微波功率增大而呈上升趋势,由于微波功率的增大,导致酸浆籽细胞内极性分子振动加速,增加了酸浆甾醇的释放,故得率增大;增大微波功率在500 W之后,酸浆甾醇得率开始下降,这可能是因为微波的功率达到一定程度时,其他杂质也开始溶解,从而使酸浆甾醇的得率下降,因此选择微波功率为500 W为宜。
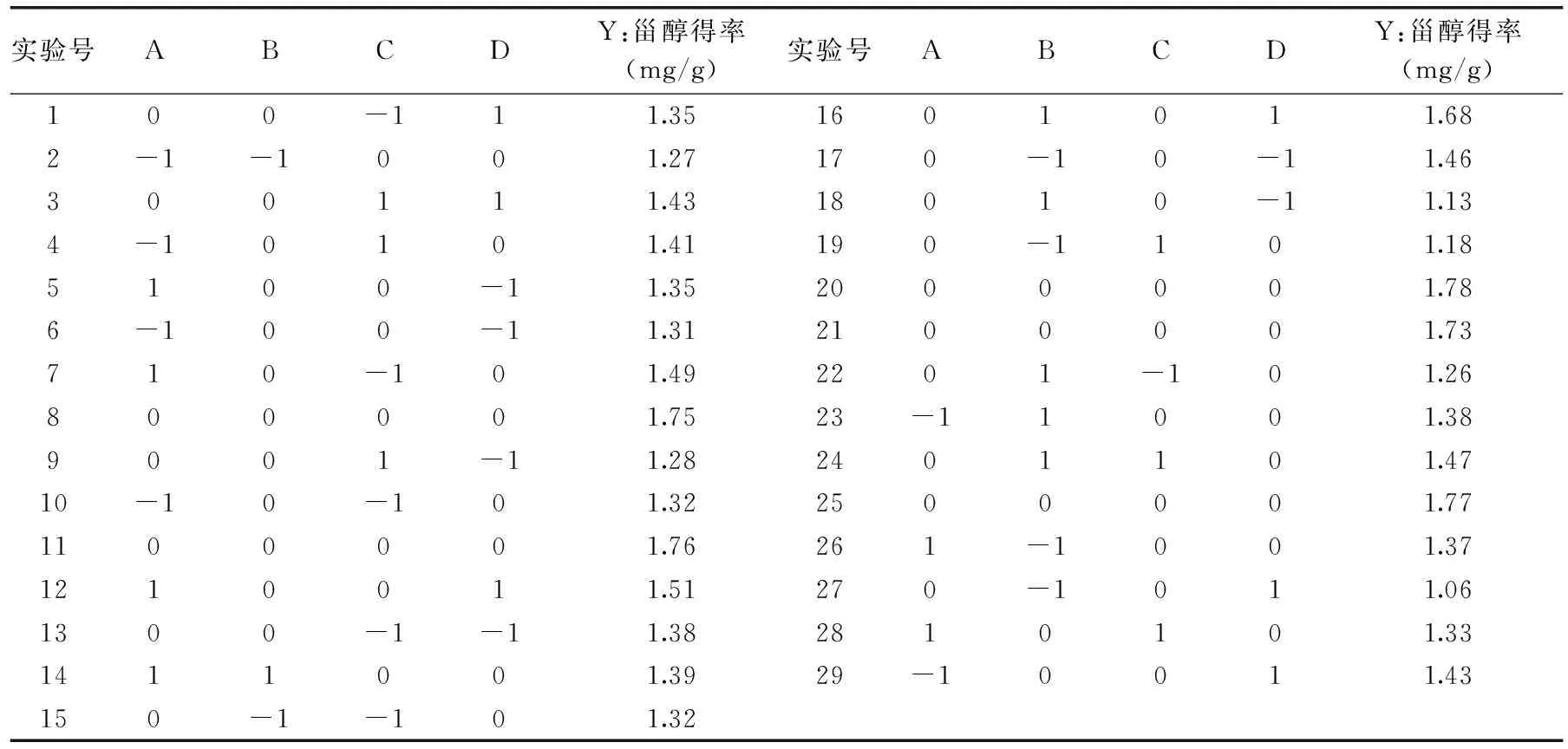
表2 响应面实验设计及结果

图6 微波功率对酸浆甾醇得率影响Fig.6 Effect of microwave output power on extraction efficiency of Physalis alkekengi phytosterol
2.4 响应曲面优化实验结果
对酸浆甾醇提取条件进行响应面分析,其具体结果见表2。
根据响应曲面实验设计,在不同条件下进行酸浆甾醇提取。液料比、提取时间、提取温度、微波功率四个因素对酸浆甾醇得率的影响并非简单的线性关系,用F检验每个变量对响应值影响的显著性,p值越小,响应变量显著性则越高。采用Design Expert 8.0.6.1软件进行二次响应面回归分析,以回归系数酸浆甾醇得率(Y)与液料比(A)、提取温度(B)、提取时间(C)、微波功率(D)四个因子优化得到如下多元二次响应面回归方程:
Y=-10.64+0.020A-0.011B+0.19C+0.48D-1.13AB-6.25AC+5.00AD+4.37BC+0.059BD+2.25CD-1.66A2-0.060B2-2.08C2-0.047D2
对二次多项回归方程进行显著性验证及方差分析,结果见表3。
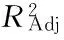
响应曲面图形是对应因素A、B、C、D与特定响应值Y(酸浆甾醇的得率)构成的三维空间在二维平面上的等高线图,通过等高线图可以直观地看出两个变量之间交互作用的显著程度。图并结合表3中p值可知:一次项A、B、D极显著,C不显著,交互项AC、BC、BD、CD极显著,AB和AD不显著,二次项均极显著;表明各因素及两两交互作用对酸浆甾醇得率的影响不是简单的线性关系。
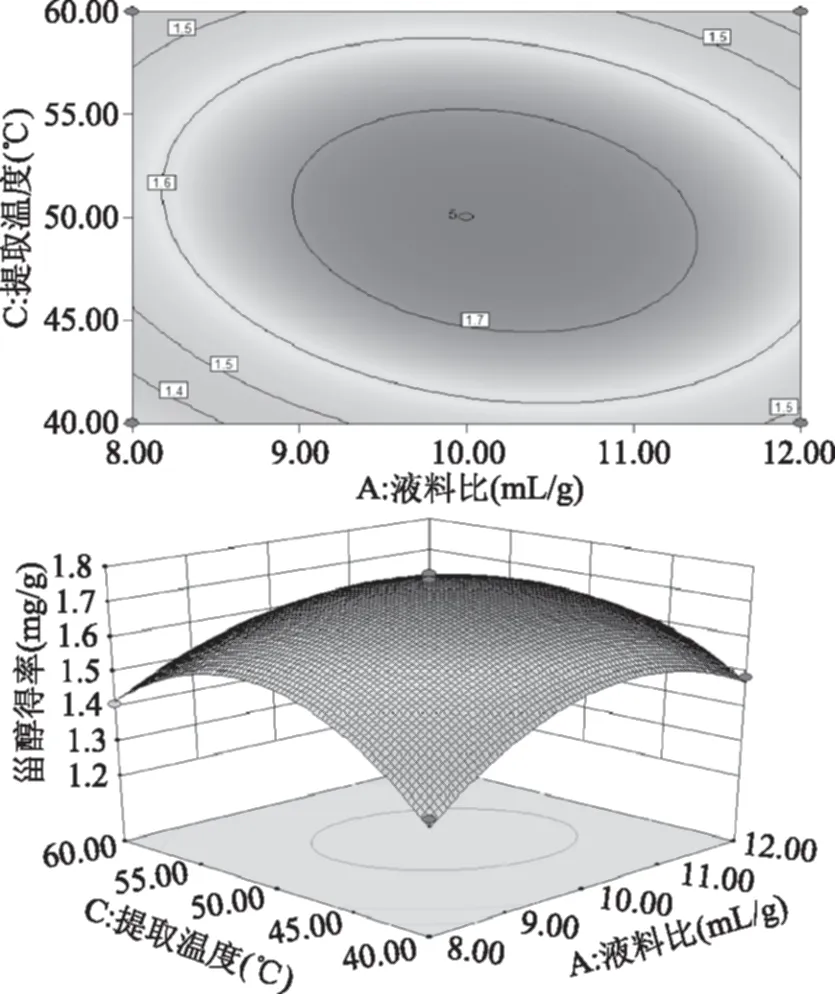
图7 液料比和提取温度交互作用对酸浆甾醇得率影响的响应面图Fig.7 Response surface plots for the effects of solid/solvent ratio and temperature on extraction efficiency of Physalis alkekengi phytosterol
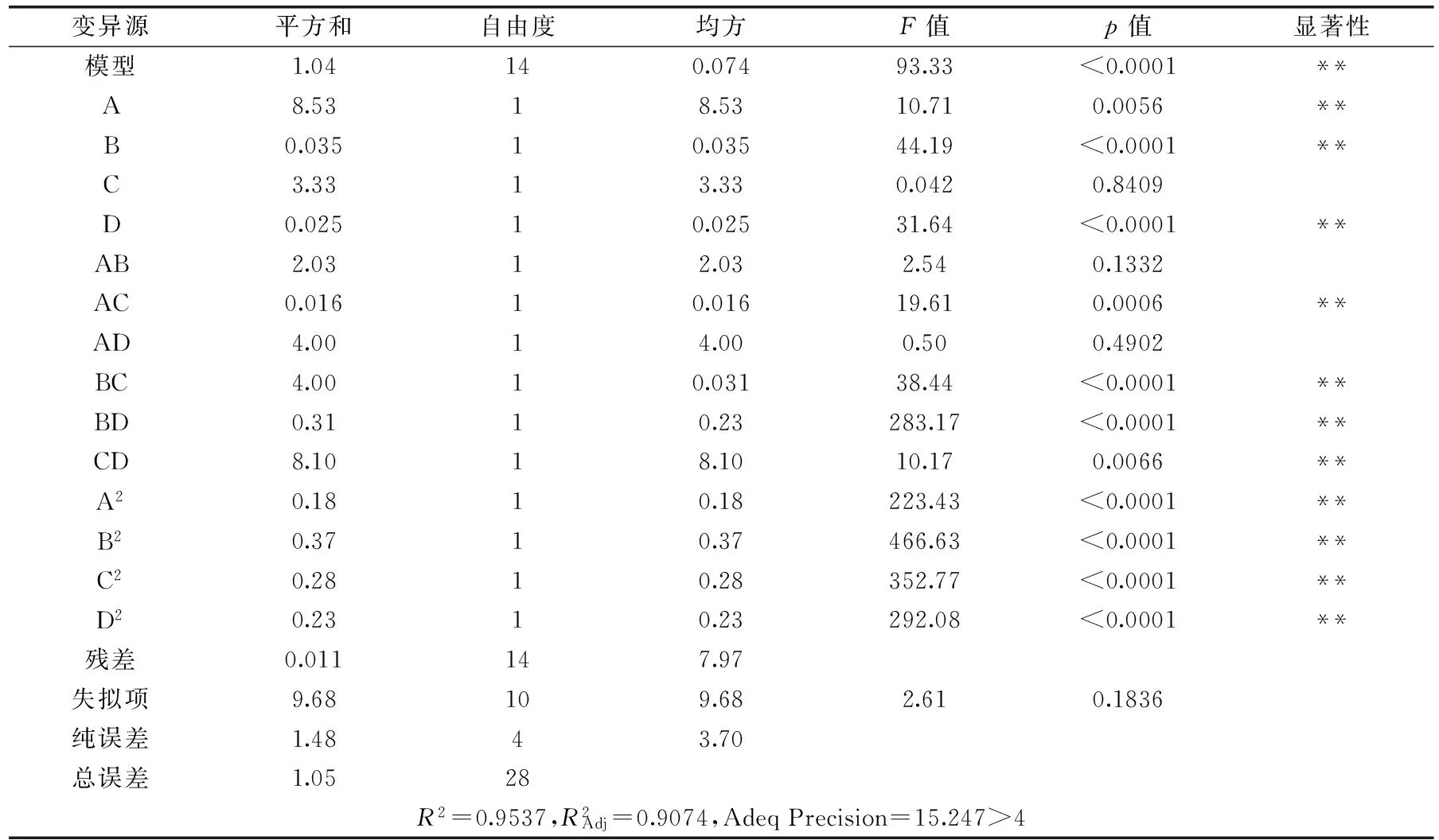
表3 回归模型方差分析
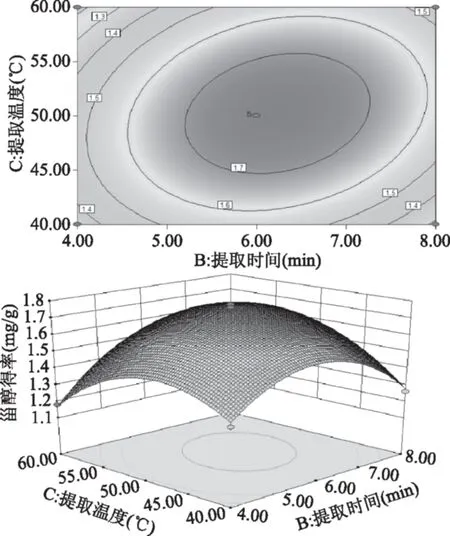
图8 提取时间和提取温度交互作用对酸浆甾醇得率影响的响应面图Fig.8 Response surface plots for the effects of extraction time and temperature on extraction efficiency of Physalis alkekengi phytosterol
注:*差异显著(p<0.05),**差异极显著(p<0.01)。
由图7~图10可以直观地看出各因素对响应面的影响。由四组图响应面曲面对比可知,液料比(A)和提取温度(C)、提取时间(B)和提取温度(C)、提取时间(B)和微波功率(D)及提取温度(C)和微波功率(D)交互作用对酸浆甾醇的影响最为显著,表现为响应面的曲面较陡。
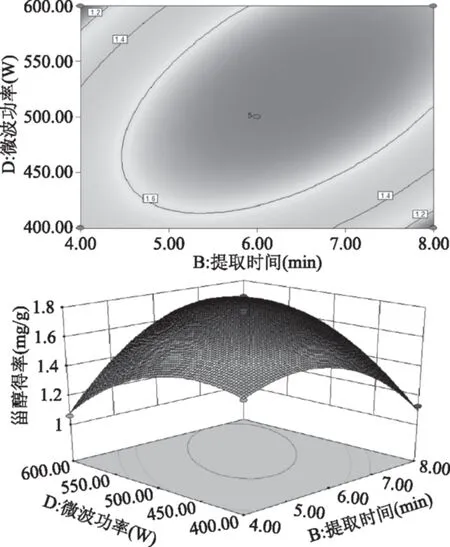
图9 提取时间和微波功率及其交互作用对酸浆甾醇得率影响的响应面图Fig.9 Response surface plots for the effects of extraction time and microwave output power on extraction efficiency of Physalis alkekengi phytosterol
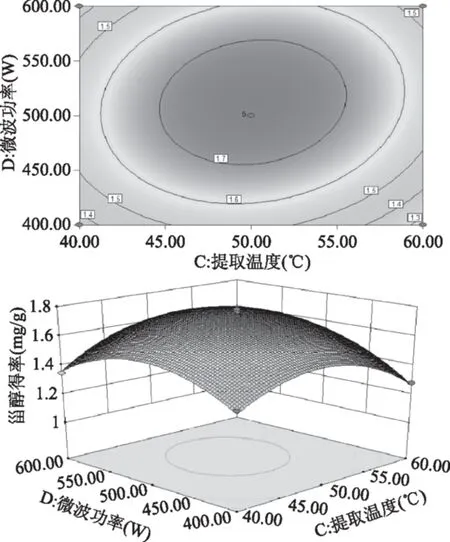
图10 提取温度和微波功率及其交互作用对酸浆甾醇得率影响的响应面图Fig.10 Response surface plots for the effects of temperature and microwave output power on extraction efficiency of Physalis alkekengi phytosterol
采用Design-Expert 8.0.6.1软件对回归方程进行模拟优化,得到最优条件为液料比10.61 mL/g、提取时间6.55 min、提取温度50.78 ℃、微波功率505.66 W,在此最佳工艺条件下酸浆甾醇得率为1.775 mg/g,考虑到实验实际条件及操作便利性,修正优化条件为液料比11 mL/g、提取时间7 min、提取温度51 ℃、微波功率500 W,在此条件下,开展平行实验提取酸浆植物甾醇,此修正条件下平均酸浆甾醇得率为1.771 mg/g,该实验值与模型方程的预测值基本一致,说明响应面法优化微波辅助提取酸浆甾醇组合条件准确可靠,该模型方程具有实用价值。
2.5 酸浆籽细胞电镜观察结果分析
酸浆甾醇存在于酸浆籽油中,首先须获得大量酸浆籽油,通过皂化除去脂肪酸,石油醚萃取,旋转蒸发石油醚萃取液,得到酸浆甾醇,图11为原酸浆籽,图12乙醇微波辅助提取酸浆籽扫描电镜图,图13为酸浆籽原样透射电镜图,图14乙醇微波辅助提取透射电镜图。
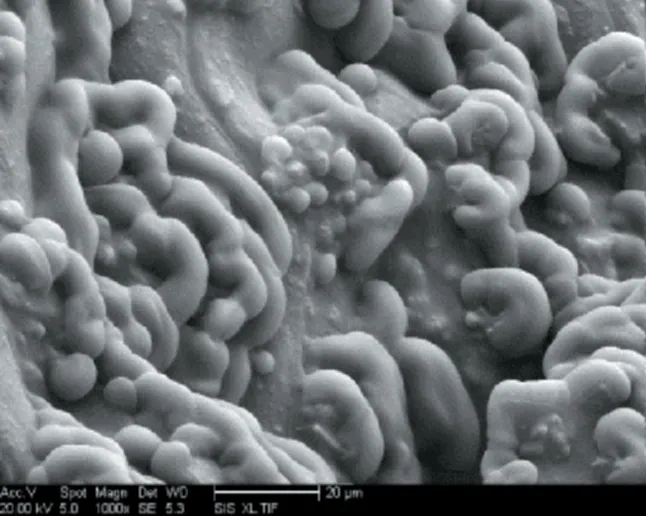
图11 原酸浆籽扫描电镜图(1000×)Fig.11 FESEM of original Physalis alkekengi seed(1000 ×)

图12 乙醇微波辅助提取电镜图(1000×)Fig.12 FESEM of ethanol microwave-assisted extraction(1000×)

图13 酸浆籽原样透射电镜图(1500×)Fig.13 TEM of original Physalis alkekengi seed(1500×)

图14 乙醇微波辅助提取透射电镜图(1500×)Fig.14 TEM of Microwave-assisted extraction process(1500×)
在细胞内和细胞间隙有大量的脂体存在,脂体与蛋白质相互作用进而形成界膜,将油脂等物质包围在细胞内部。经过加热、蛋白变性,油脂细胞将聚集在一起,释放出大量酸浆籽油。从图11中观察到酸浆原籽表面有大量的脂肪颗粒,颗粒较饱满,酸浆籽表面厚重的细胞壁将油脂、多糖、蛋白质等物质包含在内。图12中可以看出由于微波作用植物细胞壁破坏较大,几乎没有完整细胞形态,脂肪颗粒被提取干净,仅有极小脂肪颗粒存在。图13酸浆籽原样由于使用的材料是经过复水后的机械破碎酸浆籽粉末,也已经出现了部分质壁分离的现象,但其细胞壁结构仍然完整,细胞内溶物较多;图14可以看出细胞结构已经完全被破坏,无细胞形态。微波有强烈的穿透性,能够将细胞壁内外的水分子产生剧烈转动,导致细胞壁的通透性变化,使细胞内温度急剧上升,压力增大,超过细胞壁自身的承受能力,细胞壁发生破裂,酸浆籽油大量释放出来[30-31],可获得更高的酸浆甾醇,可见微波提取效果较好。
3 结论
采用微波辅助提取法,以酸浆甾醇得率为指标,通过单因素和响应面分析,对微波辅助提取酸浆甾醇的工艺条件进行研究,结果表明:以无水乙醇为提取剂,液料比11∶1 mL/g、提取时间7 min、提取温度51 ℃、微波功率500 W,挥干乙醇后加入浓度为1.5 mol/L的KOH乙醇溶液皂化1 h,石油醚萃取,取石油醚层蒸干溶剂得酸浆甾醇提取物,此时甾醇得率为1.771 mg/g,与理论预测基本一致。通过对原酸浆籽、乙醇微波辅助提取酸浆籽进行电镜观察,分析微波辅助提取机理,酸浆籽细胞壁的断裂和破碎是由微波的辐射和热效应造成的,细胞壁彻底破碎,细胞通透性增大内溶物渗出,加速了酸浆甾醇溶出速率。
[1]Normen L,Dutta P,Lia A,et al.Soy sterol esters andβ-sitostanol ester as inhibitors of cholesterol absorption in human
small bowel[J].Am J ClinNutr,2000,71:908-913.
[2]谢心美,郝海鑫,何剑斌. 植物甾醇的生理功能及其应用[J].草业科学,2013,30(12):2105-2109.
[3]许青青,金文彬,苏宝根,等. 植物甾醇酯的化学合成及其分离研究进展[J]. 中国粮油学报,2014,29(3):120-127.
[4]Saoussern H,Annik ST,FaouziS.Phytostanols and phytosterols distributions in corn kernel[J]. Food Chemistry,2008,111(1):115-120.
[5]Robert A M,Bruce D,Whitaker K B. Phytosterols,phytostanols,and their conjugates in foods:structural diversity,quantitatice analysis,and health promoting use[J]. Hicks Progress in Lipid Research,2002,41(6):457-500.
[6]Ostlund R E Jr. Phytosterols in human nutrition[J]. Ann Rev Nutr,2002,22:533-549.
[7]韩军花,李艳平,门建华,等. 我国三城市老年妇女膳食植物甾醇摄入量及血脂含量的比较研究[C]//生命发展机遇——窗口期营养——达能营养中心第十二届学术年会会议论文集. 北京:中国疾病预防控制中心达能营养中心,2009:75-79.
[8]唐庭棣. 大兴安岭药用资源[M]. 哈尔滨:哈尔滨出版社,2001:121.
[9]Masao K,Toichi O,Yasuo B,et al. Structural revision of one of the dehydration products of physalinA[J]. Tetrahedron,1991(47):2103-2110.
[10]Row L R,Reddy K S,Sarma N S,et al. New pyhsalins from Physalisalngulata and Physal is lancifolia.[J]. Phytochemistry,1980,19:1175-1181.
[11]国家药典委员会. 中华人民共和国药典[M]. 一部. 北京:化学工业出版社,2000:296.
[12]徐伟,李迎楠,高雪清,等. 复合酶对红菇娘果浆酶解条件的优化[J]. 食品科学,2013,34(18):114-117.
[13]郎秀杰,郭成宇,张广翌. 红菇娘制酒最佳工艺的研究及香气成分检测[J]. 食品工业,2014,35(9):74-78.
[14]王晓闻,常霞,宋世军. 酸浆果原汁饮料的研究[J]. 农产品加工,2010(3):47-49.
[15]单立冬,郭试瑜,俞光,等. 灯笼草镇痛作用及其机理的研究[J]. 中药药理与临床,2001,17(1):12-15.
[16]NK Sharma,DK Kulshreshtha,JS Tandon,et al.Two new sterols from Physalisfranchetii fruit[J]. Phytochemistry,1974,13(10):2229-2245.
[17]张乃辉. 鲜品酸浆草的外用[J]. 中国民间疗法,2003,11(4):28.
[18]张舵. 酸热法制备酸浆籽蛋白及其氨基酸成分分析[J]. 食品科技,2015,40(9):312-315.
[19]张明霞,呼秀智,旁建光,等. 微波辅助玉米芯酸浆提取木糖条件优化[J]. 食品科学,2012,33(2):39-42.
[20]李攻科,杜甫佑,肖小华. 微波辅助萃取技术在中药现代化中的应用[J]. 精细化工,2007,12(24):1184-1191.
[21]曹洪斌,申明金,陈莲惠. 微波萃取在中药提取中的应用[J]. 广州化学,2013(38):72-76.
[22]DENG Chunhui,LIU Ning,GAOMingxia,el al.Recent developments in sample preparation techniques for chromatography analysis of traditional Chinese medicines[J]. JChromatogr A,2007(12):90-96.
[23]傅亚,范佳,陈芳,等. 微波辅助萃取法提取玄参中哈巴苷和哈巴俄苷的工艺研究[J]. 天然产物研究与开发,2015,27(11):1938-1942.
[24]张楠,储小琴,蒋建勤. 锦灯笼醋酸乙酯部位化学成分的研究[J]. 中草药,2015,46(8):1120-1124.
[25]王和平,徐美术,孙亮,等. 锦灯笼降血糖作用的实验研究[J]. 中医药信息,2004,21(1):53-54.
[26]王丽波,庞丽萍,徐雅琴,等. 超声波辅助法提取南瓜籽中植物甾醇的研究[J]. 中国粮油学报,2011,26(11):62-64.
[27]陈易彬,王维. 响应面法优化冬瓜子中植物甾醇的提取工艺[J]. 食品科技,2014,39(1):204-210.
[28]李万林,钟姣姣,冯巩,等. 大豆油中植物甾醇提取工艺及抗氧化活性研究[J]. 大豆科学,2014,33(5):731-734.
[29]GB/T5009.128-2003,食品中胆固醇的测定方法[S].
[30]袁连山,顾国亮,廖传华,等. 微波对萃取过程的强化[J]. 香料香精化妆品,2005(1):29-32.
[31]李超,王乃馨,郑义,等. 响应曲面法优化超声波协同微波提取苘麻籽油的工艺研究[J]. 中国粮油学报,2011,26(7):48-52.
Microwave-assisted extraction of phytosterol fromPhysalisalkekengiseed and observe the microstructure of cell
XU Wei,DU Jiao,GE Yang-yang
(School of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
A large number ofPhysalisalkekengiphytosterol exist inPhysalisalkekengiseed oil. Microwave-assisted method was used to extract the seed oil. AndPhysalisalkekengiphytosterol was got by saponification and extraction. Response surface method was used to optimize the extraction condition ofPhysalisalkekengiphytosterol.The result showed that under the condition of anhydrous alcohol as extractant,liquid to solid ratio of 11∶1,extraction time 7 min,extraction temperature 51 ℃,microwave power 500 W,and the yield was 1.771 mg/g. SEM and TEM was used to observe the structure of originalPhysalisalkekengiseed andPhysalisalkekengiseed by ethanol microwave-assisted extraction method.Results indicated that a plenty of fat granule on originalPhysalisalkekengiseed cell surface,particle plumpness,ethanol microwave-assisted extraction of seed cell wall was completely broken and membrane permeability increased.A large amount of seed oil was found to be leached from the cells. Microwave-assisted method was beneficial to the extraction ofPhysalisalkekengiphytosterol.
Physalisalkekengiseed;phytosterol;microwave-assisted extraction
2016-09-22
徐伟(1963-),女,博士,教授,研究方向:微生物学与发酵工程,E-mail:xuw@hrbcu.edu.cn。
TS202.1
B
1002-0306(2017)06-0281-07
10.13386/j.issn1002-0306.2017.06.045
