利用AB-8大孔树脂纯化‘黑宝石’李果实花色苷的研究
2017-04-14夏锦锦王丽敏曹建康
夏锦锦,王 睿,祝 缘,洪 凯,王丽敏,曹建康
(中国农业大学食品科学与营养工程学院,北京 100083)
利用AB-8大孔树脂纯化‘黑宝石’李果实花色苷的研究
夏锦锦,王 睿,祝 缘,洪 凯,王丽敏,曹建康*
(中国农业大学食品科学与营养工程学院,北京 100083)
本文以‘黑宝石’李果实为材料,实验通过AB-8大孔树脂静态和动态条件下的吸附和解吸优化了AB-8大孔树脂纯化花色苷的条件,同时对纯化前后花色苷的成份和含量及抗氧化能力的变化进行了研究。结果表明,最佳纯化工艺条件:以浓度0.015 mg/mL、pH3.5的提取液,流速1.0 mL/min进行上样;以流速0.5 mL/min、80%的乙醇进行洗脱。纯化花色苷的抗氧化能力有所提高,在浓度小于100 μg/mL时,纯化花色苷对DPPH自由基的清除能力明显高于粗提物对DPPH自由基的清除能力;在浓度为10和15 μg/mL时,纯化花色苷样品对ABTS+·自由基的清除能力分别为粗花色苷的1.24和1.07倍。‘黑宝石’李中的花色苷为矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷,纯化后两种花色苷单体的含量分别达到261.6 mg/L和26.6 mg/L。研究成果将为李花色苷性质研究、李资源开发和深加工转化提供理论依据和技术支撑。
‘黑宝石’李,花色苷,AB-8大孔树脂,纯化,抗氧化
‘黑宝石’李是日本李(PrunussalicinaLindl.)和美洲李的杂交品种,在我国种植面积广,市场占有率高[1]。‘黑宝石’李较耐贮藏,果皮呈紫黑色,风味浓郁[2],深受消费者喜爱。但李子属于季节性比较强的浆果,不耐碰撞和贮藏。因此,李子果实的贮藏保鲜和深加工变得比较重要。冷藏后‘黑宝石’李果肉往往迅速变红,积累大量花色苷[3]。从‘黑宝石’李中分离纯化出活性成分物质,将其应用于食品药品等行业,可以提高其附加值。花色苷是一类重要天然色素物质,有益于人体健康,在食品、医药、保健品、化妆品等领域具有广泛应用[4-5]。但从果实中提取的花色苷,由于含糖量高、杂质多,直接影响其稳定性和着色性,需要进一步纯化得到高色价和高纯度的花色苷产品[6],以提高其应用价值。
目前,提取植物中花色苷常用的方法有溶剂萃取法、超声波辅助提取法、微波辅助提取法等[6-10]。综合比较几种提取方法在植物花色苷提取中的应用,由于各方面的因素,目前比较适用的是溶剂萃取法和超声或微波辅助提取法。由于花色苷结构的不稳定性,微波辅助提取等提取温度较高的方法应用的较少;而新兴的一些技术如超高压快速提取技术由于成本太高也仅限于小规模的科学实验研究,不能广泛应用。从植物中提取得到的花色苷通常含有糖类、有机酸等杂质,这些杂质的分子量与色素分子量接近,通过超滤膜分离技术比较难去除,粗花色苷多采用非极性或者弱极性的大孔树脂装填树脂柱,通过动态吸附和洗脱等过程来纯化[6,11]。
本研究以‘黑宝石’李果实为材料,采用AB-8大孔树脂对李果实花色苷进行静态和动态条件下解吸和吸附实验优化纯化条件,利用HPLC技术对纯化前后花色苷成份和含量变化进行了研究,同时测定了抗氧化能力的变化,以期为‘黑宝石’李果实资源开发和深加工转化提供理论依据和技术支撑。
1 材料与方法
1.1 材料与仪器
‘黑宝石’李 采自北京市延庆县张山营镇辛家堡村,采后迅速运回实验室,选取大小均一、无机械损伤和病虫害的果实,装入塑料筐,用厚度为0.02 mm的聚乙烯塑料薄膜保鲜袋挽口包装,置于5 ℃,相对湿度80%~90%条件下贮藏,以贮藏4周果肉变红的李果实为实验材料;无水乙醇、冰醋酸、无水乙酸钠、氯化钾、盐酸 分析纯,北京化工厂;AB-8大孔吸附树脂 陕西博晖生化科技有限公司;乙酸、甲醇 色谱纯,赛默飞世尔(Thermo Fisher Scientific)科技公司;1,1-二苯基-2-苦基肼(·DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+·) 西格玛奥德里奇公司(Sigma-Aldrich Company)。
DT300A型电子天平 常熟市佳衡天平仪器有限公司;SB-5200D型超声波清洗机 宁波新芝生物科技股份有限公司;3H16RI型智能高速冷冻离心机 湖南赫西仪器装备有限公司;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;RE-52旋转蒸发器 上海亚荣生化仪器厂;SHZ-D循环水式真空泵 巩义市予华仪器有限责任公司;HL-2恒流泵 上海沪西分析仪器厂;BSZ-100-LCD自动部份收集器 上海琪特分析仪器有限公司;SPD-M20A-DAD型液相色谱系统 日本岛津。
1.2 实验方法
1.2.1 花色苷粗提液的制备 变红的李子果实,液氮研磨成粉末状,-20 ℃冷冻备用;称取一定量的样品,以1∶10 g/mL的料液比,加入体积分数80%乙醇溶液,研磨均匀,转移到离心管中,放于超声波清洗机中超声提取30 min,超声功率200 W,10000×g 4 ℃离心30 min,取上清液,得到李果实花色苷粗提液,30 ℃旋转蒸发浓缩至原体积的1/6~1/5,得到浓缩液,蒸馏水稀释得到浓度为0.015 mg/mL的色素稀释液[6]。
1.2.2 树脂预处理 AB-8大孔树脂经过4倍树脂体积质量分数4%的NaOH溶液浸泡4 h,用蒸馏水冲洗至流出液pH=7;再用4倍树脂体积质量分数4%的HCl溶液浸泡4 h,用蒸馏水冲洗至流出液pH=7;最后用4倍树脂体积的体积分数95%的乙醇溶液浸泡4 h,用体积分数为95%的乙醇冲洗至流出液清澈无浑浊,再用蒸馏水洗至流出液无明显醇味。
1.2.3 花色苷吸收光谱的测定 取花色苷提取液3 mL,用紫外-可见分光光度计在400~600 nm范围内扫描,测定提取液的吸收光谱,确定最大吸收峰对应的波长。
1.2.4 花色苷含量的测定 采用pH示差法测定,参照文献[12]方法。
1.2.5 纯化条件的确定
1.2.5.1 静态实验条件的确定
a.色素液浓度对树脂吸附率的影响 分别称取已活化的AB-8大孔树脂0.5 g于100 mL三角瓶中,加入20 mL pH3.45的浓度分别为0.005、0.015、0.020、0.031、0.043 mg/mL的色素稀释液,于摇床振荡24 h,过滤后测定滤液的吸光度值,计算吸附率(E1)。
b.色素液pH对树脂吸附率的影响 分别称取已活化的AB-8大孔树脂0.5 g于100 mL三角瓶中,加入20 mL 浓度0.015 mg/mL pH分别为2.28、2.99、3.45、3.81、4.49、5.63、6.88的色素溶液,于摇床振荡24 h,过滤后测定滤液的吸光度值,计算吸附率(E1)。
c.乙醇体积分数对树脂解吸率的影响 称取0.5 g已活化的AB-8大孔树脂于100 mL三角瓶中,加入20 mL pH3.45、浓度0.015 mg/mL的色素溶液,于摇床振荡吸附24 h;过滤充分吸附了色素的树脂,加入20 mL不同体积分数的乙醇溶液进行解吸实验,于摇床振荡24 h,测定解吸液的吸光值,计算解吸率(E2)。
d.吸附率、解吸率的计算
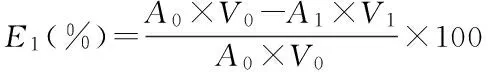
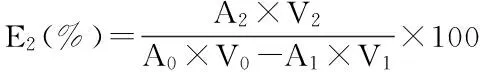
式中:A0、A1、A2分别为色素液吸附前、吸附后和解吸液的吸光值;V0、V1、V2分别为色素液吸附前、吸附后和解吸液的体积[6]。
1.2.5.2 动态实验条件的确定
a.不同上样速度对动态吸附曲线的影响 于Φ10mm×200mm的层析柱中湿法装入5gAB-8树脂,平衡后,将一定浓度色素稀释液以1.0mL/min的流速进行上样吸附,分段收集流出液,并测定不同体积流出液的吸光值,计算流出液中花色苷的含量,每10mL流出液测定一次。另取树脂,重复上述实验,分别以0.5、1.0、1.5、2.0mL/min的速度上样吸附,研究不同上样速度对动态吸附曲线的影响。
b.糖分洗脱 吸附饱和的树脂柱,用1.0mL/min的蒸馏水冲洗去除残留的糖分,分段收集流出液,绘制糖分洗脱曲线,确定洗脱蒸馏水的用量。
c.洗脱流速对解吸曲线的影响 吸附饱和的树脂柱,用一定量的蒸馏水洗去糖分。糖分去除后,用80%的乙醇溶液以1.0mL/min的流速洗脱,分段收集流出液,并测定不同体积流出液的吸光值,计算流出液中花色苷的含量,每5mL测定一次。另取树脂,重复上述实验,分别以0.5、1.0、1.5、2.0mL/min的速度洗脱,研究不同洗脱流速对解吸曲线的影响。
1.2.6 可溶性糖含量的测定 采用蒽酮-硫酸法[13]。
1.2.7 抗氧化性测定
1.2.7.1DPPH自由基清除能力测定 参照Son和Lewis方法[14],略作修改。用乙醇溶液配制不同浓度的样品溶液和0.2mmol/LDPPH·溶液,向2mL样品溶液中加入2mLDPPH·溶液,充分混合,室温避光反应30min后测定该混合溶液在517nm处的吸光值。对照组为2mL乙醇和2mLDPPH·试剂。
1.2.7.2ABTS自由基清除能力测定 将ABTS+·溶解于20mmol/L、pH4.5的醋酸缓冲溶液中得到7mmol/L的ABTS+·贮液,与过硫酸钾溶液(混合体系中的终浓度为2.45mmol/L)混合,在室温下避光反应12~16h,使溶液达到稳定的氧化态。测定前用20mmol/L、pH4.5的醋酸缓冲溶液稀释ABTS+·贮液,使溶液的吸光值在734nm下达到0.7±0.02,以此得到ABTS+·工作液,工作液每次测定前现配。测定时反应体系包括3mL的ABTS+·工作液和200μL合适浓度的提取液,室温避光静置6min后在734nm波长下测定吸光值。
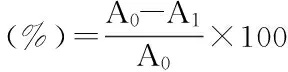
式中:A0为对照组吸光值,A1为样品组吸光值。
1.2.8 液相色谱条件 采用SPD-M20A-DAD液相色谱系统分析李果实花色苷,色谱条件如下:流动相A:1%乙酸-水溶液(v/v),B:甲醇;梯度洗脱条件:0~10 min,10%~23% B;20~40 min,23%~28% B;40~45 min,28%~40% B;45~60 min,40%~55% B;60~65 min,55%~70% B;65~70 min,70%~95% B;色谱柱:C18column(Shim-pack VP-ODS 150 mm×4.6 mm×5 μm);流速:1 mL/min,上样量10 μL,柱温:30 ℃,检测波长520 nm。
1.3 数据处理
运用Excel 2010统计分析数据,计算标准偏差并制图。运用IBM SPSS Statistics 21.0,进行差异显著性分析。
2 结果与分析
2.1 最大吸收波长的确定
‘黑宝石’李果实花色苷在pH3时最大吸收峰波长是520 nm(图1)。实验中测定样品吸光度值均在可见光区520 nm处进行。
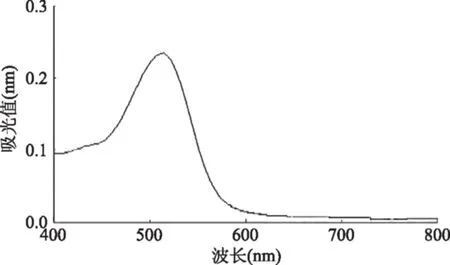
图1 黑宝石李果实花色苷色素溶液全波长扫描图Fig.1 Full wavelength scanning of pigment solution of the‘Friar’plum
2.2 色素液浓度对树脂吸附率的影响
AB-8树脂吸附花色苷的吸附率与树脂的饱和吸附量和色素液中的花色苷浓度有关。由图2可以看出,随着色素液花色苷浓度的增大,树脂的吸附率先增大后降低,色素液浓度为0.015 mg/mL时,吸附率最高达到86.46%,之后随着花色苷含量的增加,吸附率显著降低。由于色素液浓度过低时,树脂吸附饱和所需要的时间长,树脂吸附24 h吸附率比较低;色素液浓度增大,超过树脂的饱和吸附量,吸附率也会降低。因此,选择色素液的上样浓度为0.015 mg/mL。
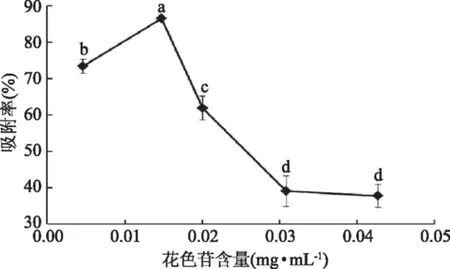
图2 色素液浓度对树脂吸附率的影响Fig.2 Effects of pigment concentration on adsorption rate of resin注:图中不同字母代表具有显著性差异(p<0.05);图3~图4同。
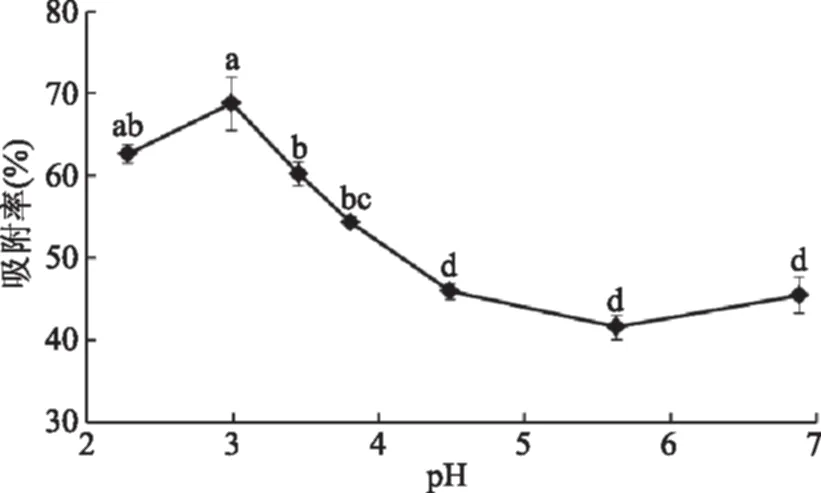
图3 色素液pH对树脂吸附率的影响Fig.3 Effects of pH value of pigment solution on adsorption rate of resin
2.3 色素液pH对树脂吸附率的影响
pH影响花色苷的解离状态和树脂对花色苷的吸附能力。由图3可知,随着色素液pH的增加,吸附率呈现逐渐增加然后显著降低的趋势。色素液在pH2~4时,树脂对花色苷的吸附率都超过了50%。其中,在pH3.0时,吸附效果较好,达到68.78%。为了减少缓冲液对色素和树脂的影响,选择蒸馏水稀释得到的pH3.5的色素溶液进行动态吸附实验。
2.4 乙醇体积分数对解吸率的影响
吸附在AB-8树脂柱体上的花色苷,需要用乙醇溶液洗脱下来。由图4可以得出,随着乙醇体积分数的增加,乙醇对吸附在树脂柱上的花色苷的解吸率逐渐提高。在乙醇体积分数为70%时,解吸率就可达80%以上。当乙醇体积分数为80%时解吸率为85.71%,而体积分数为100%时,解吸率为93.40%。乙醇浓度过低,解吸率显著降低,解吸效果不好;而乙醇浓度过高,解吸率虽然相应地提高但造成乙醇用量的增加,从解吸率和成本的角度考虑,并结合后续花色苷的浓缩,选择体积分数80%的乙醇溶液进行洗脱。
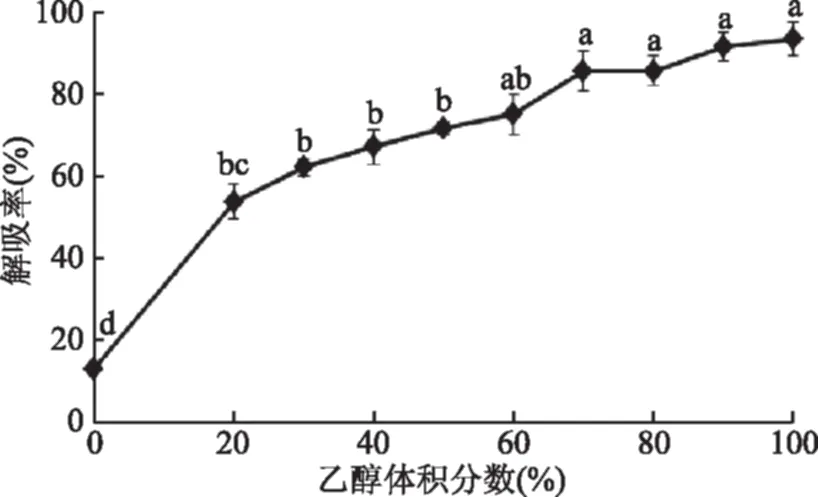
图4 乙醇体积分数对解吸率的影响Fig.4 Effects of ethanol concentration on desorption rate of resin
2.5 上样流速对吸附曲线的影响
上样流速对树脂吸附花色苷的量有一定的影响。花色苷与树脂的接触时间相对较长时,有利于色素分子与树脂表面的结合,使得色素分子充分被树脂吸附。由图5可以看出,0.5 mL/min的上样流速,流出液中的花色苷含量最低,反映出树脂吸附的花色苷最多。当上样流速提高时,流出液中的花色苷含量增多,树脂吸附的花色苷含量减少;但是,1.5和2.0 mL/min的上样流速,流出液中花色苷含量没有明显差别。但是上样流速过低,所需的吸附时间较长。综合考虑,选择上样流速1.0 mL/min。
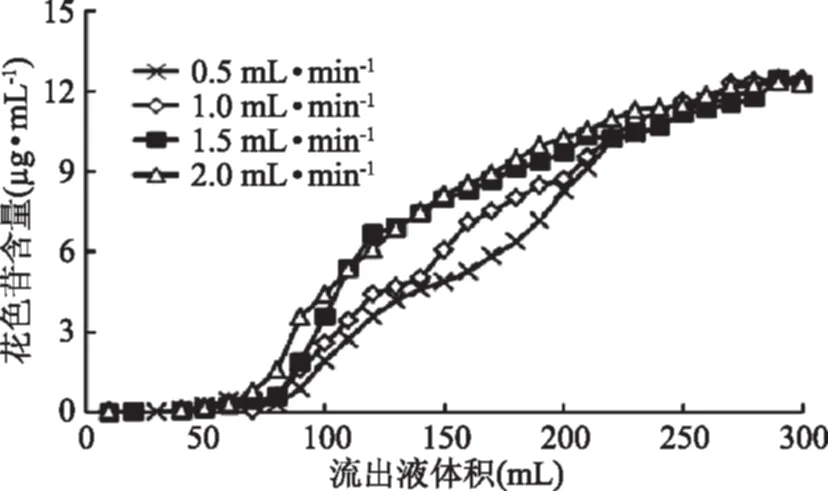
图5 上样流速对树脂吸附量的影响Fig.5 Effects of flow velocity of samples on adsorption capacity of resin
2.6 蒸馏水用量对糖分洗脱效果的影响
在AB-8树脂柱吸附花色苷达到饱和后,再用蒸馏水洗脱吸附在树脂上的可溶性糖分。由图6可知,用30 mL蒸馏水洗脱吸附饱和的AB-8树脂柱即可洗去大部分残留在树脂柱上的糖分,使糖分含量降低至0.0423 mg/mL;蒸馏水会同时将花色苷也洗脱下来,造成花色苷的损失。因此实验选用30 mL蒸馏水洗脱除去糖分。
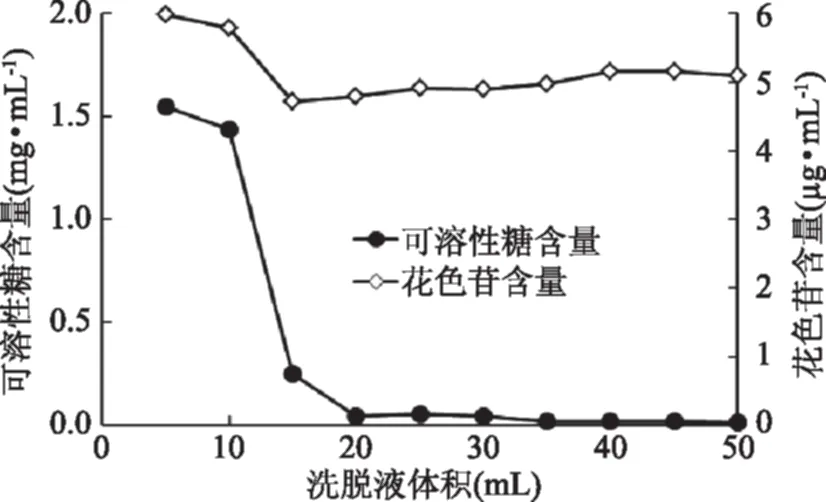
图6 蒸馏水洗脱液中可溶性糖含量和花色苷含量的变化Fig.6 Soluble sugar content and changes of anthocyanin content in distilled water washing liquid
2.7 洗脱流速对解吸曲线的影响
由图7可知,在不同洗脱流速条件下,当洗脱液的用量从5 mL增加到10 mL的时候,花色苷的含量显著增加,花色苷含量均在10 mL洗脱液中达到最高值,而继续增加洗脱液用量到15 mL时,花色苷含量显著降低。可见,洗脱液用量在5~15 mL的范围内洗脱了大部分的花色苷。当洗脱流速为0.5和1.5 mL/min时,洗脱液中花色苷含量峰值最高,当洗脱流速为1.0和2.0 mL/min时,洗脱液中花色苷含量峰值较低。当洗脱流速为0.5 mL/min时,洗脱峰型窄,而洗脱流速为2.0 mL/min时,洗脱峰型比较宽,存在严重的拖尾现象。这可能是由于较高的洗脱流速时,短时间内,只有较少量的色素溶于洗脱液中被洗脱下来,增加洗脱液的用量才能将色素洗脱地更完全,造成洗脱峰型宽。因此选用0.5 mL/min的洗脱流速。
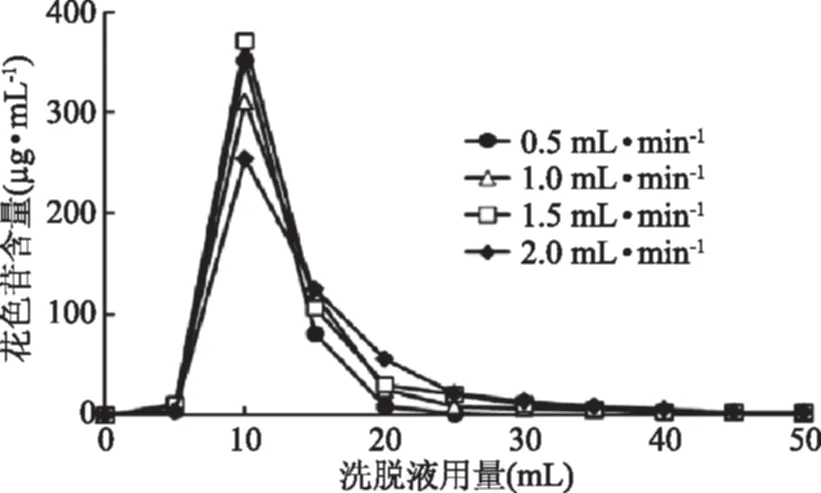
图7 洗脱流速对解吸曲线的影响Fig.7 Effects of elucnt flow rate on desorption curves
2.8 抗氧化能力的测定
2.8.1 DPPH自由基清除能力测定 花色苷清除DPPH自由基的能力常作为评价其抗氧化能力的重要指标。DPPH·中含有孤对电子,其乙醇溶液呈紫色,DPPH·清除测试实验中,当向DPPH·溶液中加入一定浓度花色苷时,花色苷可以提供H原子,与DPPH·中孤对电子配对,DPPH·转变成DPPH-H,溶液颜色由紫色向浅黄色变化,517 nm处吸光度变小,DPPH·清除程度越大,吸光值越小[16]。由图8可知,随着花色苷浓度的增大,DPPH·的清除能力增强。在浓度小于100 μg/mL时,纯化花色苷对DPPH·自由基的清除能力明显高于粗提物对·DPPH自由基的清除能力。但是,当浓度大于100 μg/mL时,纯化花色苷与粗提物对·DPPH自由基的清除能力无明显差别。
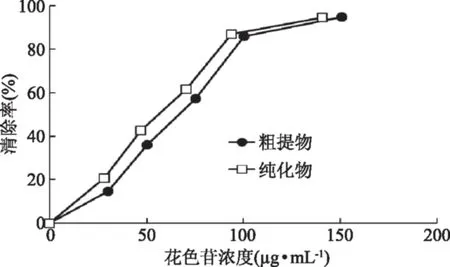
图8 样品对·DPPH的清除率Fig.8 Scavenging rate of samples on ·DPPH
2.8.2 ABTS自由基清除能力测定 ABTS+·经活性氧氧化后生成稳定的蓝绿色阳离子自由基ABTS+·,加入的被测物质中若含有抗氧化成分,则该抗氧化物质会与ABTS+·反应使得反应体系褪色[17]。由图9可知,随着花色苷浓度的增大,ABTS+·的清除能力增强。在浓度为10和15μg/mL时,纯化花色苷样品对ABTS自由基的清除能力分别为粗花色苷的1.24和1.07倍。
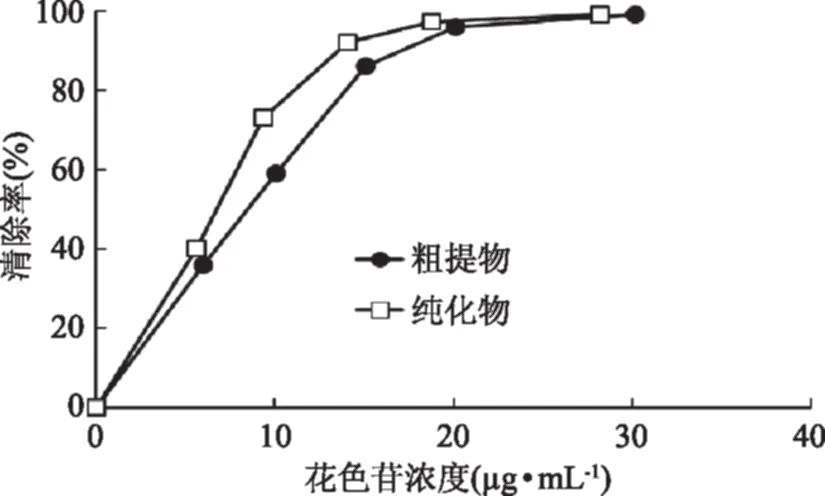
图9 样品对ABTS+·的清除率Fig.9 Scavenging rate of samples on ABTS+·
2.9 纯化对花色苷的组成的影响
由图10可知,经AB-8大孔吸附树脂纯化后样品在520 nm下有2个峰,即表示两种花色苷单体,与标品比较后确定为矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷。纯化前后花色苷提取液HPLC图谱出峰保留时间相同、峰型相似,说明树脂纯化并没有改变原提取物中花色苷的单体组成。纯化前、后两种花色苷单体的浓度如表1所示,经过纯化,两种花色苷单体浓度分别是纯化前的2.10和1.99倍,且花色苷粗提样和经树脂纯化的花色苷样品的花色苷单体组成比例比较接近。
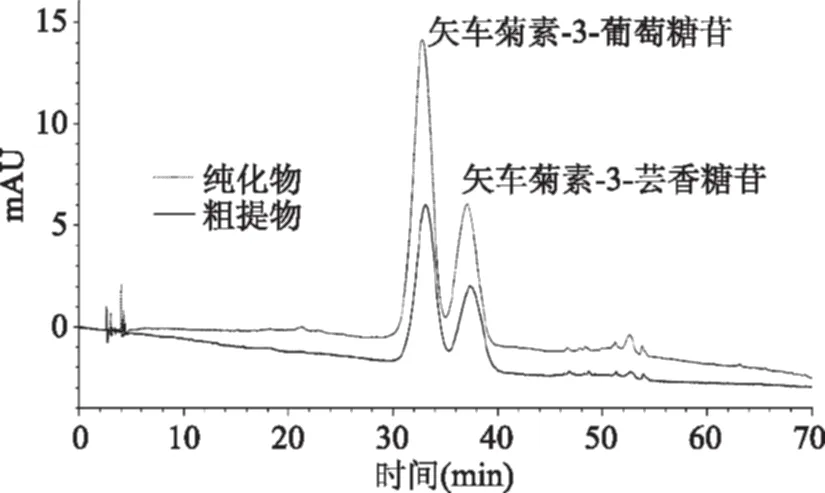
图10 纯化对李果实花色苷提取液组份的影响Fig.10 Effect of purification on the composition of anthocyanin of the‘Fraiar’plum

表1 纯化对花色苷单体的浓度的影响
3 结论
实验对AB-8大孔吸附树脂进行了静态和动态条件的优化,确定了最佳纯化条件:以蒸馏水稀释得到0.015 mg/mL的色素溶液,1.0 mL/min的上样流速进行上样,30 mL蒸馏水洗去糖分,用80%的乙醇溶液以0.5 mL/min的洗脱流速进行洗脱,得到纯化后的花色苷样品溶液。纯化花色苷对DPPH和ABTS+自由基的清除能力均得到明显的提高。
AB-8大孔吸附树脂纯化后的花色苷含有两种花色苷单体,矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷。经过纯化,两种花色苷单体浓度分别是纯化前的2.10和1.99倍,且AB-8大孔吸附树脂纯化过程中色素损失较少。由于纯化前后花色苷种类和组成没有明显改变,AB-8大孔吸附树脂纯化过程主要去除了花色苷提取液中的可溶性糖类物质,还可能脱除了一部分多酚类物质。结果还表明,冷藏‘黑宝石’李果肉红变积累的花色苷具有一定的开发利用价值。
[1]Shao Y,Luo Y,Chen A,et al.Effect of 1-MCP treatment and storage temperature on pulp browning of friar plum(Prunussalicinalindell.cv.friar)[J].Nongye Jixie Xuebao/Transactions of the Chinese Society of Agricultural Machinery,2010,41(3):128-133.
[2]刘建成. 李子新品种——“黑宝石”“玫瑰红”[J]. 农家科技,1998(11):7.
[3]Wang J,Pan H,Wang R,et al. Patterns of flesh reddening,translucency,ethylene production and storability of ‘Friar’plum fruit harvested at three maturity stages as affected by the storage temperature[J]. Postharvest Biology and Technology,2016(121):9-18.
[4]刘岱琳,林纪伟,张静泽,等. 天然植物中花色苷的研究应用现状[J]. 食品研究与开发,2010,31(9):240-244.
[5]张学英,张上隆,秦永华,等. 温度对李果实采后花色素苷合成的影响[J]. 园艺学报,2005(6):1-4.
[6]胡金奎. 桑葚花色苷的分离制备、结构分析及其体外活性[D]. 无锡:江南大学,2013.
[7]魏福祥,韩菊,于宝莉. 葡萄籽中活性成分提取工艺的研究[J]. 精细化工,2001,18(7):394-396.
[8]赵慧芳,王小敏,闾连飞,等. 黑莓果实中花色苷的提取和测定方法研究[J]. 食品工业科技,2008(5):176-179.
[9]王成东,杨华登,季晓. 先进萃取技术及装备在中药生产中的应用[J]. 中国制药装备,2008,11(2):27-30.
[10]李巧玲. 微波萃取技术在天然食用色素提取上的应用[J]. 食品科技,2003(10):60-64.
[11]Anvari M,Khayati G. Separation and purification of rebaudioside A from extract of Stevia Rebaudiana leaves by macroporous adsorption resins[J]. Polish Journal of Chemical Technology,2016,18(1):127-132.
[12]闫亚美,冉林武,曹有龙,等. 黑果枸杞花色苷含量测定方法研究[J]. 食品工业,2012(6):145-147.
[13]曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社,2013(7):54-59.
[14]Son S,Lewis B A. Free radical scavenging and antioxidative activity of caffeic acid amide and ester analogues:structure-activity relationship[J]. J Agric Food Chem,2002,50(3):468-472.
[15]国石磊,朱凤妹,王娜,等. 黑果腺肋花楸花色苷树脂纯化工艺及其稳定性研究[J]. 天然产物研究与开发,2015(9):1636-1642.
[16]Bozin B,Mimica-Dukic N,Samojlik I,et al. Phenolics as antioxidants in garlic(AlliumsativumL.,Alliaceae)[J]. Food Chem,2008,111(4):925-929.
[17]朱玉昌,焦必宁. ABTS法体外测定果蔬类总抗氧化能力的研究进展[J]. 食品与发酵工业,2005(8):77-80.
The purification of anthocyanins of ‘Friar’ plum with AB-8 macroporous resin
XIA Jin-jin,WANG Rui,ZHU Yuan,HONG Kai,WANG Li-min,CAO Jian-kang*
(College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China)
The purification of ‘Friar’ plum anthocyanins with AB-8 macroporous resin was investigated in this paper. The conditions for the purification of anthocyanins in ‘Friar’ plum material were optimized by the static adsorption and dynamic analysis of AB-8 macroporous resin,and then,the changes of the content and antioxidant capacity of anthocyanins were studied. The results showed that the best purification conditions were sample with anthocyanins concentration of 0.015 mg/mL,pH3.5,adsorption flow rate 1.0 mL/min,elution flow rate 0.5 mL/min with 80% ethanol as elution agents. The antioxidant capacity of purification anthocyanin increased,the scavenging rate of purification anthocyanins on DPPH· was significantly higher than crude extracts when the concentration of anthocyanin less than 100 μg/mL. The scavenging rate of purification anthocyanins on ABTS+· were 1.24 and 1.07 times than the crude anthocyanins were when the concentration of anthocyanin was 10 and 15 μg/mL. ‘Friar’ plum had two monomers anthocyanin cyanidin-3-glucoside and cyanidin-3-rutinoside that their concentrations reached 261.6 mg/L and 26.6 mg/L respectively. The results will provide a theoretical basis and technical support for the study of the nature of plum,resource development,deep processing and transformation.
‘Friar’ plum;anthocyanin;AB-8 macroporous resin;purification;antioxidant
2016-08-29
夏锦锦(1993-),女,大学本科,研究方向:食品科学与工程,E-mail:719664011@qq.com。
*通讯作者:曹建康(1976-),男,博士,副教授,研究方向:果蔬采后生理,E-mail:cjk@cau.edu.cn。
公益性行业(农业)科研专项经费项目(201303075)。
TS255.36
B
1002-0306(2017)06-0266-06
10.13386/j.issn1002-0306.2017.06.042
