蜡状芽孢杆菌CZ磷酸甘露糖异构酶基因的克隆表达及酶学性质研究
2017-04-14崔堂兵
张 瑶,崔堂兵,宋 妍
(华南理工大学生物科学与工程学院,广东广州 510006)
蜡状芽孢杆菌CZ磷酸甘露糖异构酶基因的克隆表达及酶学性质研究
张 瑶,崔堂兵*,宋 妍
(华南理工大学生物科学与工程学院,广东广州 510006)
将蜡状芽孢杆菌CZ中的磷酸甘露糖异构酶基因(pmi)进行克隆,并在大肠杆菌中进行异源表达。将PCR扩增得到的pmi基因与pET-22b(+)表达载体进行连接,转入大肠杆菌BL21(DE3)中,构建重组菌株BL21-pET22b(+)-pmi,并成功表达了重组磷酸甘露糖异构酶。结果显示:克隆得到pmi基因序列全长为948 bp,编码315个氨基酸。通过镍柱HisTrap HP亲和层析法纯化得到具有活性的重组酶,其蛋白分子大小约为40.8 ku。酶学性质结果显示:该酶的最适反应温度为35 ℃,在30~40 ℃酶活力相对稳定;最适pH为7.0,在弱碱性条件下保存12 h后仍存有50%以上酶活力;不同低浓度的金属离子Ni2+、Ca2+、Zn2+、Cu2+和Mg2+均对该酶表现出不同程度的激活作用,其中Mn2+对该酶激活作用最显著,当其浓度为1 mmol/L时,激活作用最大,而Co2+对其有明显的抑制作用。
磷酸甘露糖异构酶(PMI),蜡状芽孢杆菌,克隆表达,酶学性质
磷酸甘露糖异构酶(phosphomannose isomerase,简称:PMI,EC 5.3.1.8)是一种在生物体内可逆催化果糖-6-磷酸和甘露糖-6-磷酸之间相互转化的金属酶[1-2],在甘露糖代谢途径中及GDP-甘露糖的生物合成中均起着重要的作用[3-4]。近年来,有报道[5]称磷酸异构酶不仅可以催化磷酸糖之间的异构反应,也可以作用于单糖异构化,表明磷酸糖可以代替自然界中不存在的异构酶进行糖异构化作用,这些酶可以作为生物催化剂[6]来促进和简化许多化学过程来生产自然界中含量极少的稀有单糖。
L-核糖[7]是极为昂贵的稀有糖类,是合成具有抗病毒活性的核苷类化合物的潜在起始原料,在自然界并不存在。L-核糖[8]对抗肿瘤和病毒有良好的效果,并且对正常细胞的毒副作用极小,显示了强大的抗艾滋病、抗病毒中间体方面的潜能。L-核糖中间体与腺嘌呤等有机碱形成的核苷衍生物在癌症、乙肝、丙肝等疾病的治疗方面也具有重要的医学价值。近年来,多种来源磷酸异构酶[9-11]已成功应用于生物转化法制备L-核糖,但转化效率并不高,而生物转化关键性的一步就是磷酸甘露糖异构酶的催化异构作用[12]。目前,磷酸甘露糖异构酶已成功地从细菌和真菌等中克隆并在相应的表达系统中进行了表达,如大肠杆菌(E.coli)[13]、人类(H.sapiens)[14]、白色念球菌(C.albican)[15]、嗜热脱氮地芽孢杆菌(G.thermodenitrificans)[16]等。已有报道来源嗜热栖细菌(T.thermophilus)[17]、枯草芽孢杆菌(B.subtilis)[18]的磷酸甘露糖异构酶协同L-阿拉伯糖异构酶等利用L-阿拉伯糖通过生物转化法得到L-核糖,而国内几乎还没有来源于蜡状芽孢杆菌(Bacilluscereus)的磷酸甘露糖异构酶的克隆表达及有关酶学性质报道。
本文研究内容是对实验室保存的蜡状芽孢杆菌CZ中磷酸甘露糖异构酶基因进行克隆,并在E.coliBL21(DE3)中异源表达。通过在重组质粒中引入6×His-Tag标签,用镍柱HisTrap HP亲和层析纯化重组酶,并进一步研究其酶学性质,为其工业应用奠定基础。
1 材料与方法
1.1 材料与仪器
蜡状芽孢杆菌CZ菌株、大肠杆菌BL21(DE3)、大肠杆菌DH5α、质粒pET22b(+) 本实验室保存;限制性内切酶BamHI和SalI、T4DNA连接酶、Taq DNA聚合酶、pMD18-T载体及蛋白质标准分子量、DNA标准分子量、Prime START HS DNA聚合酶、细菌全基因组提取试剂盒、DNA凝胶回收试剂盒、DNA 纯化试剂盒 TaKaRa公司;蛋白质标准分子 赛默飞公司,质粒小量提取试剂盒 OMEGA公司;其他试剂 均为国产分析纯;LB培养基、LBA培养基、蓝白斑平板配制等 均按照TaKaRa商品目录配制。
PCR仪 德国Biometra东胜创新生物技术科技有限公司;Eppendorf冷冻离心机 Eppendorf公司;脱色摇床ZD-9556 常州华利达集团有限公司;超声波细胞粉碎机JY92-IIN 美国SONICS;紫外可见分光光度计UV-2802SH 上海尤尼柯仪器有限公司;SpectraMax M5 酶标仪 美国Molecular Devices;DYY-8C 型电泳仪 北京市六一仪器厂DH1008;HisTrap HP、AKTApurifer 通用电气(GE)公司。
1.2 实验方法
1.2.1pmi基因的克隆 以提取的蜡状芽孢杆菌CZ菌株的全基因组为模板,根据已发表的苏云金芽孢杆菌(BacillusthuringiensisHD1002,Genebank 登陆号:CP009349)的磷酸甘露糖异构酶的全长基因序列设计引物,利用PCR法扩增CZ中pmi基因序列,引物两端分别引入BamHI和SalI酶切位点。上游引物22bs:5′-CGCGGATCCGACTGAACCATTATTTTTT GCA-3′,下游引物22ba:5′-CGCGTCGACATATTTA CTTGAAACAATACAT-3′。PCR扩增条件:98 ℃ 10 s,55 ℃ 5 s,72 ℃ 1 min,30个循环,72 ℃延伸10 min。PCR产物泡电泳切胶回收目的片段。
1.2.2 大肠杆菌表达载体的构建 将目的片段用BamHI和SalI双酶切后切胶回收,再与双酶切后切胶回收的pET22b(+)载体片段在16 ℃下连接过夜,连接产物转化E.coliBL21(DE3)感受态细胞,涂布含氨苄青霉素抗性平板,37 ℃下培养过夜。挑取阳性转化子提质粒并送广州艾基生物公司测序,含正确克隆序列的质粒命名为pET22b(+)-pmi。
1.2.3 目的质粒在大肠杆菌中的诱导表达 将含有重组表达质粒pET22b(+)-pmi的E.coliBL21(DE3)单菌落接种于10 mL的LB液体管(含50 μg/mL的氨苄青霉素)中,37 ℃ 200 r/min培养过夜,然后以1% 接种量接入50 mL的LB液体培养基(含50 μg/mL的氨苄青霉素)中,37 ℃ 200 r/min培养至OD600为0.6时,加入IPTG诱导剂至终浓度0.1 mmol/L,在30 ℃下诱导6 h。12000 r/min下离心10 min收集菌体,保存于-80 ℃。
1.2.4 重组酶的纯化及SDS-PAGE分析 粗酶液的制备:将离心收集的菌体用50 mmol/L的Tris-HCl缓冲液(pH7.0)洗涤3次,然后按照50~100 mg/mL菌体浓度配成重悬液,冰上超声破碎(5 s,间隔时间5 s,重复100次,功率400 W),然后4 ℃ 12000 r/min下离心20 min去除细胞碎片,收集的上清液即为粗酶液。
重组酶纯化方法:将粗酶液经过0.22 μm滤膜过滤后使用GE公司的镍柱HisTrap HP进行纯化。纯化按照操作手册进行,首先使用结合缓冲液Buffer A(50 mmol/L PBS缓冲液、20 mmoL咪唑、0.5 mol/L NaCl、pH7.4)平衡预装柱,然后开始上样,当紫外吸收开始上升,同时离子浓度开始下降时,收集一管样品穿过液,再用Buffer A洗去非特异性结合,接着用洗脱缓冲液Buffer B(50 mmol/L PBS缓冲液、500 mmol/L咪唑、0.5 mol/L NaCl、pH7.4)进行梯度洗脱结合蛋白,每个梯度下观察到出峰都进行收集,最后采用Bradford法[19]进行蛋白含量的测定,以牛血清蛋白BSA溶液作标准曲线。
目的蛋白分子量的确定用标准SDS-PAGE蛋白电泳法[20],制备12%的分离胶和5%的浓缩胶,在80 V和120 V的电压下进行不连续垂直平板电泳,凝胶用考马斯亮蓝染色。
1.2.5 重组酶活力测定 Dische等[21]早期提出的测定酮糖类物质的方法,即半胱氨酸盐酸盐-咔唑法,简称BK法,以此法为基本依据稍微改进[22]用来测定重组酶pmi活力。BK法的原理是:依据酮糖物质在硫酸溶液中与显色剂咔唑反应,颜色会随着酮糖含量不同而有差别。1 mL的酶反应液[18]中分别加入10 mmol/L的L-核糖,1.5 U/mL重组酶,50 mmol/L的Tris-HCl缓冲液(pH7.0),在35 ℃下反应20 min,再加入终浓度为200 mmol/L的HCl来终止反应,最后测定酶活力。
1.2.6 重组酶酶学性质分析
1.2.6.1 最适反应温度和温度稳定性 将酶反应液分别在20、25、30、35、40、45、50、60 ℃条件下测定重组磷酸甘露糖异构酶活力以确定最适反应温度。将酶液在反应之前分别在30、35、40 ℃水浴中保温孵育0.5、1.0、1.5、2.0 h,于最适温度下测定经过不同温度孵育不同时间酶液的活力以确定酶液在不同温度下的稳定性。
1.2.6.2 最适反应pH及pH的稳定性 在最适反应温度条件下,将用于测定的底物pH分别调至5.0、6.0、7.0、7.6、8.0、9.0,测定不同pH条件下的重组磷酸甘露糖异构酶活力。然后将酶液反应前分别在pH为6.0、7.0、8.0条件下孵育3、6、9、12 h以探究不同pH下的酶的稳定性。
1.2.6.3 不同金属离子及金属离子的不同浓度对酶活力的影响 用最适pH的50 mmol/L Tris-HCl 缓冲液配制酶液,分别向酶液中加入终浓度为1 mmol/L的Ni2+、Co2+、Ca2+、Zn2+、Mn2+、Cu2+、Mg2+(以不加金属离子为对照),在最适温度下测定酶活力,探究不同金属离子对酶活力的影响。在反应体系加入浓度分别为0.5、1、2、3、4、5 mmol/L的金属离子,探究最适金属离子浓度。
2 结果与分析
2.1pmi基因的扩增及重组质粒构建
以提取的蜡状芽孢杆菌CZ全基因组作为模板,利用设计的引物22bs和22ba扩增得到pmi目的基因全长,PCR产物经1%琼脂糖凝胶电泳检测,得到与预期大小相符的基因片段,大小约为1000 bp(图1),该片段与已知的B.thuringiensis(GenBank:CP009349.1)的pmi全长同源性较高达98%。鉴定结果说明成功扩增并克隆了pmi基因片段。
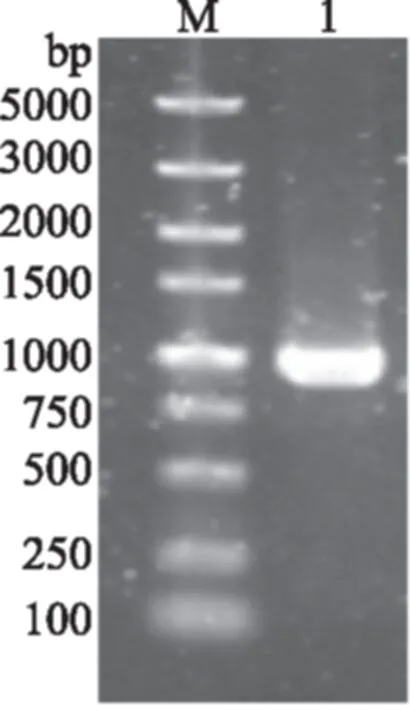
图1 PCR产物pmi电泳图Fig.1 Electrophoresis results of pmigene PCR amplifiction注:M:DNA Marker;1:PCR扩增产物。
为了实现pmi基因在E.coliBL21(DE3)中的成功表达,将扩增出的pmi基因片段连接到表达载体pET-22b(+)上,构建重组表达载体pET-22b(+)-pmi。将菌液PCR验证初步正确的阳性转化子提取质粒,用BamHI和SalI两种限制性内切酶双酶切验证重组表达质粒pET-22b(+)-pmi,经1%琼脂糖凝胶电泳检测(图2)结果显示,阳性转化子菌液PCR验证结果与目的基因大小(948 bp)基本相符,用BamHI和SalI两种限制性内切酶从表达载体pET-22b(+)-pmi切下的条带与扩增出的pmi基因片段及表达载体pET-22b(+)线性大小相符,说明pmi基因已成功插入到载体pET-22b(+)中,重组表达载体构建成功。

图2 菌液验证及重组质粒双酶切电泳图Fig.2 Electrophoresis results of the PCR of bacteria and the recombinant plasmid with double digestion 注:M:DNA Marker;1:阳性转化子菌液PCR验证;2:质粒pET-22b(+)经BamHI和SalI双酶切;3:重组质粒PET-22b(+)-pmi经BamHI和SalI双酶切。
2.2 序列分析
将初步验证正确阳性菌送测序,结果显示克隆片段大小为948 bp,编码315个氨基酸。经Clustal Omeg在线软件(http://www.ebi.ac.uk/Tools/msa/clustalo/)进行蛋白序列比对,其与来源苏云金芽孢杆菌(B.thuringiensisHD 1002)的序列同源性为97%,与枯草芽孢杆菌(B.subtilis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、肺炎链球菌(S.pneumoniae)、艾丁湖盐渍芽孢杆菌(S.aidingensis)的同源性都高达到70%以上,它们都属于cupin-like超级家族,序列比对结果如图3所示。
2.3 重组酶的异源表达及分离纯化
将重组质粒pET22b(+)-pmi转入E.coliBL21(DE3)感受态细胞中,进行目的基因诱导表达,将表达后的细胞破碎液上清进行SDS-PAGE分析。根据Protparam在线蛋白分析软件(http://web.expasy.org/protparam/)预测蛋白分子量为36.1 ku,加上表达载体上6×His-Tag标签等序列,最后推测出表达出来的目的蛋白大小约为40.8 ku左右。如(图4)所示,以空载质粒为对照,在40.8 ku处出现特征条带,且与目标蛋白的理论值吻合,说明目的基因在大肠杆菌宿主中成功实现了重组异源表达。
将粗酶液经镍柱HisTrap HP亲和层析后,收集样品穿过液和洗脱峰并进行SDS-PAGE(图5),得到一条特异性条带,结果与预测蛋白分子量相符。这与来源大肠杆菌[13]、S.typhimurium[23]、T.thermophilus[17]的PMI蛋白分子量大小(依次分别为36、42.6、29.0 ku)有所差异,可能是由于来源不同导致同一种蛋白在其生物体内具有不同的结构特性,进而分子量有所不同。
经镍柱HisTrap HP亲和层析纯化后,重组酶比酶活为6.18 U/mg,是纯化前的4.26倍,回收率为37%,结果见表1。
此外,根据1.2.4所述方法,测得蛋白质浓度标准曲线如图6所示,其标准曲线方程为Y=5.3271X+0.0055,相关系数R2=0.9955,说明在此范围内蛋白质浓度与吸光值的线性关系良好。
2.4 重组酶的酶学性质研究
2.4.1 温度对重组磷酸甘露糖异构酶的影响及重组酶的热稳定性 将纯化后的重组磷酸甘露糖异构酶在不同温度下测定酶活,结果图7(A)显示,该酶的最适作用温度为35 ℃,在30~40 ℃范围内测定酶活,相对酶活在60%以上。另外,如图7(B)所示,该酶在30、35、40 ℃保温2 h,残余酶活可保持在40%上。Yeom[16]等学者通过嗜热脱氮地芽孢杆菌(Geobacillusthermodenitrificans)来源克隆得到的PMI最适反应温度为60~70 ℃。由陆春丽[22]用常温微生物发酵得到的PMI在35~45 ℃范围时PMI酶活力整体相对较高,当温度超过50 ℃时,酶活力已经降了一半,继续升高温度后酶活力急剧减小,PMI在30 ℃时稳定性最好,与本实验结果基本一致。此外,Soo[18]研究来源B.subtilis的PMI也显示其40 ℃时酶活力反应最高。有些非嗜热性芽孢杆菌如本文研究的B.cereus生存环境就是常温,过高的温度会破坏其体内酶构象,导致酶活力降低。
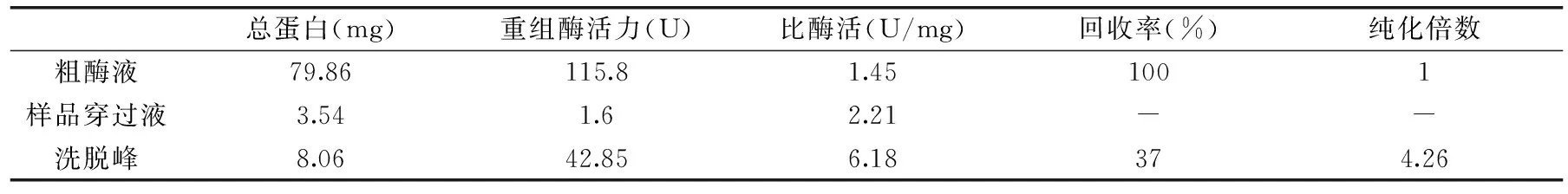
表1 重组磷酸甘露糖异构酶的纯化
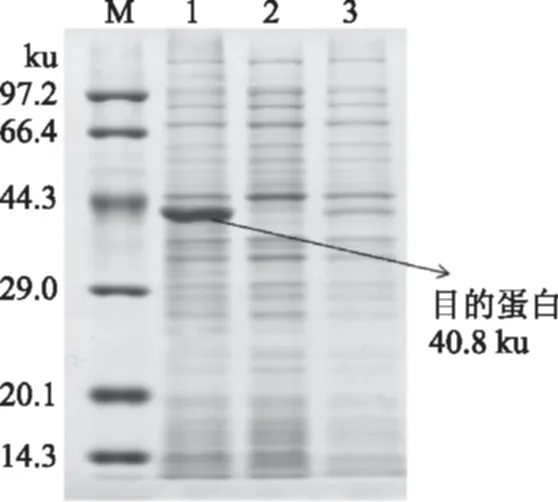
图4 重组磷酸甘露糖异构酶的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the recombinant phosphomannose isomerase注:M:低分子量蛋白标准;1:诱导表达的重组酶;2:空质粒pET-22b(+);3:未诱导的重组酶。
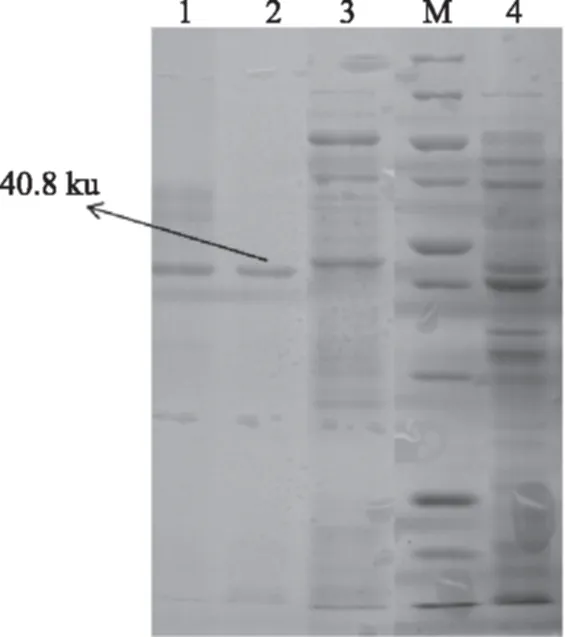
图5 重组磷酸甘露糖异构酶纯化后的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the purified recombinant phosphomannose isomerase注:M:PageRulerTM Unstained Broad Range Protein Ladder;1、2:纯化的重组酶;3:流穿液;4纯化前的重组酶。
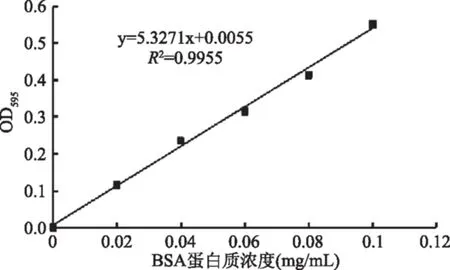
图6 蛋白质浓度标准曲线Fig.6 Standard curve of protein concentration
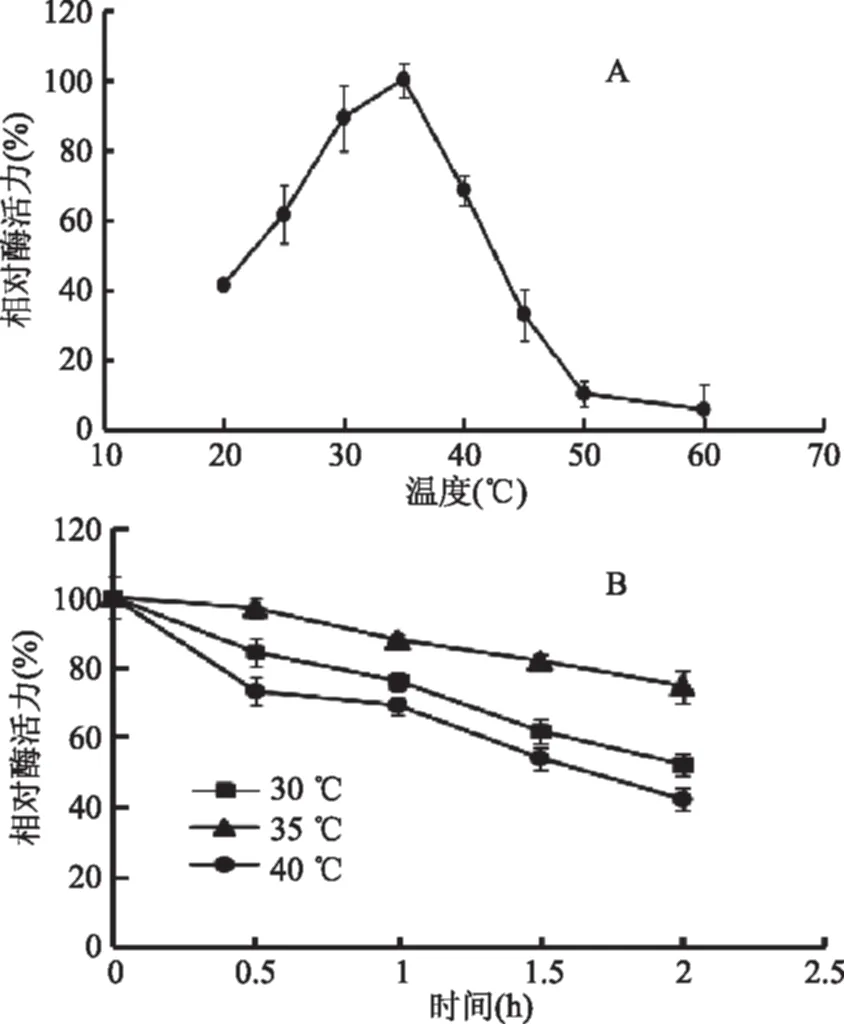
图7 温度对重组酶活力的影响及其温度稳定性Fig.7 Effect of different temperature on activity of recombinant enzyme and its thermostability注:A:温度对重组酶活力的影响;B:重组酶的温度稳定性。
2.4.2 pH对重组磷酸甘露糖异构酶的影响及重组酶的pH稳定性 将纯化后的重组磷酸甘露糖异构酶在不同pH下测定酶活,结果如图8(A)所示,该酶最适作用pH为7.0,并且在pH9.0条件下的相对酶活约为40%。可见,重组酶属于中性偏弱碱性酶;该重组酶在不同pH条件下的稳定性如图8(B)所示,在pH6.0~8.0保存12 h,残余酶活在50%以上,其中在pH为7.0时它的稳定性最好。这与Yeom团队研究的来源G.thermodenitrificans[16]、T.thermodenitrificans[17]、B.subtilis[18]的PMI的最适pH为7.0一致,推测该酶普遍适应中性条件下反应。
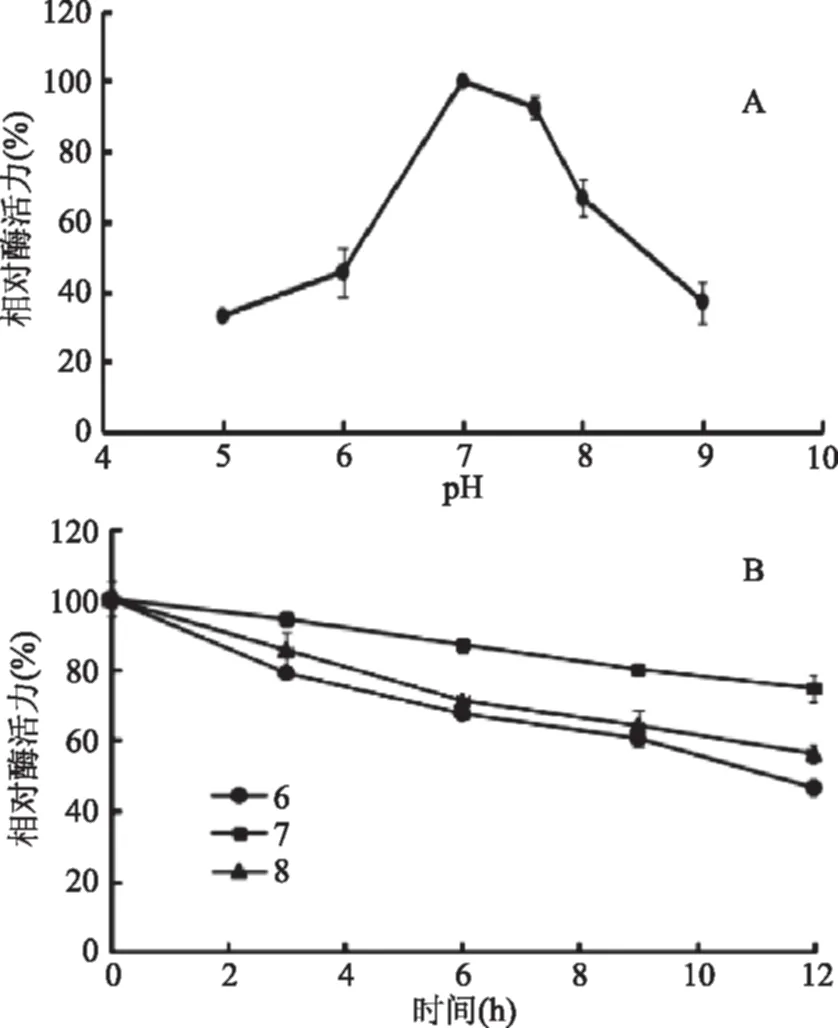
图8 pH对重组磷酸甘露糖异构酶活力的影响及酶的pH稳定性Fig.8 Effect of different pH on activity of recombinant enzyme and its pH stability注:A:pH对酶活力的影响;B:酶的pH稳定性。
2.4.3 金属对重组磷酸甘露糖异构酶的影响 金属离子的添加,对单糖异构化反应的贡献较大,因为二价金属离子对醛糖和酮糖异构酶的空间结构起到稳定作用,更重要的是这些金属离子可以结合的部位基本上是酶的活性中心[24],主要机理是作用于酮糖和醛糖的C2和C3羟基基团,进而发生异构。如图9(A)所示,低浓度Ni2+、Ca2+、Zn2+、Cu2+和Mg2+等对PMI酶表现出不同程度的激活作用,Mn2+对重组PMI有较明显的激活作用,而Co2+对重组PMI有较明显的抑制作用。图9(B)显示,不同浓度Mn2+的对酶活力有不同的激活效果,其中浓度为1 mmol/L时,酶活力最高。这结果与其他不同来源的PMI比较而言都是低浓度的金属离子对酶活有较大促进作用,当离子浓度过高反而会抑制酶反应;其次,不同的金属离子对来源不同的PMI酶有不同的作用:如Co2+对本文来源的PMI有极大的抑制作用,却对来源B.subtilis[18]、G.thermodenitrificans[12]的PMI的影响最大,是最有效的酶活促进剂,提高酶活力分别为2.5、3.0倍左右。0.5 mmol/L的Cu2+对T.thermophilus[17]来源的PMI促进作用最大达2.5倍。产生这些差异的原因可能是由于酶的活性中心不同导致的。
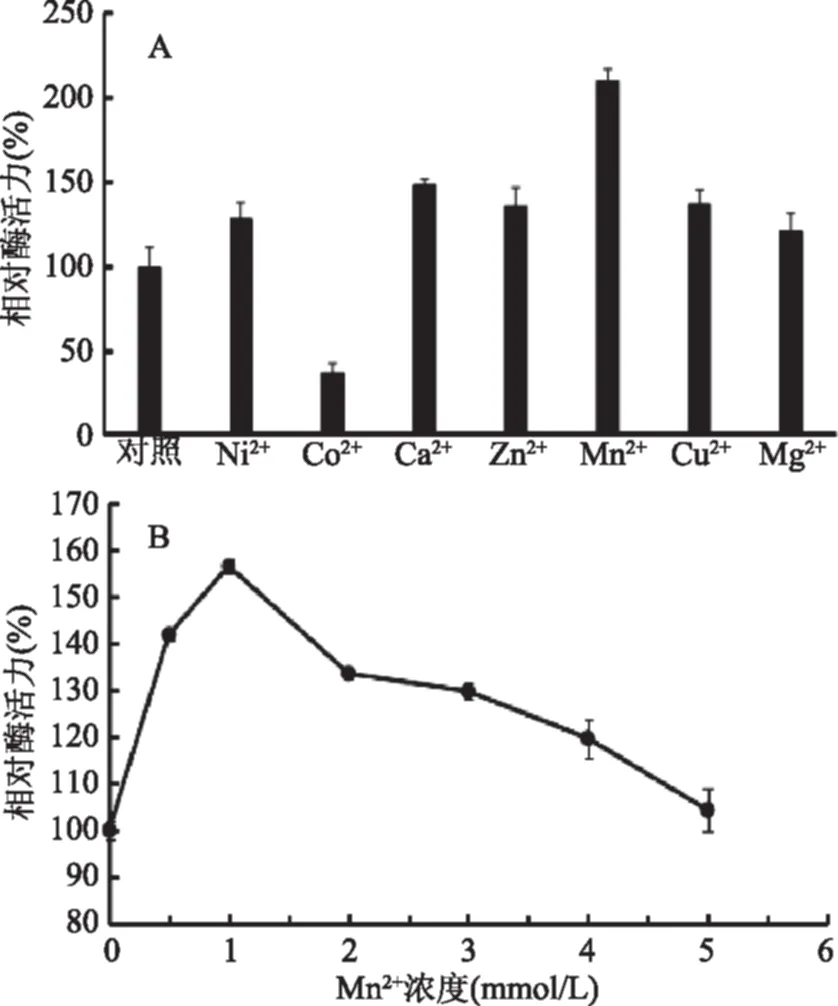
图9 不同金属离子对重组酶活力的影响及同一金属的不同浓度对重组酶活的影响 Fig.9 Effect of different metal on activity of recombinant enzyme and the effect of different concentration with same metal on recombinant enzyme 注:A:不同金属离子对酶活力的影响;B:不同浓度的Mn2+对酶活力的影响。
3 结论
成功克隆了本实验室保存的蜡状芽孢杆菌CZ中的pmi编码基因序列,全长948 bp,与已知B.thuringiensis的pmi核酸序列同源性高达98%;成功构建表达载体pET22b(+)-pmi,并获得重组菌株E.coliBL21(DE3)-pET22b(+)-pmi,其在培养至OD600值达到0.6左右加入0.1 mmol/L IPTG在30 ℃诱导6 h成功表达重组PMI蛋白。经镍柱HisTrap HP亲和层析法纯化后得到纯化目的蛋白,分子量约为40.8 ku。活性特征鉴定表明,重组PMI最适反应温度为35 ℃,最适反应pH为7.0,属于中性酶,低浓度Ni2+、Ca2+、Zn2+、Cu2+和Mg2+对其有不同程度激活作用,Mn2+对该酶激活作用较为明显,当Mn2+离子浓度为1 mmol/L时,对酶活激活作用达到最大,而Co2+对该酶有较明显的抑制作用。
[1]Cleasby A,Wonacott A,Skarzynski T,et al. The x-ray crystal structure of phosphomannose isomerase from Candida albicans at 1.7 angstrom resolution[J]Nature Structural & Molecular Biology,1996,3(5):470-479.
[2]Jensen S O,Reeves P R. Domain organisation in phosphomannose isomerases(types I and II)[J]. Biochim Biophys Acta,1998,1382(1):5-7.
[3]Roux C,Gresh N,Perera L E,et al. Binding of 5-phospho-D-arabinonohydroxamate and 5-phospho-D-arabinonate inhibitors to zinc phosphomannose isomerase from Candida albicans studied by polarizable molecular mechanics and quantum mechanics[J]. Journal of Computational Chemistry,2007,28(5):938-957.
[4]Wills E A,Roberts I S,Del P M,et al. Identification and characterization of the Cryptococcus neoformans phosphomannose isomerase-encoding gene,MAN1,and its impact on pathogenicity[J]. Molecular Microbiology,2001,40(3):610-620.
[5]Oh D K,Kim H J,Ryu S A,et al. Development of an immobilization method of L-arabinose isomerase for industrial production of tagatose[J].Biotechnology Letters,2001,23(22):1859-1862.
[6]Rose I A,O'Connell E L,Schray K J. Mannose 6-phosphate:anomeric form used by phosphomannose isomerase and its 1-epimerization by phosphoglucose isomerase[J]. Journal of Biological Chemistry,1973,248(6):2232-2234.
[7]Hu C,Li L,Zheng Y,et al. Perspectives of biotechnological production of L-ribose and its purification[J]. Appl Microbiol Biotechnol,2011,92(3):449-455.
[8]詹伊婧,徐铮,许露,等. L-核糖的生产研究进展[J]. 生物加工过程,2013(5):74-78.
[9]Yeom S J,Ji J H,Yoon R Y,et al. L-Ribulose production from L-arabinose by an L-arabinose isomerase mutant from Geobacillus thermodenitrificans[J].Biotechnology Letters,2008,30(10):1789-1793.
[10]Helanto M,Kiviharju K,Granstrom T,et al. Biotechnological production of L-ribose from L-arabinose[J]. Applied Microbiology and Biotechnology,2009,83(1):77-83.
[11]Park C,Yeom S,Kim H,et al. Characterization of ribose-5-
phosphate isomerase of Clostridium thermocellum producing D-allose from D-psicose[J].Biotechnology Letters,2007,29(9):1387-1391.
[12]Lim Y R,Yeom S J,Oh D K. Production of L-ribose from L-ribulose by a triple-site variant of mannose-6-phosphate isomerase from Geobacillus thermodenitrificans[J].Applied and Environmental Microbiology,2012,78(11):3880-3884.
[13]张倩,廖玉才,陈方方,等. 大肠杆菌6-磷酸甘露糖异构酶基因的克隆与表达[J]. 华中农业大学学报,2006(5):461-464.
[14]Schollen E,Dorland L,de Koning T J,et al. Genomic organization of the human phosphomannose isomerase(MPI)gene and mutation analysis in patients with congenital disorders of glycosylation type Ib(CDG-Ib)[J].Human Mutation,2000,16(3):247-252.
[15]Wells T N,Scully P,Magnenat E. Arginine 304 is an active site residue in phosphomannose isomerase from Candida albicans[J]. Biochemistry,1994,33(19):5777-5782.
[16]Yeom S J,Kim N H,Yoon R Y,et al. Characterization of a mannose-6-phosphate isomerase from Geobacillus thermodenitrificans that converts monosaccharides[J]. Biotechnology Letters,2009,31(8):1273-1278.
[17]Yeom S,Seo E,Kim B,et al. Characterization of a Mannose-6-Phosphate Isomerase from Thermus thermophilus and Increased L-Ribose Production by Its R142N Mutant[J].Applied Microbiology and Biotechnology,2011,77(3):762-767.
[18]Yeom S J,Ji J H,Kim N H,et al. Substrate specificity of a mannose-6-phosphate isomerase from Bacillus subtilis and its application in the production of L-ribose[J].Applied and Environmental Microbiology,2009,75(14):4705-4710.
[19]Seongjin K,Hyowon Y,Honggye S. Spray Combustion Dynamic in A Supersonic Propulsion System[M],2010:1123-1126.
[20]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.[J]. Analytical Biochemistry,1976,72:248-254.
[21]Dische Z,Borenfreund E. A new spectrophotometric method for the detection and determination of keto sugars and trioses[J]. The Journal of Biological Chemistry,1951,192(2):583-587.
[22]陆春丽.生物酶法制备L-核糖[D]. 北京:北京化工大学,2012.
[23]Sagurthi S R,Gowda G,Savithri H S,et al. Structures of mannose-6-phosphate isomerase from Salmonella typhimurium bound to metal atoms and substrate:implications for catalytic mechanism[J]. Acta Crystallographica Section D-biological Cristallography,2009,65:724-732.
[24]Chouayekh H,Bejar W,Rhimi M,et al. Characterization of an l-arabinose isomerase from the Lactobacillus plantarum NC8 strain showing pronounced stability at acidic pH[J].FEMS Microbiology Letters,2007,277(2):260-267.
Gene cloning and expression of a phosphomannose isomerase fromBacilluscereusCZ and characterization of the recombinant enzyme
ZHANG Yao,CUI Tang-bing*,SONG Yan
(School of Biological Science and Bioengineering,South China University of Technology,Guangzhou 510006,China)
TheBacilluscereusCZ phosphomannose isomerase gene(pmi)were cloned and heterogeneously expressed inEscherichiacoli. Thepmigene which was amplified by using PCR was connected with pET-22b(+)expression vector,then the recombinant plasmid was transferred toE.coliBL21(DE3). The recombinant strain BL21-pET22b(+)-pmiwas constructed and successfully expressed recombinant enzyme. The results showed that pmigene(948 bp)was cloned and encoded 315 amino acids. The crude recombinant enzyme was purified by HisTrap HP Ni-affinity chromatography and the molecular mass of the purified recombinant enzyme was detected about 40.8 ku. The enzymatic characteristics analysis showed that the optimal temperature was estimated to be 35 ℃,and it retained relatively stable at 30~40 ℃. Meanwhile,the optimal pH of the recombinant enzyme was around 7.0,and relative enzyme activity was retained 50% in weak alkaline environment for 12 h. Various low concentrations of metal ion,such as Ni2+,Ca2+,Zn2+,Cu2+,Mg2+,could activate the recombinant enzyme in different degree. Mn2+had most obviously of activation with a concentration of 1 mmol/L,whereas Co2+had obviously inhibitory effect on the recombinant enzyme.
phosphomannose isomerase;Bacilluscereus;cloning and expression;enzymatic characteristics
2016-09-26
张瑶(1993-),女,硕士研究生,研究方向:生物工程,E-mail:934952552@qq.com。
*通讯作者:崔堂兵(1967-),男,博士,教授,研究方向:发酵工程、酶工程、生物制药等,E-mail:fetbcui@scut.edu.cn。
广东省自然科学基金(S2013010013162)。
TS201.3
A
1002-0306(2017)06-0195-06
10.13386/j.issn1002-0306.2017.06.029
