松乳菇多糖对人喉癌Hep-2细胞肿瘤相关基因转录的影响
2017-04-14闫香慧侯怡铃
刘 影,丁 祥,2,刘 露,闫香慧,钱 叶,侯怡铃,*
(1.西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室,四川南充 637009;2.西华师范大学环境科学与工程学院,四川南充 637009)
松乳菇多糖对人喉癌Hep-2细胞肿瘤相关基因转录的影响
刘 影1,丁 祥1,2,刘 露1,闫香慧1,钱 叶1,侯怡铃1,*
(1.西华师范大学生命科学学院,西南野生动植物资源保护教育部重点实验室,四川南充 637009;2.西华师范大学环境科学与工程学院,四川南充 637009)
运用基因芯片技术分析松乳菇多糖对人喉癌Hep-2细胞肿瘤相关基因表达的影响及分子机制。结果表明,经松乳菇多糖600 μg/mL处理48 h后,在人喉癌Hep-2细胞中发现相关肿瘤差异基因共68个,其中人喉癌Hep-2细胞肿瘤相关基因下调倍数大于100倍的基因共8个,下调50~100倍的基因共14个,同时按基因转录水平将这些基因进行了分类。运用KEGG(Kyoto Encyclopedia of Genes and Genomes)通路分析技术分析相关基因通路,结果显示松乳菇多糖主要抑制人喉癌Hep-2细胞中的MAPK信号转导通路和PI3K-AKT信号转导通路。在松乳菇多糖的刺激作用下,人喉癌Hep-2细胞的凋亡是多种基因共同作用的综合结果。用筛选出的基因进一步研究肿瘤凋亡的分子机制,对寻找潜在的抗肿瘤作用靶点具有重要生物学意义。
松乳菇多糖,人喉癌Hep-2细胞,基因芯片,凋亡
松乳菇(Lactariusdeliciosus(L.ex Fr.)Gray)为担子菌亚门、层菌纲、伞菌目、红菇科、乳菇属的真菌,是一种纯天然的珍稀的野生可食用菌类。松乳菇多数是植物外生菌根菌,主要分布于温带地区的松林地带。松乳菇含有羧基有机酸、羟基酚类、多糖类、倍半萜烯类等多种生理活性物质,在生物医药行业和植物林业病虫害的生物防治方面有广阔的应用前景[1-6]。多糖又称多聚糖,是由聚合度大于10的单糖通过糖苷键聚合脱水形成的极性复杂大分子,分子量大小一般为1~100 ku,是生命活动中需要的四大基本物质的一员,维持生命所需的多种生理功能。至今,从天然产物中分离出来的多糖类化合物己有300余种,其中,从药用植物和食药用真菌中提取出来的水溶性多糖最为重要,并已发现从很多药用植物、食药用真菌提取的糖以及糖缀合物具有很广泛的药理及生物活性。近20年来,已有较多学术研究对多糖生物活性的免疫调节、抗肿瘤、抗氧化和抗辐射等方面进行报道[7-8]。
在前期实验研究中,从食用真菌松乳菇(Lactariusdeliciosus(L.ex Fr.)Gray)中纯化所得的水溶性的松乳菇多糖(LDG-A),运用光谱学技术解析了其结构(图1),结果显示其为一种结构新颖的多糖(LDG-A)[9]。此多糖是由两个单糖以糖苷键的方式组成的杂多糖,即α-L-甘露糖和α-D-木糖,以3∶1的比例混合组成,平均分子量约为11 ku,具有(1-6)α-L-甘露糖的骨架,2-O上连接一个→3)-α-D-木糖的侧链,且松乳菇多糖(LDG-A)对人喉癌Hep-2细胞显示了较强的抑制作用,浓度为600 μg/mL时,最高抑制率达到50.8%[10],但相关分子机制仍不清楚。
本文的主要目的是探究在LDG-A的刺激下,人喉癌Hep-2细胞肿瘤相关基因转录的变化影响,以研究其抗肿瘤活性的机制,探寻潜在的抗肿瘤作用靶点,为LDG-A诱导人喉癌Hep-2细胞凋亡的分子机制研究提供一定的科学依据。
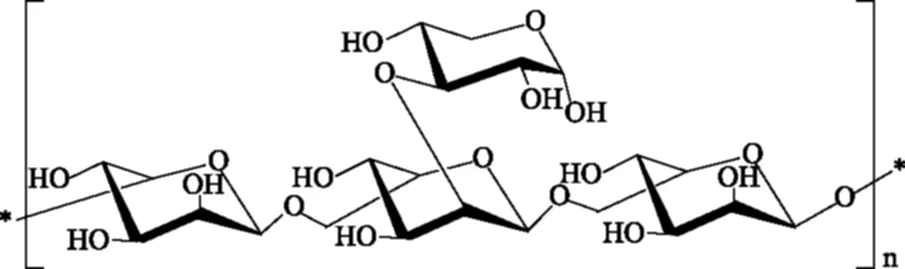
图1 松乳菇多糖(LDG-A)的结构Fig.1 The structure of polysaccharide LDG-A
1 材料与方法
1.1 材料与仪器
LDG-A 本实验室前期分离纯化;人喉癌Hep-2细胞系 川北医学院;细胞培养基RPMI-1640 gibco公司,LOT:1785905;胎牛血清 CLARK公司,Cat No:JC39761;青链霉素双抗溶液Penicillin-Streptomycin gibco公司;mRNA反转录试剂盒 楚天生物,Cat No:CTB101;实时荧光定量PCR检测试剂盒Real-Time PCR Master Mix 楚天生物,Cat No:CTB103;荧光定量PCR混合液SYBR Master Mix 楚天生物,Cat No:CTB103;楚天生物PCR 芯片 楚天生物芯片有限公司。
Real-time PCR 仪 购于Bio-rad公司,No:CFX96。
1.2 实验方法
1.2.1 细胞培养 将Hep-2细胞接种于含有热灭活10%胎牛血清的RPMI 1640培养液中,在浓度为5%的CO2培养箱中37 ℃培养,取在对数生长期的细胞使其细胞浓度调整为5×104mL,细胞贴壁率至少达到80%后,加LDG-A处理细胞(终浓度控制为600 μg/mL),在37 ℃、5% CO2、饱和湿度下常规培养48 h。对照组除不加松乳菇多糖LDG-A外,其余操作相同。培养板上每组各设3个复孔。
1.2.2 RNA抽提及RNA反转录 依次用细胞计数器从每个样品中取出5×104个细胞,采用Unizol 法来抽提细胞总RNA,电泳后,结果显示18S和28S RNA的条带非常清晰,流程参照楚天生物mRNA反转录试剂盒说明书来进行RNA 反转录具体操作。等反转录反应结束以后,用ddH2O将反转录产物稀释至100 μL备用。
1.2.3 PCR芯片Real-Time PCR检测 取出荧光定量PCR混合液(SYBR Master Mix),使其充分融解,同时上下轻微颠倒使其混合均匀,稍稍短暂离心(5000 r/min)后放置在冰上备用。处理SYBR Master Mix的同时取出楚天生物PCR芯片,将其温度调至室温且短暂离心(5000 r/min)后待用。依照说明书配制PCR的反应液且充分混匀,精确仔细分取PCR反应液20 μL加至96孔PCR芯片中,用热封模封好,少许离心(5000 r/min),进一步确保所有的试剂都在反应管底部。PCR反应程序循环条件为:预变性95 ℃ 5 min,变性95 ℃ 15 s,退火60 ℃ 1 min,延伸72 ℃ 45 s,40个循环。熔解曲线分析条件为:95 ℃×5 s,65 ℃×1 min,95 ℃×0 s,冷却40 ℃×30 s。
1.2.4 数据分析 本研究采用经典ΔΔCt法做相对定量。在这次实验中,ΔΔCT方程式为:ΔΔCT=(CT目标样本-CT参考样本)-(CT目标空白对照-参考空白对照)。ΔΔCT用于计算表达倍的变化。其计算公式如下:实验组目标基因的表达水平/空白对照组目标基因的表达水平=2(-ΔΔCT)。
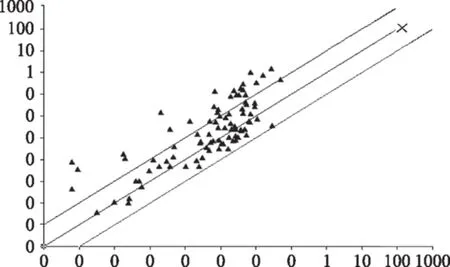
图2 LDG-A诱导人喉癌Hep-2细胞凋亡的相关肿瘤差异基因散点图Fig.2 The differential gene expression of in Hep-2 cells treated by LDG-A
2 结果与分析
前期研究发现,LDG-A对人喉癌Hep-2细胞有较强的抑制作用。终浓度为600 μg/mL时,LDG-A对人喉癌Hep-2细胞的最高抑制率达到50.8%。为探究LDG-A诱导人喉癌Hep-2细胞凋亡的分子机制,使用基因芯片技术检测分析了人喉癌Hep-2细胞中肿瘤相关的88个基因。
2.1 LDG-A诱导人喉癌Hep-2细胞凋亡的相关肿瘤差异基因散点图

表1 LDG-A作用Hep-2细胞导致上调的差异表达基因

表2 LDG-A作用Hep-2细胞导致下调100倍以上的差异表达基因

表3 LDG-A作用Hep-2细胞导致下调50~100倍的差异表达基因
结果显示,把实验组与空白组相比较,有明显差异的基因共68个,涉及细胞因子、信号传导、细胞凋亡和细胞周期等相关基因,其中5个基因表达上调,63个基因表达下调(图2)。基因表达下调100倍以上有8个,50~100倍有14个,50倍以下41个。
2.2 基因的分类
按基因表达水平将基因表达上调、下调100倍以上及50~100倍的基因进行分类,具体结果见表1~表3。
2.3 LDG-A抑制表皮生长因子受体家族基因的表达变化
表皮生长因子受体EGFR(Epidermal growth factor receptor,简称为EGFR、ErbB-1或HER1)是表皮生长因子受体(HER)家族成员之一。该家族包括HER1(erbB1,EGFR)、HER2(erbB2,NEU)、HER3(erbB3)及HER4(erbB4)。在细胞中HER家族有重要的调节作用。EGFR大部分分布于哺乳动物上皮细胞、胶质细胞、成纤维细胞、角质细胞等细胞表面,EGFR信号通路对细胞的生理过程有极为重要的作用[11]。在LDG-A的作用下,人喉癌Hep-2细胞中EGFR、E40OG、ERBB3都呈不同程度的下调,其中E40OG下调76.30倍,EGFR下调273.09倍,提示LDG-A通过抑制表皮生长因子受体(HER)家族,抑制信号传至胞核内,导致核内转录因子无法磷酸化,抑制靶基因的转录,最终抑制肿瘤细胞生长和导致肿瘤细胞凋亡。
2.4 LDG-A抑制转化生长因子-β基因的表达
转化生长因子-β(Transforming growth factor-β,TGF-β)是近来发现TGF-β超家族的成员,其功能是调节细胞生长和分化。在松乳菇多糖的刺激作用下,人喉癌Hep-2细胞中TGFβ1下调了105.03倍,提示LDG-A通过抑制转化生长因子-β,从而抑制肿瘤周围基质环境的改变,抑制上皮细胞间充质的转化,抑制血管新生,从而抑制肿瘤细胞生长和导致肿瘤细胞凋亡。[12]。
2.5 LDZ-A抑制髓样分化因子MYD88的基因表达
髓样分化因子(Myeloiddifferentiationfactor88,MyD88)是Toll样受体(Toll-likereceptor,TLR)信号通路中的一个关键接头分子,在传递上游信息的过程中发挥重要作用,在疾病的发生发展中也起一定生理作用[13]。MyD88,一种胞质可溶性蛋白质,为Toll/IL-lR家族和死亡结构域家族组员之一,在松乳菇多糖LDG-A的作用下,人喉癌Hep-2细胞中MyD88下调63.30倍,提示LDG-A通过抑MyD88蛋白,从而抑制调节核转录因子kappa B(NF-κB)产生,导致肿瘤细胞生长抑制和肿瘤细胞凋亡[14]。
2.6 LDG-A影响Asp特异性半胱氨酸蛋白酶Casp家族的基因变化
细胞凋亡由Asp特异性半胱氨酸蛋白酶(Caspartate-specific cysteinyl-proteinase,Caspase或Casp)家族介导,活化Casp,引发酶级联效应,最终使细胞内的染色体DNA降解,随后细胞膜解体,细胞破裂死亡,因此Asp特异性半胱氨酸蛋白酶又称为死亡蛋白酶。研究发现,Casp家族在细胞凋亡和炎症反应过程中,已经有14种Casp(1-14)参与其中。Casp按功能分为启动子Casp(Casp-2,8,9,10)和效应子Casp(Casp-3,6,7)。被激活的效应子由启动子启动激活,效应为:细胞凋亡。而启动子Casp则被特定的结合蛋白、其他Casp及本身激活,使凋亡信号与Casp结合,改变构型,决定两种基本凋亡途径,即线粒体途径和死亡受体途径[15]。在LDG-A的作用下,人喉癌Hep-2细胞中CASP2下调57.94倍,提示LDG-A诱导肿瘤细胞凋亡并不依赖于线粒体途径和死亡受体途径两种基本凋亡途径。
2.7 LDG-A影响CD40L基因转录
白细胞分化呈递的抗原40和其配体(CD40/CD40L)能提高肿瘤细胞的抗原递呈能力,上调内源肿瘤肽的表达,从而提高肿瘤的免疫应答[16-17]。在LDG-A的作用下,人喉癌Hep-2细胞中CD40LG下调87.88倍,提示LDG-A可影响肿瘤细胞的免疫应答。
2.8 影响丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族的基因通路
MAPK属于丝氨酸-苏氨酸蛋白激酶。MAPK通路主要包括MAPK激酶激酶(MAP kinase kinase kinase,MKKK)、MAPK激酶(MAP kinase kinase,MKK)和MAPK依次被激活,一起调控着细胞的多种重要的细胞生理或病理过程[18-19]。在LDG-A的作用下,人喉癌Hep-2细胞中MAP3K1、MAP3K10、MAP3K11、MAP3K14、MAP3K5、MAPK1、MAPK3、MAPK8、MAPK9基因均呈现不同程度的下调,其中MAP3K10,MAP3K14,MAPK3 分别下调83.90倍,183.46倍和67.02倍。KEGG通路分析显示在松乳菇多糖的刺激作用下,人喉癌Hep-2细胞基因中的MAPK信号转导通道被抑制(图3),提示松乳菇多糖(LDG-A)通过抑制MAPK信号转导通路抑制肿瘤细胞生长和导致肿瘤细胞凋亡。
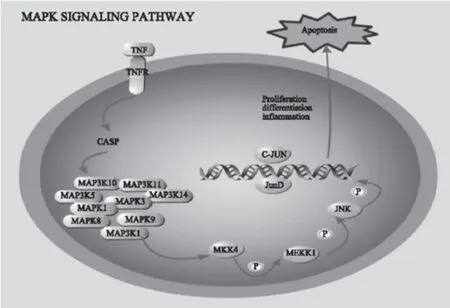
图3 松乳菇多糖LDG-A影响人喉癌Hep-2细胞中MAPK信号转导通路Fig.3 MAPK signal transduction pathway in human laryngeal carcinoma Hep-2 cells was affected by the polysaccharide(LDG-A)注:长方形标记的基因为涉及的下调基因;图4同。
2.9 影响PI3K-AKT信号转导通路中的相关基因通路
PI3K家族中Ⅰ型PI3K被研究的最多,是被细胞表面受体所激活的蛋白Ⅰ型PI3K,在哺乳动物细胞中又被分为ⅠA和ⅠB两个亚型,ⅠA从酪氨酸激酶连接受体开始传递信号,ⅠB 从G蛋白连接受体开始传递信号。由催化亚单位p110和调节亚单位p85结合,构型发生改变组成新的结构ⅠA型PI3K,新的结构具有类脂激酶和蛋白激酶的两种活性的功能[20-22];PI3K被激活有两种方式,一种方式是和具磷酸化酪氨酸残基的生长因子受体或连接蛋白相互作用,改变此聚体的构象而被激活,另一种方式是由Ras蛋白和p110蛋白直接结合,PI3K被活化,结果产生第二信号,即Akt蛋白,Akt蛋白和PDK1相互作用,由此促使PDK1磷酸化Akt蛋白的Ser308而使Akt的活化;活化的Akt通过磷酸化作用激活或抑制其下游靶蛋白Bad、Caspase9、NF-kB、FKHR、GSK-3、p21Cip1和p27Kip1等,以进而调节细胞的多种细胞生理或病理过程[23]。在松乳菇多糖(LDG-A)的作用下,Hep-2细胞中JAK、PIK3CA,PIK3CG,PIK3R2,AKT1,AKT2,AKT3,APAF1均有不同程度下调,其中AKT1,AKT2分别下调76.92倍和120.48倍。KEGG通路分析显示在松乳菇多糖的刺激作用下,人喉癌Hep-2细胞基因中的PI3K-AKT信号转导通道被抑制(图4),提示松乳菇多糖(LDG-A)通过抑制PI3K-AKT信号转导通路抑制肿瘤细胞生长和导致肿瘤细胞凋亡。
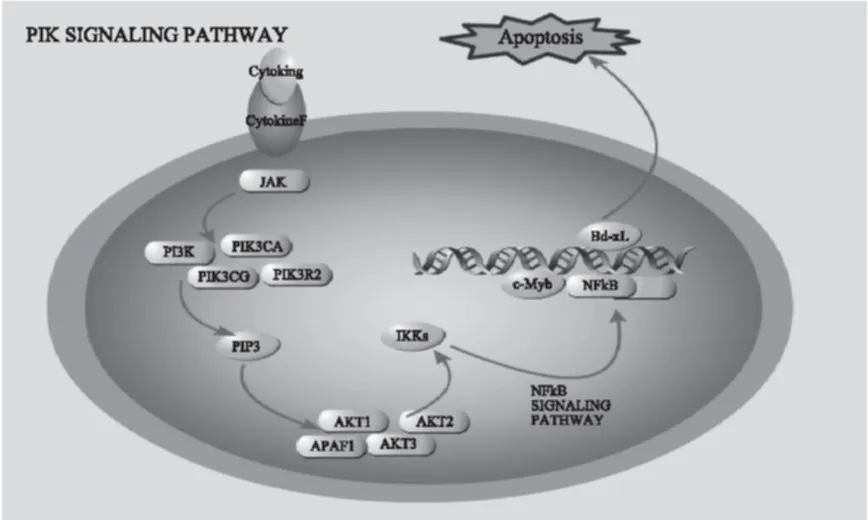
图4 LDG-A影响人喉癌Hep-2细胞中PI3K-AKT信号转导通路Fig.4 PI3K-AKT signal transduction pathway in human laryngeal carcinoma Hep-2 cells affected by the polysaccharide(LDG-A)
3 结论
在LDG-A作用下,人喉癌Hep-2细胞增殖被抑制,部分细胞被诱导凋亡,这是一个多基因共同参与、协同作用的过程。其中,5个基因显示上调,63个基因显示下调,KEGG通路分析结果显示LDG-A主要抑制人喉癌Hep-2细胞中的MAPK信号转导通路和PI3K-AKT信号转导通路。比较LDG-A作用前后基因表达谱的改变,可以深入研究这些差异表达的基因及之间的联系和相互的调控机制,为LDG-A诱导人喉癌Hep-2细胞凋亡的分子机制的研究提供更多的科学依据。
[1]熊涛,肖满. 松乳菇研究进展[J]. 食品与发酵工业,2005,31(5):84-86.
[2]Ayer W A,Trifonov L S. Aromatic compounds from liquid culture of Lactarius delicious[J].Journal of Natural Products,1994,57(6):839-841.
[3]Bergendorff O,Sterner O. The sesquiterpenes of Lactarius delicious and Lactarius deterrimus[J]. Phytochemistry,1988,27(1):97-100.
[4]Ke LX,Yang XT,Jong SC. Isolation and partial analysis of a polysaccharide-protein complex from Lactarius deliciosus[J]. Micologia Aplicada International,2003,15(2):45-50.
[5]柯丽霞. 松乳菇的抗菌活性研究[J]. 安徽师范大学学报:自然科学版,2002,25(1):63-64.
[6]任慧波,杜丽飞,肖兵南,等. 松乳菇菌丝体胞内多糖与胞外多糖体外抑菌实验[J]. 饲料工业,2009,30(20):31-32.
[7]Carolyn RB,Laura LK. Chemical glycobioloy[J]. Science,2001,291(5512):2357-2364.
[8]李建平,何轩,姜蓉,等. 人参多糖对K562细胞基因表达谱的影响[J]. 中草药,2011,45(5):940-943.
[9]Ding X,Hou Y,Hou W. Structure feature and antitumor activity of a novel polysaccharide isolated from Lactarius deliciosus Gray[J]. Carbohydrate Polymers,2012,89(2):397-402.
[10]陈杨琼,丁祥,伍春莲,等. 松乳菇多糖抗肿瘤和免疫调节活性研究[J]. 食用菌学报,2012,19(3):73-78.
[11]刘彤华. 表皮生长因子受体家族与靶向性抗癌治疗[J]. 中华病理学杂志,2006,35(10):577-579.
[12]俞清翔. 转化生长因子β与肿瘤转移的研究进展[J]. 世界华人消化杂志,2006,14(25):2538-2541.
[13]赵鑫鑫,赵慧玲,汪艳秋. 髓样分化因子MyD88与天然免疫系统中Toll样受体的关系[J],安徽农学通报,2011,17(7):50-51.
[14]孙善美,宋鲁成. TLR4与肿瘤细胞凋亡相关性的研究进展[J]. 临床肿瘤学杂志,2016,21(7):661-664.
[15]刘正清,金道忠,马志健. 死亡蛋白酶与细胞凋亡调控及机制[J]. 中国现代医学杂志,2002,12(1):30-32.
[16]杨灏,贺福初,周钢桥. CD40L/CD40轴的生物学功能及其与疾病的关系研究进展[J]. 苏州大学,国际免疫学杂志,2007,30(6):384-388.
[17]王新,刘群. 中国人群CD40LG基因单核苷酸多态性对急性冠状动脉综合征影响的相关性研究[J]. 中国动脉硬化杂志,2012,20(1):64-68.
[18]吴冬,欧俊,惠宁. 丝裂原激活的蛋白激酶(MAPK)信号转导通路与卵巢上皮癌[J]. 肿瘤,2007,27(8):676-678.
[19]侯学伶,李祥,彭宏君,等. EV71感染横纹肌肉瘤细胞与MAPK信号通路分子基因差异表达的相关性[J]. 临床检验杂志,2012,30(8):605-609.
[20]韦士勤,李常颖,李保国,等. 沉默PIK3C2B基因的表达可抑制前列腺癌PC-3细胞的增值及侵袭[J]. 肿瘤,2015,35(10):1063-1069.
[21]齐亚飞. PI3K/Akt信号通路与卵巢癌耐药关系的研究[J]. 中国医科大学,2008(5):657-660.
[22]王生才,房居高,倪鑫,等. RNA干扰介导的PIK3CA基因沉默抑制Hep-2细胞增值和侵袭力[J]. 中国耳鼻喉头颈外科,2009,16(3):119-122.
[23]蒲蓉,李为民,刘丹,等. AKT2及磷酸化AKT2在非小细胞肺癌中的表达及临床意义[J]. 四川大学学报:医学报,2010,41(4):586-589.
Effect ofLactariusdeliciosus(L. ex Fr.)Gray polysaccharides(LDG-A) on tumor associated genes in human laryngeal carcinoma Hep-2 cells
LIU Ying1,DING Xiang1,2,LIU Lu1,YAN Xiang-hui1,QIAN Ye1,HOU Yi-ling1,*
(1.Key Laboratory of Southwest China Wildlife Resources Conservation(Ministry of Education),College of Life Sciences,China West Normal University,Nanchong 637009,China;2.College of Environmental Science and Engineering,China West Normal University,Nanchong 637009,China)
The gene expression and molecular mechanism of cell apoptosis in human laryngeal carcinoma Hep-2 cells induced byLactariusdeliciosusGray polysaccharide(LDG-A)were investigated using genes chips. The results showed there were total 68 genes,which expressed differently treated with LDG-A. Among the 68 genes,8 of them were down-regulated 100 times,and 14 of them were down-regulated 50~100 times. At the same time,these genes were classified according to their transcription level. Using the KEGG(Kyoto Encyclopedia of Genes and Genomes)pathway analysis technique to analyze the related gene pathway,the results showed that LDG-A mainly inhibited the MAPK signal pathway and PI3K-AKT signal pathway in Hep-2 cells. The apoptosis of human laryngeal carcinoma Hep-2 Cells was the combined result of interaction of multiple genes under the treatment of LDGA. Using these screened genes to further study the molecular mechanism of apoptosis of tumor had important biological significance in search for potential anticancer targets.
Lactariusdeliciosus(L. ex Fr.)Gray polysaccharide;human laryngeal carcinoma Hep-2 cells;gene chip;apoptosis
2016-08-29
刘影(1991-),女,在读硕士研究生,主要从事细胞生物学方面的研究,E-mail:827293725@qq.com。
*通讯作者:侯怡铃(1983-),女,博士,教授,主要从事生物化学与分子生物学方面的研究,E-mail:starthlh@126.com。
国家自然科学基金项目(31400016);四川省教育厅重大培育项目(14CZ0016)。
TS201.2
A
1002-0306(2017)06-0174-05
10.13386/j.issn1002-0306.2017.06.025
