骨性关节炎滑膜醛缩酶及烯醇酶的差异表达
2017-04-14黄巧婷高维纬曹建民
黄巧婷, 许 杰, 高维纬, 曹建民
(1.成都大学 体育学院, 四川 成都 610106; 2.北京体育大学 运动人体科学学院, 北京 100084)
骨性关节炎滑膜醛缩酶及烯醇酶的差异表达
黄巧婷1, 许 杰1, 高维纬2, 曹建民2
(1.成都大学 体育学院, 四川 成都 610106; 2.北京体育大学 运动人体科学学院, 北京 100084)
通过分析膝关节骨性关节炎患者及对照受试者滑膜中醛缩酶及烯醇酶的差异蛋白表达,为骨性关节炎的发病机理研究提供新的思路.获取10名膝关节骨性关节炎患者(实验组)和同期10名对照受试人员(对照组)膝关节滑膜,二维凝胶电泳技术分离蛋白质,并采用基质辅助激光解析质谱技术鉴定差异表达蛋白质.结果显示,骨性关节炎组和对照组滑膜相比,醛缩酶及烯醇酶均仅存于骨性关节炎组中,而对照组中并未出现这两种蛋白.结果表明,醛缩酶、烯醇酶仅在实验组中表达,可通过调节细胞能量活动参与骨性关节炎的发病过程.
骨性关节炎;蛋白质组学;醛缩酶;烯醇酶
0 引 言
骨性关节炎(osteoarthritis,OA)是一种常见的影响中老年人生活质量的慢性关节疾病,其主要的病理表现为关节软骨面退行性变和继发性骨质增生[1].研究发现,骨性关节炎的发病过程中伴随着炎症反应,并累及关节滑膜,即产生相应的病理变化过程——滑膜炎[2].核磁共振成像和超声波扫描显示,骨性关节炎早期已伴有滑膜炎症反应,滑膜炎症反应的活性分子有血清C-反应蛋白、软骨寡聚基质蛋白、透明质酸与血清II胶原等,它们与骨性关节炎的发生发展相关联[3].骨性关节炎发作时,由于软骨细胞缺氧,细胞内能量代谢能力发生障碍,与能量代谢相关的酶类活性将发生改变,并引起关节内组织的病理生理学改变.因此,针对关节滑膜醛缩酶及烯醇酶的研究有重要意义,可为骨性关节炎的发病机理研究提供新的思路.
1 研究对象与方法
1.1 研究对象
研究对象为国家体育总局运动医学研究所体育医院微创外科10名符合纳入标准的膝关节骨性关节炎病人(实验组)其中男性5名,女性5名,平均年龄54.94(46~60)岁.同期10名非骨性关节炎膝关节手术病人(对照组),其中男性5名,女性5名,平均年龄39.5(38~44)岁.
1.1.1 研究对象纳入与排除标准.
1)实验组纳入标准:知情同意,并自愿签署知情同意书;年龄38岁以上,性别不限;身体其他部分健康;无明确膝部受伤史.
实验组排除标准:类风湿、风湿性膝关节炎;感染性关节炎;关节创伤手术史.
2)对照组纳入标准:知情同意,并自愿签署知情同意书;年龄、性别与实验组相近;无骨性关节炎.
对照组排除标准:未自愿签署知情同意书者;年龄在38岁以下者;有膝关节手术史.
1.1.2 临床表现及诊断标准.
美国风湿病学会(American College of Rheumatology,ACR)在2010年发布的膝关节骨性关节炎临床和放射学结合的诊断标准为:
1)临床症状:①1个月大多数日子膝痛;②关节活动时有骨响声;③晨僵小于30 min;④年龄≥38岁;⑤膝检查显示骨性肥大.
具备①、②、③、④项或①、②、⑤或①、④、⑤项纳入实验组.
2)临床及放射学:①1个月中大部分时间有明显膝痛;②X线显示关节边缘骨赘;③关节炎实验室检查符合骨关节炎(关节液清晰标准,白细胞<2×109个);④年龄≥40岁;⑤晨僵<30 min;⑥关节活动时有骨响声.
具备①、②或①、③、⑤、⑥项或①、④、⑤、⑥项纳入实验组.
3)所有患者根据Kellgren和Laurence放射学分级标准(0~4级)进行分级:0级为正常;1级为关节间隙可疑变窄,可能有骨赘;2级为关节间隙可疑变窄,有明显骨赘;3级为关节间隙肯定变窄,中等量骨赘,有些硬化性病变;4级为关节间隙明显变窄,大量骨赘,严重硬化性病变及关节畸形.其中,1级及1级以上可确诊为骨性关节炎.本研究限定患者为1~2级骨性关节炎.
1.2 取样及样品处理
膝关节关节镜手术过程中,用髓核钳于膝关节髌上囊滑膜增生或充血显著部位获取骨性关节炎病变滑膜组织及正常滑膜组织,每例约为0.5 g,TRIS-山梨醇漂洗后,迅速装入冷存管,并立即(30 s内)投入液氮中(-196 ℃),快速运抵-80 ℃恒温冰箱内保存备用.
1.3 蛋白质组学测试
蛋白质组学测试流程为:①TCA-丙酮沉淀法样品制备;②固相pH梯度-SDS双向凝胶电泳及银染,第一向等电聚焦的基本原理是利用蛋白质分子或其他两性分子的等电点不同,在一个稳定的、连续的、线性的pH梯度中进行蛋白质的分离和分析,第二向运用SDS聚丙烯酰胺凝胶电泳根据分子量大小对蛋白质进行分离;③质谱分析;④蛋白质鉴定,根据出峰情况决定质谱结果好坏,经NCBI数据库检索,确定蛋白质.质谱分析后进行NCBI数据库检索,获差异蛋白名称、分子量、等电点等相关信息;⑤NCBI数据库检索.
2 结 果
2.1 实验组和正常组膝关节滑膜二维凝胶电泳图像
本研究以50 μg上样蛋白量,7 cm长胶,胶条pH值为3~10,对样本进行的二维凝胶电泳实验,结果如图1所示.
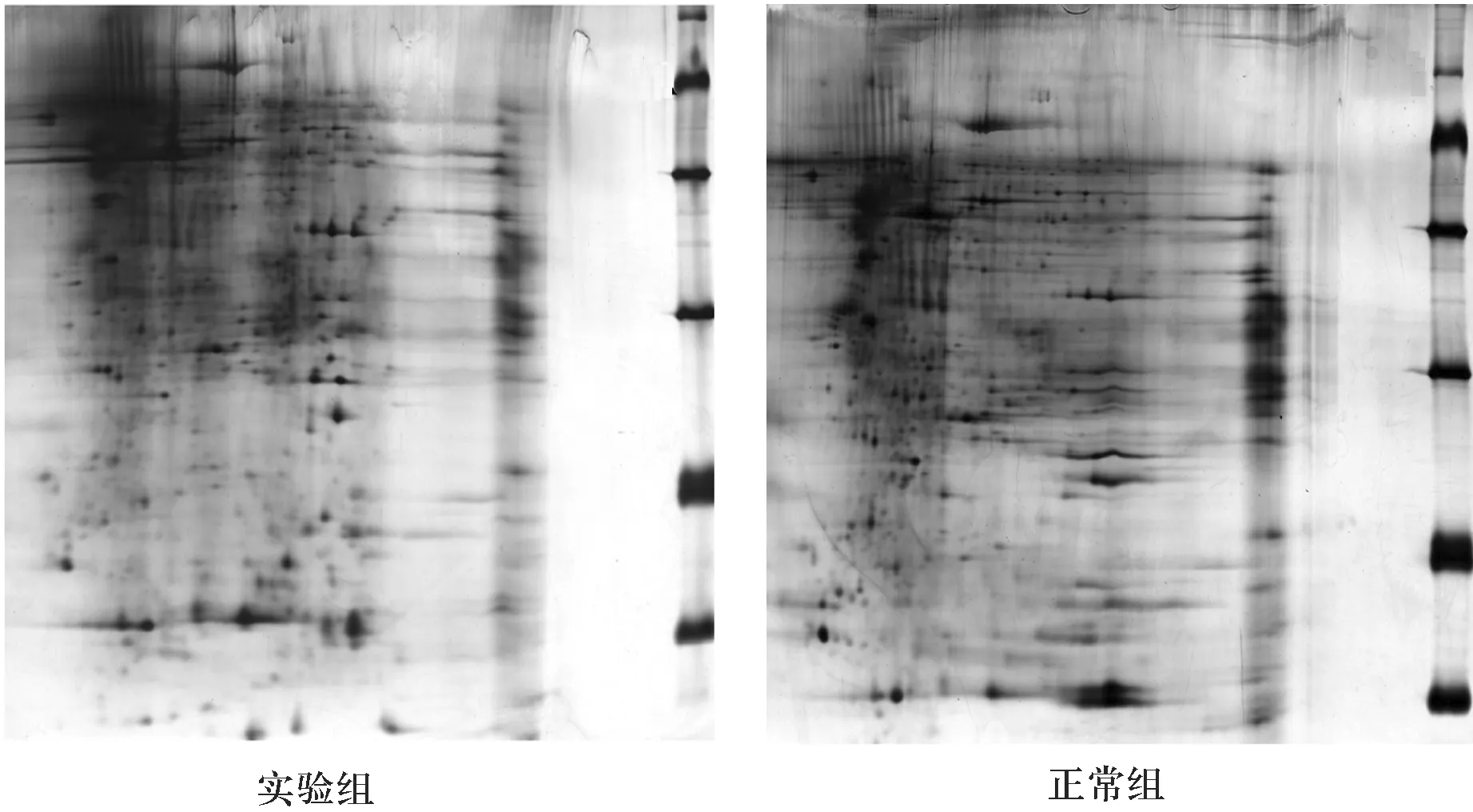
图1 实验组和正常组膝关节滑膜二维凝胶电泳图
2.2 膝关节滑膜组织烯醇酶及醛缩酶的一级质谱(PMF)
膝关节滑膜组织烯醇酶及醛缩酶的一级质谱(PMF)如图2所示.
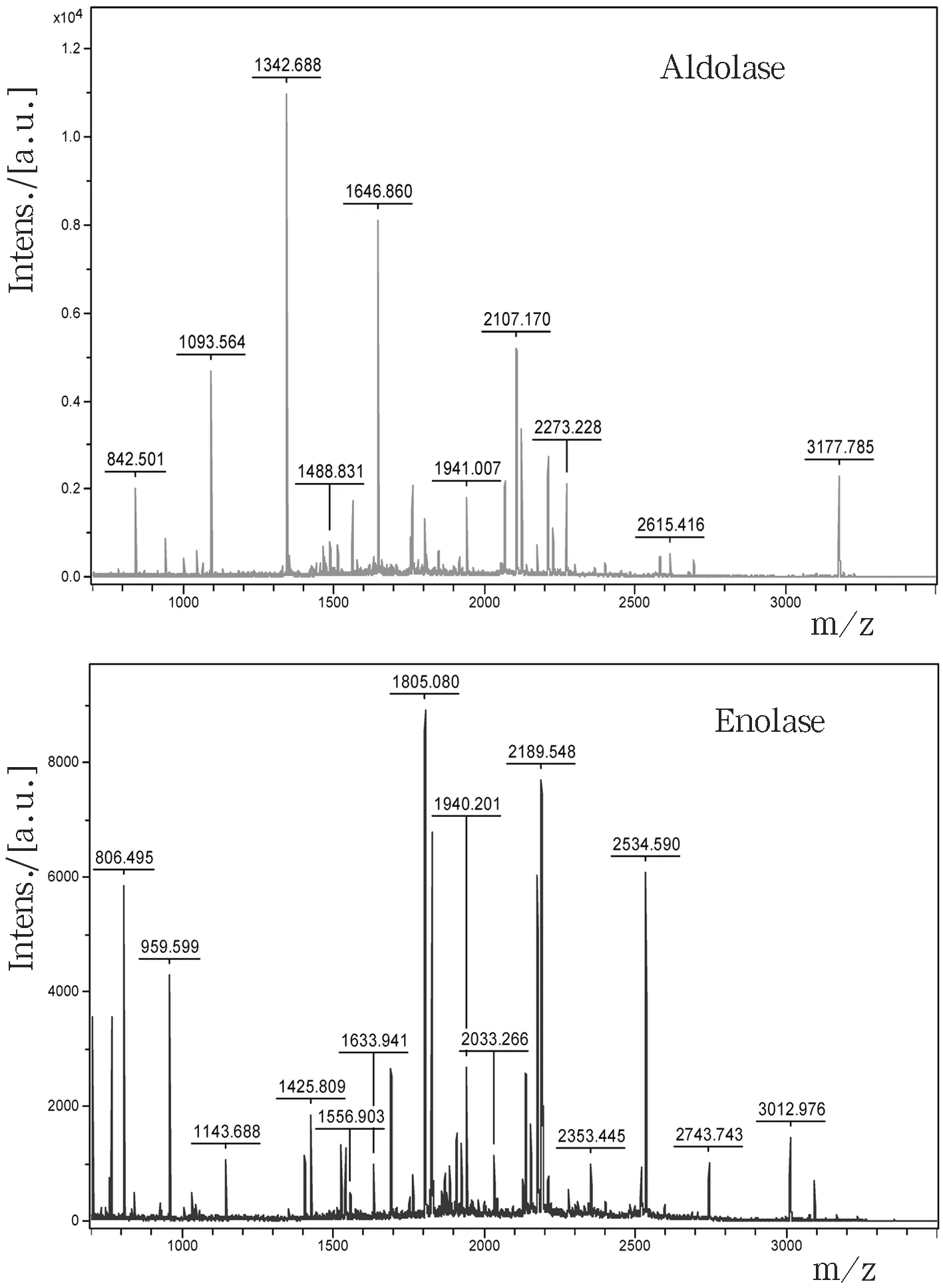
图2 烯醇酶及醛缩酶的PMF
2.3 质谱鉴定结果
通过一级质谱鉴定分析后,对差异蛋白点进行NCBI数据库检索,获得醛缩酶及烯醇酶序列号、相匹配的肽段数及匹配率等相关信息,如表1所示.
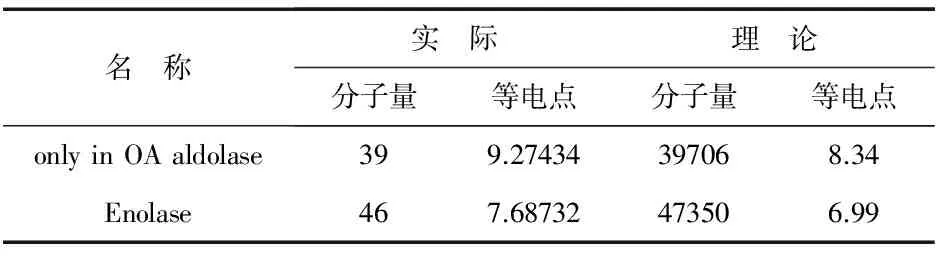
表1 OA组和对照组差异蛋白点鉴定结果
3 分析与讨论
通常认为,骨性关节炎是由于关节磨损并伴有退行性变引起的,但最近的研究发现关节的炎症反应也是其的重要致病因素.而关节炎症反应主要表现为滑膜组织上的炎症——滑膜炎,滑膜炎刺激了细胞因子等的合成与分解,破坏了软骨基质的稳态,被认为是仅次于关节软骨改变的第二重要致病因素,而与代谢有关的酶能够反映骨性关节炎滑膜内能量代谢的变化,可有效地体现关节内滑膜慢性炎症过程.
3.1 醛缩酶
醛缩酶(Adolase)属于裂合酶,是一种在糖分解过程中催化醛糖分裂与固缩反应的生物酶,它是催化1,6-二磷酸果糖(FDP)裂解为磷酸甘油醛(GAP)和磷酸二羟丙酮的糖酵解酶,同时在糖异生中也催化这个反应的可逆反应,在糖酵解和果糖代谢中起关键作用.醛缩酶主要由4个相同亚基组成,这4个亚基通过内部高度对称相互连接[4].其催化活性结构为β-筒状结构,目前的研究已证实β-筒状结构中心的口袋状区域的某些氨基酸残基对醛缩酶的催化分解过程起作用.
醛缩酶具有3种同工型:AldolaseA可存在于多个组织中,但在骨骼肌中含量最高;AldolaseB主要存在肝脏和肾脏中;AldolaseC存在于脑组织中,与A亚型,B亚型混杂共生.AldolaseA是横纹肌中主要的醛缩酶,能够分解1,6-二磷酸果糖(FDP)和1-磷酸果糖(FIP),因此在糖酵解过程中起重要作用.
正常的软骨细胞主要利用葡萄糖代谢产生ATP,糖代谢的受损与骨性关节炎软骨降解的作用机制相关[5].研究发现,在增殖的细胞中Aldolase的表达量是上调的[6],而骨性关节炎的其中一个病理性变化就是滑膜细胞的增殖,骨性关节炎滑膜的增生主要表现为衬里层成纤维样滑膜细胞的增殖,因此骨性关节炎患者Aldolase表达量的升高可能与滑膜衬里层成纤维样滑膜细胞的增生相关.大量研究显示,成纤维样滑膜细胞能够释放了各种效应分子,如透明质酸,作用于各种细胞,调节了关节的炎症和基质合成与分解的平衡.
本研究结果显示,Aldolase的表达只在骨性关节炎组出现,表明骨性关节炎软骨细胞降解,能量代谢紊乱,糖代谢受损后引起糖相关蛋白表达量的增高[7],进而有效地刺激了Aldolase的增加.表达量增加的Aldolase,可在TNF-a的调解下,进一步促进关节炎症反应,导致骨性关节炎病情加重.
3.2 烯醇酶
烯醇酶(Enolase,ENOA),又称2-磷酸-D甘油酸水解酶,是糖酵解系统的一种酶,通过催化2-磷酸甘油酸生成磷酸烯醇式丙酮酸,在ATP的合成代谢过程中起重要作用.烯醇酶由a、β、γ三种亚基以二聚体形式组成,a-Enolase,又称非神经元烯醇酶,分布于多种组织;β-Enolase,又称肌肉特异性烯醇酶,仅存在于肌肉组织;γ-Enolase又称神经元烯醇酶,主要分布于神经元及神经内分泌组织.
Enolase作为糖酵解过程中的限速酶,在结构上高度保守.当机体组织处于病理状态下,如骨性关节炎发生时,Enolase作为糖酵解过程中重要的酶,其表达量及活性随着环境的需要发生了适应性变化,以满足细胞不同状态下的需求.Enolase还是一种自身抗原.抗Enolase抗体通过识别a-Enolase的膜联形式而诱发局部免疫炎性反应.Kinloch等[8]研究发现,Enolase抗体在类风湿性关节炎患者关节滑膜中大量存在,Enolase是一种自身抗原,因此会刺激机体产生特异性抗体——Enolase抗体,进而引发类风湿性关节炎慢性炎症反应.
本研究中,Enolase仅现于骨性关节炎组滑膜中,而在对照组滑膜中并未发现Enolase的表达,这与相关文献的研究结果相一致,进一步证明Enolase作为糖酵解限速酶、自身抗原及缺氧诱导因子的靶基因在骨性关节炎病程中的重要作用,同时可以证明Enolase可作为骨性关节炎诊断及预测的生物活性分子.
4 结 论
本研究结果显示,醛缩酶和烯醇酶仅仅存在于骨性关节炎组滑膜中,这两种酶均与细胞的能量代谢有关.在正常人群中,关节内细胞ATP的产生与消耗保持平衡,进而调节软骨基质成分的合成分解,使关节软骨在总体上保证其细胞数量、形态和功能的稳定.当细胞受到外界诸如压力、低氧、炎症因子等刺激时,细胞的代谢活动随之发生改变,不足以提供充足的ATP使软骨细胞产生有效的软骨基质以维持细胞基质的完整,基质的合成分解平衡遭受破坏,软骨进一步降解,加重了骨性关节炎病程.骨性关节炎时,关节组织处于缺氧环境,ATP的供应主要靠无氧糖酵解.醛缩酶和烯醇酶催化葡萄糖进行无氧分解产生ATP以补充细胞代谢需要的同时,刺激滑膜细胞产生一系列可引起骨性关节炎慢性炎症反应的细胞因子,如白细胞介素1、白细胞介素7及肿瘤坏死因子等.通过促进基质降解酶的产生从而抑制了基质的合成,基质的分解大于合成,进一步破坏了细胞基质的平衡状态,导致软骨细胞凋亡,造成恶性循环.
[1]James N.Weinstein J D B.Thedartmouthatlasofmusculoskeletalhealthcare[M].Chicage,IL:American Hospital Association Press,2000:60-64.
[2]Garcia-Arnandis I,Guillen M I,Gomar F,et al.Highmobilitygroupbox1potentiatesthepro-inflammatoryeffectsofinterleukin-1betainosteoarthriticsynoviocytes[J].Arthritis Res Ther,2010,12(4):R165.
[3]Pearle A D S C,George S,Mandl L A,et al.Elevatedhigh-sensitivityC-reactiveproteinlevelsareassociatedwithlocalinflammatoryfindingsinpatientswithosteoarthritis[J].Osteoarthritis Cartilage,2007,15(5):516.
[4]Kukita A,Mukai T,Miyata T,et al.Thestructureofbrain-specificrataldolaseCmRNAandtheevolutionofaldolaseisozymegenes[J].Eur J Biochem,1988,171(3):471-478.
[5]Guzman R E,Evans M G,Bove S,et al.Mono-iodoacetate-inducedhistologicchangesinsubchondralboneandarticularcartilageofratfemorotibialjoints:ananimalmodelofosteoarthritis[J].Toxicol Pathol,2003,31(6):619-624.
[6]Gautron S,Maire P,Hakim V,et al.RegulationofthemultiplepromotersofthehumanaldolaseAgene:responseofitstwoubiquitouspromoterstoagentspromotingcellproliferation[J].Nucleic Acids Res,1991,19(4):767-774.
[7]Ruiz-Romero C,Carreira V,Rego I,et al.Proteomicanalysisofhumanosteoarthriticchondrocytesrevealsproteinchangesinstressandglycolysis[J].Proteomics,2008,8(3):495-507.
[8]Kinloch A,Tatzer V,Wait R,et al.Identificationofcitrullinatedalpha-enolaseasacandidateautoantigeninrheumatoidarthritis[J].Arthritis Res Ther,2005,7(6):R1421-1429.
Different Expression of Osteoarthritis Synovial Aldolase and Enolase
HUANGQiaoting1,XUJie1,GAOWeiwei2,CAOJianmi2
(1.School of Sports, Chengdu University, Chengdu 610106, China; 2.Sport Science College, Beijing Sport University, Beijing 100084, China)
The purpose of this study is to provide a new approach for the study of pathogenesis of osteoarthritis by analyzing the different protein expression of adolase and enolase by comparing the expression profiles of synovial membrane from patients with osteoarthritis(OA) and normal.Synovial membranes are collected from the experimental group(n=10) and the normal control group(n=10).Proteins are separated by the two-dimensional electrophoresis.The proteins with significantly different expressions are evaluated by matrix-assisted laser disorption/ionization-time of flight(MALDI-TOF) MS.The results show that by comparing the synovial membranes in the experimental group and the control group,it is found that aldolase and enolase only exist in the experimental group,while do not appear in the control group.Finally,the paper draws a conclusion that adolase and enolase are only expressed in the experimental group,and adolase and enolase are involved in the pathogenesis of osteoarthritis process by regulating cell energy activities.
osteoarthritis;proteomics;aldolase;enolase
1004-5422(2017)01-0030-04
2017-01-14.
中央高校基本科研业务费专项资金(2015BS004)资助项目.
黄巧婷(1986 — ), 女, 博士, 副教授, 从事骨骼肌损伤与运动营养研究.
G804.3;R684.3
A
