HPLC测定奥贝胆酸片含量
2017-04-14陆云霞潘星燕
陆云霞,潘星燕,姚 军,2
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药用分子化学重点实验室-省部共建国家重点实验室培育基地,河北石家庄 050018)
HPLC测定奥贝胆酸片含量
陆云霞1,潘星燕1,姚 军1,2
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药用分子化学重点实验室-省部共建国家重点实验室培育基地,河北石家庄 050018)
为建立HPLC-UV测定奥贝胆酸片含量的方法,采用高效液相色谱法及紫外检测器,色谱柱为Agilent HC-C18(250 mm × 4.6 mm,5 μm),流动相为乙腈(含0.02% (体积分数) 甲酸)-水(含0.02% (体积分数) 甲酸),二者体积比为60∶40,以1.0 mL/min的流速进行洗脱,检测波长为195 nm,柱温为30 ℃,进样量为100 μL。结果表明:奥贝胆酸质量浓度在0.200 26~1.001 30 mg/mL范围内与峰面积呈良好的线性关系,相关系数r=0.999 9;中间精密度、稳定性、重复性试验的RSD值不超过1.0%;平均回收率为99.64%,RSD值为0.58%(n=9)。该方法简便、专属性好、精密度高、耐用性良好,可用于奥贝胆酸片含量的测定。
药物化学;色谱分析;奥贝胆酸;高效液相色谱法;紫外检测器;含量测定
奥贝胆酸(obeticholic acid,OCA)是美国Intercept公司研发的首个用于治疗胆汁淤积性肝病的药物[1-2],化学结构式见图1[3],主要用于治疗原发性胆汁性肝硬化(PBC)、非酒精性脂肪性肝病(NAFLD),对高血压和Ⅱ型糖尿病也有一定的疗效[4-5]。因其临床效果显著,获得了加速审批和优先审批[2],并于2016年5月在美国批准上市,目前中国并未有奥贝胆酸质量控制方面的研究报道。
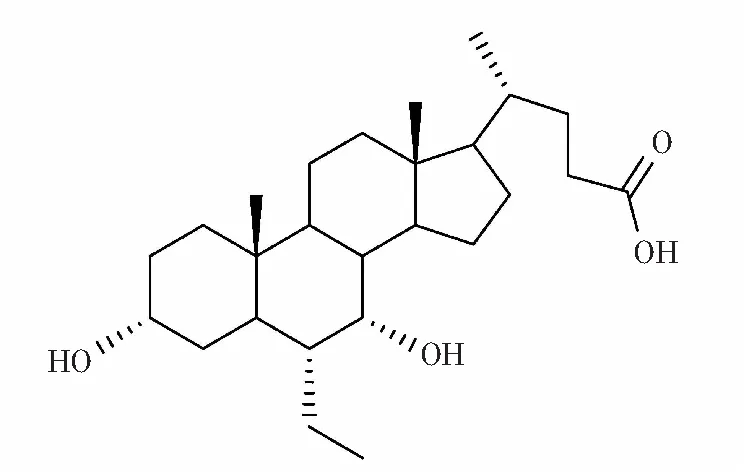
图1 奥贝胆酸化学结构Fig.1 Chemical structure of obeticholic acid
近年来,NAFLD和PBC发病率增高并趋向低龄化, NAFLD在中国的患病率在15%左右,已经成为危害人们健康的第二大肝病。FDA批准的药物熊去氧胆酸(UDCA)的临床治疗效果并不理想,作为唯一可能对PBC有效的药物,仍有30%~50%的患者对其治疗反应不良[6-11]。对于NAFLD而言,目前尚未有特效的治疗制剂。奥贝胆酸可以联合UDCA治疗PBC,尤其是作用于对UDCA应答不良或单独用药对UDCA不耐受的成年患者,可能会成为20余年来治疗PBC的首选新方法[1-2]。

图2 奥贝胆酸全波长扫描图谱Fig.2 Full-wavelength scanning of obeticholic acid
根据对奥贝胆酸的全波长扫描发现其具有末端吸收,全波长扫描图谱见图2。参考《中华人民共和国药典》2015年版二部,环磷酰胺片等剂型的检测波长均为195 nm[12],本文建立奥贝胆酸的HPLC-UV法也将采用195 nm作为检测波长,考虑到实验进行过程中产生的干扰,在方法学验证之前进行了大量的预实验来排除实验中可能产生的干扰,能够实现主峰与辅料峰的良好分离。所建立的HPLC-UV法,不仅专属性良好、重复性高、操作简便,方便用于奥贝胆酸片的质量控制,而且能够在基层得到推广应用。
1 仪器与试药
1.1 仪器
Waters 2695 高效液相色谱仪,包括紫外检测器、Empower色谱工作站;XA105U型电子天平(瑞士梅特勒-托利多有限公司提供);L400型医用离心机(湖南湘仪实验室仪器开发有限公司提供)。
1.2 药品与试剂
奥贝胆酸对照品(自制,批号为20151201,质量分数为99.82%);奥贝胆酸片(自制,批号为20160501,20160502,20160503,规格为5 mg /片);乙腈,色谱纯(珠海市格特生物科技有限公司提供);甲酸,色谱纯(德国默克公司提供);水为自制三蒸水。
2 方法与结果[13-15]
2.1 色谱条件
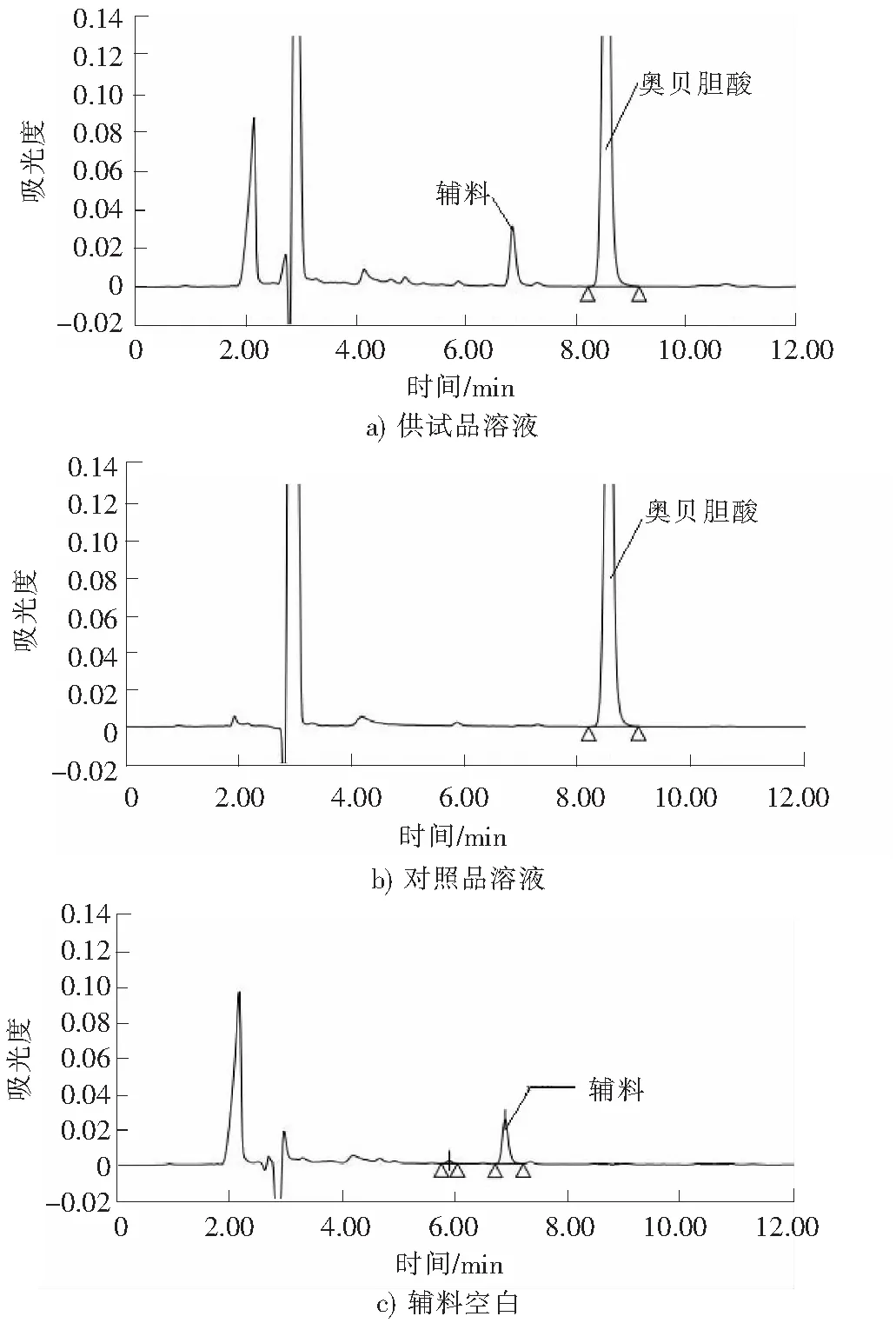
图3 高效液相色谱图Fig.3 HPLC chromatograms
色谱柱:Agilent HC-C18(250 mm × 4.6 mm,5 μm);流动相:乙腈(含0.02%(体积分数)甲酸)-水(含0.02%(体积分数)甲酸),二者体积比为60∶40;流速:1.0 mL/min;检测波长:195 nm;柱温:30 ℃;进样量:100 μL。
2.2 溶液制备
2.2.1 供试品溶液
取本品20片(约4 167.08 mg),研细,精密称取细粉适量(约相当于10 mg的奥贝胆酸)置于20 mL量瓶中,加入乙腈-水(二者体积比为70∶30)振摇,使奥贝胆酸充分溶解,摇匀,超声,离心(4 500 r/min,5 min),取上层清液适量,过滤后作为供试品溶液。
2.2.2 对照品溶液
取奥贝胆酸对照品适量,精密称定,加入乙腈-水(二者体积比为70∶30)溶解并定量稀释成1 mL中约含0.5 mg奥贝胆酸的溶液。
2.2.3 空白样品溶液
取处方量不含奥贝胆酸的空白样品,按“2.2.1”项下的方法制备,即得空白样品溶液。
2.3 专属性试验
取“2.2”项下供试品溶液、对照品溶液、空白样品溶液各100 μL,按“2.1”项下色谱条件进样测定,记录色谱图,详见图3。由图3可以看出,供试品溶液与对照品溶液色谱图中主峰保留时间一致,而空白样品溶液中无此峰,表明空白样品溶液对测定无干扰。
2.4 线性关系考察
精密称取奥贝胆酸对照品100.13 mg,置于50 mL量瓶中,加入乙腈-水(二者体积比为70∶30)溶解并稀释至刻度,摇匀,作为储备液。精密量取上述储备液各1.0,2.0,5.0,2.0,5.0 mL,分别置于10,10,20,5,10 mL量瓶中,加入乙腈-水(二者体积比为70∶30)稀释至刻度,摇匀。按“2.1”项下色谱条件进样测定,记录峰面积。以质量浓度(ρ,mg/mL)为横坐标、峰面积(A)为纵坐标进行线性回归,得到奥贝胆酸的回归线性方程为A=5 441 128ρ+11 275(r=0.999 9)。结果表明,在0.200 26~1.001 30mg/mL范围内,奥贝胆酸质量浓度与峰面积呈良好的线性关系。
2.5 重复性试验
按“2.2”项下供试品溶液和对照品溶液的方法分别配制,按“2.1”项下色谱条件,将供试品溶液连续进样6份,记录峰面积并计算结果。结果显示,奥贝胆酸含量的RSD值为0.68%,表明该方法的重复性良好。
2.6 中间精密度试验
由不同人员在不同日期测定含量样品,按“2.2”项下供试品溶液和对照品溶液的方法分别配制,按“2.1”项下色谱条件将供试品溶液连续进样6份,记录峰面积并计算结果。结果显示,奥贝胆酸含量的RSD值为0.53%,表明该方法的中间精密度良好。
2.7 稳定性试验
室温条件下将供试品溶液分别在0,2,4,8,12,24h,按“2.1”项下色谱条件进行测定。结果显示,奥贝胆酸峰面积的RSD值为0.81%,表明供试品溶液在24h内的稳定性良好。
2.8 回收率试验
精密称取奥贝胆酸对照品100.74mg,置于20mL容量瓶中,加乙腈-水(二者体积比为70∶30)溶解并稀释至刻度,摇匀,作为储备液。精密量取储备液1.0mL,置于10mL容量瓶中,加入乙腈-水(二者体积比为70∶30)溶解并稀释至刻度,摇匀,作为对照品溶液。称取处方量的空白辅料9份,精密加入一定量的奥贝胆酸储备液,按“2.2.1”项下方法分别制备回收率为80%,100%和120%的样品溶液。按“2.1”项下色谱条件进样测定,记录峰面积,计算回收率,结果见表1。
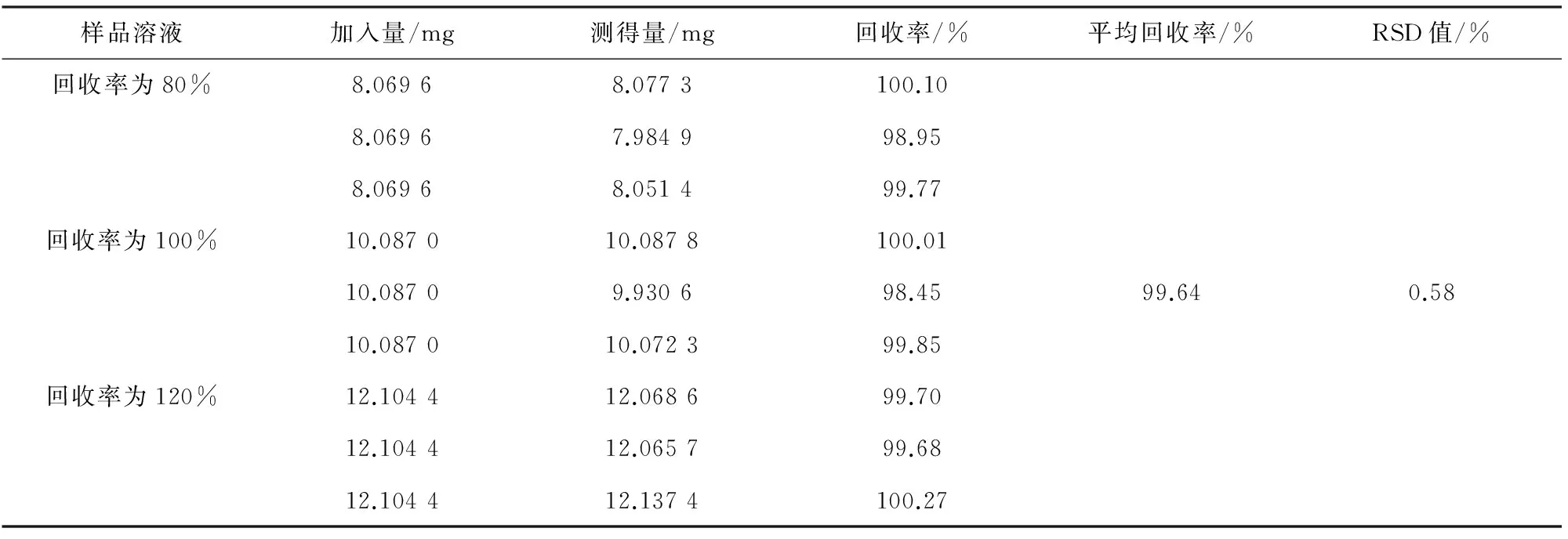
表1 回收率实验结果(n=9)
2.9 样品含量测定
各取中试3批样品适量,按“2.2.1”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,结果见表2。
3 讨 论
3.1 溶剂的选择
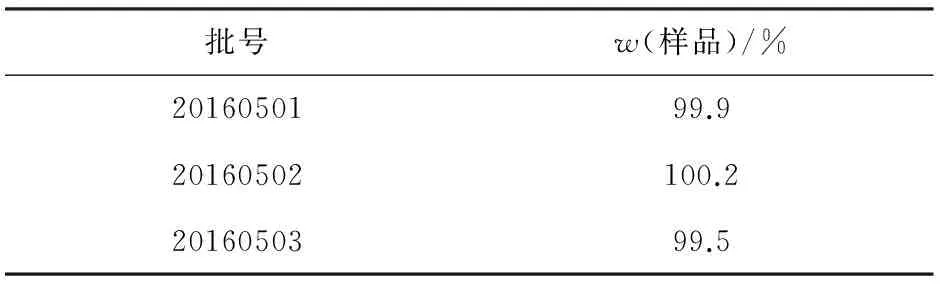
表2 样品含量测定结果(n=3)
本研究发现,奥贝胆酸在水中几乎不溶、在乙腈中微溶、在甲醇中易溶。根据奥贝胆酸的溶解性、检测波长以及流动相的配比,以不同比例的上述溶剂与水作为溶剂。通过比较发现:乙腈与水的体积比小于70∶30时,溶解时间逐渐增加;乙腈与水的体积比大于70∶30时样品溶解时间短,但对样品的出峰有影响。故采用体积比为70∶30的乙腈-水作为溶剂。
3.2 检测波长的选择
研究发现,奥贝胆酸对照品溶液在195 nm处有最大吸收。空白样品溶液虽在195 nm处也有吸收,但本方法能够实现主峰与辅料峰的良好分离,故选择195 nm作为本研究的检测波长。参考《中华人民共和国药典》2015年版二部中环磷酰胺片等剂型的检测波长均为195 nm,因此本文建立奥贝胆酸的HPLC-UV法采用195 nm作为检测波长是合理的[12]。
3.3 流动相的选择[13-21]
分别比较了乙腈-水、乙腈-磷酸、乙腈-磷酸氢二钾等不同的流动相系统。例如:0.001 mol/L磷酸氢二钾溶液(用磷酸调节pH值至2.6)-90%(体积分数)乙腈(二者体积比为45∶55)、乙腈(含0.02%(体积分数)磷酸)-水(含0.02%(体积分数)磷酸)(二者体积比为70∶30)、乙腈(含0.02%(体积分数)甲酸)-水(含0.02%(体积分数)甲酸)(二者体积比为60∶40)等作为流动相。结果发现:采用乙腈-磷酸、乙腈-磷酸氢二钾等流动相系统时,样品与相邻杂质以及辅料峰之间的分离不好,且峰形不佳;而以乙腈(含0.02%(体积分数)甲酸)-水(含0.02%(体积分数)甲酸)(二者体积比为60∶40)作为流动相的分离效果较好,能得到良好的峰形,故选择其作为本研究的流动相。
4 结 语
HPLC法广泛用于各种药品的检测,是应用最为广泛的检测方法。本研究采用HPLC-UV法测定奥贝胆酸片的含量,解决了液质联用(HPLC-MS)、超高液相色谱(UPLC)、蒸发光散射检测器(HPLC-ELSD)等检测方法因操作繁琐、价格偏高而导致基层难以推广的难题[7]。采用HPLC-UV法测定奥贝胆酸含量,方法简便、专属性良好、重复性高,能够为奥贝胆酸片的质量控制提供参考。
/References:
[1] 朱士超, 郑学敏, 张玥, 等. 法尼醇X受体激动剂奥贝胆酸[J]. 现代药物与临床, 2016, 31(3): 396-400. ZHU Shichao, ZHENG Xuemin, ZHANG Yue, et al. A farnesoid X receptor agonist: Obeticholic acid[J]. Drugs & Clinc, 2016, 31(3): 396-400.
[2] 汤森路透. 2016年最具市场前景的药物预测[J]. 药学进展, 2016, 40(3): 235-240. THOMSON Reuters. Drugs to watch in 2016[J]. Progress in Pharmaceutical Sciences, 2016, 40(3): 235-240.
[3] 邱玥珩, 曹忠诚, 强晓明, 等. 奥贝胆酸及其有关物质的合成[J]. 中国医药工业杂志, 2016, 47(4): 376-379. QIU Yueheng, CAO Zhongcheng, QIANG Xiaoming, et al. Synthesis of obeticholic acid and its related substances[J]. Chinese Journal of Pharmaceuticals, 2016,47(4): 376-379.
[4] 张柳, 牛尚梅, 马慧娟. 胆汁酸与代谢综合征的研究进展[J]. 医药综述, 2016, 22(5): 964-967. ZHANG Liu, NIU Shangmei, MA Huijuan. The progress of bile acid and metabolic syndrome[J]. Medical Recapitulate, 2016, 22(5): 964-967.
[5] 陆伦根, 曾民德. 胆汁淤积和自身免疫性肝病[M]. 北京: 人民卫生出版社, 2014.
[6] 李艳梅, 王绮夏, 马雄. 原发性胆汁性胆管炎的治疗进展[J]. 临床肝胆病杂志, 2016,32(8): 1491-1496. LI Yanmei, WANG Qixia, MA Xiong. Research advances in treatment of primary biliary cholangitis[J]. Journal of Clinical Hepatology, 2016, 32(8): 1491-1496.
[7] 彭灿, 吕蒙莹, 李耕, 等. 牛黄及其代用品胆酸类物质分析方法研究进展[J]. 中草药, 2013,44(5): 632-636. PENG Can, LYU Mengying, LI Geng, et al. Research progress in analytical methods of cholic acids in Bovis Calculus and its substitutes[J]. Chinese Traditional and Herbal Drugs, 2013,44(5): 632-636.
[8] 陆妙. RP-HPLC法测定熊去氧胆酸胶囊中熊去氧胆酸的含量[J]. 中国药房, 2008, 19(30): 2384-2385. LU Miao. RP-HPLC method for the determination of ursodeoxycholic acid in ursodeoxycholic acid capsule[J]. Chinese Pharmacy, 2008, 19(30): 2384-2385.
[9] 唐元军, 陈育琳, 陈庆辉. HPLC-ELSD法同时测定猪胆粉中猪去氧胆酸和鹅去氧胆酸的含量[J]. 中药新药与临床药理, 2011, 21(6): 651-653. TANG Yuanjun, CHEN Yulin, CHEN Qinghui. Simulatneous determination of hyodeoxycholic acid and chenodeoxycholic acid in suis fellis pulvis by HPLC-ELSD[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2011, 21(6): 651-653.
[10]何姣, 李静, 朱砂, 等. RP-HPLC法同时测定猪胆粉药材中3种牛磺结合型胆酸的含量[J]. 药物分析杂志, 2012, 32(2): 229-232. HE Jiao, LI Jing, ZHU Sha, et al. RP-HPLC simultaneous determination of three tauro-conjugated cholia acids in pulvis fellis suis[J]. Chinese Journal of Pharmaceutical Analysis, 2012, 32(2): 229-232.
[11]赵静, 管璐晗, 祝连彩. HPLC-ELSD法同时测定生物转化样品中牛磺熊去氧胆酸等5种成分的含量[J]. 中国药房, 2014, 25(45): 4291-4293. ZHAO Jing, GUAN Luhan, ZHU Liancai. Simultaneous content determination of 5 components as tauroursodeoxycholic acid in biotransformation samples by HPLC-ELSD[J]. Chinese Pharmacy, 2014, 25(45): 4291-4293.
[12]国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015.
[13]施泰纳, 维纳伦德普尔森, 乔利博瓦, 等. 奥贝胆酸的制备、用途和固体形式[P]. 中国专利:201380043964.8, 2013-06-17.
[14]戎欣玉, 高倩, 陈涛, 等. 阿奇霉素纳米晶体片剂的制备及其质量评价[J]. 河北科技大学学报, 2015, 36(6): 606-612. RONG Xinyu, GAO Qian, CHEN Tao, et al. Preparation and evaluation of tablets of azithromycin nanocrystals[J]. Journal of Hebei University of Science and Technology, 2015, 36(6): 606-612.
[15]哈婧, 刘晓争. RP-HPLC法测定左旋苯甘氨酸乙基邓钾盐的含量[J]. 河北工业科技, 2011, 28(5): 288-290. HA Jing, LIU Xiaozheng. Determination of content of RP-HPLCl-glycine ethyl benzene Deng sylvite[J]. Hebei Journal of Industrial Science and Techology, 2011, 28(5): 288-290.
[16]陈菲, 龙海林, 雷海民, 等. HPLC测定复方熊胆胶囊中牛磺熊去氧胆酸的含量[J]. 中国中药杂志, 2014, 39(5): 838-840. CHEN Fei, LONG Hailin, LEI Haimin, et al. Determination of tauroursodeoxycholic acid in compound bile capsule by HPLC[J]. China Journal of Chinese Materia Medica, 2014, 39(5): 838-840.
[17]陈悦, 王静, 陈剑锋. HPLC同时测定猪胆汁水解产物中猪去氧胆酸、鹅去氧胆酸的含量[J]. 中国实验方剂学杂志, 2014, 20(19): 61-63. CHEN Yue, WANG Jing, CHEN Jianfeng. Determination of contents of hyodeoxycholia acid and chenodeoxycholic acid in hydrolysate of fel suillus by HPLC[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(19): 61-63.
[18]张晓艳, 崔蕊, 贾建静, 等. HPLC测定牛磺熊去氧胆酸胶囊中的有关物质[J]. 华西药学杂志, 2012, 27(5): 585-587. ZHANG Xiaoyan, CUI Rui, JIA Jianjing, et al. Determination of related substances in tauroursdeoxycholia acid capsule by HPLC[J]. West China Journal of Pharmaceutical Sciences, 2012, 27(5): 585-587.
[19]潘星燕,陆云霞,姚军.高效液相色谱法测定芒柄花素磺酸钠有关物质[J].河北科技大学学报,2017,38(1):32-38. PAN Xingyan, LU Yunxia, YAO Jun.Related substance determination of formononetin by HPLC[J].Journal of Hebei University of Science and Technology,2017,38(1):32-38.
[20]张燕, 佟爱东. 高效液相色谱法测定熊去氧胆酸片的含量[J]. 中国药品标准, 2012, 13(5): 359-362. ZHANG Yan, TONG Aidong. HPLC determination of content of ursodeoxycholic acid tablets[J]. Drug Standards of China, 2012, 13(5): 359-362.
[21]甘勇强, 邱明明. HPLC法测定天黄猴枣散中胆酸、去氧胆酸的含量[J]. 中国药师, 2013, 16(7): 1000-1001. GAN Yongqiang, QIU Mingming. Determination of cholic acid and deoxycholic acid in Tianhuang Houzao powders by HPLC[J]. China Pharmacist, 2013, 16(7): 1000-1001.
Content determination of obeticholic acid tablets by HPLC
LU Yunxia1, PAN Xingyan1, YAO Jun1,2
(1.School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China; 2.State Key Laboratory Breeding Base-Key Laboratory of Molecular Chemistry for Drug of Hebei Province, Shijiazhuang, Hebei 050018, China)
In order to establish a method for the content determination of obeticholic acid tablets, HPLC-UV method is adopted. The determination is performed on Agilent HC-C18column(250 mm×4.6 mm,5 μm) with mobile phase acetonitrile (0.02% formic acid)-water (0.02% formic acid) = 60∶40 (V/V) at the flow rate of 1.0 mL/min. The detection wavelength is 195 nm, the column temperature is 30 ℃ and the volume is 100 μL. The result shows that there is a good liner relationship between the mass concentration of obeticholic acid in the range of 0.200 26~1.001 30 mg/mL and the peak area, andr=0.999 9. The RSD of precision, stability and reproducible tests are all less than 1.0%. The average recovery rate is 99.64%, and RSD is 0.58%(n=9). The method is simple, exclusive, accurate and durable, and can be used for the content determination of obeticholic acid tablets.
medicinal chemistry; chromatography; obeticholic acid; HPLC; ultraviolet detector; content determination
1008-1542(2017)02-0158-05
10.7535/hbkd.2017yx02009
2016-11-28;
2017-01-13;责任编辑:张士莹
河北省人力资源和社会保障厅择优资助项目(C201400317)
陆云霞(1991—),女,河北定州人,硕士研究生,主要从事药物分析方面的研究。
姚 军教授。E-mail:twobright@163.com
R944.4
A
陆云霞,潘星燕,姚 军.HPLC测定奥贝胆酸片含量[J].河北科技大学学报,2017,38(2):158-162. LU Yunxia,PAN Xingyan,
YAO Jun.Content determination of obeticholic acid tablets by HPLC[J].Journal of Hebei University of Science and Technology,2017,38(2):158-162.
