药物一致性评价实施与药用辅料关联审评的探讨
2017-04-14蔡仲曦干荣富
蔡仲曦+干荣富
摘 要 目前国产药品95%以上都是仿制药,但这些仿制的原料药生产并不比发达国家落后,而是制成制剂后这些药品中的大部分无论从质量及临床疗效与对照品相比差距颇大,其重要原因之一即在于国产药用辅料品种开发上的落后。为了使患者能用上放心药,国家政府部门对仿制药的质量提升设置了时间节点,国内仿制药质量一致性评价工作的深入推进也给药用辅料提出了更高要求,这些势必会带动医药工业提高对原辅料的品质要求,势必规范辅料行业整体的质量控制与流程管理。没有好的药用辅料就没有好的制剂也不会有好的药品,而没有好的药品要想完成一致性评价以及走出国门融入国际市场也只是一种奢望,要想从用药大国走向制药强国更是一种空想,所以时下对于国内药用辅料行业发展的研究也成为业内外的聚焦点。
关键词 药品质量 一致性评价 药用辅料 机遇与挑战
中图分类号:R951 文献标识码:C 文章编号:1006-1533(2017)05-0003-04
Study on the relationship between drug re-evaluation and pharmaceutical excipients
CAI Zhongxi*, GAN Rongfu**
(Sinopharm Group Co. Ltd., Shanghai 200051, China)
ABSTRACT Nowadays, more than 95% domestic drugs are generic drugs. The quality of APIs in these generic drugs is not worse than those in developed countries. However, after preparations are manufactured, there is a huge gap between most of domestic producing drugs and reference substances in terms of quality and clinical efficacy. One of the important reasons is that the development of domestic pharmaceutical excipients falls behind. To ensure the drug safety of the public, the government has set deadline for the quality improvement of generic drugs. The deepening of quality re-evaluation of domestic generic drugs also raises higher demands for pharmaceutical excipients. It leads pharmaceutical industry to increase standard for the quality of raw materials, and to standardize the quality control and process management in excipient industry. There would be no good drugs and good preparations if there are no good excipients. It is a fantasy that we can pass quality re-evaluation and get into international market without good drugs. It is also a pipe dream to become a powerful country in pharmaceutical production without good drugs. Therefore, both inside and outside of the industry have been currently focus on the study of the development of domestic pharmaceutical excipients.
KEY WORDS drug quality; re-evaluation; pharmaceutical excipients; chance and challenge
据报道,目前我国批准上市的药品共有1.6万余种,大部分为仿制药。有关部门针对多个品种的评价性抽验发现,不少已上市制剂的体外多条溶出曲线与原研制剂相差较大,部分仿制药质量与国际先进水平存在较大差距。国家希望通过药品一致性评价这一工程,提升我国制药行业整体水平,保障药品的安全性和有效性,促进医药产业升级和结构调整,创造出新模式、新产品、新机遇、新发展,实现医药产业生态重构与创新发展,打造产业发展新引擎。推动药品一致性评价工程另一目的则是为了增强我国的医药制剂水平具有国际竞争能力。
1 简述药品一致性评价
1.1 我国药品一致性评价政策
第一个阶段是2012年到2015年上半年,国务院首次提出要开展药品一致性评价,但并未持续推进。2012年1月20日,国务院发布《国家药品安全“十二五”规划》(国发〔2012〕5号)提出全面提高仿制藥质量,分期分批开展仿制药一致性评价,尽管当时规划要求“国家基本药物目录、临床常用的仿制药在2015年前完成”,但直到2012年底,CFDA才由注册司发布《仿制药质量一致性评价工作方案(征求意见稿)》,随后2013年CFDA正式开始推进一致性评价,但因为无法得到合理的评价方法而争执不下,继而搁浅。
第二个阶段是2015年8月份至今,国务院再次启动药品一致性评价并高效迅猛地执行。2015年8月18日,国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),文中明确指出加快仿制药一致性评价进度,力争2018年底前完成国家基本药物口服制剂与参比制剂质量一致性评价。2016年4月1日,CFDA发布的《关于落实“国务院办公厅关于开展仿制药质量和疗效一致性评价的意见”的有关事项(征求意见稿)》标志着一致性评价工作将正式全面展开。
至今为止,CFDA已发布20多个仿制药一致性评价的相关政策和文件,基本确定仿制药一致性评价的工作流程、参比制剂的确定方法、生物等效性试验的备案管理、第一批参比制剂目录以及符合检验机构名单等,仿制药一致性工作已进入实质性阶段。高效迅猛的政策推进速度表明本次一致性评价实施力度显著区别于第一次。
1.2 对药品一致性评价文件的理解
CFDA转发了国务院办公厅发布的《关于开展仿制药质量和疗效一致性评价的意见》与原先的《关于开展仿制药质量和疗效一致性评价的意见(征求意见稿)》在措辞上有所不同,制药企业必须对照几个重要的变化点对自身一致性评价策略做战术上的调整。此外《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)是一致性评价的指导精神。特别要关注的是2016年3月4日颁布的《化学药品注册分类改革工作方案》对注册分类进行了颠覆性的改变。此前将中国未上市的药品定义为新药,只有老6类被定义为仿制药,而《化学药品注册分类改革工作方案》新药定义为“全球新”,原新3类、新4类定义为仿制药,所以对实行一致性评价药品范围的时间节点应理解为2016年3月4日前了,既然这么理解了,那么一致性评价的对象应该是囊括了2016年3月4日之前批准的所有仿制药,而2018年大限品种是指2007年10月1日前批准的属于基本药物的已公示的289个口服固体制剂,其它未规定大限之日的品种可以理解是采用制药企业竞争的办法——若首家通过,其他企业必须3年内完成。由此可见国内制药企业所面临的严峻形势与任重道远的压力!
2 药用辅料与药品一致性评价的关联性分析[1]
一致性评价过程中,药用辅料对药品的药学研究和生物等效性(bioequivalency, BE)试验研究均有重要影响。药学研究的主要内容就是制备工艺,辅料是制备时的重要一环,且体外溶出作为药学研究的重要评价更是与药用辅料的质量和规格密切相关;在BE实验中,药用辅料对药品在体内的代谢吸收产生一部分的影响。因此制药企业在选择辅料时绝不能只考虑成本最小化,而应该非常严谨地考察供应商生产是否规范、辅料的质量特性、辅料在制剂中的作用由哪些理化指标决定、这些指标的变化会导致制剂性质发生怎样的变化、各企业生产的同名辅料有什么差异、辅料生产工艺中哪些参数变化会导致产品发生何种变化等,因为这些都决定了质量一致性评价的最终结果。
辅料的杂质控制也决定了制剂杂质水平是否与原研药保持一致性,药品溶出度与药物本身在不同pH值的溶解度有关。这些都给辅料企业提出了更高的质量控制要求,过去许多技术人员在处方设计时只重视选择原研药所用的原辅料的化学名称,忽视相同化学名的原辅料不同企业产品间的理化性质以及产品质量上的差异,仿制药质量一致性评价带动医药工业提高对原辅料的品质要求,势必规范辅料行业整体的质量控制与流程管理。
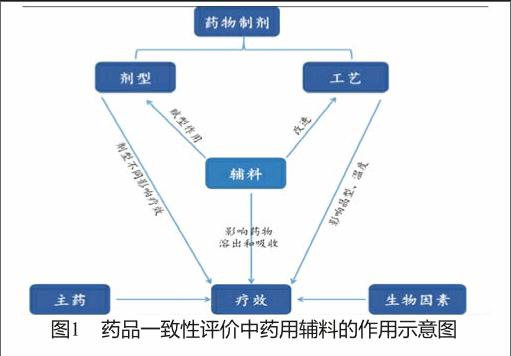
影响药品疗效的因素主要有药物性质、制剂性质和生物因素,其中制剂性质主要取决于剂型、辅料和制备工艺三个方面。辅料是保证药物以一定的程序选择性运送到一定的组织部位,防止药物在人体释放之前失活,并使药物在体内按照一定的速度和时间释放。剂型、辅料和工艺都对药物疗效有一定影响,而辅料对其他两者则有着重要的影响(图1)。
1) 辅料对制剂有赋形作用,加入辅料的不同,药物制剂可被制备成不同剂型,继而发挥不同疗效,如胰酶制备成肠溶衣片口服可助脂肪消化,若制备成注射液则对胸腔积液、血栓性静脉炎和毒蛇咬伤有明显疗效。
2) 药用辅料的选择也决定了必要的生产工艺过程从而对生产成本带来长期影响,而不同的制备工艺会影响活性药物晶型和活性,进而影响药效。
在固体制剂中,药用辅料对药物溶出和吸收起到重要影响,尤其是辅料中的崩解剂对药物溶出和吸收有着重要影响。固体制剂中的药物只有在崩解后才能被释放,采用不同功能和规格的辅料组合可影响崩解时间和程度,从而实现对药物溶出和吸收的控制。例如在氢氯噻嗪片中采用不同种类和规格的崩解剂其崩解时间也发生变化,尤其是与未添加崩解剂的片剂相比,大大加快了崩解时间。
3 药用辅料与药品关联审评审批[2]
2016年5月12日,CFDA发布《关于药包材药用辅料与药品关联审评审批有关事项的公告(征求意见稿)》,使药物管理档案(drug master file, DMF)和关联审评初现雏形。2016年8月10日,CFDA发布《关于药包材药用辅料与药品关联审评审批有关事项的公告》称,自公告发布起,将直接接触药品的包装材料和容器、药用辅料由单独审批改为在审批药品注册申请时一并审评审批,标志着辅料管理从批文时代进入文档管理时代。此前,辅料申报分两部分,已有国家标准的由各省食药监局审批,新辅料则由国家食药监局审批,由于发达省份要求严格,其他省份的审批相对随意,各省在审评过程中尺度不一,导致药用辅料产品质量相差较大、企业发展水平良莠不齐。国务院2017年1月12日签发,1月21日頒布的《关于第三批取消中央指定地方实施行政许可事项的决定》取消中央指定地方实施的39项行政许可事项目录中,涉及医药行业的3个重大项目中有一项是关于药用辅料(不含新药用辅料和进口药用辅料)注册审批,文件取消药用辅料的省级注册(不含新药用辅料和进口药用辅料),取消审批后,将药用辅料注册纳入药品审批一并办理。
同时CFDA明确药品注册申请人所在地食品药品监督管理部门应加强延伸监管,将药用辅料生产企业纳入正常监管范围,药用辅料和包材与药品的关联审评政策尘埃落定。辅料供应商和药品生产企业将不再仅仅是卖方和买方的供应链关系,而需要建立更为紧密的战略合作伙伴关系。由于药品质量最终责任在药品生产企业,药品生产企业尤其需要慎重选择合作伙伴。除了在研发阶段的技术和样品的大力支持,合作伙伴是否可以按时保质保量提供所需要的资料,合作伙伴长期的供应能力(避免各种原因的停产断货导致的麻烦)以及产品质量长期保证能力等都需要制药企业进行仔细评估。辅料的审评直接与制剂品种有关,辅料生产企业要随时接受下游制剂企业的审计和监管机构的日常监管,这对辅料技术和标准的提升是很大的促进。
4 药用辅料行业的机遇与挑战[3]
4.1 关联审评的推行对药用辅料行业的影响
4.1.1 市场环境更加规范,行业规模有望快速扩大
参考欧美发达国家的药用辅料市场在整个药品市场的占比,加上关联审评新政实施,促进了行业规范化,也提高了行业内部对药用辅料的重视。预计辅料占国内制剂行业的比值将快速提升,行业市场规模将快速扩大,整个药用辅料市场达到千亿的时代将很快到来。
4.1.2 药用辅料市场重新分配,大型企业将迎来新的一轮扩张
就制剂企业来说,新政下为避免生产停滞的风险以及规避因辅料不合格而造成的转换成本,会优先选择正规化的辅料企业。就药用辅料企业自身来说,公告中要求国产药用辅料在2018年1月1日前按照新的申报资料向食品药品监督管理部门提交资料,参照新的申报资料,最低质量标准是2015版药典且需提供稳定的生产工艺。为此,辅料企业需加强与下游制剂企业的沟通,不断推出适应新剂型要求的新辅料或者更加适合制剂企业个性化要求的辅料,而目前国内具有研发和技术优势的药用辅料企业数量并不多。总的来说,关联审评政策的实施将会导致药用辅料市场重新分配,行业集中度得到提高,利好大型企业。
4.1.3 促进国内药用辅料企业的国际化
新政提高门槛后,国内化工企业若要继续拓展药用辅料市场,需配备专门的药学研发人员以及符合GMP的生产车间和质量管理体系才能抢占市场先机。一致性评价加快行业整合,一致性评价及关联审评等利好政策的出现,药用辅料行业市场份额将重新划分。药物制剂行业要去产能,对能提供定制化服务并参与预实验、药学研究、调整生产工艺过程和质量体系,同时能满足客户个性化需要的药用辅料企业有望在此次一致性评价中脱颖而出。预计国内会产生一批真正能与进口辅料企业产品质量相媲美的国际化辅料企业。
4.2 药品一致性评价对药用辅料生产的影响
一致性评价提高了对辅料质量技术的要求,将药用辅料提升到与主药相同的地位,扭转以前“重原料、轻辅料”的现状。药品生产企业在进行药学研究的处方考察和工艺研究过程中还需要深入了解辅料的特性,进入生产后,更需要药用辅料企业保障生产的持续和稳定。一致性评价过程中,药用辅料对药品的药学研究和BE研究均有重要影响,因此制药企业在选择辅料时绝不能只考虑成本最小化,而应该非常严谨地考察供应商生产是否规范、辅料来源是否有保障、质量是否稳定等,以顺利完成仿制药一致性评价的工作。
4.3 药用辅料市场分析[4-5]
过去很长一段时间我国医药工业对辅料行业不重视,自从毒胶囊等药用辅料质量安全事件发生后,我国对药用辅料标准的重视程度一直在提升。药典收纳的辅料标准已从2010年版的132种增加到2015版的270种,目前我国正在使用的药用辅料数量为543种。药典收纳的标准占到总数的49.72%,接近于美国和欧洲50%的比例,但整体来说我国药用辅料行业正在使用和被药典收录的品种数量方面远远落后于欧美。国内市场规模前十大种类分别为明胶胶囊、蔗糖、淀粉、薄膜包衣粉、1,2-丙二醇、PVP、羟丙基甲基纤维素(HPMC)、微晶纤维素、HPC、乳糖。
我国药用辅料行业呈“散、小、差”的状态。我国现有内资的药用辅料生产企业约400家。其中,以药用辅料为主要产品的生产企业有294家(含133家空心胶囊生产企业,17家明胶生产企业,42家化工企业);注册药用辅料140余个品种,进口药用辅料70余个品种。CFDA共下发187份注册证,分别由40余家企业持有,包括卡乐康、美剂乐、巴斯夫、瑞登梅尔、凯瑞、陶氏化学、信越化学、罗盖特、国际特品、罗姆、曹达、罗门哈斯等国际知名药用辅料生产企业。目前国内主要辅料生产企业有湖南尔康制药股份有限公司、安徽山河药用辅料股份有限公司、天津红日药业股份有限公司(2015年收购湖州展望药业)及苏州胶囊有限公司、山西广生胶囊有限公司、安徽黄山胶囊股份有限公司和青岛益青药用胶囊有限公司等,总体而言竞争激烈,行业格局混乱。
发达国家药用辅料占整个药品制剂产值的5%~10%,而我国药用辅料起步较晚,整体水平较低,因此国内药用辅料在整个药品制剂中占比较低,仅占我国药品制剂总产值的2%~3%。随着我国医药行业的药品一致性评价深入实施,药用辅料行业也将迅速发展。按照占药品制剂总产值的2.5%(取2%和3%的平均数)进行计算。根据医药终端市场规模的数据(2014年我国医药终端市场规模12 802亿元,2015年医药终端市场数据为13 775.2亿元),2014年国内药用辅料的市场规模约为320.05亿元,2015年约为344.38亿元。随着一致性评价及关联审评等利好政策的出现,药用辅料行业市场份额将重新划分,迎来黄金增长期,可以推断我国药用辅料行业未来可达700~1 300亿元规模。
4.4 药用辅料发展方向
世界药剂辅料发展极为迅速,除了传统辅料质量不断提高外,新辅料不断问世。优良的肠溶与胃溶材料、靶向制剂材料、无毒高效药物载体、无毒高效透皮促进剂与适合各種药物剂型的复合材料,都将是发展方向。例如,长效缓释剂专用辅料、帕洛沙姆、可将油状液体加工成微囊剂的新型药用明胶、非离子型表面活性剂、药用甘油系列液态药用辅料、高分子聚合物类药物新辅料、多糖类新型药用辅料、纤维素酯系列产品等。
5 结语
没有好的药用辅料就没有好的制剂也不会有好的药品,而没有好的药品要想完成一致性评价以及走出国门融入国际市场也只是一种奢望,要想从用药大国走向制药强国更是一种空想,所以时下对于国内药用辅料行业发展的研究也成为业内外的聚焦点。
药用辅料行业正处于历史的拐点,能够对产品的质量严格把关,能够提供技术支持的药用辅料生产企业;具备一定的科研水平,能够与药剂企业合作并开发新型辅料的药用辅料生产企业;有能力获得欧美国家认可、引进第三方认证的企业将会获益并发展壮大。
参考文献
[1] 干荣富. 药品审评正本清源方能保证药品的质量与疗效[J]. 上海医药, 2015, 36(17): 64-66.
[2] 蔡仲曦, 干荣富. 从医药产业链维度寻找医药工业发展之契机[J]. 中国医药工业杂志, 2016, 47(1): 120-126.
[3] 徐培红, 干荣富. “黄金10年”为中国药用辅料行业发展带来新的契机[J]. 上海医药, 2011, 32(7): 354-356.
[4] 谢正福, 吴莺. 浅析我国药用辅料管理现状及存在问题[J]. 今日药学, 2010, 20(7): 64-66.
[5] 张士涛. 我国药用辅料行业的态势分析和前景展望[J]. 中国医药技术经济与管理, 2007, 1(5): 18-21.
