液相色谱串联质谱法测定果蔬中双三氟虫脲、四氯虫酰胺和氰虫酰胺残留
2017-04-14崔淑华李瑞娟张晓梅程刚王宇李正
崔淑华 李瑞娟 张晓梅 程刚 王宇 李正义
摘要建立了蔬菜和水果中双三氟虫脲、四氯虫酰胺和氰虫酰胺3种新型杀虫剂的分散固相萃取液相色谱串联质谱检测方法。样品经乙腈均质提取,混合使用乙二胺N丙基硅烷(PSA)和C18基质分散净化剂进行净化,液相色谱三重四极杆串联质谱(LCMS/MS)同时进行检测。双三氟虫脲和四氯虫酰胺采用多反应监测负离子模式,氰虫酰胺采用多反应监测正离子模式。双三氟虫脲在苹果、洋葱和经微波处理的洋葱样品中均不存在基质效应,可采用纯溶剂标准外标法或者采用基质匹配标准溶液定量检测;四氯虫酰胺和氰虫酰胺存在程度不同的基质减弱效应,采用空白基质匹配的校正标准曲线外标法定量。3种杀虫剂均在0.2~100μg/L线性范围内具有良好的线性关系,相关系数均大于0.9990。在0.005~2.000mg/kg范围内,平均添加回收率为81.6%~99.9%,相对标准偏差为3.6%~9.8%。氰虫酰胺、四氯虫酰胺和双三氟虫脲的检出限分别为0.064,0.048和0.001μg/kg,定量限分别为0.210,0.160和0.004μg/kg。
关键词液相色谱串联质谱;水果和蔬菜;双三氟虫脲;四氯虫酰胺;氰虫酰胺
1引言
鳞翅目害虫是我国大部分地区蔬菜和水果生产中的主要害虫[1]。使用选择性好、环境相容性好、无公害、活性高、与传统杀虫剂不存在交互抗性等特性的杀虫剂防治害虫已成为目前的应用趋势。双三氟虫脲(Bistrifluron,商品名为Hanaro)能抑制昆虫几丁质形成,影响内表皮生成,使昆虫不能顺利蜕皮而死亡[2~4]。氰虫酰胺(又名溴氰虫酰胺,Cyantraniliprole)和四氯虫酰胺(SYP9080,化学名称为3溴N\[2,4二氯6(甲氨基甲酰基)苯基\]1(3,5二氯2吡啶基)1H吡唑5甲酰胺)作为鱼尼丁受体激活剂,是新型双酰胺类杀虫剂。这些新型杀虫剂不仅对鳞翅目等害虫有优良的活性,与现有杀虫剂无交互抗性,而且对哺乳动物安全,适用范围广[5~9]。
随着双三氟虫脲、氰虫酰胺和四氯虫酰胺的推广使用,作为我国蔬菜、水果主要出口市场的美国、韩国、日本等国家对其制定了残留限量标准。韩国规定双三氟虫脲在黄瓜、大葱、白菜、辣椒、甜椒等蔬菜中的最大允许残留量为0.2~2.0mg/kg、在葡萄、草莓、西瓜、苹果、桃子、梨等水果中的最大允许残留量(MRL)为0.2~1.0mg/kg;2014年2月5日,美国环保署发布对氰虫酰胺(Cyantraniliprole)的MRL为0.02~30.00mg/kg。对四氯虫酰胺,欧盟和日本规定以0.01mg/kg为限值,美国规定不得检出[10]。
目前,对果蔬中氰虫酰胺残留一般采用QuEChERS方法进行前处理,高效液相色谱串联质谱(HPLCMS/MS)进行检测[11~16];对果蔬中双三氟虫脲和四氯虫酰胺残留量检测方法,目前仅有几个申请专利[17~20],也采用QuEChERS的前处理方法,HPLCMS/MS和GCMS进行检测。目前尚未见同时检测果蔬中这3种新型杀虫剂残留量的研究报道。QuEChERS前处理方法简便快捷,已成为现阶段应用最广泛的前处理方法,但由于不同农药的性质不同,需采用加标回收方法验证。同时,使用HPLCMS/MS分析时,还可能存在基质效应问题。本研究对仪器检测方式、样品基质等因素对基质效应的影响进行了分析,在优化QuEChERS基质固相分散萃取条件的基础上,建立了HPLCMS/MS同时测定果蔬中双三氟虫脲、四氯虫酰胺和氰虫酰胺残留的检测方法,并用于检测实际样品,结果令人满意。
2实验部分
2.1仪器与试剂
Agilent12906460液相色谱串联质谱仪(配ESI离子源,美国Agilent公司);3K15型离心机(德国Sigma公司);ULTRATURRAXT18basic型均质器(IKA公司,德国);MilliQ超纯水仪(美国Millipore公司);Vortex3000型旋涡混合器(德国Wiggens公司)。
双三氟虫脲标准品(纯度≥98.0%,德国Sigma公司);氰虫酰胺(纯度≥98.0%,德国Dr.EhrenstorferGmbH公司);四氯虫酰胺(纯度95.5%,中化农化有限公司);乙腈、甲醇、乙酸铵(色谱纯,德国Merck公司);NaCl、无水MgSO4(分析纯,国药集团化学试剂有限公司);十八烷基键合相硅胶(C18)净化剂、乙二胺N丙基硅烷(PSA)净化剂(AgelaTechnologies公司);QuEChERS分散固相萃取管(15mL离心管中装150mgPSA、900mg无水MgSO4)、QuEChERS分散固相萃取管(15mL离心管中装150mgC18、900mg无水MgSO4)、QuEChERS分散固相萃取管(15mL离心管中装150mgPSA、45mg石墨炭黑(Carb)粉末、855mg无水MgSO4);QuEChERS分散固相萃取管(15mL离心管中装150mgPSA、150mgC18和900mg无水MgSO4,美国Agilent公司)。黄瓜、苹果和洋葱等实际样品均购于本地市场。
2.2标准溶液的配制
准确称取适量双三氟虫脲、氰虫酰胺和四氯虫酰胺标准品,分别用乙腈配制成浓度为1.0mg/mL的标准储备液;准确吸取适量上述3种农药的标准储备溶液,用乙腈配制成浓度为10μg/mL的标准中间溶液;准确移取上述标准中间液,以乙腈逐级稀释,得到0.5,1,2,5,10,20,50和100μg/L系列纯溶剂标准工作溶液;取空白样品按样品前处理过程进行处理,得到空白基質提取净化液,用此基质溶液稀释标准中间液,配制成适当浓度的标准工作液。
2.3样品处理
取试样可食用部分,粉碎并混合均匀,准确称取10.00g(精确至0.01g),加入20mL乙腈,均质提取1min,加入4g无水MgSO4、1gNaCl,立即涡旋混匀后,7000r/min离心5min。吸取2.0mL上层有机相转移至装有100mgC18、50mgPSA和300mg无水MgSO4粉末的离心管中,立即涡旋混匀2min,7000r/min离心5min,取上清液过0.22μm滤膜,待LCMS/MS测定。
2.4液相色谱质谱条件
2.4.1色谱条件色谱柱:EclipseplusC18柱(100mm×2.1mm,1.8μm);流动相A:乙腈,流动相B:5mmol/L乙酸铵溶液,梯度洗脱程序:0~0.5min,5%A;0.5~2.0min,5%~95%A;2.0~3.5min,95%A;5.5~5.6min,95%~5%A;5.6~8.0min,5%A。流速:0.2mL/min;进样体积:10μL;柱温:30℃。
2.4.2质谱条件电喷雾离子源(ESI);负离子和正离子同时扫描,氰虫酰胺采用正离子扫描,双三氟虫脲和四氯虫酰胺采用负离子扫描;多反应监测(MRM)模式;雾化器压力:275.9kPa;干燥气温度:350℃;干燥气流速:6.0L/min;鞘气温度:350℃;鞘气流速:10.0L/min;毛细管电压:
3500V和+3500V;监测离子对、毛细管出口电压/碎裂电压和碰撞能量等质谱采集参数见表1。
3结果与讨论
3.1仪器条件的确定
3.1.1质谱条件的优化采用1mg/L待测化合物标准溶液,分别在正离子(ESI+)和负离子(ESI
)模式下进行全扫描(SCAN模式),双三氟虫脲和四氯虫酰胺在ESI
模式下响应更高,氰虫酰胺在ESI+模式下响应更高,因此选择采用正负离子同时扫描方式,并确定了氰虫酰胺、四氯虫酰胺和双三氟虫脲母离子分别为m/z475.0,m/z535.8和m/z445.0。其它優化后的质谱参数见表1。
3.1.2色谱条件的优化
当采用甲醇作为有机流动相时,双三氟虫脲响应值大大降低,而流动相中存在甲酸时会抑制负离子电离,因此选择使用乙腈和5mmol/L乙酸铵为流动相。采用不同比例的流动相等度洗脱时,待测农药的灵敏度和重复性均不理想,因此采用梯度洗脱程序。比较不同的色谱柱,采用EclipseplusC18柱分析时,待测农药保留时间以及峰形均比较理想。在优化后的色谱质谱条件下,在黄瓜、苹果和洋葱混合空白样品中进行3种杀虫剂加标回收实验,同时包括定量离子和定性离子的MRM色谱图如图1所示,样品基质不干扰3种杀虫剂的测定。
3.2样品前处理条件的确定
3.2.1提取溶剂的选择进行QuEChERS前处理方法时,常加入乙酸等试剂以改善回收率[21,22]。但加入酸性溶液会影响PSA的净化效果,本研究中双三氟虫脲、氰虫酰胺和四氯虫酰胺对酸和碱都不敏感,为使PSA达到最佳净化效果,选择乙腈作为提取溶剂。
3.2.2基质分散净化剂的选择基质分散净化常用的净化剂有乙二胺N丙基硅烷(PSA)、十八烷基硅胶键合相(C18)、石墨化炭黑(Carb)[23],在去除杂质的同时也可能对目标化合物产生吸附。
分别将6mL20μg/L双三氟虫脲、氰虫酰胺和四氯虫酰胺混合溶剂标2准溶液和阴性黄瓜基质标准溶液,经装有不同种类净化剂的4种QuEChERS分散固相萃取管进行涡旋净化处理,回收率结果见表2。
由表2可见,使用纯溶剂标准溶液进行吸附实验时,氰虫酰胺和四氯虫酰胺经PSA、PSA+C18和PSA+Carb处理后,回收率仅为15.1%~62.6%,而C18对氰虫酰胺和四氯虫酰胺无吸附作用,可见,PSA对氰虫酰胺和四氯虫酰胺产生了很强的吸附;但使用黄瓜基质标准溶剂进行同样的吸附试验时,PSA和C18对这3种杀虫剂均未产生吸附作用,这可能是因为PSA吸附剂上存在很多活性位点,吸附了待测物;使用基质标准进行试验时,吸附剂上的活性位点被基质占据,对待测农药吸附作用减小。本研究选择使用PSA和C18作为基质分散固相萃取剂,通过优化,选择在每毫升提取液中加入25mgPSA和50mgC18进行基质固相分散净化。
3.3样品基质效应的考察
采用2.3节方法,获得以同比例混合的、不含待测农药的黄瓜、苹果和洋葱混合空白基质溶液,将此溶液经上述基质分散固相萃取净化管(即C18、PSA、PSA+C18和PSA+Carb基质分散提取净化剂)净化处理,分别用乙腈和4种净化处理后的净化液配制系列标准溶液,进样后得到各自的基质标准曲线。基质效应=基质匹配校准曲线斜率/纯溶剂标准曲线斜率,斜率比越接近1,则基质效应越小[24],具体结果见表3。从表3可知,氰虫酰胺和四氯虫酰胺标准溶液的基质减弱效应很大,双三氟虫脲的基质效应较弱;使用PSA+C18作为基质分散固相萃取剂时,3种农药的基质减弱效应均最小,但其中氰虫酰胺和四氯虫酰胺的基质减弱效应仍较强。
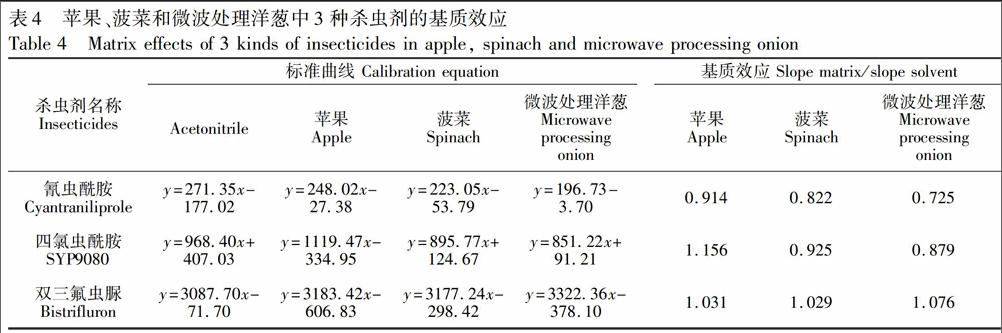
同时,对不含待测农药的苹果、菠菜和经微波处理的洋葱样品,经PSA+C18基质分散固相萃取处理,对得到的相应基质标准曲线和基质效应进行了考察,结果见表4。
对比表4和表3结果,即使经PSA+C18净化处理,除双三氟虫脲外,只要含有洋葱基质的样品溶液均存在较强的基质效应,而洋葱经微波处理后基质减弱效应得到了很大改善。另外发现,除菠菜基质中氰虫酰胺基质减弱效应较强外,其余基质效应均较弱。这可能是因为菠菜样品的色素含量很高的原因。双三氟虫脲和四氯虫酰胺均采用ESI
进行检测,但双三氟虫脲受基质影响很小,四氯虫酰胺则受基质
影响较大,基质效应不一致。通过上述实验可知,基质效应主要受样品基质、化合物性质和离子源监测模式因素的影响,应进行实际实验明确具体农药在多种基质下的实际基质效应。为消除样品基质效应,本研究选择以空白样品提取净化液配制基质标准溶液。实际样品的双三氟虫脲添加回收实验表明,分别采用纯溶剂标准溶液和基质匹配标准溶液进行外标法定量时,检测结果无明显差异。另外,葱蒜类样品使用微波处理后可降低杂质干扰,减轻基质效应,但通过上述实验可知,即使使用微波处理洋葱,氰虫酰胺仍存在较强的基质效应,而微波操作影响因素也较复杂,因此,本研究不使用微波处理进行样品前处理。
3.4方法的线性范围、检出限和定量限
在优化的色谱条件和质谱条件下测定2.2节配制的系列标准工作溶液,以峰面积为纵坐标(y),浓度为横坐标(x),绘制校准曲线,3种杀虫剂在苹果、菠菜单基质溶液的线性方程见表4,在苹果和洋葱混合基质溶液中的线性方程见表3(PSA+C18),相关系数均大于0.9990,氰虫酰胺、四氯虫酰胺和双三氟虫脲在0.2~100μg/L范围内具有良好的线性关系。以信噪比S/N=3确定检出限(LOD),S/N=10确定定量限(LOQ),氰虫酰胺、四氯虫酰胺和双三氟虫脲在苹果和洋葱混合基质中的检出限分别为0.064、0.048和0.001μg/kg,定量限分别为0.210、0.160和0.004μg/kg。
3.5回收率和精密度
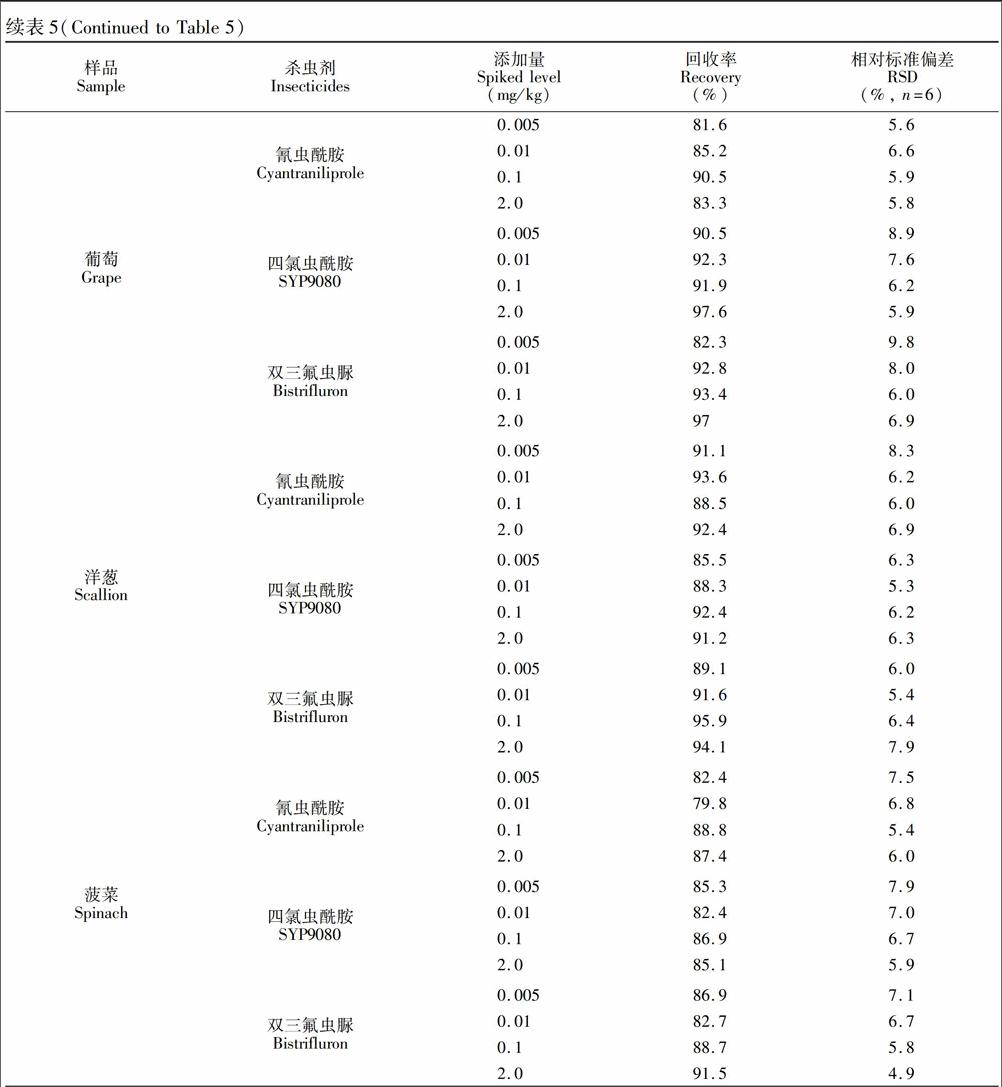
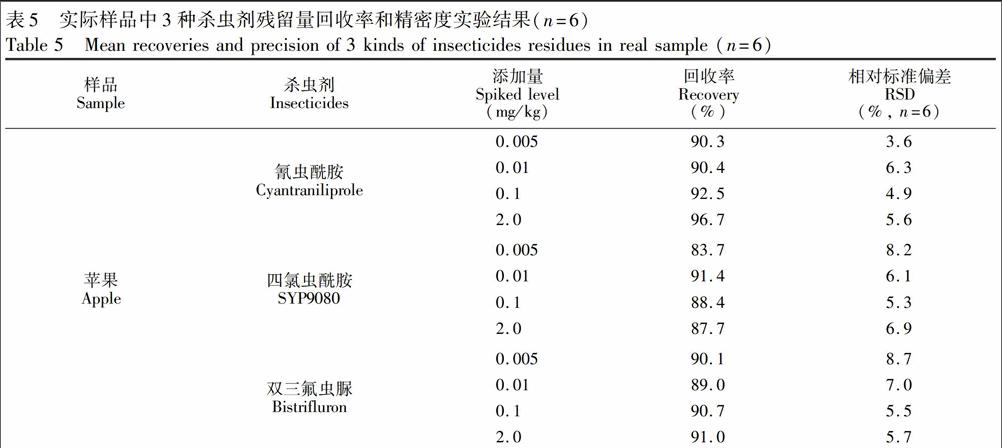
对市售的苹果、葡萄、洋葱和菠菜样品按照2.3节进行处理再检测,以未检出3种杀虫剂的的上述样品进行添加回收实验。在10g粉碎样品中分别添加0.005、0.01、0.1mg/kg和2.0mg/kg浓度水平的混合标准溶液,进行含量测定,结果见表5。3种杀虫剂在苹果、葡萄、洋葱和菠菜中添加回收率在79.8%~99.9%之间,相对标准偏差(RSD)在3.6%~9.8%之间。
3.6实际样品检测
按照本方法对市售菠菜、甘蓝、草莓、苹果、小葱等23批农贸市场销售的蔬菜和水果进行双三氟虫脲、氰虫酰胺和四氯虫酰胺的检测,在两批甘蓝中检出四氯虫酰胺,残留量分別0.018和0.023mg/kg。
4结论
本研究在优化样品前处理条件和仪器条件的基础上,建立了液相色谱串联质谱法测定蔬菜和水果中双三氟虫脲、氰虫酰胺和四氯虫酰胺残留量的检测方法。本方法采用改良QuEChERS方法进行样品前处理,操作简便快捷,样品净化液经LCMS/MS分析后,氰虫酰胺和四氯虫酰胺采用基质匹配标准溶液外标法定量、双三氟虫脲采用基质匹配标准溶液或纯溶剂标准溶液外标法定量,结果准确可靠,用于蔬菜和水果中3种杀虫剂残留量的检测分析,结果令人满意。
References
1GUOQingLong,CUIShuHua,LIUJingJing,LIURunZhu.Chemistry,2013,76(10):951-956
郭庆龙,崔淑华,刘靖靖,刘润珠.化学通报,2013,76(10):951-956
2ZHAOHaiZhen,HUShan,ZHANGZhiXiang,LIANGMingLong,XUHanHong.ChineseJournalofPesticides,2006,45(1):59-61,63
赵海珍,胡珊,张志祥,梁明龙,徐汉虹.农药,2006,45(1):59-61,63
3LIUAnChang,YUCaiHong,ZHANGShuKang,FENGJiaLi,HEXiaoLu.JournalofWuhanInstituteofTechnology,2015,37(1):11-13
刘安昌,余彩虹,张树康,冯佳丽,贺晓露.武汉工程大学学报,2015,37(1):11-13
4LIUChangLing.WorldpesticideInsecticide.Beijing:Chemicalindustrypress,2012:148-150
刘长令.世界农药大全杀虫剂卷.北京:化学工业出版社,2012:148-150
5FENGJian,GUQun.ModernAgrochemical,2008,7(5):40-42
冯坚,顾群.世界农药,2008,7(5):40-42
6LIUChangLing.WorldpesticideInsecticide.Beijing:ChemicalIndustryPress,2012:148-150
刘长令.世界农药大全杀虫剂卷.北京:化学工业出版社,2012:135-138
7YANGGuiQiu,HUANGQi,CHENLin,YANGHuiBin,YUHaiBo,LIBin.WorldPesticides.2012,34(6):19-21
杨桂秋,黄琦,陈霖,杨辉斌,于海波,李斌.世界农药,2012,34(6):19-21
8ANXin.PesticideMarketNews,2015,(8):45
安心.农药市场信息,2015,(8):45
9YUHuiLing,XIANGXing,YUANGuiXin,CHENYiQu,WANGXueGui.ActaEntomologicaSinica,2015,58(6):634-641
余慧灵,向兴,袁贵鑫,陈羿渠,王学贵.昆虫学报,2015,58(6):634-641
10SONGWenCheng,SHANWeiLi,YEJiMing,LIZiAng,ZHOUZhiQiang,PANCanPing.ChineseJournalofPesticideScience,2009,11(4):414-420
宋稳成,单炜力,叶纪明,李子昂,周志强,潘灿平.农药学学报,2009,11(4):414-420
11DongFS,LiuXG,XuJ,LiJ,LiYB,ShanWL,SongWC,ZhengYQ.Biomed.Chromatogr.,2012,26:377-383
12TimoS,TimothyAS,ChristopherJS,ChristopherCM,ThomasC,MichaelPW,SergioCN.J.Agric.FoodChem.,2011,59:814-821
13SunJP,FengN,TangCF,QinDM.BullEnviron.Contam.Toxicol.,2012,89:845-852
14HuXQ,ZhangCP,ZhuYH,WuM,CaiXM,PingLF,LiZ.J.AOACInter.,2013,96(6):1448-1452
15NanitaSC,StryJJ,PentzAM,McCloryJP,MayJH.J.Agric.FoodChem.,2011,59:7557-7568
16CUIShuHua,LIRuiJuan,MAHui,BEIFeng.DeterminationofCyantraniliproleResiduesinFruitsandVegetablesbyGCNCIMS,ZL201410841490.8,ChinaPatent,20151118
崔淑華,李瑞娟,马惠,贝峰.一种NCI测定果蔬中氰虫酰胺残留的方法,ZL201410841490.8,中国专利,20151118
17CUIShuHua,ZHAOHan,YIWeiXian,YUXiaoYun,WANGJing,WANGXingHua.TheMethodofDeterminationBistrifluronResiduesinFruitsandVegetables,ChinaPatent,ZL201410007694.120150408
崔淑华,赵晗,衣维贤,于晓云,王静,王兴华.一种双三氟虫脲残留量的测定方法,ZL201410007694.1,中国专利,20150408
18CUIShuHua,CHENGGang,LIURunZhu,ZHAOFeng.DeterminationofSYP9080ResiduesinFruitsandVegetablesbyLCMS/MS.ZL201510026280.8,ChinaPatent,20160330
崔淑华,程刚,刘润珠,赵峰.一种果蔬中四氯虫酰胺残留的LCMS/MS测定方法,ZL201510026280.8,中国专利,20160330
19CUIShuHua,CHENGGang,ZHAOFeng,LIURunZhu.DeterminationofSYP9080ResiduesinFruitsandVegetablesbyGCEIMS,ZL201510025664.8,ChinaPatent,20160309
崔淑华,程刚,赵峰,刘润珠.一种GCEIMS测定果蔬中四氯虫酰胺残留的方法,ZL201510025664.8,中国专利,20160309
20CUIShuHua,LIZhengYi,WEIXiaoTang,WANGYu.TheMethodofDeterminationSYP9080ResiduesinFruitsandVegetables,ChinaPatent,ZL201510025665.220160330
崔淑华,李正义,魏晓棠,王宇.一种蔬菜和水果中四氯虫酰胺残留量的测定方法,ZL201510025665.2,中国专利,20160330
21AysalP,AmbrusAmLehotayS.J.JEnviron.Sci.HealthB,2007,42(5):481-490
22BSEN15662:2008,FoodsofPlantOriginDeterminationofPesticideResiduesusingGCMSand/orLCMS/MSFollowingAcetonitrileExtraction/PartitioningandCleanupbyDispersiveSPEQuEChERSMethod.EuropeanCommiteeforStandardization
23CUIShuHua,XUMeiLing,QIANJiaLiang,DUANHao,LIUJinFeng,LINLiMing,WANGKaiYun.ChineseJ.Anal.Chem.,2011,39(12):1836-1840
崔淑华,许美玲,钱家亮,段浩,刘金峰,林黎明,王开运.分析化学,2011,39(12):1836-1840
AbstractAliquidchromatographytandemmassspectrometric(LCMS/MS)methodwasdevelopedforthedeterminationofbistrifluron,cyantraniliproleandSYP9080residuesinfruitsandvegetables.Theanalyteswereextractedfromsampleswithacetonitrile,andpurifiedbydispersionsolidphaseextractionusingC18andprimarysecondaryamine(PSA)assolidphaseadsorbent,thenanalyzedbyLCMS/MS.BistrifluronandSYP9080wereanalyzedwithnegativeionmultiplereactionmonitoring(MRM),cyantraniliprolewasanalyzedwithpositiveionMRM.ThematrixinducedweakeningeffectwasobservedintheanalysisofcyantraniliproleandSYP9080inseveralsamplesincludingcucumber,appleandonion,andtheweakeningextentofthematrixinducedeffectdependedonthesampleproperties.Butnomatrixeffectwasfoundintheanalysisofbistrifluroninseveralsamples.TheinterferenceofmatrixwasreducedbyusingthematrixmatchedcalibrationstandardscurveintheanalysisofcyantraniliproleandSYP9080.Bistrifluroncouldbequantifiedbyanexternalstandardofthematrixmatchedcalibrationstandardsorthepuresolventcalibrationstandards.Thelinearrangewasfrom0.2μg/Lto100μg/Lforbistrifluron,cyantraniliproleandSYP9080withthegoodcorrelationcoefficients(r≥0.9990).Therecoveriesofcucumber,grape,appleandscallionaddedbistrifluronat0.005-2mg/kgwere79.8%-99.9%,withrelativestandarddeviations(RSD)of3.6%-9.8%.Thelimitsofquantification(S/N=10)were0.210μg/kg,0.160μg/kgand0.004μg/kg,andlimitsofdetection(S/N=3)were0.064μg/kg,0.048μg/kgand0.001μg/kgforbistrifluron,cyantraniliproleandSYP9080,respectively.
KeywordsLiquidchromatographytandemmassspectrometry;Fruitsandvegetables;Residues;Bistrifluron;SYP9080;Cyantraniliprole
(Received29June2016;accepted4January2017)