表面接枝法制备磁性邻苯二甲酸二丁酯印迹聚合物及其识别性能研究
2017-04-14徐婉珍张枭明黄卫红聂仪晶杨文明
徐婉珍 张枭明 黄卫红 聂仪晶 杨文明


摘要采用表面接枝法对四氧化三铁纳米粒子表面进行功能化修饰,以二甲基丙烯酸乙二醇酯(EGDMA)为交联剂,偶氮二异丁腈(AIBN)为引发剂,成功制备了对邻苯二甲酸二丁酯(DBP)具有特异识别性能的磁性表面印迹聚合物(MMIPs)。利用扫描电镜、透射电镜、振动样品磁强计、元素分析、红外光谱等对其进行表征。BET测试结果表明,MMIPs的比表面积(380m2/g)大于MNIPs(324m2/g)。吸附动力学、等温线模型分析显示,MMIPs对DBP的Sips等温线模型相关系数R2=0.999,动力学Pseudosecondorder模型相关系数(R2)为0.9797。对邻苯二甲酸二烯丙酯(DAP)、DBP和邻苯二甲酸二(2乙基己基)酯(DEHP)的印迹因子分别为1.53、2.21和1.39,对DBP具有较高的印迹因子和较好的识别性能。磁性分子印跡聚合物经5次再生后,对DBP的吸附能力仅下降了12.3%,表明再生循环效果较好。
关键词邻苯二甲酸二丁酯;分子印迹聚合物;选择性;吸附剂
1引言
邻苯二甲酸酯类物质(Phthalateesters,PAEs),是邻苯二甲酸及其醇类物质经酯化反应,合成得到的一系列有机化合物。因其常用于增加材料的延展性、弹性和柔软性,也被称为塑化剂或增塑剂(Plasticizer)。PAEs已被广泛应用到塑料制品的添加剂[1],亦作为农药、驱虫剂、化妆品等的生产原料[2,3]。研究表明,长期接触PAEs会对生物机体产生严重的危害[4,5],其具有慢性毒性和急性毒性,可导致生物机体致畸、致癌、致突变等危害。
分子印迹技术(Molecularimprintingtechnology,MIT)是一种通过制备具有特殊选择能力的材料来识别特定化学物质(小分子或生物大分子等)的技术[6,7],已被大量应用于分离吸附[8~11]、传感器[12,13]、催化[14,15]、药物传输[16,17]等领域。利用MIT技术制备的分子印迹聚合物(MIPs),具有对特定分子特异性识别的能力。MIPs对目标检测物具有很好的识别性能,能克服环境样品中复杂基质干扰等缺陷[18~23],在对痕量物质的检测中展示出准确和灵敏等优点。
在Fu[24]和Yilmaz等[25]的工作基础上,本研究采用Febrianto等[26]对硅球羧基化的方法,制备出性能优异的表面MIPs,用以识别DBP。由于DBP分子上的氧原子与甲基丙烯酸(MAA)的羧基易形成氢键[27],因此,将上述方法引入到DBPMIPs的制备过程。
2实验部分
2.1仪器与试剂
LC2010A高效液相色谱仪(日本岛津公司);NicoletNexus470傅里叶变换红外光谱仪(美国尼高力公司);MERLINCompact场发射扫描电镜(德国卡尔蔡司公司);JEM2100HR透射电子显微镜(日本电子株式会社);No.735振动样品磁强计(美国Lakeshore公司);TRISTARII3020比表面和孔隙分析仪(美国MicromeriticsInstrument公司)。
邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二异辛酯(DEHP)、邻苯二甲酸二烯丙酯(DAP)、正硅酸四乙酯(TEOS)、3氨丙基三乙氧基硅烷(APTES)、N,N二甲基甲酰胺(DMF)、聚(4苯乙烯磺酸共聚马来酸)钠盐(PSSMA)、乙腈(阿拉丁公司);偶氮二异丁腈(AIBN)、顺丁烯二酸酐(国药集团化学试剂有限公司);二甲基丙烯酸乙二醇酯(EGDMA,SigmaAldrich公司)。以上试剂均为分析纯。甲醇(色谱纯,美国TEDIA公司)。
2.2四氧化三铁微球及二氧化硅包覆的四氧化三铁微球的制备
四氧化三铁(Fe3O4)微球的制备过程[28]简述如下:将2g聚(4苯乙烯磺酸共聚马来酸)钠盐加入到80mL乙二醇溶剂的三口烧瓶中搅拌溶解,直至澄清。随后加入FeCl3·6H2O(2.16g)和无水乙酸钠(6g),搅拌至完全溶解。将上述混合溶液转移到100mL含有聚四氟乙烯内衬的不锈钢高压水热反应釜中,置于200℃的烘箱中,加热反应10h。取出反应釜,冷却至室温,用乙醇和蒸馏水反复洗涤除去未反应的反应物和副产物,磁性分离便得到超顺磁流体。
二氧化硅包覆的四氧化三铁微球(Fe3O4@SiO2)制备过程[26]如下:取1mL储备液,将其加入到装有20mL乙醇、1mL水、1mL氨水混合液的烧瓶中,超声分散均匀(约10min)。随后加入TEOS乙醇溶液(0.5mLTEOS和5mL乙醇的混合液),继续超声搅拌90min,然后磁性分离,乙醇和水反复洗涤3次。最后,将分离产物置于真空干燥箱中,35℃下干燥12h,便可得到Fe3O4@SiO2。
2表面改性
将10.05mLAPTES加入到10mL溶有4.4g顺丁烯二酸酐的DMF溶剂中。然后将500mgFe3O4@SiO2分散于150mLDMF溶剂中,超声分散均匀。最后,将第一步中APTES和顺丁烯二酸酐反应后的混合液加入到上述分散液中,在30℃下搅拌反应24h,然后用乙醇和水洗涤3次,在35℃下真空干燥12h,即可得到羧基化Fe3O4@SiO2,即Fe3O4@SiO2COOH。
2.4磁性表面分子印迹聚合物的合成
将500mg上述制备好的Fe3O4@SiO2COOH分散于装有150mL乙腈溶剂中,超声分散均匀。然后加入DBP(1mmol,0.27mL)振荡1h,形成预组装混合液。随后,将4mmol(0.76mL)EGDMA和20mgAIBN加入到上述预组装混合液中,超声10min使其混合均匀,在60℃水浴条件下,搅拌反应24h,然后磁性分离,分离产物用乙醇和水反复洗涤3次,将分离物65℃下真空干燥12h,便可得到磁性表面印迹聚合物(MMIPs)。磁性表面非印迹聚合物(MNIPs)在同样的条件下得以制备,未加入模板分子。
2.5吸附实验
2.5.1吸附等温线考察配制初始浓度分别为10,20,30,40,50,60,80和100mg/L的DBP标准乙醇溶液。然后将8份30mg的MMIPs(或MNIPs)分别加入到装有5mL上述DBP标准溶液的玻璃管中;随后,将装有吸附剂和吸附液的玻璃管放入恒温振荡器中,于25℃下振荡24h;最后,磁性分离并检测上清液中DBP的含量。MMIPs对DBP的吸附量(qe,mg/g)可通过式(1)得到:
qe=V(C0-C)/m〖FH(1)
其中,C0(mg/L)是DBP的初始浓度,C(mg/L)是吸附完成后分离液中DBP的浓度;V(mL)是加入DBP溶液的体积;m(mg)是MMIPs(或MNIPs)的质量。
2.5.2吸附动力学考察分别称取30mgMMIPs(或MNIPs)分散于40mg/L(或50mg/L,60mg/L)的DBP乙醇溶液(5mL)中,然后將混合溶液置于恒温振荡器中振荡(25℃,150r/min),在一定时间间隔(5、10、15、20、30、45、60、120和180min)内磁性分离,检测上清液中DBP的含量。不同时间内印迹聚合物对DBP的吸附量可根据式(2)得到:
qt=V(C0-Ct)/m〖FH(2)
其中,qt(mg/g)和Ct(mg/L)分别是时间t时对DBP的吸附量和在时间t时溶液中DBP的浓度。
2.5.3选择性分析DAP和DEHP作为DBP的结构类似物。将印迹聚合物分别置于初始浓度为50mg/L的DAP、DBP和DEHP溶液中。吸附完成后,磁性分离上清液中所有PAEs的浓度由HPLC检测得到。
2.5.4再生实验用甲醇乙酸溶液(9〖KG-3∶〖KG-51,V/V)作为洗脱液,将吸附到MMIPs中的DBP洗脱干净,重复实验,此过程反复进行5次。
3结果与讨论
3.1MMIPs的制备
以PSSMA为添加剂,制备MMIPS。采用表面接枝的方法,修饰Fe3O4@SiO2表面,引入双键。加入交联剂EGDMA和引发剂AIBN,热引发聚合反应,形成MMIPs,再通过甲醇乙酸洗脱液的洗脱除去DBP模板分子。合成原理如图1所示。
3.2MMIPs及MNIPs的表征
图2分别是Fe3O4(a),Fe3O4@SiO2(b)和Fe3O4@SiO2COOH(c)的红外光谱图。如图2a所示,581.3cm 1处是Fe3O4纳米微球中〖JG(Fe〖ZJYO〖JG)键振动产生的典型特征峰。在1097.1cm 1强的红外吸收峰是〖JG(Si〖ZJYO〖ZJYSi〖JG)的反对称伸缩振动产生的;799.5和474cm 1处分别是〖JG(Si〖ZJYO〖JG)键对称伸缩振动和〖JG(Si〖ZJYO〖JG)键弯曲振动产生的峰型;这3处吸收峰是SiO2的典型特征峰(图2b)。如图2c所示,1714.4cm 1处是不饱和羧酸中〖JG(C〖ZJLX,YO〖JG)伸缩振动峰,
表1分别是Fe3O4@SiO2,Fe3O4@SiO2COOH及MMIPs表面元素成分的分析结果,
结合红外光谱的分析结果,可以推测羧基基团已成功修饰到微球表面。
由图3A~3C可见,Fe3O4呈现出规则的球形,分散性好。由图3E和3F的插图可见,MMIPs的表面比较粗糙,而MNIPs的表面较光滑。BET测试结果表明,MMIPs的比表面积为380m2/g,大于MNIPs(324m2/g),与SEM结果一致。
图4是Fe3O4(a),Fe3O4@SiO2(b),Fe3O4@SiO2COOH(c)和MMIPs的磁滞回归线,属于“S”型回线,呈对称,剩余磁化强度(Mr)分别为6.97、2.69、3.53和2.94emu/g;矫顽磁性值(Hc)分别为11.70,14.38,22.83和24.50Oe。此外,Fe3O4@SiO2和Fe3O4@SiO2COOH的饱和磁化强度值(分别为42.56和37.89emu/g),低于Fe3O4(55.09emu/g),因Fe3O4表面包覆了SiO2,进一步羧基修饰后,Fe3O4微球包埋,导致其磁性减弱。MMIPs的饱和磁化强度值为33.98emu/g。
3.3吸附等温线分析
在25℃下,MMIPs和MNIPs对DBP的吸附等温线见图5。随着DBP初始浓度的增加,MMIPs和MNIPs对DBP的吸2附量均增加,因DBP的初始浓度越大,吸附剂表面和吸附溶液的浓度差越大,吸附剂对DBP的吸附动力越大。但相同浓度下MMIPs对DBP的吸附量远大于MNIPs,而且当吸附溶液的初始浓度达到一定值后,MNIPs对DBP的吸附趋于饱和。
分别用Langmuir(3)、Freundlich(4)和Sips(5)等温线模型对实验数据进行拟合分析。3种模型的数学表达式如下所示:
qe=KLqmLCe/(1+KLCe)〖FH(3)
其中,qmL和kL分别是单层吸附的最大吸附量以及Langmuir常数。
qe=KFCe1/n〖FH(4)
其中,KF和n分别代表吸附强度的等温参数和吸附能力。
qe=qms(asCe)〖SX(1〖n〖SX)/〖JB((1+(asCe)〖SX(1〖ns〖SX)〖JB))〖FH(5)
其中,as是吸附能量常数。ns用于表示吸附的均匀性。
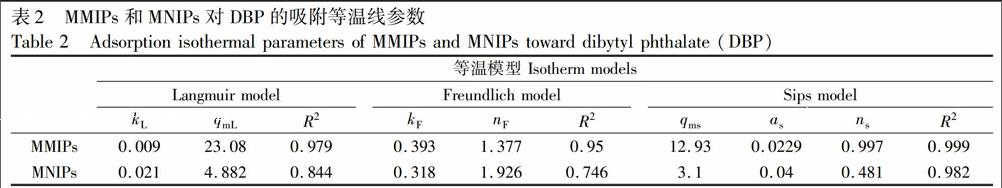
由Langmuir[29]、Freundlich[30]和Sips[31]等温线模型对实验数据的拟合结果如表2所示,相比Langmuir和Freundlich模型,3个模型拟合的相关系数(R2)分别是0.979、0.95和0.999,Sips模型拟合的线性相关系数均大于Langmuir和Freundlich模型,更接近于1,所以根据相关系数的值得到,Sips模型更适合拟合MMIPs的吸附等温线模型。此外,在Sips模型中,1/ns值常用于表示吸附的不均一性,1/ns值越接近1,说明吸附剂的表面越均一,MMIPs的1/ns=1.0031,与1非常接近,说明DBP在印迹聚合物表面的吸附是非常均一的。
3.4动力学分析
不同DBP初始浓度下,MMIPs及MNIPs对DBP的吸附动力学曲线如图6所示。在吸附初始阶段,MMIPs和MNIPs对DBP的吸附量,随着时间延长而升高。随着DBP初始浓度的增加,MMIPs及MNIPs对DBP的吸附平衡量增大,达到吸附平衡后,在3种不同浓度的吸附液中,MMIPs对DBP的吸附量均高于相应的MNIPs。MMIPs的特异性结合的印迹识别位点,致使其对DBP具有特异性亲和效果。DBP初始浓度为50mg/L时,MMIPs对DBP的吸附量约是MNIPs的2.5倍。
用Pseudofirstorder模型,Pseudosecondorder模型及Elovich方程进行了拟合处理[32~34]。表达式如(6),(7)和(8)所示。拟合结果如表3所示。
qt=qe-qee k1t〖FH(6)
qt=〖SX(k2q2et〖1+k2qet〖SX)〖FH(7)
qt=〖SX(lnab+lnt〖b〖SX)〖FH(8)
其中,k1和k2分别指pseudofirstorder和pseudosecondorder方程的吸附速率常数;t是吸附时间;a和b分别是初始吸附速率和表面覆盖相关常数。
对于MMIPs,Pseudosecondorder动力学模型更适合,2拟合结果相关系数最接近1,实验和理论qe值较接近,而其Elovich模型拟合结果的相关系数低。而MNIPs则比较符合Pseudofirstorder动力学模型。
3.5选择性分析
为了考察MMIPs的吸附特异性,以DAP和DEHP作为DBP的结构类似物进行了一系列的选择性批量吸附实验。通过印记因子(Imprintingfactor,IF)评价MMIPs对DBP的特异识别能力,印记因子的定义为MMIPs和MNIPs对目标分子或结构类似物的吸附量之比。
如图7所示,MNIPs对DBP及其结构类似物的吸附量没有明显区别,因为其表面没有特异性识别位点存在,对DBP及其结构类似属于非特异性吸附。然而,MMIPs对DBP的吸附量明显高于它的结构类似物,MMIPs对DAP、DBP和DEHP的IF值分别为1.53、2.21和1.39,可知MMIPs具有较高的印迹因子,说明其对DBP具有很高的选择性识别能力。MIPs对DBP高的特异识别性可归结于两个因素:(1)3种物质化学结构的不同,与DBP分子相比,DAP分子的空间结构小于DBP,而DEHP的空间尺寸大于DBP,这使得DAP虽然容易进入印迹位点,并形成作用力,但这种相互作用不稳定;(2)只有DBP分子的空间结构和尺寸与MMIPs的印迹位点一致,形成较强的吸附作用,比较稳定。
3.6吸附再生性分析
在50mg/LDBP乙醇溶液中,进行循环实验,吸附过程与等温线相同。以甲醇乙酸(9〖KG-3∶〖KG-51,V/V)混合液為洗脱液,进行了5次吸附与解吸附实验。5次循环实验后,MMIPs对DBP的吸附能力下降,这是由于在反复的洗脱过程中,部分印迹空穴及其识别位点遭到不同程度的破坏。但其对DBP的吸附能力仅下降了12.3%,说明制备的MMIPs具有良好的重复利用性。
References
1CaoY,LiuJ,LiuY,WangJ,HaoX.Regul.Toxicol.Pharmacol.,2016,74:34-41
2GuoY,WangL,KannanK.Arch.Environ.Contam.Toxicol.,2014,66(1):113-119
3SelfRL,WuWH.FoodControl,2012,25(1):13-16
4NaaralaJ,KorpiA.Toxicol.Lett.,2009,188(2):157-160
5HuangPC,KuoPL,GuoYL,LiaoPC,LeeCC.Hum.Reprod.,2007,22(10):2715-2722
6RamstramO,AnsellRJ.Chirality,1998,10(3):195-209
7AlexanderC,AnderssonHS,AnderssonLI,AnsellRJ,KirschN,NichollsIA,O′MahonyJ,WhitcombeMJ.J.Mol.Recognit.,2006,19(2):106-180
8SULiQiang,ZHOULei,HANShuang,ZHANGWeiBing.ChineseJ.Anal.Chem.,2015,43(11):1772-1776
苏立强,周磊,韩爽,张维冰.分析化学,2015,43(11):1772-1776
9MAOYanLi,NIUYunFeng,WUJunFeng,KANGHaiYan,LIDong,WANGXiangWen.ChineseJ.AnalChem.,2016,44(6):915-922
毛艳丽,牛云峰,吴俊峰,康海彦,李东,王巷文.分析化学,2016,44(6):915-922
10LulińskiP,MacIejewskaD.J.Sep.Sci.,2012,35(8):1050-1057
11HUShuGuo,LILi,HEXiWen.Prog.Chem.,2005,17(3):531-543
胡树国,李礼,何锡文.化学进展,2005,17(3):531-543
12HanQ,ShenX,ZhuW,ZhuC,ZhouX,JiangH.Biosens.Bioelectron.,2016,79,180-186
13MazzottaE,TurcoA,ChianellaI,GuerreiroA,PiletskySA,MalitestaC.Sens.ActuatorB,2016,229:174-180
14LiY,SongH,ZhangL,ZuoP,YeB,YaoJ,ChenW.Biosens.Bioelectron.,2016,78:308-314
15LiuJQ,WulffG.J.Am.Chem.Soc.,2008,130(25):8044-8054
16ByrneME,HiltJZ,PeppasNA.J.Biomed.Mater.Res.A,2008,84(1):137-147
17CirilloG,IemmaF,PuociF,ParisiOI,CurcioM,SpizzirriUG,PicciN.J.DrugTarget.,2009,17(1):72-77
18KatarzynaJ,MariannaC.Polimeros,2013,23(6):718-724
19WuQH,ZhouX,SunM,MaXX,WangC,WangZ.Microchim.Acta,2015,182(34):879-885
20TranfoG,PapaleoB,CaporossiL,CapannaS,RosaMD,PiginiD,CorsettiF,PaciE.Int.J.Hyg.Envir.Heal.,2014,216(4):481-485
21JINGLiJing,WANGYang,WEITianXin.ChineseJ.Anal.Chem.,2016,44(8):1157-1164
景麗静,王洋,韦天新.分析化学,2016,44(8):1157-1164
22ChenJ,LichwaJ,SnehotaM,MohantyS,RayC.Chromatographia,2006,64(78):413-418
23FarahaniH,NorouziP,DinarvandR,GanjaliMR.J.Chromatogr.A,2007,1172(2):105-112
24FuG,HeH,ChaiZ,ChenH,KongJ,WangY,JiangY.Anal.Chem.,2011,83(4):1431-1436
25YilmazE,HauptK,MosbachK.Angew.Chem.Int.Ed.,2000,39(12):2115-2118
26FebriantoJ,KosasihAN,SunarsoJ,JuYH,IndraswatiN,IsmadjiS.J.Hazard.Mater.,2009,162(2):616-645
27HeJ,LvR,ZhuJ,LuK.Anal.Chim.Acta,2010,661(2):215-221
28GaoJ,RanX,ShiC,ChengH,ChengT,SuY.Nanoscale,2013,5(15):7026-7033
29LangmuirI.J.Am.Chem.Soc.,1918,40(9):1361-1403
30FreundlichH.J.Phys.Chem.,1906,57:385-470
31SipsR.J.Chem.Phys.,1948,16(429):490-495
32LagergrenS.KungligaSvenskaVetenskapsakademiensHandlingar,1898,24(4):1-39
33GossetT,TrancartJL,ThvenotDR.WaterRes.,1986,20(1):21-26
34ChienS,ClaytonW.SoilSci.Soc.Am.J.,1980,44(2):265-268
AbstractThemagneticmolecularlyimprintedpolymers(MMIPs),basedonthesurfaceofmagneticnanoparticlesbeingmodifiedbysurfacegrafting,havebeensuccessfullysynthesized,withdibutylphthalate(DBP)astemplatemolecule,ethyleneglycoldimethacrylate(EGDMA)ascrosslinkingagentandazobisisobutyronitrile(AIBN)asinitiator.Scanningelectronmicroscopy(SEM),transmissionelectronmicroscope(TEM),andelementalanalysiswereemployedtocharacterizetheMMIPs.ThestructureandmagneticpropertiesoftheMMIPswereinvestigatedbymeansofXraydiffractionandvibratingsamplemagnetometer.TheBETsurfaceareashowsthatMMIPsis380m2/gandMNIPsis324m2/g.Aseriesofstaticadsorptionexperimentswereconductedtoanalyzeitsadsorptionperformance,whichfollowedpseudosecondordermodelbythekineticanalysiswithcorrelationcoefficient(R2)0.9797,andSipsequationwithcorrelationcoefficient(R2)0.999bytheisothermalanalysis.Theimprintingfactorsofdiallylphthalate(DAP),DBPanddi2ethylhexylphthalate(DEHP)were1.53,2.21and1.39respectively,showingthatMMIPshadbetterrecognitionperformanceforDBP.TheexperimentofregenerationrecycleswithfivetimesshowedtheregenerationabilityofDBPwasonlyreducedby12.3%.
KeywordsDibutylphthalate;Molecularlyimprintedpolymer;Selectivity;Sorbent
(Received21November2016;accepted25January2017)
ThisworkwassupportedbytheNationalNaturalScienceFoundationofChina(No.21677064)