银离子固相萃取程序升温大体积进样气相色谱法定量分析市售巧克力中的饱和烷烃矿物油
2017-04-14李冰宁刘玲玲张贞霞武彦文
李冰宁 刘玲玲 张贞霞 武彦文
摘要建立了银渍硅胶固相萃取柱离线(AgSPE)净化,程序升温进样气相色谱氢火焰离子化检测器(PTVGCFID)定量分析巧克力中饱和烷烃矿物油(MOSH)的方法。以正己烷浸泡提取巧克力中的MOSH,离心后取1mL上清液,过0.3%Ag渍硅胶SPE柱净化,氮吹浓缩,定容至0.2mL,注入GC分析;GC的进样口程序升温过程:初始温度45℃,保持1min(分流比200〖KG-3∶〖KG-51),以250℃/min升温至360℃(分流阀关闭2min),并保持27min(分流比100〖KG-3∶〖KG-51);进样量40μL;柱温箱升温程序为:35℃保持3min,以25℃/min升温至350℃,以5℃/min升温至370℃,保持10min,载气为高纯氮气,流速1.3mL/min(压力60kPa);FID温度为380℃。结果表明,本方法的MOSH定量限为0.5mg/kg,加标回收率为84.9%~108.6%,相对标准偏差(RSD)为0.2%~1.5%。运用本方法对25个市售巧克力样品中的MOSH含量进行了测定,3个样品未检出,其余22个样品中MOSH含量为1.09~8.15mg/kg(其中C16~C35的含量为0.56~4.43mg/kg),有3个样品含量高于5.00mg/kg,为严重污染样品。本方法操作简便,检出限低,适用于巧克力中MOSH的定量测定。
关键词巧克力;矿物油污染;饱和烷烃;固相萃取;气相色谱法;氢火焰离子化检测器
1引言
矿物油是石油分馏得到的C10~C50烃类化合物的总称,主要包括直链、支链和烷基取代环状的饱和烷烃(Mineraloilsaturatedhydrocarbons,MOSH)以及烷基取代的芳香烃(Mineraloilaromatichydrocarbons,MOAH)两类,同时含有极少量无烷基取代的多环芳烃及含硫、含氮化合物[1]。研究表明,食品中的矿物油,特别是C16~C35的MOSH会蓄积在人体的各种组织和器官中,如皮下腹部脂肪组织、肠系膜淋巴结、脾脏、肝脏、肺、心脏和大脑中MOSH的含量为15~360mg/kg[2]。MOSH呈低等到中等毒性,大量蓄积容易引发微粒肉芽肿,诱导浆细胞瘤形成,改变免疫功能或诱导自身免疫反应,高剂量的长链MOSH甚至是肿瘤的启动因子[3,4]。德国联邦食品与农业部2014年规定,迁移至食品的MOSH不得高于2mg/kg;联合国粮农和世界卫生组织(FAO/WHO)规定,矿物油的每日允许摄入量(ADI)不能超过45mg/kg[2]。
食品中的MOSH来源于从原料种植到终产品销售的各个环节,包括环境污染、加工过程的引入和包装材料迁移等[2,4]。研究表明,食用油、谷物、婴幼儿食品、母乳、食品包装材料等均受到了不同程度的MOSH污染[5~9]。食品中矿物油的检测主要采用液相色谱气相色谱(配氢火焰离子化检测器)联用法(LCGCFID)[10~12],该方法准确、灵敏、干扰低,但仪器昂贵、操作复杂,难以普及。LCGC中的液相色谱用于除去MOSH的干扰物,利用固相萃取(SPE)代替液相色谱,即SPEGCFID方法也能达到净化目的[13~15]。目前,已经建立了离线SPEGC定量检测食用油、面包及食品接触材料中MOSH的方法[6,14~17],但巧克力样品尚未涉及,原因是巧克力的基质复杂,对MOSH检测干扰严重。本研究通过优化SPE净化条件,根据巧克力的样品基质选取了合适的定量内标,建立了离线SPE净化,然后注入配有大体积程序升温(Programmedtemperaturevaporization,PTV)进样系统的气相色谱仪,定量分析巧克力中MOSH的方法,并采用此方法检测了市售巧克力中的矿物油污染情况。
2实验部分
2.1仪器、与试剂
GC2010plus气相色谱仪,配备PTV进样系统和FID检测器(日本Shimadzu公司);DB5HT毛细管柱(15m×0.25mm×0.1μm,美国Agilent公司);NEVAP氮吹仪(美国Organomation公司)。
正己烷、丙酮(色谱纯,美国FisherScientific公司);硅胶(0.063~0.200mm,德国Merck公司,使用前在马弗炉中600℃烘烤6h,冷却后置于干燥器中备用);液体石蜡(Paraffinoil,用作外标)、联环己烷(Cyclohexylcychlohexane,Cycy,用作内标)、胆甾烷(5alphacholestane,Cho,作为MOSH洗脱结束的定位标准)、1,3,5三叔丁基苯(1,3,5tritertbutylbenzene,TBB,作为MOAH洗脱开始的定位标准)、C7~C40正构烷烃混合标准溶液(用于挥发损失分析),均购自美国SigmaAldrich公司;巧克力样品购于当地超市。玻璃器皿用铬酸洗液、超纯水、丙酮和正己烷淋洗后晾干。
分别配制10mg/mL的Cycy、Cho、TBB的单标溶液,然后分别取0.5mL的单标溶液,以正己烷定容至25mL,得到200mg/L的混合标准溶液。
2.2实验方法
2.2.1巧克力中MOSH的提取
称取5g切碎的巧克力样品,加入30μL200mg/L混合标准溶液,10mL正己烷,涡旋混匀后浸泡过夜,振荡、离心,取上清液,即得到样品提取液[18]。
2.2.2SPE柱制备及样品净化
取5mL玻璃注射器(8cm×13mm,外层包裹铝箔),底部放入玻璃纤维滤纸(Φ13mm),装入3g0.3%银渍硅胶(参照文献\[15\]制備),轻轻敲实。SPE柱先用10mL正己烷淋洗,弃去流出液,待正己烷近干时,取1mL样品提取液上样过柱,待提取液近干时,加入10mL正己烷洗脱SPE柱。流出液的前2mL弃去,收集后续的5mL流出液,氮吹浓缩至0.2mL,备用。
2.2.3GC分析条件PTV参数:初始温度45℃保持1min(分流比200〖KG-3∶〖KG-51),以250℃/min升温至360℃并保持27min(分流阀关闭2min,使MOSH全部进入分析柱,随后打开分流阀,以100〖KG-3∶〖KG-51分流比洗脱衬管中残留的高沸点物质)。进样量40μL。柱箱升温程序:35℃保持3min,以25℃/min升温至350℃,以5℃/min升温至370℃,保持10min,载气为高纯氮气,流速1.3mL/min(压力60kPa);FID温度为380℃。
2.2.4挥发损失考察将2mg/LC7~C40正构烷烃混标溶液直接注入GC分析,随后取2mg/L正构烷烃混标溶液200μL,稀释至5mL,氮吹浓缩至0.2mL,注入GC分析。平行测定11次,考察程序升温进样过程和氮吹浓缩过程的挥发损失。
3结果与讨论
3.1样品提取
巧克力固体样品切成小块,液体样品则直接称量5g,加入10mL正己烷提取,涡旋混匀、浸泡过夜,次日离心取上清液,采用烘干称重法计算脂肪含量。结果表明,巧克力产品包装上标识的95%以上的脂肪被提取出来。Fiselier等[15]发现,3g0.3%银渍硅胶能够保留400mg油脂,建议上样量不超过200mg油脂。根据实验结果,1mL巧克力提取液的平均油脂含量是0.17g,因此,确定SPE柱的上样体积为1mL。结果表明,SPE柱未出现甘油三酯流出,即过载现象。
3.2MOSH洗脱组分的确定
将Cho、TBB、Cycy混合标准溶液添加到巧克力基质中,按照2.2.2节方法净化样品,分段接收流出液(1mL为1段),并注入GC检测,以确定MOSH组分的洗脱区间。由于MOSH和MOAH先后流出,通常采用Cho和TBB作为定位标准,用于标示MOSH和MOAH的分离情况[15]。由图1可见,前2mL流出液未出现任何标准品,可视为SPE柱的死体积。后续3~7mL流出液出现Cycy和Cho,且主要集中于3~5mL流出液。第8mL流出液中仅含极少量的Cycy和Cho,却出现大量MOAH的定位标记物TBB。因此,收集第3~7mL流出液即得到MOSH洗脱组分。
3.3内标物的选择
由于FID对矿物油中所有烃类化合物的响应都一致,因而任意烃类化合物均可作为参考标准对MOSH进行定量分析[18]。然而,由于实际样品的MOSH碳数范围差异较大,采用外标定量法会引起分析误差,内标法则可以消除MOSH不同碳数范围、操作方法和分析条件的影响,因而成为矿物油分析的常用定量方法。同样,由于MOSH通常具有一定的碳数范围,其GC谱图中呈宽峰形式,即占据的色谱图范围较宽,内标只能选择在此宽峰的前后区域出现的化合物,即低沸点或高沸点的烷烃化合物。一般高沸点烷烃的熔点高,分流歧视效应明显,不适合作内标。因此,处于谱图前面的低沸点烷烃常是内标的选择对象,如食用油中矿物油分析即选择C18作内标[6]。巧克力样品在C18处存在样品基质干扰,无法用于定量分析。因此,本方法根据样品谱图选取Cycy作为内标。
3.4挥发损失实验
MOSH由不同碳数的烷烃组成,碳数越小,沸点越低。因此,含有不同沸程的MOSH在浓缩和GC进样过程中均可能发生低沸点物质的挥发损失,即分别在氮吹浓缩过程中和程序升温进样条件下低沸点化合物的挥发损失。本研究模拟MOSH馏分的浓缩步骤,对混合正构烷烃溶液进行氮吹浓缩,结果表明,氮吹浓缩过程C11~C40的挥发损失很小,可以忽略(图2B)。进样过程的挥发损失则采用正构烷烃溶液直接注入GC进行考察。由于程序升温进样口温度的高低是挥发损失的关键,本研究设定了不同的进样口初始温度(45℃和75℃)。由图2可见,当初始温度为75℃时,C7~C10几乎全部损失,C11损失75%,C18损失了10%以上,原因是进样口温度较高时,低沸点正构烷烃在分流阀打开时直接气化,
〖HK〖TS)并随溶剂分流逸出。当进样口温度为45℃时,C11~C40峰面积基本相同,说明低温可以抑制低沸点物质的分流逸出,从而有效减少了低碳数烷烃的挥发损失。此时,可以选择C11及其之后的烷烃作为MOSH的定量内标。
3.5定量限
MOSH的GC谱图是一个类似“驼峰”的宽峰,MOSH的含量通过计算GC谱图的基线与驼峰之间的“空白”面积得到[18]。MOSH宽峰上方的尖峰为食品中的天然正构烷烃,定量计算时需要扣除。定量限(LOQ)根据注入GCFID的MOSH质量确定。一般经验认为进入FID的MOSH超过50ng时,GC谱图的宽峰面积才能正确积分计算[18]。原因是MOSH是众多烷烃化合物的集合(宽峰),其FID的检测灵敏度仅是单个化合物(尖峰)的1%,因此,通常要求进入FID的MOSH总量至少达到50ng才能准确定量分析。本方法采用5g巧克力样品,以10mL正己烷提取,离心分离后取1mL提取液过SPE柱净化,随后收集5mLMOSH流出液,浓缩至0.2mL,取40μL注入GCFID进行定量分析。整个过程相当于有0.1g巧克力样品进入FID检测,对应的LOQMOSH值为0.5mg/kg,即只有当巧克力中MOSH的含量高于0.5mg/kg才能检出。
3.6加标回收率
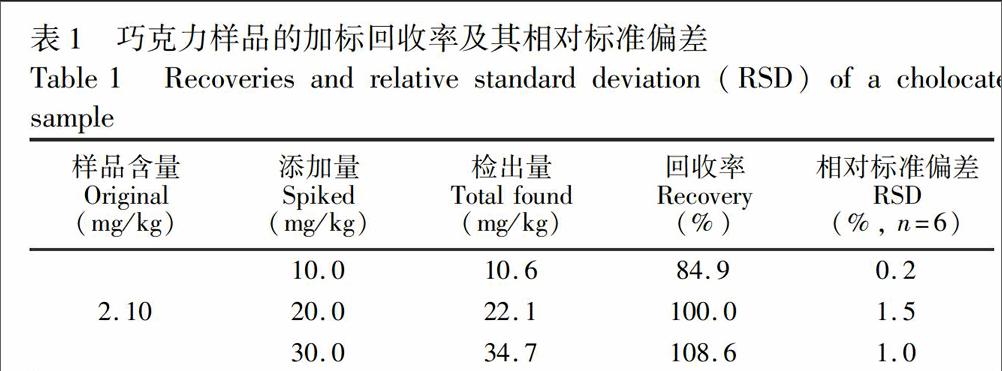
以巧克力作为样品基质,分别〖ZH(添加液体石蜡标准溶液进行加标回收实验,添加水平分别为10.0,20.0和30.0mg/kg。每个样品及空白平行测定6次,计算平均加标回收率和相对标准偏差(表1)。结果表明,加标回收率在84.9%~〖ZH)108.6%之间,RSD在0.2%~1.5%之间,可以满足分析检测要求。
3.7样品检测
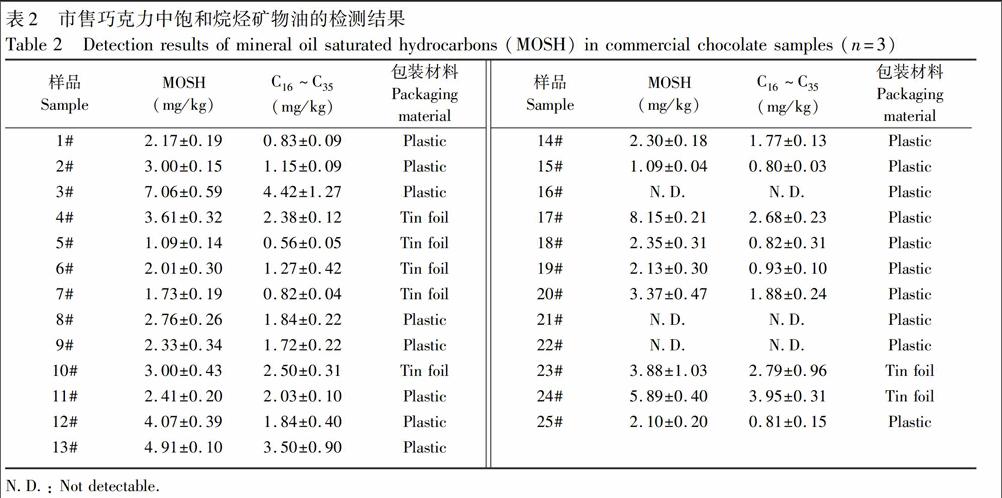
采用本法对市售的25个不同品牌及包装的巧克力样品中的MOSH含量进行检测(表2)。结果表明,3个样品中的MOSH含量低于检出限,其余22个样品中MOSH含量为1.09~8.15mg/kg,其中容易被人体吸收的C16~C35为0.56~4.43mg/kg。这些样品中,3个样品的矿物油含量低于2.00mg/kg,16个样品的MOSH含量为2.00~5.00mg/kg,其中3#、17#和24#中的MOSH含量高于5.00mg/kg。一般认为,MOSH含量≤2mg/kg为低度污染,2~5mg/kg为中度污染,超过5mg/kg为嚴重污染。因此,市售巧克力中大多含有MOSH,且个别样品存在严重污染。对比国外的研究结果,Moret等[19]研究的巧克力中矿物油含量为200~700mg/kg,其中一个样品的可可豆原料受到严重污染,MOSH高达1300mg/kg。因此,巧克力的矿物油污染不容忽视。
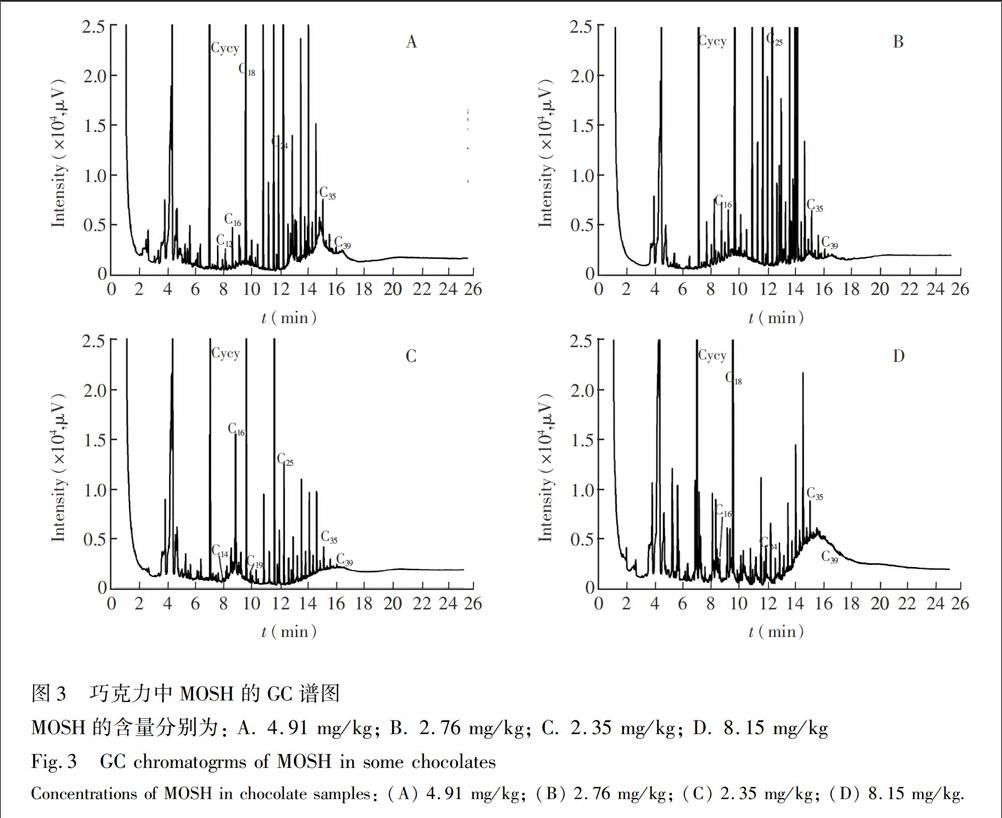
食品中矿物油污染来源也是人们关注的热点,德国联邦风险评估所(BundesinstitutfürRisikobewertung,BfR)认为食品中矿物油主要来自食品包装(如包装上的印刷油墨及粘合剂)。巧克力的包装材料有纸、铝箔、锡箔、塑料等。本研究中的17#样品是矿物油含量最高的塑料包装巧克力酱,其污染原因可能是液体巧克力酱与包装接触面积较大。通常,通过分析MOSH谱图可以推测矿物油污染来源。图3A、3B、3C的MOSH谱图范围均由两部分宽峰组成,其中低沸点宽峰的覆盖范围为C14~C25,中心位置位于C16和C18附近。根据文献报道,这类MOSH属于典型的包装油墨迁移引起的矿物油污染[20];图3中MOSH的高沸点部分位于C25~C39(中心位置为C35)范围的驼峰,这类MOSH通常认为源于润滑油和塑料包装粘合剂[21]。此外,聚α烯烃类(PAO)粘合剂的典型色谱峰的中心也位于C35附近[22]。由此可见,巧克力中的矿物油污染来源于生产加工与包装迁移。
4结论
本研究建立了离线AgSPE净化、PTVGCFID测定巧克力中MOSH的方法,并对部分市售的巧克力产品进行了检测。结果表明,本方法的定量限为0.5mg/kg,加标回收率为84.9%~108.6%,可以用于巧克力中MOSH含量的测定。本方法检测了25个市售巧克力样品中矿物油污染情况,结果表明,22个样品中检出含有MOSH,含量为1.09~8.15mg/kg,其中容易被人体吸收的C16~C35含量为0.56~4.43mg/kg;且有3个样品中矿物油含量超过了5.00mg/kg,属于严重污染。因此,建立巧克力中矿物油的标准检测方法并实施相应监管十分必要。此外,根据GC的MOSH谱图的碳数范围分析了矿物油污染源,包括润滑油、油墨和粘合剂等,可能来自巧克力原料采集、运输、生產加工与包装过程,建议生产企业与相关部门加强监控,采取有效措施,保证食品安全。
References
1WUYanWen,WANGYing,LIBingNing,WANGXinXin,WANGYu,ZUWenChuan.J.FoodSafeQual.,2015,6(6):2145-2150
武彦文,王颖,李冰宁,王欣欣,汪雨,祖文川.食品安全质量检测学报,2015,6(6):2145-2150
2EuropeanFoodSafetyAuthority(EFSA)(2012)ScientificOpiniononMineralOilHydrocarbonsinFood.EFSAJ,2012,10(6):2704,1-185
3BarpL,KornauthC,WuergerT,RudasM,BiedermannM,ReinerA,ConcinN,GrobK.FoodChem.Toxicol.,2014,72:312-321
4GrobK.J.Verbr.Lebensm.,2014,9:231-219
5GB27602014,ChineseStandardsforFoodAdditives.NationalStandardsofthePeople′sRepublicofChina
食品添加剂使用标准.中华人民共和国国家标准.GB27602014
6LIULingLing,WUYanWen,LIBingNing,WANGYu,YANGYiFan,ZUWenChuan,WANGXinXin.ChineseJ.Anal.Chem.,2016,44(9):1419-1424
刘玲玲,武彦文,李冰宁,汪雨,杨一帆,祖文川,王欣欣.分析化学,2016,44(9):1419-1424
7MondelloL,ZoccaliM,PurcaroG,FranchinaFA,SciarroneD,MoretS,ConteL,TranchidaPQ.J.Chromatogr.A,2012,1259:221-226
8VollmerA,BiedermannM,GrundbckF,IngenhoffJE,BiedermannBremS,AltkoferW,GrobK.Eur.Food.Res.Technol.,2011,232:175-182
9ConcinN,HofstetterG,PlattnerB,TomovskiC,FiselierK,GerritzenK,FesslerS,WindbichlerG,ZeimetA,UlmerH,SieglH,RiegerK,ConcinH,GrobK.FoodChem.Toxicol.,2008,46:544-552
10FiselierK,GrobK.Eur.FoodRes.Technol.,2009,229:679-688
11TranchidaPQ,ZoccaliM,PurcaroG,MoretS,ConteL,BeccariaM,DugoP,MondelloL.J.Chromatogr.A,2011,1218:7476-7480
12BiedermannM,FiselierK,GrobK.J.Agri.FoodChem.,2009,57:8711-8721
13FioriniD,PaciaroniA,GigliF,BalliniR.FoodControl,2010,21:1155-1160
14MoretS,BarpL,GrobK,ConteLS.FoodChem.,2011,129:1898-1903
15FiselierK,GrundbckF,SchnK,KappensteinO,PfaffK.HutzlerC,LuchA,GrobK.J.Chromatogr.A,2013,1271(1):192-200
16ANHongMei,KERunHui,LIUXiu,TIANFeiFei,WANGLiJuan,HUANGXinWang,YINJianJun.FoodFerment.Industr.,2016,42(1):152-156
安紅梅,柯润辉,刘秀,田菲菲,王丽娟,黄新望,尹建军.食品与发酵工业,2016,42(1):152-156
17LIKeYa,ZHONGHuaiNing,HUChangYing,CHENYanFen,LIUZhuoQin,WANGZhiWei.Sci.Technol.FoodIndus.,2015,19:280-285
李克亚,钟怀宁,胡长鹰,陈燕芬,刘卓钦,王志伟.食品工业科技,2015,19:280-285
18BiedermannM,GrobK.J.Chromatogr.A,2012,1255:56-75
19MoretS,GrobK,ConteLS.Z.Lebensm.Unters.Forsch.A,1997,204:241-246
20DrozC,GrobKZ.LebensmUntersForsch.A,1997,205:239241
21BiedermannM,GrobK.J.ChromatogrA,2012,1255:76-99
22NotiA,GrobK,BiedermannM,DeissU,BrüschweilerBJ.Regul.Toxicol.Pharm.,2003,38:317-325
AbstractAnofflinesilverimpregnatedsilicagelsolidphaseextraction(AgSPE)approachcombinedwithaprogrammedtemperaturevaporizationgaschromatographyflameionizationdetector(PTVGCFID)wasproposedforroutineanalysisofmineraloilsaturatedhydrocarbons(MOSH)inchocolates.TheMOSHinchocolateswereextractedbynhexaneand1mLofextractwaspurifiedbyofflineAgSPEcolumn.TheSPEcolumnspackedwith0.3%AgactivatedsilicagelwereusedtoseparateMOSHfromtriglyceridesandolefinsinchocolates.TheeluentofMOSHfractionwasonly5mLandthenconcentratedto0.2mLthroughnitrogenblowingwithlittleevaporationloss.ThePTVparameterswereasfollows:theinitialtemperaturewassetat45℃andheldfor1min(splitratiowas200〖KG-3∶〖KG-51),thenwarmedupto360℃atlineargradientof250℃min 1andheldfor27min(splitvalvewasclosedfor2minfollowedbysplitratioof100〖KG-3∶〖KG-51).TheGCinjectionvolumewas40μL.TheGCcolumnwasheatedfrom35℃(3min)to350℃at25℃/min,andthenraisedto370℃(10min)at5℃/min.Theflowrateofthecarriergaswas1.3mL/min(andpressurewas60kPa),FIDtemperaturewassetat380℃.Thelimitofquantification(LOQ)andtherecoveriesofthemethodwere0.5mg/kgand84.9%-108.6%,respectively,withtherelativestandarddeviations(RSD)of0.2%-1.5%.Twentyfivecommercialchocolatesampleswereanalyzedwiththeproposedmethod,anditwasfoundthattheMOSHinthreesampleswerenotdetected,andtheconcentrationsofMOSHinother22sampleswere1.09-8.15mg/kg(theconcentrationsofMOSHwithC16-C35componentwere0.56-4.43mg/kg).Theresultssuggestedthatitwasnecessarytoroutinelydetectmineraloilcontaminationinchocolatesforfoodsafety.
KeywordsChocolate;Mineraloilcontamination;Saturatedhydrocarbons;Solidphaseextraction;Gaschromatography;Hydrogenflameionizationdetector
(Received14November2016;accepted12January2017)