AKT/FOXO在一次低氧致骨骼肌蛋白质代谢变化中的作用
2017-04-14李俊平叶鸣张全成王瑞元
李俊平+叶鸣+张全成+王瑞元

摘 要:目的:通过观察一次性低氧暴露后不同恢复时间大鼠骨骼肌蛋白含量、3-MH含量,并检测骨骼肌FOXO3a和AKT蛋白磷酸化变化,探讨一次性低氧暴露后不同恢复时间骨骼肌蛋白质代谢的变化以及AKT/FOXO通路在骨骼肌蛋白质代谢变化中的作用。方法:雄性SD大鼠35只,随机分为对照组和低氧刺激后即刻组、1小时组、6小时组和12小时组,除对照组外,其他各组在低氧环境下(3 500米)生活10小时。于低氧刺激后即刻、常氧恢复1小时、6小时和12小时,分别对大鼠称重、麻醉后,取腓肠肌。BCA法测腓肠肌总蛋白含量,高效液相色谱检测骨骼肌3-MH含量,Western Blot检测FOXO3a、p-FOXO3a和AKT,p-AKT蛋白含量。结果:1)一次低氧暴露后常氧恢复期间,各组大鼠骨骼肌3-MH含量没有显著变化(P>0.05);2)一次性低氧暴露后常氧恢复期间,大鼠腓肠肌总蛋白含量,恢复6小时、12小时组与对照组相比,具有显著性增加(P<0.05);3)一次性低氧暴露后常氧恢复期间,各组腓肠肌AKT含量均显著高于对照组(P<0.05),AKT的磷酸化均显著高于对照组(P<0.05)。4)一次性低氧暴露后常氧恢复期间,腓肠肌FOXO3a含量与对照组相比没有显著性变化(P>0.05),FOXO3a的磷酸化均显著高于对照组(P<0.05)。结论:一次低氧暴露后常氧恢复期间骨骼肌蛋白质合成增加,其机制之一可能是由于低氧激活了AKT/FOXO通路,抑制了骨骼肌蛋白的降解。
关键词:骨骼肌;低氧; 3-MH;AKT;FOXO3a
中图分类号:G804.7 文献标识码:A文章编号:1006-2076(2017)02-0080-06
Abstract:Objective: To detect the changes in skeletal muscle protein metabolism and the changes of Akt/FoxO pathway after one-time exposure to hypoxia.Methods: 35 male SD rats were randomly divided into control group and immediately after hypoxia group, 1 hr, 6 hr and 12-hr group. All the groups except control group have been living in the hypoxic environment (3 500 m) for 10 h. The total protein, 3-MH, Akt, P-Akt, FOXO3a and P-FOXO3a of Gastrocnemius muscle were detected. Results: After 10 hours under hypoxia, the 3-MH not changed, total protein of 12 h group and 6 h group increased markedly (P<0.05), the content of Akt and p-Akt increased markedly (P<0.05) than control, the content of P-FOXO3a increased markedly (P<0.05) than control. Conclusion: The results show that total protein of skeletal muscle increases after hypoxic stimulus, and one of the mechanisms might be that Akt/FOXO signal pathway activated by hypoxia has led to less protein synthesis.
Key words: skeletal muscle; hypoxia; 3-MH; AKT; FOXO3a
许多研究表明,长期低氧暴露可引起体重和肌肉质量明显下降。低氧对体重的影响与低氧暴露方式、低氧濃度、持续时间有关,但其机理仍不清楚。Hoppeler[1]等研究发现,人在慢性低氧暴露后肌肉萎缩,肌肉横截面积下降10%。刘晔[2]等报道,模拟4 000 m 海拔高度生活和耐力训练导致大鼠骨骼肌蛋白质分解代谢显著增强。叶鸣[3]等研究发现,模拟海拔3 500 m对大鼠进行单纯间歇性低氧暴露,使大鼠体重和肌肉质量下降,肌肉蛋白含量减少,推测低氧暴露可促进骨骼肌蛋白质分解代谢加强。
目前对于一次低氧暴露及暴露后不同恢复时间对骨骼肌蛋白质代谢的影响及其机制还不清楚。本研究拟观察一次低氧暴露及其恢复过程中,骨骼肌蛋白质含量、3-MH(三甲基组氨酸)、Akt(蛋白激酶B)及FOXO(Forkhead转录因子O亚家族)的变化,探讨一次低氧暴露是否可通过Akt/FOXO通路影响骨骼肌蛋白质代谢。
1 研究对象与方法
1.1 实验对象与分组
1.1.1 实验对象
雄性SD大鼠35只,8周龄,SPF级,购自北京维通利华实验动物技术有限公司。国家标准啮齿类动物饲料,分笼饲养,自由饮食、进水,室温(22±2)℃,相对湿度30%~60%。常压低氧房氧浓度为13.6%,相对高度3 500 m。
1.1.2 大鼠分组与低氧暴露方式
大鼠购进后称重,随机分为常氧对照组(C)和低氧暴露后即刻组(H0),低氧暴露后常氧恢复1小时组(H1),低氧暴露后常氧恢复6小时组(H6),低氧暴露后常氧恢复12小时组(H12),共5组,每组7只。
实验前对所有大鼠进行为期7天的常压常氧适应性饲养。实验时常氧对照组不施加任何干预,所有低氧暴露组大鼠进入设定为3 500 m高度的低氧房一次性低氧暴露10小时,最后在常氧环境下恢复。
1.1.3 大鼠腓肠肌样本的采集与处理
大鼠称重后,用2%戊巴比妥钠腹腔注射麻醉,腹主动脉取血后,速取右侧腓肠肌,切成小块,用锡纸编号、包好,投入液氮中冰冻暂存。取材完成后把腓肠肌标本转移至-80℃冰箱保存,备用。
1.2 测试指标与测试方法
1.2.1 骨骼肌蛋白含量测定
采用BCA测试法,按照试剂盒说明书进行。标准品(样品):BCA工作液=1[KG-*2]∶8,混匀后37℃孵育30 min,酶标仪562 nm波长读取OD值。标准品制备标准曲线,待测样品的OD值代入标准曲线方程得出蛋白含量。
1.2.2 高效液相色谱检测骨骼肌3-MH含量
1)肌肉组织的处理:称取50 mg左右的腓肠肌组织,加入到预冷的含500 μL高氯酸(3.0%)的1.5 mL离心管内,用眼科剪迅速剪碎,冰浴中高速匀浆(20 000 rpm)10秒,14 000 g,4℃离心25 min,沉淀蛋白,提取上清液。注意肌肉匀浆一定要充分。
2)柱前衍生:取50 μL上清液至1.5 mL离心管内,加入125 μL 0.2 mmoL/L硼酸钠(先配制0.2 mmoL/L硼酸,用氢氧化钠将调至12.2),旋涡振荡,缓慢加入125 μL乙腈(含荧光胺1.6 g/L)混勻,静置5 min后,加入70%高氯酸18 μL,盖紧离心管,80℃水浴1小时。冷却至室温后,加入中和剂3 M的NaOH(含0.5 M MOPS)50 μL,使标本液终pH在6.0左右,即上机分离、检测。
3)色谱条件:流动相采用10 mM磷酸钠缓冲液(含30%乙腈,pH 7.50),等度洗脱,流速1.0 mL/min,进样量100 μL,经Zorbarx SB-C18柱(4.6×150 mm,5 μm,柱温为常温)分离,荧光分光光度计检测波长。激发365 nm/发射460 nm发射。外标法定量。注意乙腈要选用光谱纯,降低本底值。
4)色谱分离:3-MH的出峰时间约为5.9分钟。
标准曲线和最低检测浓度:配制3-MH标准液的浓度分别为2.5、5.0、7.5、10.0、15.0、20.0 umoL/mL,按样品处理方法进行测定。利用3-MH标准品的不同浓度(C:umoL/mL)与各自对应的面积(S)建立回归方程。
1.2.3 Western blot 方法测定AKT、FOXO3a 蛋白及其磷酸化水平
取出肌肉组织加入液氮研磨后,称取0.1 g 组织,以1∶9 加入预冷的裂解液,电动匀浆器( 置于冰浴中) 匀浆,冰上孵育20 min,4℃离心,12 000 rpm,20 min,取上清。采用BCA 测试法定量蛋白浓度。浓缩胶浓度为4%,分离胶浓度为10%。样品通过浓缩胶时电压为90 V,电泳1小时,溴酚蓝进入分离胶后电压改为150 V,电泳大约3.5小时。电泳结束后取出凝胶,采用湿转方法,将电泳后的蛋白样品转移至PVDF 膜上,转膜电流300 mA,时间100 min。把膜放入盛有3% TBST BSA 的培养皿中,室温振摇封闭1小时。弃去TBST BSA,用TBST 振摇洗膜3次,每次10 min。用3% TBST BSA 稀释一抗P- FOXO3a(1∶1[KG*4]500),FOXO3a(1∶500),P-AKT(1∶500),Akt(1∶10 000),GAPDH(1∶20 000),把膜放入盛有抗体的塑料试管中,4℃ 振摇过夜。弃去一抗,TBST 振摇洗膜3次,每次10 min。用3% TBST BSA 稀释二抗,辣根过氧化物酶标记羊抗鼠IgG(1∶10 000),辣根过氧化物酶标记羊抗兔IgG(1∶8 000),室温振摇结合二抗40 min。弃去二抗,TBST 洗膜3次,每次10 min。PVDF置于ECL 发光液中,室温反应5 min,之后将膜放入曝光盒中,胶片压片、感光,显影、定影、水冲洗后,室温晾干,用凝胶影像分析系统拍摄照片。ImageJ 处理条带, ImageQuant TL 软件计算条带Integrated OpticalDensity 值。
1.3 数据处理
全部统计学分析均采用SPSS13.0统计软件进行分析。实验数据用均数±标准差表示。实验数据的比较用单因素方差分析。显著性水平取P<0.05。
2 研究结果
2.1 一次低氧暴露骨骼肌3-MH的含量变化
一次性低氧暴露后不同恢复时间骨骼肌3-MH的含量变化见表1。一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组3-MH的含量与对照组相比均有升高趋势,但无显著性差异(P>0.05)。
2.2 一次性低氧暴露后不同恢复时间大鼠骨骼肌蛋白含量变化
一次性低氧暴露后不同恢复时间大鼠骨骼肌蛋白含量的变化见表1。一次性低氧暴露后恢复6小时、12小时组与对照组相比,具有显著性差异(P<0.05)。恢复即刻和1小时组与对照组相比虽然没有显著性差异,但也具有增高趋势。
2.3 一次低氧暴露不同恢复时间骨骼肌Akt含量的变化
一次性低氧暴露后不同恢复时间骨骼肌Akt含量的变化见图1和图5。一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组Akt含量均显著高于对照组(P<0.05)。
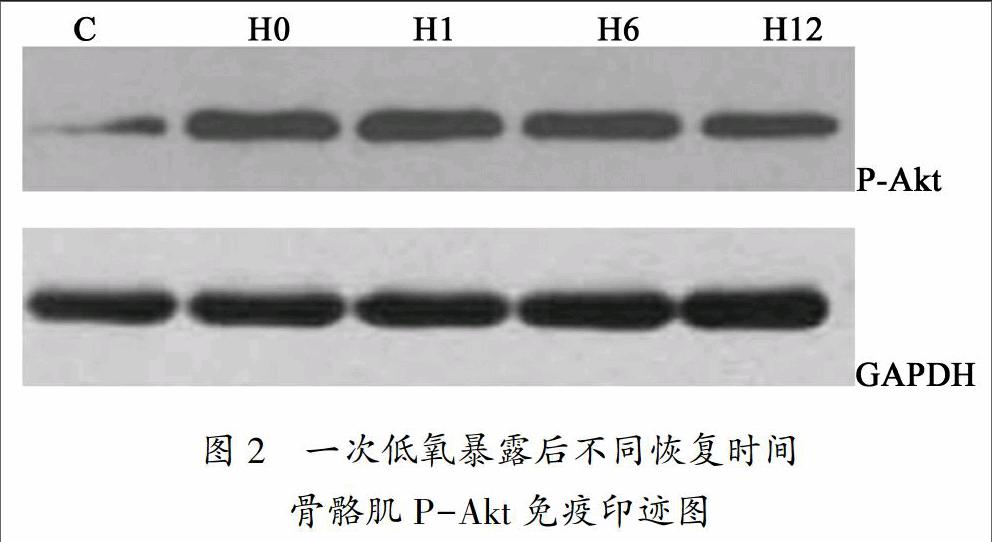
2.4 一次低氧暴露不同恢复时间骨骼肌Akt的磷酸化变化
一次性低氧暴露后不同恢复时间骨骼肌Akt的磷酸化变化见图2和图5。一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组Akt的磷酸化水平均显著高于对照组(P<0.05)。
2.5 一次低氧暴露不同恢复时间骨骼肌FOXO3a含量的变化
一次性低氧暴露后不同恢复时间骨骼肌FOXO3a含量的磷酸化变化见图3和图5。一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组FOXO3a含量虽略有下降趋势,但与对照组相比没有显著性变化(P>0.05)。
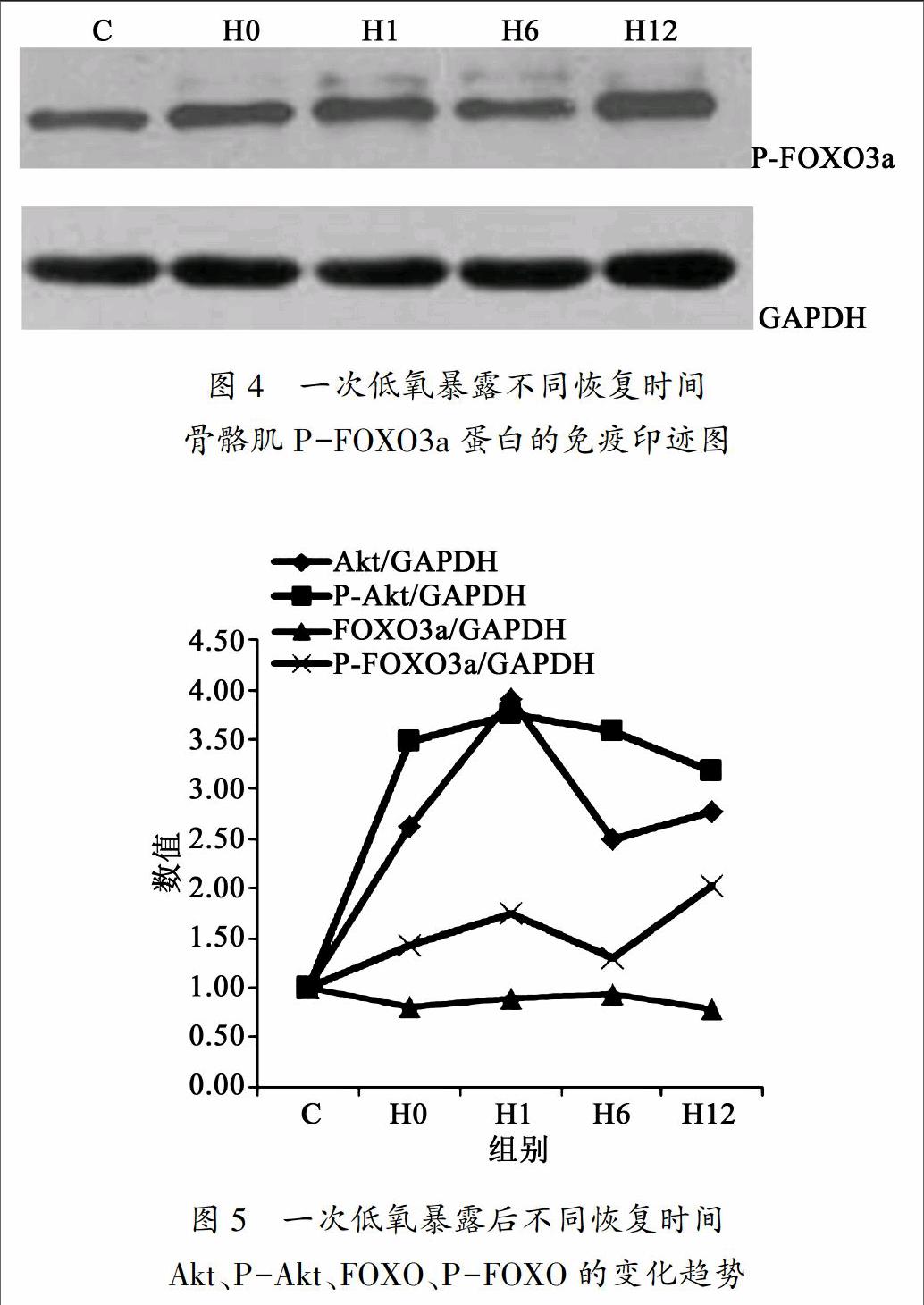
2.6 一次低氧暴露不同恢复时间骨骼肌FOXO3a的磷酸化变化
一次性低氧暴露后不同恢复时间骨骼肌P-FOXO3a的磷酸化变化见图4和图5。一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组P-FOXO3a均显著高于对照组(P<0.05)。
3 分析与讨论
3.1 一次性低氧暴露后不同恢复时间大鼠骨骼肌蛋白含量的变化
许多研究表明,低氧暴露抑制机体蛋白质合成。低氧抑制蛋白质合成可能因为低氧暴露降低ATP浓度,导致蛋白质合成抑制。低氧训练对蛋白质合成代谢影响的机制不太清楚,可能存在多种作用途径。吸入体内的氧浓度高低和低氧暴露时间的长短可能直接调节骨骼肌蛋白质的合成。贺道远[4]研究发现,模拟海拔3 500 m对大鼠进行为期4周的低氧暴露(每天晚上暴露12小时),大鼠体重和肌肉质量显著下降。但是关于一次性低氧暴露后不同恢复时相对骨骼肌蛋白质代谢的影响及其机理还未见报道。
本研究中设计了3 500 m高度的低氧环境,实验结果发现,各组大鼠的骨骼肌蛋白含量均有逐渐增加的趋势,其中低氧暴露后6小时组和12小时组与对照组比较,有显著性增高。这个结果表明,可能是由于低氧暴露促发了某种蛋白质的合成机制,或同时抑制了骨骼肌的降解机制,从而导致了蛋白含量的增加。
3.2 一次性低氧暴露后不同恢复时间对大鼠骨骼肌3-MH含量的影响
3-甲基组氨酸(3-MH)是组氨酸形成组氨酰-tRNA后发生甲基化的产物,它也是肌肉收缩蛋白降解的特征性代谢产物,主要存在于骨骼肌的肌动蛋白和肌球蛋白中(约占体内3-甲基组氨酸总含量的91.1%)[5]。蛋白质分解代谢释放的3-MH不能再作为tRNA的底物合成新肽链,因此,测定3-MH的释放量或排泄量可间接反映肌纤维收缩蛋白的降解率。大部分人体和动物实验采用尿3-MH含量进行评价,但尿3-MH 含量部分还来源于机体其他器官[6],而测量骨骼肌内3-MH 含量可以真实反映骨骼肌收缩蛋白降解的变化[7,8]。
有研究表明一次大强度运动0.5 小时即刻、运动1 小时即刻和运动后6小时大鼠骨骼肌3-MH含量均有显著性增高[9],说明一次大强度运动后骨骼肌收缩蛋白有明显降解。本研究结果显示,一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组3-MH的含量与对照组相比并无显著性增加。这个结果表明低氧刺激并未激活蛋白质降解系统,蛋白质并未出现明显降解。
3.3 一次性低氧暴露后不同恢复时间大鼠骨骼肌Akt含量及其磷酸化的变化
蛋白激酶B(Akt)属于丝/苏氨酸蛋白激酶,是磷脂酰肌醇3-羟基激酶下游的直接靶蛋白之一。在多种细胞中,Akt充当抗凋亡信号激酶的作用,此外,Akt还在细胞存活、细胞增殖和葡萄糖代谢等活动中扮演着重要角色。近年来,随着研究的深入,有报道认为Akt通过FOXOs调控MAFbx基因的表达,进而调节肌肉萎缩[10]。Akt磷酸化后处于活化状态而脱磷酸化后处于非活化状态,激活后的Akt聚集在胞核,磷酸化多种蛋白底物,而这些底物能调节基因转录,这些底物包括forkhead家族蛋白、SRK、E2F和端粒酶逆转录酶等。
关于运动对Akt影响的研究还不是很多。有研究显示,力量训练8周致骨骼肌肥大,Akt和mTOR磷酸化水平分别显著增加1.4倍和44%,而在停止運动8周后,Akt磷酸化和运动后相比,水平降低33%,mTOR磷酸化水平保持在与运动后相似的较高水平[11]。还有研究显示,运动0.5小时组Akt磷酸化显著升高,运动1小时组非常显著性升高,而运动后1小时组与安静组相比有下降趋势,但是没有显著性差异,运动后2小时、6小时组与安静组相比非常显著地下降[12]。马铁[13]通过对3周的大运动量训练和2周的减量训练发现,在大运动量训练的前期,Akt磷酸化水平具有升高的趋势,这可能是训练前期加强蛋白合成以对抗由于负荷压力导致的骨骼肌炎症和降解的适应性反应。在连续3周的训练后大鼠处于运动疲劳状态。此时Akt磷酸化水平低于对照组,表明骨骼肌的合成代谢能力降低。减量训练过程中,与对照组相比Akt和mTOR磷酸化均呈现升高的趋势,mTOR磷酸化水平升高幅度最大,且存在显著差异。通过对比可知,减量训练会促进骨骼肌蛋白的合成,其中Akt/mTOR信号通路发挥着相对主要的作用。
持续或间歇性低氧对Akt的影响的研究还没有检索到。本研究采用一次性低氧暴露后不同恢复时间这种模式,结果显示一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组Akt蛋白含量均显著高于对照组。一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组Akt的磷酸化水平均显著高于对照组。提示一次性低氧暴露后恢复期间Akt磷酸化显著升高,这说明低氧刺激促进了Akt的磷酸化。
3.4 一次性低氧暴露后不同恢复时间大鼠骨骼肌FOXO3a含量及其磷酸化的变化
FOXO转录因子是INS/IGF-I通路中重要的信号分子,对下游靶基因的表达有一定的调控作用。FOXO有多个苏氨酸和丝氨酸磷酸化位点。FOXO被传统认为是Akt的下游底物[14],当Akt磷酸化水平升高时,FOXO被磷酸化,移位于细胞质而失去活性,细胞质内的FOXO蛋白被最终降解[15]。Akt磷酸化降低时,FOXO磷酸化降低,移位于核内,具有活性,促进相关基因的表达,如泛素连接酶的表达。
有报道FOXO1mRNA在运动后即刻,运动后恢复1小时,3小时分别增加46%,85%和45%显著性升高[16]。Baviera等[17]报道用化学性交感神经阻断术促进糖尿病大鼠蛋白质降解时,观察到Akt、FOXO磷酸化降低,认为交感神经阻断可能通过Akt/FOXO信号途径,促进蛋白质降解。另有研究报道,老年人与年轻人相比肌肉萎缩显著增加,同时观察到老年人安静时FOXO3amRNA、MuRF1mRNA表达量与年轻人相比显著升高,说明FOXO3amRNA表达量升高可能促进蛋白质降解[18]。张凯的研究对比了10周四种不同运动形式(耐力训练、抗阻训练、后肢悬垂和损伤训练)对骨骼肌FOXO1的影响,发现不同运动形式对不同肌肉的影响不尽相同,可能参与骨骼肌纤维类型的转变[19]。
目前,关于一次性低氧暴露后,FOXO3a蛋白含量及其磷酸化的研究还未见报道。本研究结果显示,一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组FOXO3a蛋白含量虽略有下降趋势,但与对照组相比没有显著性变化。但一次性低氧暴露后恢复即刻、1小时、6小时和12小时各组P-FOXO3a均显著高于对照组。提示低氧刺激并没有引起FOXO3a蛋白含量的变化,但是FOXO3a的磷酸化水平明显增加。有研究证明FOXO3aSer253磷酸化降低,FOXO3a被活化,促进MAFbx mRNA和MuRF1 mRNA基因表达[10]。因此,本研究结果表明,虽然FOXO3a蛋白含量没有明显变化,但其磷酸化水平的增高,可能抑制了MAFbx mRNA和MuRF1 mRNA基因表达,从而抑制了骨骼肌蛋白质的降解。
Akt对FOXOS的磷酸化具有调节作用。FOXOs 是Akt的下游底物,有研究报道:降低Akt的磷酸化,细胞核中FOXO1和FOXO3a蛋白的含量增加,认为Akt活性下降,可使FOXOS脱磷酸化移位于核,调节靶基因的表达;相反用IGF-1处理,促进Akt的磷酸化,可使FOXO1和 FOXO3a磷酸化增加,抑制MAFbx mRNA的表达,说明Akt对FOXO磷酸化具有调节作用。
本研究观察到的FOXO磷酸化的变化与Akt磷酸化的变化趋势相一致,说明一次性低氧暴露后FOXO3a磷酸化受Akt磷酸化的调节。结果表明,一次低氧暴露后大鼠骨骼肌p-FOXO3含量升高,可能是一次低氧暴露刺激促使骨骼肌Akt/FOXO信号通路开放,抑制了骨骼肌蛋白质分解代谢所致。
4 结论
一次低氧暴露后常氧恢复期间骨骼肌蛋白质合成增加,其机制之一可能是由于低氧激活了AKT/FOXO通路,抑制了骨骼肌蛋白的降解。
参考文献:
[1]Hoppeler H,Kleinert E.Muscular exercise at high altitude.II.Morphological adaptation of skeletal muscle to chronic hypoxia[J]. Int J Sports Med.1990,11: S3-S9.
[2]刘晔, 刘桂华, 陈珑. 模拟海拔4000 m 高原训练1-3周对大鼠骨骼肌蛋白质代谢和血清睾酮的影响[J]. 北京体育大学学报, 2000(3): 41-44.
[3]叶鸣. 低氧和运动经雄激素-雄激素受体途径对骨骼肌蛋白质合成的作用[D]. 北京: 北京体育大学,2007.
[4]贺道远, 叶鸣, 朱一力,等. 高住低训对大鼠骨骼肌myostatin mRNA表达的影响[J]. 首都体育学院学报, 2012, 24(3): 280-288.
[5]Kumar V, Atherton P, Smith K, et al. Human muscle protein synthesis and breakdown during and after exercise[J]. J Appl Physiol, 2009, 106: 2026-2039.
[6]Trappe T, Williams R, Carrithers J, et al. Influence of age and resistance exercise on human skeletal muscle proteolysis: a microdialysis approach[J]. J Physiol, 2004, 554: 803-813.
[7]申传安, 柴家科, 廖杰, 等. 高效液相色谱-荧光检测法测定大鼠骨骼肌组织内微量三甲基组氨酸[J]. 军医进修学院学报, 2003, 24(2): 120-122.
[8]朱荣, 马延超, 许寿生,等. 一次大强度运动后大鼠骨骼肌收缩蛋白降解和26S 蛋白酶体活性的变化[J]. 中国运动医学杂志, 2010,29(3): 305-308.
[9]朱荣, 马延超, 王瑞元. 一次大强度运动对大鼠骨骼肌泛素蛋白酶体途径基因表达及蛋白质降解的影响[J]. 中国运动医学杂志, 2012, 31(5): 414-426.
[10]Nader GA. Molecular determinants of skeletal muscle mass: getting the "AKT" together[J]. Int J Biochem Cell Biol, 2005, 37(10): 1985-96.
[11]Leger B, Cartoni R, Praz M, et al. Akt signalling through GSK-3{beta}, mTOR and Foxo1 is involved in human skeletal muscle hypertrophy and atrophy[J]. J. Physiol,2006, 576(3): 923-933.
[12]馬延超, 朱荣, 许寿生,等.一次大强度耐力运动中AMPK 活性变化对Akt-mTOR 信号通路的影响[J]. 北京体育大学学报, 2013, 36(4): 53-57.
[13]马铁, 郑媛, 曾凡星. 大运动量和减量训练对大鼠骨骼肌Akt及其下游信号磷酸化水平的影响[J]. 沈阳体育学院学报, 2013, 32(6): 77-81.
[14]Van Der Heide LP, Hoekman MF, Smidt MP. The ins and outs of FOXO shuttling: mechanisms of FOXO translocation and transcriptional regulation[J]. Biochem J, 2004, 380:297–309.
[15]Plas, DR; Thompson, CB. Akt activation promotes degradation of tuberin and FOXO3a via the proteasome[J]. J Biol Chem, 2003, 278:12361–12366.
[16]Jrgensen SB, Wojtaszewski JF, Viollet B,et al. Effects of alpha-AMPK knockout on exercise-induced gene activation in mouseskeletal muscle[J]. FASEB J,2005,19(9):1146-8.
[17]Baviera AM, Zanon NM, Navegantes LC, et al. Chemical sympathectomy further increases muscle protein degradation of acutely diabetic rats[J]. Muscle Nerve, 2008, 38(2):1027-1035.
[18]Raue U, Slivka D, Jemiolo B, et al. Proteolytic gene expression differs at rest and after resistance exercise between young and old women[J]. J Gerontol A Biol Sci Med Sci, 2007, 62(12): 1407-1412.
[19]张凯. 不同运动形式NFAT和FoxO1的蛋白表达及骨骼肌纤维类型转换的研究[D]. 大连: 辽宁师范大学,2013.
