基于光波导微环谐振器的lgG非标记检测微流体分析系统
2017-04-14郭盈盈吴尚犬��金里王皖君张青川
郭盈盈 吴尚犬 ��金里 王皖君 张青川

摘要 设计开发了与微环谐振器集成的微流体通道系统,不仅避免了敞开环境中由于液体挥发造成的微环谐振器表面盐分的聚结,屏蔽空气中的各种杂质,而且只需要30 μL反应溶液,减少了药品用量,大大节约了实验成本。同时,采用绝缘体硅(SOI)材料,利用光刻技术设计和制作了波导宽度为450 nm,半径为5 μm,品质因子(Q值)为20000的光波导微环谐振器。集成的微环谐振器传感系统具有低成本、免标记、能实时监测生化反应过程等特点。以不同浓度的酒精溶液为测试对象,研究了微环谐振器对均质溶液的传感性能,传感芯片对溶液折射率的探测灵敏度为76.09 nm/RIU,探测极限为5.25×10Symbolm@@ 4 RIU,验证了此微环谐振器对均质溶液进行浓度检测的可行性。利用此传感系统对人免疫球蛋白IgG进行了非标记免疫检测。在测试中,采用微流体通道系统将相应抗体修饰到微环谐振器表面,利用光谱仪对修饰过程以及抗原抗体特异性结合过程中的共振谱线漂移情况进行了监测。结果表明,光波导微环谐振器可以对生物分子进行实时监测。
关键词 微环谐振器; 生物传感器; 微流体通道; 倏逝波; 免疫球蛋白G
1引 言
生化传感器广泛应用于食品安全、药物开发、临床诊断、环境监控等领域。根据输出的物理信号不同可分为光学生物传感器、电化学生物传感器[1]、机械生物传感器(微悬臂梁[2~4]等)及热生物传感器等。与其它类型的生物传感器相比,基于平面光波导的光学生物传感器具有无需标记、成本低、可实时监测、易集成、快速、稳定[5]等优点,在药物筛选、生物制药、环境监测和临床诊断领域得到广泛应用[6],不仅可与微流体通道系统进行集成,实时监测波导微环表面的物质变化,而且日渐成熟的微电子工艺进一步降低了微环谐振器芯片的加工成本,可实现大批量生产。光波导微环谐振器传感技术在生化测试领域显示出广阔的应用前景[7~9]。
光波导微环谐振器利用光波的倏逝波进行探测。光在介质中传播时,会在两种不同介质的分界面上产生一种称为倏逝波[10]的电磁波,其幅值会随着与分界面相垂直的深度的增大而呈指数形式衰减,而且这种衰减可以通过输出光的共振谱线漂移反映出来。当在微环中传输的光满足公式(1)时,光会发生共振。基于抗原抗体特异性结合的光波导微环免疫生物传感器,是在微环的表面固定一层抗体。当含有目标分子(特异性抗原)的溶液流过微环表面时,固定抗体分子与目标分子发生特异性免疫反应,形成抗原抗体复合物,引起倏逝波变化,波导有效折射率改变,最终在输出端共振波长发生漂移。共振波长由公式(1)给出,通过检测这些性质的改变,就可以获得待测物的变化信息,实现系统传感。所以,可以通过观察芯片输出谱线的变化得到待测物的变化。
λ=2πRneff/m〖FH(1)
其中, R为微环的半径,neff为波导微环的有效折射率, m为共振阶数(m=1, 2, 3…),λ为微环的共振波长。人免疫球蛋白G(IgG)是血清中含量最高的免疫球蛋白,在机体免疫应答中起着重要作用[11]。人表皮生长因子受体2 (Her2)是重要的乳腺癌预后判断因子[12]。目前,广泛应于免疫检测抗原或抗体的方法有酶联免疫法、蛋白质芯片法和荧光素标记法等。 酶联免疫法检出限较低,但需要对底物进行标记,且底物存在污染,所需样品量大,成本高;蛋白质芯片法与酶联免疫法的检出限相当,但需要利用多个荧光标记物进行标记,而且检测仪器昂贵,成本较高。本研究设计开发了与微环谐振器集成的微流体通道系统,以SiO2为衬底,采用光刻技术,设计和制作了基于Si波导结构的微环谐振器。以不同浓度的酒精溶液为测试对象,研究了微环谐振器对均质溶液的传感性能,并且利用此微环谐振器对人IgG和Her2进行实时非标记免疫检测。
2实验部分
2.1仪器与试劑
M5000 CCD光谱仪(北京聚光盈安科技有限公司);MAC50DMCFENN温控器(日本Shimax公司);调谐光源(瀚宇科技(香港)有限公司);BT3002J/YZII1蠕动泵(保定兰格公司)。
人IgG、羊抗人IgG(antiIgG)(上海生工生物工程有限公司);人Her2蛋白、Her2兔源单克隆抗体(北京义翘神州生物技术有限公司);牛血清白蛋白(BSA)、3氨丙基三乙氧基硅烷 ((3Aminopropyl)triethoxysilane,APTES,美国Sigma公司);磷酸盐缓冲溶液 (PBS,4.0 g NaCl+0.1 g Na2HPO4+1.48 g KH2PO4·H2O+500 mL去离子水,pH 7.5);98% H2SO4,30% H2O2,25%戊二醛等其它均为分析纯。实验用水为去离子水。
2.2光波导的制备
制作的光波导微环谐振器如图1A所示,圆形部分为微环波导,微环下方为直波导结构,插图为直波导和微环波导耦合部分的放大图。光波导的基本结构是绝缘体硅结构(SOI),其横截面示意图如图1B所示,由两层原料组成,芯层材料为Si,包层材料为SiO2,折射率分别为3.45和1.44,由于Si和SiO2之间的折射率差(Δn=2.01)较大,Si波导对光场有很大的限制作用。芯层波导厚度为220 nm,宽度为450 nm,包层厚度为2 μm,微环半径为5 μm,微环与直波导之间的间距为160 nm。
工艺流程如图1C所示,采用光刻技术加工制作[13],首先在芯片表面旋涂一层280~320 nm的光刻胶,90℃烘干90 s。电子束曝光之后,显影2.5 min, 100℃烘干5 min,然后在光刻胶的保护下进行等离子干法刻蚀。刻蚀后,将芯片浸在H2SO4H2O2(1〖KG-3∶〖KG-51, V/V)溶液中10 min,得到实验所需的光波导芯片。
实验装置包括微流体通道系统和光学控制系统两部分[14]。待测液体由蠕动泵控制,经输入导管进入反应腔,再经输出导管流入废液瓶。光由可调谐光源发出后,经由输入光纤进入微环谐振腔,经过一系列的耦合振荡,由输出光纤进入光谱仪。实验过程中,将微流体通道系统置于加载有温控台的三维可调节高精度光学测试平台上,可以精确调节芯片所在位置,使得输入和输出光纤精确的与微环谐振腔对应,提高实验结果的准确度和真实度。
由于微环谐振器具有很高的灵敏度,其输出谱线很容易受到外界因素如振动、温度、灰尘和杂质的影响。实验设计了如图2所示的微流体通道系统。此系统避免了敞开环境中由于液体挥发造成的微环谐振器芯片表面盐分的聚结,屏蔽空气中的各种杂质,而且只需要30 μL反应溶液,大大节约了实验成本。经实验考察,选择了容易加工的亚克力材料和具有生物相容性的聚二甲基硅氧烷(PDMS)[15,16]。首先将芯片置于作为衬底的模块上,并将精确加工配合的PDMS置于其上,用另一个模块进行密封,同时,在盖子中留有适合待测物进出的小孔,形成待测物通道。如图2所示,模具只封装了芯片的表面,不仅保护了微环表面,露出了与光纤耦合的输入输出波导,而且形成了供待测物进出的通道,使待测物能够浸润并吸附在微环表面,从而影响芯片的输出谱线。
2.3IgG抗体修饰及检测
将刻有微环谐振器的芯片置于“Piranha dip”(H2O2H2SO4,1〖KG-3∶〖KG-53, V/V)溶液中超声20 min,在芯片表面修饰一层羟基组(
Symbolm@@ OH)。取出后用大量去离子水冲洗,N2吹干,备用。将芯片置于2.5%(V/V)APTES(H2OEthanol, 1〖KG-3∶〖KG-5100,V/V)中孵化2 h,用大量去离子水冲洗,N2吹干;然后将其浸泡5% (w/V)戊二醛溶液1 h,用大量去离子水冲洗,N2吹干。将芯片固定到微流体通道中,反应池的温度控制在(25±0.01)℃,室温控制在(27±0.2)℃,流动泵以恒定速率4.2 mL/h通入200 μg/mL AntiIgG中10 min,静置1.5 h,得到修饰有antiIgG的芯片;以PBS流动清洗芯片10 min;通入5%(w/V)BSA溶液,静置30 min,以PBS流动清洗芯片10 min。最后通入一定浓度的IgG溶液,利用微环生物传感系统进行实时监测共振谱线的漂移。图3为微环谐振器表面活化和抗体固定的示意图。
3结果与讨论
3.1微流体通道系统和测试温度对微环谐振器性能的影响
在测试器件的生物传感特性之前,首先使用同一个芯片分别在敞开的液体环境和微流体通道系统中对共振谱线漂移进行了实时检测,如图4A所示,所用缓冲液为PBS溶液,在未加微流体通道系统敞开环境中,共振谱线在10 min后,约向短波长方向漂移了110 pm。检测结束后,芯片表面析出大量盐分,可能是水分挥发导致,盐分析出的过程导致微环表面的有效折射率不断变化,从而导致共振波长的持续漂移;同时,液滴表面张力使得光纤无法精确地对准输入输出光波导,导致无法获得有效的输入输出信号。在微流体通道系统中,不断流动的液体环境和小尺寸的挥发面积使微环一直处于稳定的PBS液体环境中,谱线基本处于平稳状态,偏移量为±4 pm。图4B为微流体通道系统在无水乙醇环境中,芯片在未加温控装置的输出谱线漂移与恒温25 ℃的漂移比较。未加温控装置时,微环的外界环境随着室温不断改变,谱线在30 min后,向长波长方向偏移约30 pm;恒温25℃时,谱线基本处于平稳状态,偏移量为±4 pm。上述结果表明, 所构建的微流体通道系统的稳定性良好。
3.2乙醇浓度对微环谐振器性能的影响
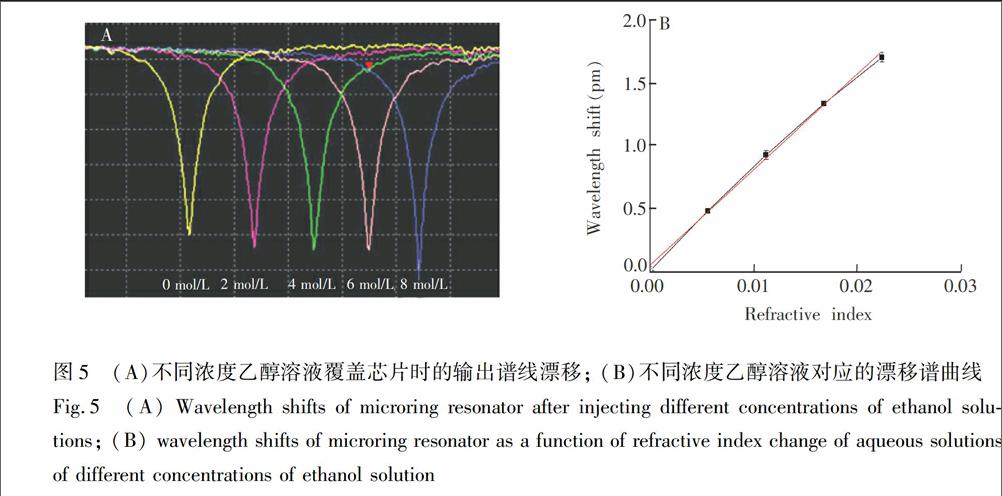
如图5所示,随着乙醇溶液浓度提高,波长均向长波方向漂移。由图5B可知,相邻浓度乙醇溶液的谐振波长差约为0.4 nm,而且不同浓度乙醇溶液的折射率与芯片的输出谐振波长漂移量有较好的线性对应关系,与微环的一维有效折射率算法理论模型相符[17]。由斜率可知,折射率灵敏度为76.09 nm/RIU。实验所用的光谱仪的波长分辨为4 pm,可得微环的探测极限为5.25×10Symbolm@@ 4 RIU。因此,此微环谐振器可以对均质溶液进行浓度表征。
3.3微环谐振器对生物分子的定量检测
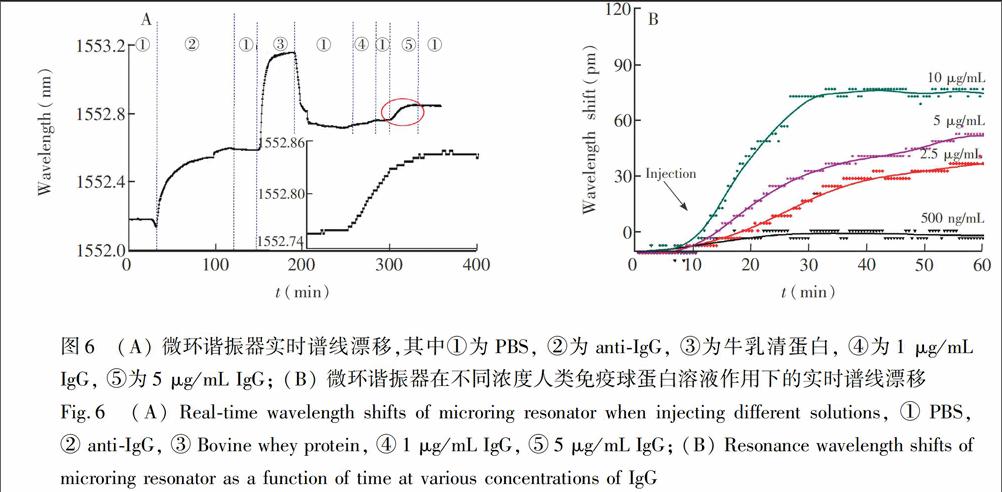
对实验过程进行实时监测的曲线如图6A,每隔30 s取一个点,首先通入PBS,共振波长基本不变;通入antiIgG,共振谱线发生漂移,在1.5 h后达到稳定,漂移了408 pm, 说明抗体已经稳定地修饰在微环上,并在该抗体浓度下达到饱和状态。通入PBS,冲洗掉未结合在微环上的抗体,曲线漂移量并没有发生明显改变。而按照图3中的修饰步骤在完全相同条件下采用孔板修饰的芯片,共振谱线只漂移128 pm,可能是由于孔板修饰完成后使用PBS进行手动冲洗,可能导致一些已经修饰在微环上的antiIgG被冲洗掉。
通入BSA进行封闭,并用PBS冲洗,曲线漂移132 pm;依次通入1和5 μg/mL IgG,在波导表面形成抗原抗体复合物,引起波导表面倏逝波变化,波导有效折射率也发生改变,导致输出端共振波长发生漂移。当微环表面抗原抗体的结合与微流体通道中抗原达到动态平衡时,
微环的谱线漂移也达到平衡,曲线分别漂移了44和90 pm,而分别通入PBS,曲线未发生明显漂移,说明IgG与固定抗体间发生特异性结合。图6B为0.5, 2.5, 5.0和10.0 μg/mL IgG分别与固定的antiIgG作用时微环的共振谱线漂移曲线。不同浓度的IgG导致微环产生的共振谱线漂移量不同,漂移量随着IgG浓度的增加而增大,最终漂移量分别为12,52,64和88 pm。上述实验验证了波导微环谐振器用于免标记生物传感的可行性与有效性,表明此微环生物传感器可以对生物分子进行定量检测。
采用同样原理,利用微环谐振器对Her2溶液进行检测,结果如图7所示。在实验中,前20 min通入PBS溶液时,曲线处于平稳状态;20 min后通入5 μg/mL Her2抗原溶液,曲线偏移约130 pm,说明抗原抗体结合,导致微环谐振腔覆盖层折射率发生改变,从而导致共振谱线发生漂移。將修饰有相同抗体的芯片浸没在不含Her2抗原的PBS溶液中,共振谱线没有发生明显漂移,说明Her2抗原与固定的Her2抗体可以发生特异性结合。
4結 论
本研究构建与微环谐振器集成的微流体通道系统,只需要30 μL反应溶液,大大降低了实验成本。同时,以不同浓度的乙醇为测试对象,研究了微环谐振器对均质溶液的传感性能,此传感芯片的检测灵敏度为76.09 nm/RIU,检出限为525×10Symbolm@@ 4 RIU。利用此传感方法对IgG和Her2进行实时免疫监测,可以检测500 ng/mL IgG标准样品。本方法具有小面积、易集成、灵敏度高等优点。本研究结果表明,光波导微环谐振器可以实现生物传感,对生物分子进行实时监测。
References
1Kyung W K, Song J F, Kee J S, Liu Q, Lo G Q, Park M K. Biosens. Bioelectron., 2013, 46: 15-21
2 Zhou X R, Wu S Q, Liu H, Wu X P, Zhang Q C. Sens. Actuator B, 2016, 226: 24-29
3Wu S Q, Liu X L, Zhou X R, Gao D Y, Zhao G, Zhang Q C, Wu X P. Biosens. Bioelectron., 2016, 15: 164-173
4Wu S Q, Liu H, Liang X, Wu X P, Zhang Q C. Anal. Chem., 2014, 86(9): 4271-4277
5Avraham R, James J. Biosens. Bioelectron., 2006, 21 (10) : 1851-1858
6Park M K, Kee J S, Quah J Y, Nettob V, Song J F, Fang Q, La Fosse E M, Lo G Q. Sens. Actuator B, 2013, 176: 552-559
7Estevez M C, Alvarez M, Lechuga L M. Laser Photon. Rev., 2012, 6: 463-487
8Qavi A J, Bailey R C. Angew. Chem., 2010, 122 (27): 4712-4715
9Kindt J T, Bailey R C. Curr. Opin. Chem. Biol., 2013, 17: 818-826
10Erickson D, Mandal S, Yang A H J, Cordovez B. Microfluid Nanofluid., 2008, 4(1): 33-52
11Ramachandran A, Wang S P, Clarke J, Ja S J, Goad D, Wald L, Flood E M, Knobbe E, Hryniewicz J V, Chu S T, Gill D, Chen W, King O, Little B E. Biosens. Bioelectron., 2008, 23: 939-944
12Kim K W, Song J F, Kee J S, Liu Q, Lo G Q, Park M K. Biosens. Bioelectron., 2013, 46: 15-21
13Wang L H, Ren J, Han X Y, Claes T, Jian X G, Bienstman P, Baets R, Zhao M S, Morthier G. IEEE., 2012, 4(3): 920-930
14Chen Y Q, Yu F, Yang C, Song J Y, Tang L H, Li M Y, He J J. Opt. Commun., 2015, 344: 129-133
15Carlborg C F, Gylfason K B, Kaz〖KG-2'mierczak A, Dortu F, Polo M B, Catala A M, Kresbach G, Sohlstrm H, Moh T, Vivien L. Lab Chip, 2010, 10: 281-290
16Xia Y N, Whitesides G M. Angew. Chem. Int. Ed., 1998, 37: 550-575
17SUN Fei, LIU RunMin, LI GuoZheng. Semicond Opt., 2001, 22(1): 34-37
孙 飞,刘润民,李国正. 半导体光电, 2001, 22(1): 34-37
AbstractThe microfluidic channels integrated with microring resonator were designed. The salt coalescence on chip surface caused by liquid volatilization in open environment was avoided and only 30 μL of reaction solution was consumed. These channels significantly reduced the experiment cost. The design, fabrication and characterization of a highly sensitive and labelfree silicononinsulator (SOI) microring optical resonator integrated with the microfluidic channels were demonstrated. The radius of the microring was 5 μm and the straight waveguide with a width of 450 nm was employed in the microring resonator. The microring resonator device had many advantages such as high sensitivity, labelfree and realtime detection. Using different concentrations of ethanol solution with known refractive indices, the refractive index detection sensitivity was 76.09 nm/RIU and the volume refractive index detection limit was 5.25×10Symbolm@@ 4 RIU. We also demonstrated the labelfree quantitative specific detections of human immunoglobulin G (IgG) solutions using an antibodymodified microring resonator by measuring the resonance wavelength shift resulting from refraction index changes causing by the immobilization of antibodies and specific recognition between antibodies and antigens, respectively. The results showed that the microring optical resonator could realtime monitor the reaction between biological molecules, the resonator could be used in the quantitative detection and biological sensing.
Keywords2Silicon microring optical resonator; Biosensor; Microfluidics; Evanescent wave; Immunoglobulin G
(Received 2 September 2016; accepted 15 February 2017)
This work was supported by the National Natural Science Foundation of China (Nos. 1162780010, 11502265, 11472266)