染色质重塑蛋白MORC2通过调节ALDH1A3表达促进乳腺癌细胞的干性
2017-04-14许佳慧柳素玲李大强
张 飒,许佳慧,柳素玲,李大强
复旦大学生物医学研究院及肿瘤研究所,上海 200032
染色质重塑蛋白MORC2通过调节ALDH1A3表达促进乳腺癌细胞的干性
张 飒,许佳慧,柳素玲,李大强
复旦大学生物医学研究院及肿瘤研究所,上海 200032
背景与目的:染色质重塑蛋白MORC家族CW型锌指结构蛋白2(microrchidia family CW-type zinc finger 2, MORC2)在DNA介导的基因转录及DNA损伤修复等基本生物学过程中发挥重要作用,但其对乳腺癌细胞生物学行为的影响目前尚无相关报道。乙醛脱氢酶(aldehyde dehydrogenase,ALDH)家族成员ALDH1A3(aldehyde dehydrogenase family 1 member A3,ALDH1A3)是一种公认的乳腺癌干细胞的标志物,但其在乳腺癌细胞中的调控机制目前尚不清楚。该研究拟探讨敲低MORC2基因对ALDH1A3表达以及对乳腺癌细胞干性的影响。方法:利用短发夹RNA (short hairpin RNA,shRNA) 介导的基因沉默方法构建稳定敲低MORC2基因的乳腺癌细胞系;利用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)分析敲低MORC2基因对ALDH1A3表达的影响;利用微球体形成实验和流式细胞荧光分选技术(fluorescence activated cell sorting, FACS)分析敲低MORC2对乳腺癌干细胞亚群的影响。结果:Western blot和RTFQ-PCR分析结果显示,敲低MORC2基因显著下调ALDH1A3蛋白及mRNA水平;微球体形成实验显示敲低MORC2基因显著抑制MCF-7细胞的成球能力;FACS分析显示敲低MORC2基因显著下调ALDH1A3阳性乳腺癌干细胞亚群, 而对CD44+CD24-乳腺癌干细胞亚群没有明显影响。结论:MORC2通过调节ALDH1A3的表达促进乳腺癌干细胞表型。
MORC2;ALDH1A3;乳腺癌;乳腺癌干细胞
乳腺癌是女性常见的恶性肿瘤之一[1]。在我国,近年来乳腺癌的发病率逐年上升,在大中城市尤为突出[2]。以北京和上海为例,乳腺癌已经成为女性发病率最高的恶性肿瘤,有逐步接近欧美发达国家水平的趋势[3]。大量的临床研究表明,侵袭转移以及治疗耐药是导致大约90%的乳腺癌患者治疗失败和死亡的最主要原因[4-5],但其具体的分子机制目前尚不清楚。
MORC家族CW型锌指结构蛋白2(MORC family CW-type zinc finger 2,MORC2)属于新的核蛋白MORC家族中的一员[6]。蛋白质结构分析显示(图1),其氨基端存在一个保守的ATP酶(ATPase) 结构域,羧基端有一个染色体样(chromo-like)的结构域, 在其中间部分存在一个衍生的植物同源结构域(divergent plant homeodomain,PHD-X),也被称作CW型锌指结构域(CW-type zinc finger,CW-ZF)[6-12]。根据包含有这些重要结构域的其他蛋白质的功能(图1),提示MORC2蛋白可能与基因转录以及DNA损伤修复功能有关[6,11]。
我们最近的研究发现,MORC2是一个新的染色体重塑蛋白,以ATP酶依赖性的方式改变染色体的结构从而有效地修复离子照射诱导的DNA损伤[8]。然而,迄今为止有关MORC2在肿瘤发生、发展过程中的作用研究甚少。其中,Wang等[13]报道MORC2蛋白主要定位于细胞核,通过转录抑制抑癌基因p21[14]和细胞骨架相关基因ArgBP2[15]的表达,以及PAK1蛋白激酶介导的磷酸化[16]参与胃癌的发生、发展。另外,Chen等[17]利用基因芯片技术对185个三阴性乳腺癌患者的癌组织基因表达谱进行了分析,发现包括MORC2在内的6个基因能预测三阴性乳腺癌的复发风险,但该研究并没有探讨MORC2基因在三阴性乳腺癌发生、发展中的具体作用及其分子机制。其他文献报道细胞质MORC2能调节脂肪细胞的分化[18],MORC2基因在结直肠癌中存在热点突变[19]以及在肺癌细胞中高表达[20]。综上所述,目前我们对MORC2蛋白的结构和功能,特别是MORC2蛋白在乳腺癌发生、发展过程中的作用及其分子机制知之甚少。
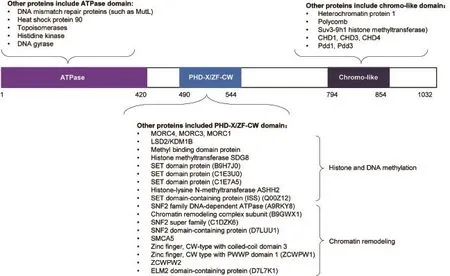
图 1 MORC2蛋白结构域以及包含这些结构域的其他蛋白质的功能Fig. 1 Functional domains of MORC2 protein and the biological functions of the proteins containing these functional domains
ALDH1A3(aldehyde dehydrogenase 1 family member A3)是乙醛脱氢酶(aldehyde dehydrogenase,ALDH)家族的成员之一,在细胞内主要催化醛类物质的氧化代谢[21]。最近的研究表明,ALDH1A3是一种乳腺癌干细胞标志物[22],并且ALDH1A3高表达与乳腺癌复发转移以及不良预后密切相关[23]。然而,ALDH1A3在乳腺癌细胞中的调控机制目前尚不清楚。
因此,本研究主要探讨MORC2对乳腺癌干细胞相关基因ALDH1A3表达以及乳腺癌细胞干性的影响。
1 材料和方法
1.1 材料和试剂
人乳腺癌MCF-7细胞株及HEK293T细胞株购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,DMEM/ F12及DMEM培养基购自美国Mediatech公司,胎牛血清购自美国Gibco公司,胰酶及PBS购自上海源培生物科技股份有限公司,细胞培养皿和超低黏附6孔板购自美国Mediatech公司,MORC2 shRNA(shMORC2)以及阴性对照shRNA(shNC)表达载体购自美国Origene公司,LipofectamineTM2000转染试剂、TRIzol、表皮生长因子(epidermal growth factor,EGF)、碱性成纤维生长因子(basic epidermal growth factor,bFGF)、肝素及B27购自美国Invitrogen公司,嘌呤霉素购自美国Cayman公司,RNA反转试剂盒购自宝生物工程(大连)有限公司,SYBR green购自美国Bio-Rad公司,兔抗人MORC2多克隆抗体(货号:A300-149)、兔抗人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)多克隆抗体(货号:A300-623A)和兔抗人雌激素受体α(estrogen receptor α,ERα)多克隆抗体(货号:A300-498A)均购自美国Bethyl公司,兔抗人ALDH1A3多克隆抗体购自美国Proteintech公司(货号:25167-1-AP),鼠抗人Vinculin单克隆抗体购自美国Sigma公司(货号:V9131),鼠抗人CD44荧光单克隆抗体(货号:559942)和鼠抗人CD24 荧光单克隆抗体(货号:555428)购自美国BD Pharmingem公司,羊抗兔IgG二抗购自美国Santa Cruz公司(货号:sc-2004),羊抗鼠IgG二抗购自美国Santa Cruz公司(货号sc-2005),ALDEFLUOR分析试剂盒购自美国STEMCELL公司(货号:01700)。
1.2 实验方法
1.2.1 MCF-7稳定敲低MORC2基因的细胞系构建
shNC及shMORC2表达载体转染HEK293T细胞,48 h后收集病毒上清液用于感染MCF-7细胞。24 h后加入2 μg/mL的嘌呤霉素进行筛选,1~2周后获得稳定敲低MORC2基因的细胞系。
1.2.2 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测MORC2及ALDH1A3的表达水平
TRIzol法提取细胞总RNA,取1 μg RNA按照宝生物工程(大连)有限公司的PrimeScriptRTRNA反转录试剂盒说明书操作进行反转录。反转录反应体系为10 μL,反转录条件为37 ℃,30 min,85 ℃,15 s。反转录获得的cDNA用ddH2O稀释5倍作为RTFQ-PCR的反应模板,于Eppendorf PCR仪对MORC2和ALDH1A3基因进行扩增和检测,内参基因为β-actin。RTFQ-PCR具体反应条件为反应条件为95 ℃预变性3 min、95 ℃变性15 s、57 ℃退火30 s、72 ℃延伸30 s,扩增40个循环。RTFQ-PCR所得结果用2-ΔΔCt法分析。
RTFQ-PCR所用引物序列:MORC2顺义链为AAGCCGTTTCAAGACC,反义链为GTCGCAACATCACCCT;ALDH1A3顺义链为TTAAAGAAGCTGCGTCCCG,反义链为CACTCCACTGCCAAGTCCAA;β-actin顺义链为AGCCATGTACGTAGCCATCC,反义链为CTCTCAGCTGTGGTGGTGAA。
1.2.3 蛋白[质]印迹法(Western blot)检测实验
采用RIPA裂解液(含有蛋白酶抑制剂和磷酸酶抑制剂)于4 ℃摇床裂解细胞20 min,然后20 000×g 于4 ℃离心20 min,取蛋白上清液用BCA法进行蛋白定量。取相同蛋白量样品加4×上样缓冲液于100 ℃加热5 min,离心后上样。采用湿转法将凝胶上的蛋白转至PVDF膜上,用含5%的牛血清白蛋白(BSA)的封闭液于室温封闭1 h后分别加入MORC2(1∶2 000稀释)、ALDH1A3(1∶2 000稀释)、HER-2(1∶2 000稀释)、ERα(1∶2 000稀释)和Vinculin(1∶5 000稀释)抗体,于4 ℃摇床温育过夜。第二天用PBST洗膜3次,每次10 min,然后分别加入1∶5 000稀释的HRP标记的羊抗兔或羊抗鼠二抗,室温温育1 h,用PBST漂洗3次,每次10 min,然后用ECL发光液发光。
1.2.4 微球体形成实验检测微球体形成情况
取对数期生长的MCF-7细胞,用含表皮生长因子 (EGF 20 ng/mL)、碱性成纤维生长因子(bFGF 10 ng/mL)、肝素(4 ng/mL)和B27(1×)的DMEM/F12的培养液重悬,接种至超低黏附6孔板中,在37 ℃、CO2体积分数为5%的条件下进行培养,每3天换1次液,培养两周后于倒置显微镜下拍照观察微球体形成情况并计数,直径大于200 μm的记为一个微球,统计并分析各组微球体形成数量。
1.2.5 FACS分析敲低MORC2基因对ALDH阳性乳腺癌干细胞亚群的影响
ALDEFLUOR试剂盒是以ALDH的活性为基础[22]。ALDH可以将ALDH的底物BAAA(BodipyTM-aminoacetaldehyde)转化为荧光产物BAA(BodipyTM-aminoacetate)。ALDH高表达的细胞呈现明亮的荧光(ALDHbr),可以通过流式细胞仪进行分选和评估。用含2%胎牛血清(FBS)的PBS重悬经胰酶消化的细胞(加入的量取决于细胞团块的大小),并进行细胞计数。在TEST管加入1×106个细胞,离心后去上清液。用Aldefluor检测缓冲液按照细胞浓度为1×106个/mL重悬细胞,在DEAB管中加入5 μL的DEAB溶液(抑制剂),立刻盖上盖子。在TEST管中加入5 μL活化的BAAA(1×106个细胞),混合均匀,立刻把TEST溶液中的0.3 mL细胞转移到对应的DEAB管中,混匀并盖上盖子。将所有流式管置于37 ℃培养箱中避光温育40 min。加入含有2%FBS的PBS,离心弃去上清液洗去多余的抗体,重复洗2~3次。在TEST管和DEAB管中加入含 2% FBS的PBS和DAPI重悬细胞(每300~500 μL 1×106个细胞)。把样品保存在冰上置于黑暗环境中,转移到流式细胞仪(型号:MOFLO ASTRIOS)上检测。
1.2.6 FACS分析敲低MORC2基因对CD44+CD24-乳腺癌干细胞亚群的影响
用含2%FBS的PBS重悬经胰酶消化的细胞(加入的量取决于细胞团块的大小),并进行细胞计数。在TEST管和CTRL管中分别加入0.5×106个细胞,离心后去上清液。用含2%FBS的PBS以适当比例稀释抗体,然后在TEST管中加入50 μL抗体稀释液(每100 μL 1×106个细胞)。将TEST管置于冰上避光温育30 min,用含有2% FBS的PBS也洗涤2~3次。在TEST管和CTRL管中加入含有2%FBS的PBS和DAPI重悬细胞(每300~500 μL 1×106个细胞)。把样品保存在冰上置于黑暗环境中,转移到流式细胞仪(型号:MOFLO ASTRIOS)上检测。
1.3 统计学处理
采用SPSS 20.0统计软件对数据进行统计分析,两组样品均数比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 MCF-7稳定敲低MORC2基因细胞系的鉴定
本研究采用Western blot方法分析MORC2及ALDH1A3在10种常用的乳腺癌细胞系中的表达情况,同时分析ERα以及HER-2的表达状态作为阳性对照。与以前报道的结果一致,MCF-7、T47D、ZR-75-1以及BT474细胞表达ERα,而BT474、SK-BR-3以及MDA-MB-453细胞表达HER-2(图2A),表明这10种乳腺癌细胞系生物学特征无误。另外,MORC2在大多数乳腺癌细胞系中均高表达,而ALDH1A3在SK-BR-3、ZR-75-30、MDA-MB-468以及Hs578T细胞系中表达水平最高(图2A)。根据以上结果,我们选择最常用的MCF-7乳腺癌细胞系作为模型,采用慢病毒感染的方法建立稳定敲低MORC2的细胞系,然后分别提取蛋白质和RNA进行Western blot以及RTFQ-PCR分析以验证MORC2敲低情况。结果显示,与shNC对照细胞相比,MORC2蛋白(图2B)和mRNA (图2C)水平在shMORC2感染细胞中均显著下调,提示MORC2基因在MCF-7细胞中稳定敲低。
2.2 Western blot法和RTFQ-PCR分析检测敲低MORC2基因对ALDH1A3蛋白和mRNA表达水平的影响
Western blot检测结果显示,与对照shNC细胞相比,ALDH1A3蛋白表达水平在shMORC2细胞中下调达60%(图3A)。RTFQ-PCR分析结果显示,与对照shNC细胞相比,ALDH1A3 mRNA水平在MORC2基因敲低细胞中下调了70%(P<0.05,图3B)。这些结果表明,MORC2作为一个染色质重塑蛋白的基因转录激活ALDH1A3基因的表达。
2.3 敲低MORC2基因对MCF-7细胞微球体形成能力的影响
稳定敲低MORC2基因的MCF-7细胞用微球体培养液培养两周后在倒置显微镜下观察、拍照。结果显示,shNC组微球体形成数量显著多于shMORC2组(图4A)。定量结果显示,与对照组相比,MORC2基因敲低组细胞成球数量下调50%(图4B),差异有统计学意义(P<0.05)。表明敲低MORC2能显著降低MCF-7细胞的成球能力,提示MORC2促进乳腺癌干细胞特性的改变。
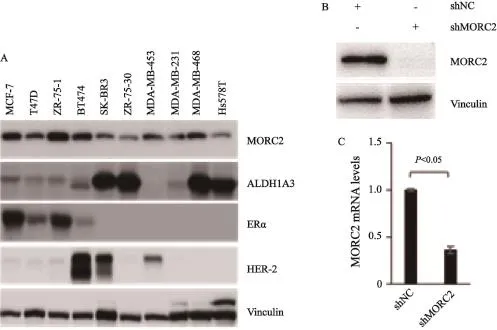
图 2 10种乳腺癌细胞系中MORC2蛋白表达水平的检测及稳定敲低MORC2基因的MCF-7乳腺癌细胞系的建立Fig. 2 Detection of MORC2 protein levels in 10 breast cancer cell lines and establishment of MCF-7 stable clone cells expressing shNC and shMORC2
2.4 流式细胞术检测敲低MORC2对乳腺癌细胞干细胞亚群的影响
最近发现了一种鉴定乳腺癌干细胞的新方法,即利用 ALDEFLUOR试剂来检测细胞中的ALDH活性[22]。表达高水平ALDH的细胞会发出荧光并且能够通过流式细胞术被检测到。我们利用此方法分析发现,MORC2基因敲低后ALDH酶的活性从0.98%下降到0.22%(图5A)。考虑到ALDH比例可作为干细胞分离的标志,这些结果表明敲低MORC2能减少MCF-7细胞中干细胞数量,即下调MCF-7细胞的干性。另外,本研究发现,敲低MORC2对CD44+CD24-乳腺癌干细胞亚群没有明显影响(图5B)。
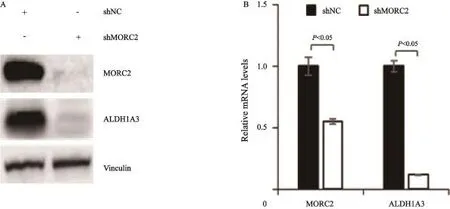
图 3 Western blot检测和RTFQ-PCR分析敲低MORC2对ALDH1A3蛋白及mRNA水平的影响Fig. 3 Western blot and RTFQ-PCR analysis of the effects of MORC2 knockdown on the protein and mRNA level of ALDH1A3

图 4 微球体形成实验检测敲低MORC2对MCF-7细胞成球能力的影响Fig. 4 Analysis of mammosphere formation ability in MCF-7 cells stably expressing shNC and shMORC2
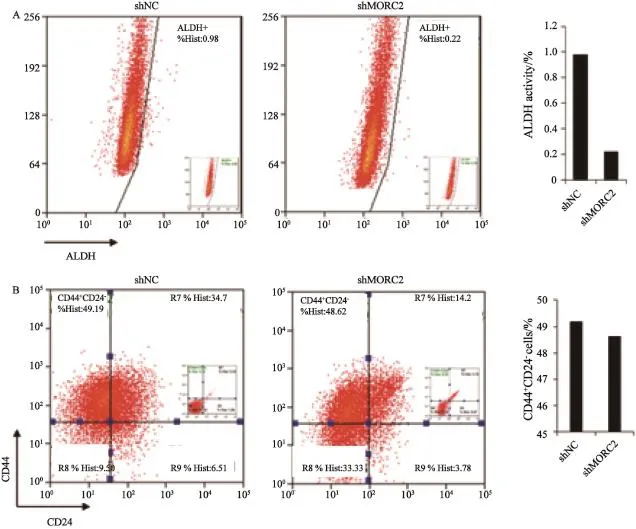
图 5 敲低MORC2对乳腺癌干细胞亚群的影响Fig.5 Effects of knockdown of endogenous MORC2 by specific shRNAs targeting human MORC2 on breast cancer stem cell population
3 讨 论
自2003年Al-Hajj等[24]从乳腺癌患者标本中分离得到乳腺癌干细胞以来,乳腺癌干细胞在乳腺癌转移及耐药性发生过程中的关键作用日益受到重视[25]。因此,深入研究乳腺癌干细胞在乳腺癌发生、发展过程中的关键作用、探索有效针对乳腺癌干细胞的治疗策略是乳腺癌防治的一个新方向。本研究通Western blot和RTFQ-PCR方法分析发现在稳定敲低MORC2的MCF-7细胞系中MORC2可以正向调控乳腺癌干细胞相关基因ALDH1A3的表达。功能实验分析进一步证实,敲低MORC2基因能显著降低MCF-7细胞的成球能力以及ALDH阳性乳腺癌干细胞亚群的数量。这些结果表明MORC2基因沉默显著下调ALDH1A3基因的表达以及抑制MCF-7细胞的干性。基于此研究结果,我们推测MORC2有可能是未来干细胞治疗乳腺癌的有效靶点。
本研究发现了MORC2正向调控ALDH1A3基因的表达,但MORC2调控ALDH1A3基因表达的分子机制有待进一步深入研究。另外,本研究仅在乳腺癌MCF-7细胞系中对MORC2-ALDH1A3通路进行了研究,是否该信号通路在其他乳腺癌细胞系中可得到证实将是我们今后研究的另外一个重点。
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[2] HUANG L, LIU Z, CHEN S, et al. A prognostic model fortriple-negative breast cancer patients based on node status, cathepsin-D and Ki-67 index[J]. PLoS One, 2013, 8(12): e83081.
[3] FAN M, ZHANG J, WANG Z, et al. Phosphorylated VEGFR2 and hypertension: potential biomarkers to indicate VEGF-dependency of advanced breast cancer in anti-angiogenic therapy[J]. Breast Cancer Res Treat, 2014, 143(1): 141-151.
[4] WEIGELT B, PETERSE J L, VAN ‘T VEER L J. Breast cancer metastasis: markers and models[J]. Nat Rev Cancer, 2005, 5(8): 591-602.
[5] HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674.
[6] LI D Q, NAIR S S, KUMAR R. The MORC family: new epigenetic regulators of transcription and DNA damage response[J]. Epigenetics, 2013, 8(7): 685-693.
[7] PERRY J, ZHAO Y. The CW domain, a structural module shared amongst vertebrates, vertebrate-infecting parasites and higher plants[J]. Trends Biochem Sci, 2003, 28(11): 576-580.
[8] LI D Q, NAIR S S, OHSHIRO K, et al. MORC2 signaling integrates phosphorylation-dependent, ATPase-coupled chromatin remodeling during the DNA damage response[J]. Cell Rep, 2012, 2(6): 1657-1669.
[9] MOISSIARD G, COKUS S J, CARY J, et al. MORC family ATPases required for heterochromatin condensation and gene silencing[J]. Science, 2012, 336(6087): 1448-1451.
[10] IYER L M, ABHIMAN S, ARAVIND L. MutL homologs in restriction-modification systems and the origin of eukaryotic MORC ATPases[J]. Biol Direct, 2008, 3(1): 8.
[11] LORKOVIC Z J. MORC proteins and epigenetic regulation[J]. Plant Signal Behav, 2012, 7(12): 1561.
[12] HOPPMANN V, THORSTENSEN T, KRISTIANSEN P E, et al. The CW domain, a new histone recognition module in chromatin proteins[J]. EMBO J, 2011, 30(10): 1939-1952.
[13] WANG G L, WANG C Y, CAI X Z, et al. Identification and expression analysis of a novel CW-type zinc finger protein MORC2 in cancer cells[J]. Anat Rec (Hoboken), 2010, 293(6): 1002-1009.
[14] ZHANG Q, SONG Y, CHEN W, et al. By recruiting HDAC1, MORC2 suppresses p21 Waf1/Cip1 in gastric cancer[J]. Oncotarget, 2015, 6(18): 16461-16470.
[15] TONG Y, LI Y, GU H, et al. Microchidia protein 2, MORC2, downregulates the cytoskeleton adapter protein, ArgBP2, via histone methylation in gastric cancer cells[J]. Biochem Biophys Res Commun, 2015, 467(4): 821-827.
[16] WANG G, SONG Y, LIU T, et al. PAK1-mediated MORC2 phosphorylation promotes gastric tumorigenesis[J]. Oncotarget, 2015, 6(12): 9877-9886.
[17] CHEN L H, KUO W H, TSAI M H, et al. Identification of prognostic genes for recurrent risk prediction in triple negative breast cancer patients in Taiwan[J]. PLoS One, 2011, 6(11): e28222.
[18] SANCHEZ-SOLANA B, LI D Q, KUMAR R. Cytosolic functions of MORC2 in lipogenesis and adipogenesis[J]. Biochim Biophys Acta, 2013, 1843(2): 316-326.
[19] TUUPANEN S, HANNINEN U A, KONDELIN J, et al. Identification of 33 candidate oncogenes by screening for base-specific mutations[J]. Br J Cancer, 2014, 111(8): 1657-1662.
[20] WANG J, SHIVAKUMAR S, BARKER K, et al. Comparative study of autoantibody responses between lung adenocarcinoma and benign pulmonary nodules[J]. J Thorac Oncol, 2016, 11(3): 334-345.
[21] XU X, CHAI S, WANG P, et al. Aldehyde dehydrogenases and cancer stem cells[J]. Cancer Lett, 2015, 369(1): 50-57.
[22] GINESTIER C, HUR M H, CHARAFE-JAUFFRET E, et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome[J]. Cell Stem Cell, 2007, 1(5): 555-567.
[23] MARCATO P, DEAN C A, GIACOMANTONIO C A, et al. Aldehyde dehydrogenase: its role as a cancer stem cell marker comes down to the specific isoform[J]. Cell Cycle, 2011, 10(9): 1378-1384.
[24] AL-HAJJ M, WICHA M S, BENITO-HERNANDEZ A, et al. Prospective identification of tumorigenic breast cancer cells[J]. Proc Natl Acad Sci U S A, 2003, 100(7): 3983-3988.
[25] CONLEY S J, GHERODUNESCU E, KAKARALA P, et al. Antiangiogenic agents increase breast cancer stem cells via the generation of tumor hypoxia[J]. Proc Natl Acad Sci U S A, 2012, 109(8): 2784-2789.
Chromatin remodeling protein MORC2 promotes a breast cancer stem-like phenotype by regulating
ALDH1A3 expression
ZHANG Sa, XU Jiahui, LIU Suling, LI Daqiang (Institutes of Biomedical Sciences and Cancer Institute, Shanghai Medical College, Fudan University, Shanghai 200032, China)
Correspondence to: LI Daqiang E-mail: daqiangli1974@fudan.edu.cn
Background and purpose: MORC2 (microrchidia family CW-type zinc finger 2, MORC2) is a newly identified chromatin remodeling protein that plays key roles in DNA-based biological processes including gene transcription and DNA damage repair. However, its functional role in breast cancer development and progression remains unknown. ALDH1A3 (aldehyde dehydrogenase 1 family member A3), a member of the aldehyde dehydrogenases (ALDH) superfamily, is a putative breast cancer stem cell marker, but its regulatory mechanism in breast cancer is poorly characterized. This study aimed to investigate the effects of knockdown of endogenous MORC2 on the expression levels of ALDH1A3 and the breast cancer stem-like phenotype in MCF-7 cells. Methods: Human breast cancer MCF-7 cells were infected with negative control short hairpin RNAs (shNC) and specific shRNAs targeting human MORC2 (shMORC2), followed by selection with puromycin to generate stable MORC2 gene knockdown cell lines. Western blot and real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) were used to examine the protein and mRNA levels of ALDH1A3 in MCF-7 cells stably expressing shNC and shMORC2. Microsphere formation and fluorescence-activated cell sorting (FACS) assays were used to analyze the effects of knockdown of MORC2 on the breast cancer stem-like phenotype. Results: Western blot and RTFQ-PCR analyses revealed that the protein and mRNA levels of ALDH1A3 were significantly down-regulated in shMORC2 expressing cells as compared with shNC -transfectedcontrol cells. Moreover, mammosphere formation assay showed that knockdown of endogenous MORC2 in MCF-7 cells significantly reduced the ability of cells to form microspheres. Consistently, FACS assays demonstrated that shMORC2-transfected cells had a lower proportion of ALDH-positive stem cells as compared with shNC expressing cells. In contrast, knockdown of MORC2 did not significantly affect the CD44+CD24-stem cell population. Conclusion: MORC2 promotes a breast cancer stem-like phenotype through, at least in part, regulating ALDH1A3 expression.
MORC2; ALDH1A3; Breast cancer; Breast cancer stem cells
10.19401/j.cnki.1007-3639.2017.03.001
R737.9
A
1007-3639(2017)03-0161-08
2016-09-15
2016-12-10)
国家自然科学基金(81372847)。
李大强 E-mail:daqiangli1974@fudan.edu.cn
