靶向肝癌细胞自噬提高大黄素的毒性杀伤作用
2017-04-14党中峰何科基那光玮孙文平程永生王维君
党中峰,何科基,那光玮,孙文平,程永生,王维君,李 瑞
甘肃省肿瘤医院腹外二科,甘肃 兰州 730050
靶向肝癌细胞自噬提高大黄素的毒性杀伤作用
党中峰,何科基,那光玮,孙文平,程永生,王维君,李 瑞
甘肃省肿瘤医院腹外二科,甘肃 兰州 730050
背景与目的:大黄素处理肝癌细胞后能够诱导内质网应激和凋亡。鉴于内质网应激与自噬之间的关联及后者作为细胞对抗应激环境的一种自我防御机制,该研究拟探讨通过抑制肝癌细胞自噬信号通路的策略提高大黄素对肿瘤细胞的毒性杀伤作用。方法:大黄素处理肝癌细胞后,应用CYTO-ID自噬检测试剂盒和蛋白[质]印迹法(Western blot)分别检测大黄素诱发细胞自噬情况;利用细胞自噬抑制剂(氯喹)预先抑制肝癌细胞自噬的产生,然后用大黄素处理肝癌细胞,最后通过ATPlite试验和细胞克隆形成实验检测肿瘤细胞存活;通过流式细胞术检测氯喹和大黄素联合处理诱导肝癌细胞发生凋亡的凋亡率,采用Western blot检测凋亡效应蛋白caspase-3活化断裂后产生活性片段的水平。结果:大黄素处理肝癌细胞后能够诱导肝癌细胞自噬;利用氯喹抑制肝癌细胞自噬能够显著能够提高大黄素对肝癌细胞克隆存活的抑制作用;氯喹和大黄素联合处理肝癌细胞能够显著提高细胞周期sub-G1期和活化caspase-3蛋白的表达水平。结论:靶向肝癌细胞自噬能够提高大黄素的毒性杀伤作用。
大黄素;细胞自噬;肝癌细胞;细胞凋亡
肝癌是我国多发的一种恶性消化系统肿瘤。因其恶性程度高、病程进展快,患者确诊后往往已丧失手术治疗的机会。由于肝癌对常规化疗药物及靶向药物不敏感,同时容易产生耐药性,目前可供临床肝细胞癌治疗用的药物极其有限。中草药因其广谱的抗肿瘤效果及低毒特点,近年来逐渐受到国际关注。其中,来源于中药大黄的大黄素单体化合物已在临床前模型层面被证实具有一定的抗肝癌治疗效果,成为抗肝癌药物研究领域的新尝试[1]。为了进一步提高大黄素的抗肝癌治疗效果,本研究拟从联合用药的角度探寻提高大黄素临床疗效的潜在策略。
细胞自噬是哺乳动物细胞通过其溶酶体自我消化的一个代谢过程,通常被认为是细胞在营养缺乏或其他外界应激条件下诱发的一个自我保护机制[2]。迄今,细胞自噬通路已被证实是多种恶性肿瘤的治疗靶点。同时,大量研究发现,通过靶向细胞自噬通路也可以显著提高其他抗肿瘤药物的治疗效果[3]。在前期工作中,我们发现大黄素处理肝癌细胞后能够诱导内质网应激和细胞凋亡[4]。鉴于内质网应激与细胞自噬之间的内在关联[5],我们推测大黄素处理肝癌细胞后能够激活细胞自噬通路,后者作为细胞对抗应激环境的重要机制,能够促进肿瘤细胞存活。基于此,本研究拟通过一系列实验验证靶向肝癌细胞自噬信号通路提高大黄素对肿瘤细胞的毒性杀伤效果。
1 材料和方法
1.1 药品与试剂
大黄素购自中国药品生物制品检定所,纯度大于98%;细胞培养基DMEM购自美国Corning公司;CYTO-ID自噬检测试剂盒购自美国Enzo Life Sciences公司;氯喹购自美国Selleck Chemicals公司;碘化丙啶(propidium iodide,PI)染色液购自美国Yeasen公司;Cleavedcaspase3、β-actin抗体购自美国Cell signaling公司;抗LC3A/B抗体购自美国Abcam公司;细胞存活率ATPlite检测试剂盒购自美国PerkinElmer公司。
人肝癌HepG2和Huh7细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。两种细胞均用含10%小牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养液进行培养,其培养条件为37 ℃、CO2体积分数为5%的饱和湿度。当细胞处于对数生长期时即用于后续实验。
1.3 细胞自噬的检测
细胞自噬用CYTO-ID自噬检测试剂盒进行检测,具体实验方法严格按照产品使用说明书进行,其步骤如下:当细胞长到50%~70%汇合度后,弃上清液,直接添加CYTO-ID自噬检测染料和细胞核染料Hoechst 33342,然后在37 ℃条件下活染20 min,最后在荧光显微镜下观察并拍照;同时通过蛋白[质]印迹法(Western blot)检测细胞自噬标记蛋白LC3-Ⅱ的表达。
1.4 细胞增殖实验
采用适当药物处理生长状态良好的肿瘤细胞后,接种于96孔培养板(每孔2 000个细胞)上,然后继续培养72 h,最后按照产品使用说明书使用ATPlite试剂盒检测细胞的存活率。
1.5 细胞克隆形成实验
将处于生长对数期的人肝癌HepG2、Huh7细胞分别接种于直径为6 cm的培养皿,每个培养皿接种400个细胞。第2天在培养皿中添加氯喹、大黄素或两者联合处理,阴性对照用0.1% DMSO处理。细胞继续培养10~14 d后用含有0.1%结晶紫的染色液进行固定与染色。按含有50个细胞以上的细胞克隆为阳性克隆,在普通光学显微镜下观察并计算细胞克隆形成情况。
1.6 流式细胞仪分析
根据以上均值方程的残差平方序列偏相关函数(表3),ARCH-LM检验滞后期选择10期。根据以上ARCH-LM检验结果,F统计量和卡方统计量的伴随概率均小于0.05,因此ARCH-LM检验表明收益率序列存在ARCH效应,也就是存在自回归条件异方差特性。[4]
用浓度为0.025%的胰酶充分消化细胞,以300×g的速度离心5 min收集细胞;用PBS(pH为7.4)清洗细胞后用70%乙醇进行固定,置冰上放置30 min以上;用适量PBS(pH为7.4)清洗后,按照使用说明书添加适量PI染色液,轻柔混匀,置室温避光温育15 min后,供流式细胞仪分析细胞周期。
1.7 Western blot检测
肿瘤细胞经过药物处理后,用细胞刮子直接刮下细胞,300 ×g离心5 min后收集细胞沉淀;添加适量RIPA裂解液(含50 mmol/L Tris pH为7.4,150 mmol/L氯化钠,1% Triton X-100,1% sodium deoxycholate,0.1% SDS)进行重悬,置冰上放置15 min;在4 ℃条件下18 000×g离心10 min,收集上清液并用二喹啉甲酸(BCA)蛋白定量试剂盒测定蛋白样品的浓度。蛋白样本经煮沸变性后供SDS-PAGE分离;电泳完毕后将蛋白通过半干法转移至硝酸纤维素膜上,先后经过膜封闭、一抗和二抗结合等实验步骤后进行化学发光显影。
1.8 统计学处理
利用Graph pad 5.0软件包进行统计学分析,组间比较采用Newman-Keuls检验法。P<0.05为差异有统计学意义。
2 结 果
2.1 大黄素能够诱导肝癌细胞自噬
本研究的前期工作证实,大黄素抑制肝癌细胞的效果呈剂量依赖性。其中大黄素在浓度为100 µmol/L的条件下处理细胞48 h,能够抑制大约30%肿瘤细胞的增殖[4]。在此基础上,本实验预先用大黄素(100 µmol/L)处理肝细胞癌细胞株HepG2,然后检测细胞自噬情况。结果发现大黄素处理细胞后24 h,不但能够诱发大量自噬泡的产生(图1B),而且可以提高细胞自噬标记蛋白LC3-II的表达(图1C),表明该化合物能够显著诱导肝癌细胞自噬。尽管克隆形成试验发现,大黄素(100 µmol/L)处理细胞24 h仅能够抑制部分肿瘤细胞的克隆存活(图1D),但鉴于细胞自噬是细胞抵抗外界应激环境的一种自我保护机制,我们推测肝癌细胞自噬参与抑制大黄素所诱导的肿瘤细胞毒性效应。因此,抑制肿瘤细胞自噬可能有助于促进大黄素对肿瘤细胞的杀伤作用。
2.2 抑制自噬通路提高大黄素对肝癌细胞克隆存活的抑制作用
为了验证靶向细胞自噬对大黄素抑制肝癌细胞生长的效果,我们首先利用氯喹预先抑制细胞自噬的发生,然后用大黄素处理肝癌细胞。结果发现,当使用氯喹(10 µmol/L)阻断肿瘤细胞自噬通路后(图2A),大黄素能够显著抑制肝癌细胞的增殖(图2B)及克隆存活(图2C),提示自噬通路可以作为提高大黄素抗肝癌治疗效果的潜在增效靶点。
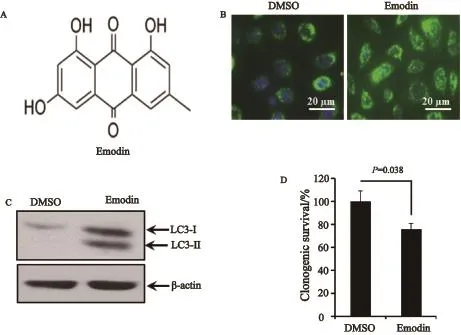
图 1 大黄素诱导肝癌细胞自噬Fig. 1 Emodin induced autophagy in liver cancer cells
2.3 抑制自噬显著促进大黄素诱导的肝癌细胞凋亡
在前期工作中,我们证实了大黄素能够诱导肝癌细胞凋亡[2]。鉴于上述实验结果发现,氯喹和大黄素联合应用能够显著抑制肿瘤细胞的存活,我们拟进一步评价氯喹和大黄素联合作用对肝癌细胞凋亡的影响。首先通过流式细胞仪分析技术发现氯喹和大黄素联合处理肿瘤细胞能够显著提高细胞周期的sub-G1期,提示两者联合作用后可以促进肿瘤细胞凋亡(图3A)。为验证以上实验结果,我们通过Western blot检测细胞cleaved-caspase3蛋白的表达,结果发现,氯喹和大黄素联合处理肿瘤细胞后能够显著提高cleaved-caspase3蛋白水平(图3B),从而表明以上两种药物联合作用能够显著促进肿瘤细胞凋亡。
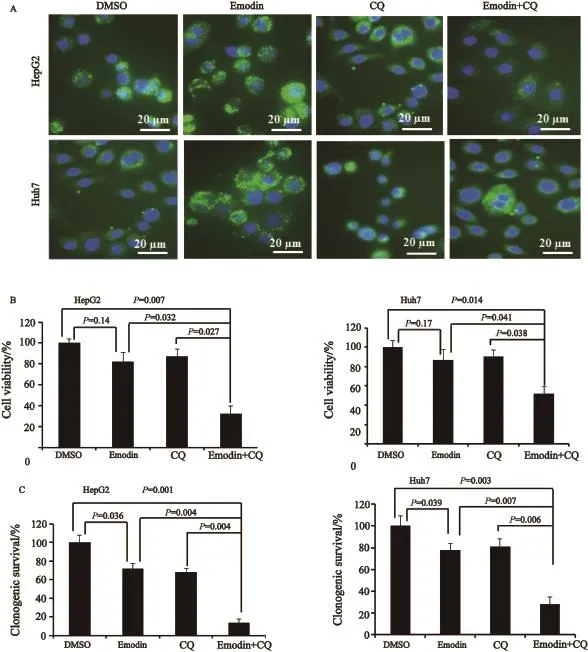
图 2 抑制细胞自噬提高大黄素对肝癌细胞的抑制作用Fig. 2 Inhibition of autophagy enhanced the inhibitory effect of emodin on liver cancer cells
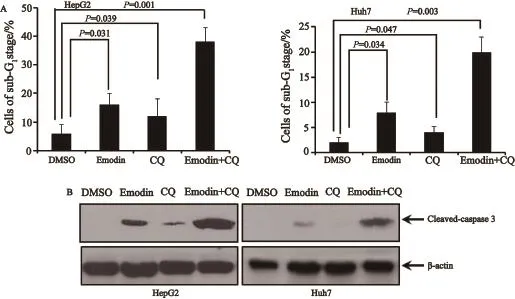
图 3 抑制细胞自噬显著促进大黄素诱导肝癌细胞凋亡Fig. 3 Blockage of autophagy significantly promoted emodin-induced apoptosis in liver cancer cells
3 讨 论
在前期工作中,我们发现大黄素能够诱导肝癌细胞产生内质网应激并导致肿瘤细胞凋亡[4]。但值得关注的是,大量研究发现内质网应激能够通过错综复杂的细胞信号通路诱发细胞自噬。后者作为哺乳细胞抵抗细胞内外不良环境的生理反应,已被证实与肿瘤细胞耐药机制密切相关[3]。为了探索细胞自噬与大黄素的抑瘤效应之间的潜在关联,本研究以肝癌细胞株为研究模型,首先确认大黄素处理肝癌细胞后能够显著刺激肝癌细胞产生自噬现象。基于这一实验基础,我们后续进一步证实通过氯喹抑制肝癌细胞自噬后能够显著促进大黄素诱导肝癌细胞凋亡。
事实上,大量研究已证实通过抑制细胞自噬能够提高多种类型肿瘤对化疗药物的敏感性,其涉及机制多样、复杂[6-7]。虽然本研究从细胞水平证实了靶向细胞自噬也能够提高大黄素对肝癌细胞的抑制作用,同时这种抑制效应与细胞凋亡密切相关,但对其中的作用分子机制及动物模型层面的评估尚未进一步研究。这将是本项目今后需要解决的重要问题。本研究探索通过靶向细胞自噬提高大黄素抑制肝癌细胞生长效果的潜在治疗策略将具有一定的临床应用价值。
[1] MANU K A, SHANMUGAM M K, ONG T H, et al. Emodin suppresses migration and invasion through the modulation of CXCR4 expression in an orthotopic model of human hepatocellular carcinoma[J]. PLoS One, 2013, 8(3): e57015.
[2] WHITE E. The role for autophagy in cancer[J]. J Clin Invest, 2015, 125(1): 42-46.
[3] YANG Z J, CHEE C E, HUANG S, et al. The role of autophagy in cancer: therapeutic implications[J]. Mol Cancer Ther, 2011, 10(9): 1533-1541.
[4] 党中峰, 党雅梅, 陈 城, 等. 大黄素诱导对内质网应激相关蛋白表达及肝癌HepG2细胞凋亡的影响[J]. 兰州大学学报: 医学版, 2015, 41(2): 50-54.
[5] RASHID H O, YADAV R K, KIM H R, et al. ER stress: Autophagy induction, inhibition and selection[J]. Autophagy, 2015, 11(11): 1956-1977.
[6] YANG M C, WANG H C, HOU Y C, et al. Blockade of autophagy reduces pancreatic cancer stem cell activity and potentiates the tumoricidal effect of gemcitabine[J]. Mol Cancer, 2015, 14(1): 179.
[7] CHEN P, HU T, LIANG Y, et al. Synergistic inhibition of autophagy and neddylation pathways as a novel therapeutic approach for targeting liver cancer[J]. Oncotarget, 2015, 20, 6(11): 9002-9017.
Therapeutically targeting autophagy enhances cytotoxicity of emodin in liver cancer cell lines
DANG Zhongfeng, HE Keji, NA Guangwei, SUN Wenping, CHENG Yongsheng, WANG Weijun, LI Rui (Second Department of Abdominal Surgery, Gansu Provincial Tumor Hospital, Lanzhou 730050, Gansu Province, China)
HE Keji E-mail: 13893265154@163.com
Background and purpose: The previous work of this study has showed that the treatment of liver cancer cells with emodin could induce endoplasmic reticulum (ER) stress and apoptosis. Given the cross-talk between ER stress and autophagy, this study aimed to investigate whether blockage of autophagy, a defense mechanism against environmental stress, could improve the killing effect of emodin on liver cancer cells. Methods: The CYTO-ID autophagy detection kit and Western blot were used to determine autophagy in liver cancer cells. After combined treatment with chloroquine (CQ) and emodin, cancer cell survival was analyzed by ATPlite assay and clonogenic assay. Apoptosis was detected by both flow cytometry analysis and Western blot. Results: Autophagy could be induced in liver cancer cells after treatment with emodin. Inhibition of autophagy significantly increased growth-inhibitory effect of emodin on both HepG2 and Huh7 cancer cells. The combination treatment with CQ and emodin promoted remarkable apoptosis in liver cancer cells, evidenced by the increase in the percentage of cells in sub-G1phase and the higher expression lever of cleaved caspase-3. Conclusion: Therapeutically targeting autophagy is capable of enhancing cytotoxicity of emodin in liver cancer cell lines.
Emodin; Autophagy; Liver cancer cells; Apoptosis
10.19401/j.cnki.1007-3639.2017.03.004
R735.7
A
1007-3639(2017)03-0186-05
2016-09-30
2016-12-10)
甘肃省中医药管理局基金项目(GZK-2014-71)。
何科基 E-mail: 13893265154@163.com
