西瓜食酸菌TA基因酵母双杂交诱饵载体的构建及其自激活作用的检测
2017-04-13胡金凤黄成文刘君
胡金凤,黄成文,刘君
(1.新疆农业大学林学与园艺学院,乌鲁木齐 830052;2. 新疆农业大学农学院,乌鲁木齐 830052)
西瓜食酸菌TA基因酵母双杂交诱饵载体的构建及其自激活作用的检测
胡金凤1,黄成文2,刘君1
(1.新疆农业大学林学与园艺学院,乌鲁木齐 830052;2. 新疆农业大学农学院,乌鲁木齐 830052)
【目的】构建西瓜食酸菌TA基因的酵母双杂交诱饵载体,为探究TA基因编码产物参与西瓜食酸菌致病的机制奠定基础。【方法】通过PCR扩增TA基因,并定向克隆到载体pGBKT7,获得可用于酵母双杂交的诱饵载体pGBKT7-TA,经酶切鉴定和测序验证为正确后将pGBKT7-TA转化到酵母菌株AH109中;进一步用ADE2、HIS3、LacZ报告基因活性检测法检测pGBKT7-TA的自激活作用,用固体及液体营养缺陷型培养基培养法检测pGBKT7-TA的毒性作用。【结果】诱饵载体pGBKT7-TA对酵母菌株AH109没有自激活及毒性作用。【结论】所构建的诱饵载体可用于酵母双杂交系统的后续工作,为进一步从被西瓜食酸菌侵染的黄瓜子叶cDNA文库中筛选与TA互作的蛋白奠定了基础。
西瓜食酸菌;TA基因;酵母双杂交;诱饵载体
0 引 言
【研究意义】由西瓜食酸菌(Acidovoraxcitrulli,Ac)引起的细菌性果斑病(Bacterial Fruit Blotch,以下简称BFB)是一种可对葫芦科植物造成毁灭性危害的病害[1-3],自从1987年在美国的一些商品西瓜地自然爆发以来[4,5],该病害已在全球传播蔓延,并被发现也可导致甜瓜、籽瓜、南瓜、笋瓜以及黄瓜等其它葫芦科植物发病[6-12],细菌性果斑病目前已经成为全球葫芦科作物产业的严重威胁[13]。迄今为止,世界范围内针对BFB病菌致病的生物学和分子生物学基础的认知非常有限,研究BFB病菌与寄主互作的分子机理,是开发有效控制BFB新途径、新方法的基础。TA基因是研究小组前期工作中筛选西瓜食酸菌Tn5转座子插入突变体库鉴定得到的,该基因缺失突变体在寄主植物上完全丧失致病力,在非寄主植物烟草(NicotianatabacumL.)上诱导过敏性坏死反应的能力也丧失,其基因功能注释为编码细菌新陈代谢途径中的一个相对保守的酶,为该菌的致病必需因子,但目前未见有关于TA参与任何病菌致病作用机制的研究报道。酵母双杂交系统 (Yeast two hybrid system) 最初是由Fields和Song[14]建立的用于检测蛋白与蛋白相互作用的一种方法,它可以在活体酵母中探究蛋白质间的相互作用,并用于发现蛋白的新功能及新蛋白[15-18]。研究欲使用酵母双杂交系统筛选与TA互作的蛋白,对探究西瓜食酸菌的致病机制具有重要意义。【前人研究进展】目前,利用酵母双杂交系统探究蛋白质之间的相互作用已经发展成为一个成熟的研究手段,在众多研究中得到应用。薛璞[19]构建了柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库并且初步筛选了EtAMA1相互作用蛋白;林振[20]构建了乳鼠成骨细胞酵母双杂交cDNA文库并且筛选与CITED1相互作用蛋白;萨娜瓦尔·艾比布拉等[21]利用酵母双杂交系统构建了拟南芥At4g05060基因的表达载体,并对其进行自激活检测,筛选出与At4g05060基因互作的蛋白,从而为研究该基因的作用机制奠定基础。【本研究切入点】迄今,BFB病菌致病机制的研究仍处于起步阶段,TA参与西瓜食酸菌致病作用的发现为认识该菌致病的分子机制打开了一扇新的窗口。由于TA参与病菌致病未见相关报道,利用酵母双杂交系统可以探寻与其互作的因子,构建有功能的酵母双杂交诱饵载体成为必要条件。【拟解决的关键问题】研究构建的TA基因的酵母双杂交诱饵表达载体在酵母菌株中应不存在自激活能力和毒性作用,这是下一步筛选与TA互作的蛋白、解析TA基因的作用机制的基础。
1 材料与方法
1.1 材 料
西瓜食酸菌FC440野生型菌株为该实验室保存,大肠杆菌(E.coli)化学感受态细胞购自北京全式金生物技术有限公司,酵母菌株AH109、表达载体pGBKT7,对照质粒pGBKT7-53、pGBKT7-Lam、pGADT7-T购自上海北诺生物公司,细菌基因组提取试剂盒购自天根(Tiangen Biotech Inc.),PCR试剂、限制性内切酶、T4DNA连接酶等为TaKaRa产品,DNA质粒提取试剂盒及DNA凝胶回收试剂盒为Axygen产品,酵母缺陷型培养基、50%PEG3350、Yeastmaker Carrier DNA、二甲基亚砜(DMSO)等为Sigma产品。引物合成及测序由华大 (Beijing Genomics Institute)公司完成。
1.2 方 法
1.2.1TA基因的克隆
根据pGBKT7载体上的多克隆位点,用Primer Premier 5设计特异引物序列对,TA-F:5‘-3’ CGCGGATCCGATCCGATGCACGACTTC,TA-R:5’-3’ ACGCGTCGACTCAGCCCCGGAATTCCTC,下划线部分分别表示BamHⅠ和SalⅠ酶切位点。以野生型FC440的基因组DNA为模板,使用高保真的PrimerSTARTMHS DNA polymerase扩增大小约为1 072 bp含TA基因的片段。PCR反应体系为:5×Primer STARTMbuffer (Mg2+)4 μL,dNTPs(2.5 mmol/L) 1.6 μL,TA-F (10 μmol/L)1.0 μL,TA-R (10 μmol/L) 1.0 μL,FC440 DNA(30ng/L) 1.0 μL,Primer STARTMHS DNA polymerase (2.5 U/L) 0.2 μL,ddH2O 11.2 μL 。PCR反应条件为:95℃变性5 min;98℃变性10s,68℃退火2 min,共30个循环;最后72℃延伸5 min。PCR产物用1%琼脂糖凝胶电泳检测后,用DNA凝胶回收试剂盒切胶回收目的片段。
1.2.2 酵母双杂交诱饵载体pGBKT7-TA的构建
将PCR扩增的目的基因TA、载体PGBKT7分别用BamHⅠ和SalⅠ进行双酶切,用DNA凝胶回收试剂盒回收纯化目的片段与载体片段,经T4DNA连接酶16℃过夜连接,产物经热激法转化进E.coli大肠杆菌感受态细胞中,用含50 μg/mL Kan的LB平板筛选转化子,提取转化子的质粒用BamHⅠ和SalⅠ双酶切鉴定,将鉴定呈阳性的质粒测序,序列正确的质粒即为诱饵载体pGBKT7-TA。
1.2.3 酵母感受态细胞的制备
取保存于-80℃的AH109酵母菌株,划线接种至YPDA固体平板上,30℃培养3~4 d,从YPDA固体平板上挑取直径2~3 mm的单克隆,接种于30 mL YPDA液体培养基中,30℃,200 r/min,过夜培养;将过夜培养的菌液稀释至100 mL 新鲜的YPDA 液体培养基中,直至 OD600约为 0.2~0.3,200 r/mim 30℃摇菌至OD600为0.4~0.6(约3 h);1 000×g室温离心5 min,弃上清;用约 25~50 mL 无菌水重悬细胞,1 000×g离心5 min,弃上清;重复洗涤一次;沉淀用1.5 mL 新鲜配制的1×TE/LiAc重悬,即获得酵母感受态细胞。
1.2.4 酵母感受态细胞的转化
按照表1中分组分别于1.5 mL无菌离心管中加入200 ng待转化质粒和0.1 mg Carrier DNA(10 mg/mL)(新配置时水浴煮沸20 min,立即插入冰浴,保存于-20℃,每次使用前煮沸5 min,立即置于冰上备用),再加入 100 μL新制备的酵母感受态细胞AH109,震荡混匀;各加入 600 μL PEG/LiAc溶液,剧烈振荡(提高转化效率),30℃,200 r/mim 振荡培养30 min,中间每隔10 min颠倒混匀一下;各加入 70 μL DMSO,缓缓倒置混匀(不能振荡),42℃水浴热休克15 min,每隔5 min混匀一次,立即置于冰浴冷却1~2 min;于室温12 000×g离心15s,尽量弃尽上清,以500 μL 1×TE 重悬沉淀细胞,分别取100 μL涂布于相应的缺陷型固体平板,30℃倒置培养3~5 d,观察酵母菌落的生长情况。表1
表1 酵母转化分组
Table 1 The groups of Yeast Transform

反应ReactionAD质粒ADplasmidBD质粒BDplasmid涂板种类Typesofcoating备注Remarks1pGADT7-TpGBKT7-53SD-TL阳性对照2pGADT7-TpGBKT7-lamSD-TL阴性对照3pGADT7pGBKT7-TASD-TL自激活检测4-pGBKT7-TASD-T筛库备用
1.2.5 诱饵载体pGBKT7-TA转化AH109酵母菌
将诱饵质粒pGBKT7-TA转化进酵母菌AH109,涂布于SD/-T缺陷型固体平板上,30℃培养3~5 d,观察菌落生长情况。再随机挑选克隆做菌落PCR鉴定,PCR反应体系中MgCl2、dNTP 终浓度分别为2 mmol/L和200 μmol/L,引物TA-F/TA-R(10 μM)终浓度为500 μmol/L,Taq酶(TaKaRa)2.5 U。PCR反应条件为:95℃预变性5 min;95℃变性 30s,57℃ 退火30s,72℃ 延伸30s,共35个循环;最后72℃延伸10 min。用0.5%琼脂糖凝胶电泳检测PCR产物,验证诱饵质粒转化到酵母菌AH109的成功与否。
1.2.6 诱饵载体pGBKT7-TA的自激活检测
pGBKT7-TA与pGADT7共转化AH109长出的酵母转化子随机挑取了6个菌落进行自激活检测。HIS3和ADE2报告基因的检测采用点板培养的方法,将转化子点板至SD-TLHA平板,30℃恒温培养4 d,观察其生长状态。LacZ报告基因的检测,从转化平板随机挑取6个菌落于滤纸片上;将滤纸完全浸于液氮中90s,取出常温放置2 min晾干;在培养皿中加入新鲜配制的显色液,一般9 cm培养皿用2~3 mL显色液,将显色液加入培养皿中,再放入一张干净的滤纸,让其完全浸湿;将冻溶后的滤纸放在最上面,使显色液浸透表层,盖上皿盖;30℃避光培养,20 min后开始观察,一般2 h后可开始看到颜色变化,4~5 h拍照记录结果。自激活检测组的生长情况同阴性对照,就说明其无激活作用。
1.2.7 诱饵载体pGBKT7-TA的毒性检测
将诱饵载体pGBKT7-TA和空质粒pGBKT7分别转化至酵母菌AH109中,方法同1.2.4。观察二者在SD/ -T选择培养基上的菌落生长的快慢及数量,来判断诱饵蛋白是否有毒性。待菌落长出后,分别从两组平板上挑取单个菌落重悬于50 mL SD/ -T液体培养基中30°C、250 r/mim振荡培养18 h,通过比较pGBKT7-TA转化子和pGBKT7转化子菌液OD600值,可进一步判断诱饵质粒pGBKT7-TA对酵母菌AH109是否有毒性。
2 结果与分析
2.1 诱饵载体pGBKT7-TA的构建
以野生型FC440的基因组DNA为模板,采用高保真的DNA聚合酶扩增目的基因TA,PCR产物经电泳检测,结果显示扩增得到1 072 bp左右的TA片段,与预期目标大小一致,表明成功扩增到TA基因。图1
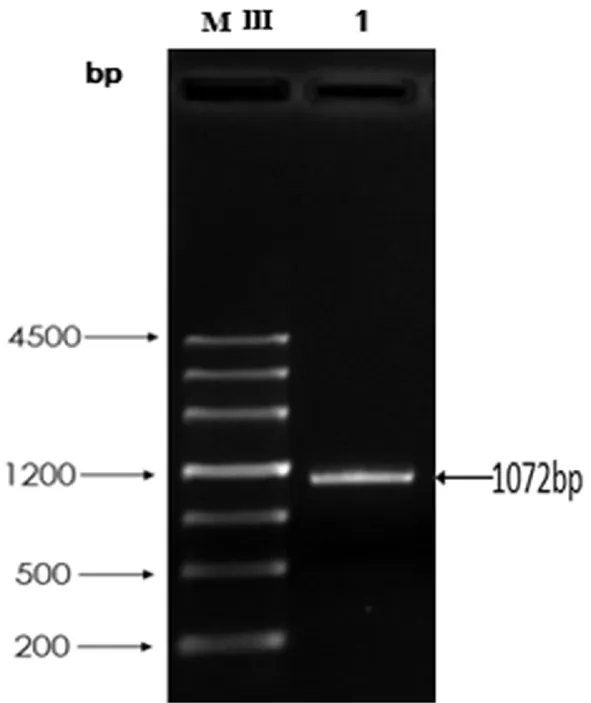
MⅢ:MarkerⅢ 1:TA基因PCR产物
MⅢ:MarkerⅢ 1:amplicon
图1TA基因PCR扩增
Fig.1 PCR amplification ofTAgene
载体pGBKT7与TA基因片段连接后获得的候选重组子用BamHⅠ和SalⅠ双酶切后经琼脂糖凝胶电泳分析,得到的酶切片段大小与预期片段大小一致,测序结果也表明与目的基因序列完全一致,表明酵母双杂交诱饵载体pGBKT7-TA构建成功。图2

M1:1kb DNA Ladder;M2:MarkerⅢ;1:诱饵质粒PGBKT7-TA酶切产物
M1:1kb DNA Ladder;M2:MarkerⅢ;1:pGBKT7-TAdigested withBamHⅠandSalⅠ
图2 诱饵质粒pGBKT7-TA的酶切鉴定
Fig.2 Identification of pGBKT7-TAby restriction enzyme digestion
2.2 诱饵质粒pGBKT7-TA转化AH109酵母菌
将诱饵质粒pGBKT7-TA转化进酵母菌株AH109中,涂布于SD/-T缺陷型固体平板上,30℃培养3~5 d后有粉色菌落长出,随机挑选克隆做菌落PCR鉴定,扩增得到1 072左右的片段,与预期片段大小一致。结果说明诱饵质粒pGBKT7-TA成功转化进AH109酵母菌中。图3
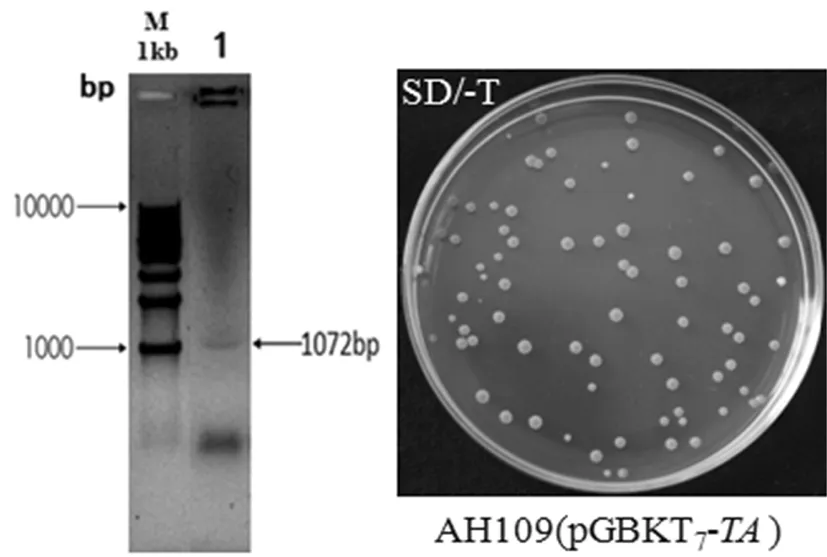
M1:1kb DNA Ladder;1:AH109(pGBKT7-TA)
图3 诱饵质粒pGBKT7-TA转进酵母菌AH109的鉴定
Fig.3 Identification of pGBKT7-TAtransformed in yeast strain AH109
2.3 诱饵载体pGBKT7-TA的自激活检测
将自激活检测组、阳性对照、阴性对照转化进AH109酵母感受态细胞培养3~5 d后,再采用点板培养的方法检测ADE2和HIS3报告基因,结果显示三组菌株在SD/-TL缺陷平板上均能正常生长,在SD/-TLHA缺陷平板上仅有阳性对照生长,pGBKT7-TA/pGADT7转化子中随机挑选的5个菌落在SD/-TLHA缺陷平板上不能生长,同阴性对照生长状态相同,LacZ检测中结果显示结果也与阴性对照相同,这说明重组质粒pGBKT7-TA无自激活作用,可用于后续实验。图4

阳性对照:pGBKT7-53/pGADT7-T;阴性对照:pGBKT7-lam/pGADT7-T
Positive control: pGBKT7-53/pGADT7-T Negative control: pGBKT7-lam/pGADT7-T
图4 诱饵质粒pGBKT7-TA对报告基因的自激活检测
Fig.4 Analysis of self-activation of the bait vector pGBKT7-TA
2.4 诱饵载体pGBKT7-TA的毒性检测
研究表明,诱饵质粒pGBKT7-TA和空质粒pGBKT7转化进酵母菌中,于SD/-T缺陷型固体平板上长势良好数量大致相同,且菌落直径大多都大于2 mm。AH109(pGBKT7-TA)和AH109(pGBKT7)分别接种于50 mL SD/-T缺陷型液体培养基中,30℃培养18 h后,测得OD600分别为1.636和1.643,均大于0.8 。结果表明,诱饵载体pGBKT7-TA对酵母菌株AH109没有毒性作用。图5
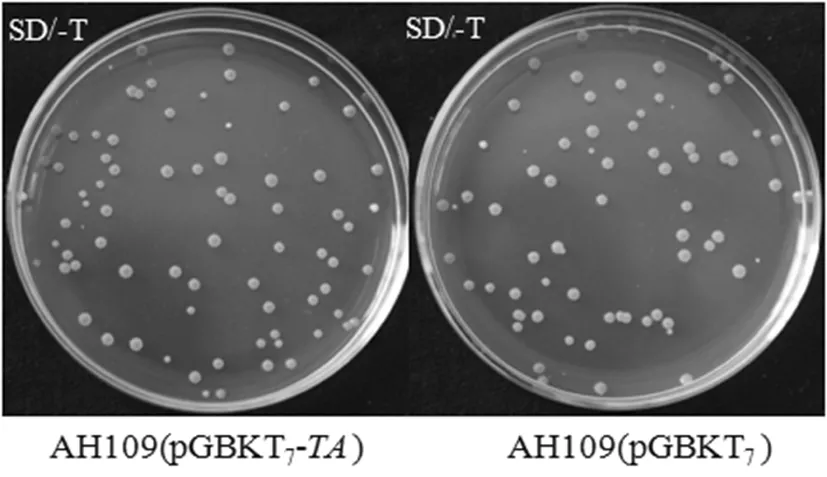
图5 诱饵质粒pGBKT7-TA对酵母菌AH109的毒性检测
Fig.5 Analysis of toxicity of pGBKT7-TAto yeast strain AH109
3 讨 论
BFB作为先后被列入《中华人民共和国进境植物检疫性有害生物名录》和《全国农业植物检疫性有害生物名单》一种检疫性细菌病害,对葫芦科作物的生产造成的损失是巨大的。因此,科学的认识细菌性果斑病菌致病机理成为有效防控病害传播的关键。目前针对BFB病原菌参与寄主致病机制方面已有一些研究报道,陈涛等[22]验证了瓜类细菌性果斑病中具有细菌群体感应调节系统,将降解细菌信号分子的基因aiiA导入瓜类细菌性果斑病菌中,降低了信号分子的产生,并使该菌株的致病性降低;Johnson[23]研究发现T2SS减弱了病菌的定殖能力和从种子到幼苗的传播能力;刘君[24]研究发现非鞭毛Ⅲ分泌系统ATPase蛋白为西瓜食酸菌的致病必需因子;王建超等[25]研究表明,西瓜食酸菌鞭毛的形成与吡哆醛磷酸(VB6)的生物合成有关;王敏鑫等[26]研究表明pilQ基因是Ⅳ型菌毛的功能基因且能参与合成西瓜食酸菌Ⅳ型菌毛,同时证实西瓜食酸菌的颤动性、致病性、游动性及生物膜的形成与Ⅳ型菌毛有密切关联。上述研究发现的存在于西瓜食酸菌中参与致病的因子:群体感应系统(quorum sensing, QS)、Ⅱ型分泌系统(T2SS)和Ⅲ型分泌系统(T3SS)、鞭毛、菌毛等,均是已经证实的存在于细菌中的致病因子(系统)。一些研究也发现在病原细菌新陈代谢中的酶也会参与致病过程,例如,结核分枝杆菌(Mycobacteriumtuberculosis)中参与脂肪酸代谢的异柠檬酸裂解酶(Isocitrate lyase)ILC1 和ILC2同时为该菌的毒性所必需,二者的缺失菌株完全丧失致病性[27];Schmid等[28]证实在致病性耶尔森氏菌(Yersiniaenterocolitic)中参与T3SS效应物蛋白表达调节的功能调节子YscM1和YscM2也调控该菌的中央代谢,二者的缺失显著改变菌的一些代谢活动,且均可以与磷酸烯醇丙酮酸羧激酶(PEPC)互作,体外实验证实YscM1显著地抑制PEPC的活性。研究中的TA基因功能注释为西瓜食酸菌代谢途径中一个相对保守的酶,目前其参与西瓜食酸菌的致病性的功能尚未见研究报道。TA蛋白为一个依赖5'-磷酸吡哆醛辅因子的酶。已有研究报道表明,多个被批准的药物靶标是5'-磷酸吡哆醛依赖型的代谢酶,如DOPA 脱羧酶(参与帕金森病)、GABA氨基转移酶等,另有二十多个被识别的潜在药物靶标或除草剂靶标均为5'-磷酸吡哆醛依赖型酶[29]。认为西瓜食酸菌中的TA蛋白可以作为杀菌剂的靶标而能够开发出防控BFB的有效措施。
目前,研究蛋白质间相互作用的方法很多,例如酵母双杂交技术、免疫共沉淀、GST pull-down技术、Western blot技术、噬菌体展示技术等等,其中酵母双杂交技术敏感度极高,能省略纯化蛋白质的繁琐步骤检测到一些微弱或短暂的蛋白质之间的相互作用,并且能在活体酵母细胞中进行,且不受外界环境条件的影响,在一定程度上代表细胞内的真实水平,这是其他离体生化检验方法所达不到的[30]。但酵母双杂交技术也存在一定的局限性,首要问题就是报告基因的自激活造成的假阳性[31,32],如若所构建的诱饵表达载体存在自激活作用,将会对后续的筛选工作造成严重影响。研究构建了西瓜食酸菌TA基因的酵母双杂交诱饵载体,并对其进行了自激活和毒性作用的检测。自激活实验结果证实诱饵质粒对报告基因没有自激活作用,排除假阳性的影响;毒性作用实验证实诱饵质粒对酵母菌株AH109没有毒性作用,酵母菌能正常生长。诱饵载体构建是成功的,为进一步利用酵母双杂交系统筛选TA蛋白的互作蛋白奠定了基础。
4 结 论
研究构建的酵母双杂交诱饵载体pGBKT7-TA,通过检测AH109(pGBKT7-TA/pGADT7)中报告基因ADE2、HIS3、LacZ的活性,并对比AH109(pGBKT7-TA) 、AH109(pGBKT7)在固体及液体营养缺陷型培养基中的生长状况。诱饵载体pGBKT7-TA对酵母菌株AH109无自激活及毒性作用,该诱饵载体可用于酵母双杂交系统中筛选与TA蛋白相互作用的蛋白质,为研究BFB菌致病机制奠定了基础。
References)
[1] Schaad, N. W., Postnikova, E., Sechler, A., Claflin, L. E., Vidaver, A. K., & Jones, J. B., et al. (2008). Reclassification of subspecies of acidovorax avenae as a. avenae (manns 1905) emend. a. cattleyae (pavarino, 1911) comb. nov. a. citrulli schaad et al. 1978) comb. nov. and proposal of a. oryzae sp. nov.Systematic&AppliedMicrobiology,31(8):434-446.
[2]Schaad, N. W., Sowell, G., Goth, R. W., Colwell, R. R., & Webb, R. E. (1978). Pseudomonas pseudoalcaligenes subsp. citrulli subsp. nov.InternationalJournalofSystematicBacteriology, 28(4):621.
[3]Willems, A., Goor, M., Thielemans, S., Gillis, M., Kersters, K., & De, L. J. (1992). Transfer of several phytopathogenic pseudomonas species to acidovorax as acidovorax avenae subsp. avenae subsp. nov. comb. nov. acidovorax avenae subsp. citrulli, acidovorax avenae subsp. cattleyae, and acidovorax konjaci.InternationalJournalofSystematicBacteriology, 42(1):107-119.
[4]Somodi, G. C., Jones, J. B., Hopkins, D. L., Stall, R. E., Kucharek, T. A., & Hodge, N. C., et al. (1991). Occurrence of a bacterial watermelon fruit blotch in florida.PlantDisease, 75(10):1,053-1,056.
[5] Wall G C and Santos V M. (1988). A new bacterial disease on watermelon in the Mariana Islands .Phytopathology, (78):1,605.
[6]Burdman, S., Kots, N., Kritzman, G., & Kopelowitz, J. (2005). Molecular, physiological, and host-range characterization of acidovorax avenae subsp. citrulli isolates from watermelon and melon in israel.PlantDisease, 89(12):1,339-1,347.
[7]Isakeit, T., Black, M. C., Barnes, L. W., & Jones, J. B. (1997). First report of infection of honeydew with acidovorax avenae subsp. citrulli.PlantDisease, 81(6):694.
[8]Isakeit, T., Black, M. C., & Jones, J. B. (1998). Natural infection of citronmelon with acidovorax avenae subsp. citrulli.PlantDisease,82(3):351.
[9]Dbjr, L., Walcott, R. D., Gitaitis, R. D., & Fhjr, S. (1999). First reports of a fruit rot of pumpkin caused by acidivorax avenae subsp. citrulli in georgia.PlantDisease, 83(2):199.
[10]Martin, H. L., & O'Brien, R. G. (1999). First report of acidovorax avenae subsp. citrulli as a pathogen of cucumber.PlantDisease, 83(10):965.
[11]Walcott, R. R., Fessehaie, A., & Castro, A. C. (2004). Differences in pathogenicity between two genetically distinct groups of acidovorax avenae, subsp. citrulli, on cucurbit hosts.JournalofPhytopathology,152(5):277-285.
[12] 刘君,王燕凌,郭蔼光,等. 细菌性果斑病菌Acidovoraxavenaesubsp.citrulli对黄瓜侵染及离体叶片接种方法的研究[J]. 新疆农业科学,2009,46(1):132-137.
LIU Jun, WANG Yan-ling, GUO Ai-guang, et al. (2009). Studies on infection of cucumber byAcidovoraxavenaesubsp.citrullidetached leaves inoculation [J].XinjiangAgriculturalSciences, 46(1):132-137. (in Chinese)
[13]Bahar, O., Burdman, S., Edelstein, M., & Cohen, R. (2010). Bacterial fruit blotch: a threat to the cucurbit industry.IsraelJournalofPlantSciences, 58(1):19-31.
[14] Fieldss S,, & Song, O. K. (1989). A novel genetic system to detect protein-protein interactions.Nature,340(6,230):245-246.
[15]Ezaki, J., Takeda-Ezaki, M., Koike, M., Ohsawa, Y., Taka, H., & Mineki, R., et al. (2003). Characterization of cln3p, the gene product responsible for juvenile neuronal ceroid lipofuscinosis, as a lysosomal integral membrane glycoprotein.JournalofNeurochemistry, 87(5):1,296-1,308.
[16]Ezaki, J., Tanida, I., Kanehagi, N., & Kominami, E. (1999). A lysosomal proteinase, the late infantile neuronal ceroid lipofuscinosis gene ( cln2 ) product, is essential for degradation of a hydrophobic protein, the subunit c of atp synthase.JournalofNeurochemistry, 72(6):2,573-2,582.
[17]Golabek, A. A., Kida, E., Walus, M., Kaczmarski, W., Michalewski, M., & Wisniewski, K. E. (2000). Cln3 protein regulates lysosomal ph and alters intracellular processing of alzheimer's amyloid-β protein precursor and cathepsin D in human cells.MolecularGenetics&Metabolism, 70(3):203-213.
[18]Puranam, K. L., Guo, W. X., Qian, W. H., Nikbakht, K., & Boustany, R. M. (1999). Cln3 defines a novel antiapoptotic pathway operative in neurodegeneration and mediated by ceramide.MolecularGenetics&Metabolism, 66(4):294-308.
[19] 薛璞. 柔嫩艾美耳球虫子孢子酵母双杂交cDNA文库的构建及EtAMA1相互作用蛋白的初步筛选[D].上海: 上海师范大学硕士论文,2013.
XUE Pu. (2013).Theconstructionofayeasttwo-hybridcDNALibraryofEimeriatenellaandpreliminaryscreeningofinteractionproteinswithEtAMA1[D]. Master Dissertaion. Shanghai Normal University, Shanghai. (in Chinese)
[20] 林振. 应用酵母双杂交系统筛选与CITED1相互作用蛋白[D].广州:南方医科大学硕士论文,2013.
LIN Zhen. (2013).ScreeningtheinteractionproteinsofCITED1byyeasttwo-hybridsystem[D]. Master Dissertation. Southern Medical University, Guangzhou. (in Chinese)
[21] 萨娜瓦尔·艾比布拉,陈全家. 拟南芥At4g05060基因的酵母双杂交诱饵表达载体的构建、表达及自激活检测[J]. 西北农业学报,2015,(4):138-142.
Sanawaer Aibibula, CHEN Quan-jia. (2015). Construction,Expression and self-activation detection of bait vector for yeast two-hybrid ofAt4g05060 gene inArabidopsisthaliana[J].ActaAgriculturaeBoreali-occidentalisSinica, (4):138-142. (in Chinese)
[22] 陈涛,钱国良,杨小丽,等. 瓜类细菌性果斑病菌群体感应信号分子的检测及其对致病性的影响[J]. 农业生物技术学报,2008,(4):653-657.
CHEN Tao, QIAN Guo-liang, YANG Xiao-li, et al. (2008). Detection of quorum sensing signal molecule ofAcidovoraxavengesubsp.Citrulliand its regulation on pathogenicity [J].JournalofAgriculturalBiotechnology, (4):653-657.(in Chinese)
[23] Johnson K. (2010). Quorum sensing affects virulence and seed-to-seedling transmission of Acidovorax avenge subsp. Citrulli, the causal agent of bacterial fruit blotch.Phytopathology, 100(6S):S148.
[24] 刘君. 西瓜食酸菌(Acidovorax citrulli)Tn5转座子插入突变体的制备和致病性缺失突变体的鉴定与分析[D].杨凌:西北农林科技大学博士论文,2012.
LIU-Jun. (2012).CreationofTn5insertionalmutantsofbacterialfruitblotchpathogenAcidovoraxcitrulliandidentificationofpathogenicityalteredmutants[D]. PhD Dissertation. Northwest A&F University. .Yangling. (in Chinese)
[25] 王健超,袁云云,代园凤,等. 西瓜噬酸菌吡哆醛磷酸(VB6)营养缺陷型与致病性相关[J]. 农业生物技术学报,2013,(9):1 093-1 102.
WANG Jian-chao,YUAN Yun-yun,DAI Yuan-feng, et al. (2013). Relationship between pyridoxal phosphate(VB6) auxotrophy of Acidovorax citrulli and pathogenicity [J].JournalofAgriculturalBiotechnology, (9):1,093-1,102. .(in Chinese)
[26] 王敏鑫,武珍,邱晓静,等. 西瓜噬酸菌Ⅳ型菌毛相关基因pilO及pilQ的功能分析[J]. 农业生物技术学报,2013,(6):716-724.
WANG Min-xin, WU Zhen, QIU Xiao-jing, et al. (2013).Functional analysis of type Ⅳ pili related genes pilO and pilQ in Acidovorax citrulli [J].JournalofAgriculturalBiotechnology, (6):716-724.(in Chinese)
[27]Muoz-Elías, E. J., & Mckinney, J. D. (2005). Mycobacterium tuberculosis isocitrate lyases 1 and 2 are jointly required for in vivo growth and virulence.NatureMedicine, 11(6):638-644.
[28]Schmid, A., Neumayer, W., Trülzsch, K., Israel, L., Imhof, A., & Roessle, M., et al. (2009). Cross-talk between type three secretion system and metabolism in yersinia.JournalofBiologicalChemistry,284(18):12,165-12,177.
[29]Amadasi, A., Bertoldi, M., Contestabile, R., Bettati, S., Cellini, B., & Di, S. M., et al. (2007). Pyridoxal 5'-phosphate enzymes as targets for therapeutic agents.CurrentMedicinalChemistry, 14(12):1,291-1,324.
[30]Yang, M., Wu, Z., & Fields, S. (1995). Protein-peptide interactions analyzed with the yeast two-hybrid system.NucleicAcidsResearch,23(7):1,152-1,156.
[31]Serebriiskii, I. G., & Golemis, E. A. (2001). Two-hybrid system and false positives. approaches to detection and elimination.MethodsinMolecularBiology, 177(1):123-134.
[32]Suter, B., Kittanakom, S., & Stagljar, I. (2008). Two-hybrid technologies in proteomics research.CurrentOpinioninBiotechnology, 19(4):316-323.
Supported by:The National Natural Science Foundation of China"Genetic and molecular characterization of a novel pathogenicity gene inAcidovoraxcitrulli" (31260419)
Construction and Self-activation Detection of Bait Vector for Yeast Two-hybrid System ofTAgene inAcidovoraxcitrulli
HU Jin-feng1, HUANG Cheng-wen2, LIU Jun1
(1.CollegeofForestryandHorticulture,XinjiangAgriculturalUniversity,Urumqi830052,China;2.CollegeofAgronomy,XinjiangAgriculturalUniversity,Urumqi830052,China)
【Objective】 This project aims to construct a bait vector for yeast two-hybrid system ofTAgene inAcidovoraxcitrulliin order to lay the foundation for exploring the gene function involved in the pathogenic mechanism.【Method】TheTAgene was amplified by PCR and cloned into the vector pGBKT7. The verified pGBKT7-TAwas then transformed into the yeast strain AH109. The activities of report genesADE2,HIS3 andLacZwere used to detect the self activation of pGBKT7-TA, and the toxicity of pGBKT7-TAwas investigated in nutrient deficient medium.【Result】The constructed bait vector pGBKT7-TAhad neither self-activation nor toxic effect in the yeast strain AH109.【Conclusion】The constructed bait vector can be used for the follow-up work of the yeast two hybrid system, which has laid a foundation for further screening of proteins interacting with TA from the cDNA library of cucumber cotyledons infected byAcidovoraxcitrulli.
Acidovoraxcitrulli;TAgene; yeast two-hybrid system; bait vector
10.6048/j.issn.1001-4330.2017.02.011
2016-12-05
国家自然科学基金项目“细菌性果斑病菌(Acidovoraxcitrulli)一个新型致病基因的作用机制研究”(31260419)
胡金凤(1990-),女,重庆铜梁人,硕士研究生,研究方向为分子生物学,(E-mail)hujinfeng137@126.com
刘君(1970-),女,湖北麻城人,副教授,研究方向为植物病原细菌致病机制,(E-mail)liujem@126.com
S188
A
1001-4330(2017)02-0289-08
