不同引物对和退火温度对盐生植物盐穗木内参基因β-actin扩增效率的影响
2017-04-13白雪芹杨瑞瑞曾幼玲
白雪芹,杨瑞瑞,曾幼玲
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
不同引物对和退火温度对盐生植物盐穗木内参基因β-actin扩增效率的影响
白雪芹,杨瑞瑞,曾幼玲
(新疆大学生命科学与技术学院/新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
【目的】以盐生植物盐穗木为材料,研究不同引物对和不同退火温度对盐穗木内参基因β-actin扩增效率的影响。【方法】设计扩增β-actin基因的两对引物,标记为β-actin1和β-actin2,分别建立这两对引物扩增盐穗木β-actin基因和特异性引物扩增该物种的过氧化物酶基因POD(盐响应的代表性基因),在不同退火温度下的标准曲线和扩增曲线。【结果】不论55还是58℃退火温度,引物对β-actin1比引物对β-actin2有更好的扩增效率;在55℃退火温度下,引物对β-actin1有更高的扩增效率。在这两个退火温度下,分别以β-actin1和β-actin2引物对扩增β-actin基因作为内参,盐穗木POD基因的相对表达水平具有一定的差异性。【结论】引物和退火温度会影响荧光定量PCR的扩增效率,进而会影响靶基因的相对表达水平。
盐穗木;不同引物对;退火温度;β-actin;扩增效率
0 引 言
【研究意义】盐穗木 (Halostachyscaspica) 为藜科(Chenopodiaceae )多年生盐生植物。广泛生长于新疆极端盐碱环境中。为了适应高度的盐渍化,其植株叶片高度肉质化,是盐土荒漠主要植物之一[1]。目前主要研究了盐穗木耐盐的生理指标和盐相关基因的克隆及功能鉴定[2-5]。为准确反映受盐胁迫的盐穗木组织中各基因的表达模式,通过实时荧光定量PCR技术,利用常用的看家基因β-actin作为内参基因,以不同的引物对和退火温度探讨盐穗木β-actin扩增效率的影响,进而分析对靶基因相对表达水平的影响。【前人研究进展】传统的核酸序列定量分析方法包括Southern杂交、斑点印迹、RNA酶保护分析、原位杂交等技术[6-7],实时定量PCR技术检测基因转录水平的表达状况也是当前科学研究的重要手段,是近些年发展起来的研究基因表达水平差异的重要方法。它是1996年由美国Applied Biosystems公司发明[8],该项技术的应用使得PCR技术由定性到定量的飞跃。它具有灵敏性高,特异性强、快速准确等特点,但通常它也会受到一系列因素的影响,比如内参基因的选择,引物的扩增效率等。实时定量PCR技术检测基因的表达分为绝对定量和相对定量两种方法。目前常用相对定量2-ΔΔCt法,需要引入看家基因作为参照[9]。【本研究切入点】β-actin是构成细胞骨架的主要成分肌动蛋白的一种,几乎在所有的真核细胞中表达[10],具有基因序列高度保守和mRNA表达数量高且稳定的特点,所以在很多动植物组织中开展检测基因表达的相关实验中常以β-actin作为内参基因[11]。在进行各基因的表达检测前,一般都需要先建立各基因的标准质粒和标准曲线,以便检测基因的扩增效率及对模板进行精确定量分析[12]。【拟解决的关键问题】研究不同引物对和退火温度对盐穗木内参基因β-actin扩增效率的影响,为盐穗木实时定量PCR中内参基因β-actin的引物设计和退火温度的选择具有一定的借鉴意义,为不同实验处理的盐穗木候选靶基因的表达检测提供真实而准确的数据。
1 材料与方法
1.1 材 料
1.1.1 盐穗木种子
盐穗木种子采自五家渠106团盐碱地。将种子播于花土∶蛭石∶珍珠岩(2∶1∶1)基质的花盆中,置于自然光照下,白天(25~30)℃,夜间(21±2)℃,日照时间≥15 h,在此期间用自来水进行浇灌,当幼苗长至约7~8 cm左右时提取盐穗木同化枝总RNA。
1.1.2 引物
根据已发表的植物β-actin基因的mRNA序列,利用DNAMAN软件设计,由上海生工有限公司合成2对特异性引物,扩增片段长度为分别为230与180 bp,列出引物序列。表1
表1 引物列表
Table 1 Primers sequences
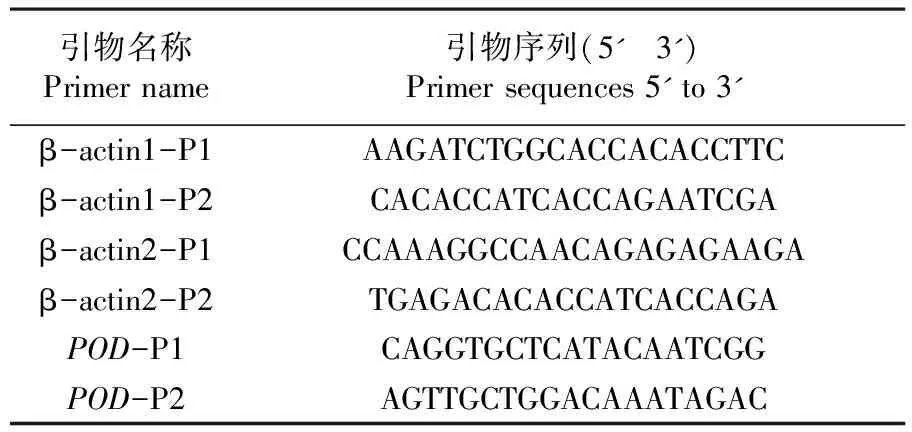
引物名称Primername引物序列(5' 3')Primersequences5'to3'β-actin1-P1AAGATCTGGCACCACACCTTCβ-actin1-P2CACACCATCACCAGAATCGAβ-actin2-P1CCAAAGGCCAACAGAGAGAAGAβ-actin2-P2TGAGACACACCATCACCAGAPOD-P1CAGGTGCTCATACAATCGGPOD-P2AGTTGCTGGACAAATAGAC
注:POD为盐响应的盐穗木过氧化物酶基因
Note:PODis the peroxidase gene responding to salinity
1.2 方 法
1.2.1 盐穗木总RNA的提取
使用天根植物总RNA提取试剂盒提取盐穗木同化枝总RNA,以其为模板,按照TaKaRa公司M-mLV第一链cDNA合成试剂盒操作说明进行cDNA第一链的合成。
1.2.2 标准质粒的构建
对已发表的植物β-actin基因的mRNA序列进行比对,设计两对引物β-actin1-P1、β-actin1-P2与β-actin2-P1、β-actin2-P2用于扩增盐穗木β-actin基因片段。预测β-actin1引物对扩增的片段长度为230 bp,β-actin2引物对扩增的片段长度为180 bp,同时也利用POD-P1和POD-P2这一对引物分别构建了盐穗木β-actin和POD基因的标准曲线。
以第一链cDNA为模板,分别用设计好的引物进行扩增,PCR扩增反应体系:20 μL体系,其中10 ×PCR Buffer 2 μL,dNTP 3.2 μL,P1和P2各0.5 μL,ExTaq酶 0.2 μL,cDNA 2 μL,最后加ddH2O 11.6 μL;反应条件:94℃预变性 5 min;94℃变性30s,56℃退火30s,72℃延伸30 s,40个循环;最后72℃延伸10 min。
将扩增出的正确条带进行切胶回收(上海生工胶回收试剂盒),回收产物与pMD18-T在16℃下进行过夜连接(大约12~16 h),其连接体系为:solution I 5 μL,回收产物4.6 μL,pMD18-T(Takara公司) 0.4 μL。
将连接产物转化到大肠杆菌DH5α,用含有1‰氨苄青霉素的LB培养基进行筛选培养12~16 h,挑取单克隆,在LB培养基中进一步培养6~8 h之后,进行菌液PCR鉴定,对于阳性克隆提取质粒后进行酶切,鉴定正确后测序。将鉴定正确的质粒进行梯度稀释(101、100、10-1、10-2、10-3、10-4、10-5和10-6),制作标准曲线时,先将样品质粒稀释到10 ng/μL,依次按10倍体积稀释。Ct值通过ABI7500荧光定量仪产生,将数据输入Excel进行计算分析。
1.3 数据统计
计算盐穗木POD基因以及不同退火温度下β-actin基因(β-actin1和β-actin2引物对)的扩增效率,基因扩增效率的计算公式:E=10-1/a-1(E为扩增曲线,a为质粒标准曲线的斜率),利用2-ΔΔCt法计算POD基因在不同β-actin引物对扩增产物做内参基因时的相对表达量。利用Excel和GraphPad Prism 5.0统计软件分析数据。
2 结果与分析
2.1 标准质粒的构建
从盐穗木中提取总RNA,其260/280比值为1.8~2.0,琼脂糖凝胶电泳显示28s rRNA条带是18s rRNA的2倍,表明总RNA质量较好(图1)。通过反转录获得第一链cDNA,以cDNA为模板,分别用β-actin1和β-actin2引物对扩增β-actin基因,其扩增产物大小分别为230 bp左右,和180 bp左右(图2)。分别将这2种扩增产物连接到克隆载体pMD18-T上,经测序获得正确的序列后,将鉴定正确的菌液二次活化,提取的质粒浓度分别为185.3 ng/μL(β-actin1的引物扩增)和237.7 ng/μL (β-actin2的引物扩增),其260/280分别为1.82以及1.86,而260/230分别为2.05及2.08,都在正常范围之内,可以后续下面实验。图1,图2
2.2 标准曲线的建立
对以上质粒进行梯度稀释。将质粒稀释到10 ng/μL的浓度,然后荧光定量PCR进行标准曲线的构建,总结不同稀释浓度下55和58℃质粒的平均Ct值,根据表2分别建立标准曲线(图3)。首先可以看到在55℃下β-actin1和β-actin2的标准曲线的R2值分别为0.997 5与0.999 4,而在58℃下两者标准曲线的R2值分别为0.995 4与0.998 6,说明标准曲线的线性相关性良好。为了提高PCR的可靠性和准确性,必须知道PCR产物特异性和PCR的动力学特性[12],扩增曲线指数扩增期和平台期均十分明显,线性范围广,从6~31个循环都能检测到,并且不论是β-actin1还是β-actin2引物对在55与58℃条件下都很平滑,说明扩增的整个PCR过程是较好的,是较为理想的扩增曲线(图4);第三,引物对β-actin1在55与58℃下的熔解温度分别为82.50、82.54℃,引物对β-actin2在55与58℃下的熔解温度同为81.74和81.34℃,在这两种温度的变化下两种引物对β-actin1与β-actin2在熔解温度上基本没有太大变化,并且没有杂峰产生,说明两对引物在两种温度条件下的扩增特异,没有引物二聚体产生(图5)。总体来说,标准曲线的线性关系良好,不存在非特异性扩增,构建的β-actin基因的标准曲线是真实可靠的。表2,图3~5

图1 盐穗木总RNA提取
Fig.1 Total RNA fromHalostachyscaspica

M.DL2000;1.β-actin1引物对扩增的β-actin;2.β-actin2引物对扩增的β-actin
M.DL2000; 1.Amplificationofβ-actinwithapairofprimersactin1; 2.Ampificationofβ-actinwithapairofprimersβ-actin2
图2 盐穗木β-actin基因扩增结果
Fig.2 PCR amplification ofHalostachyscaspicaβ-actingene
表2 不同引物对和退火温度下,以质粒为模板扩增β-actin基因的平均Ct值
Table 2 The averageCtvalues ofβ-actingene from plasmid templates amplified with the

质粒浓度Concentration(ng/μL)温度Temperature(℃)10110010-110-210-310-410-510-6引物对β-actin1apairofβ-actin15569292212741653193423352709299358848114314771842208225452925引物对β-actin2apairofβ-actin25569586111891560193523062695581002122915421968234227713150
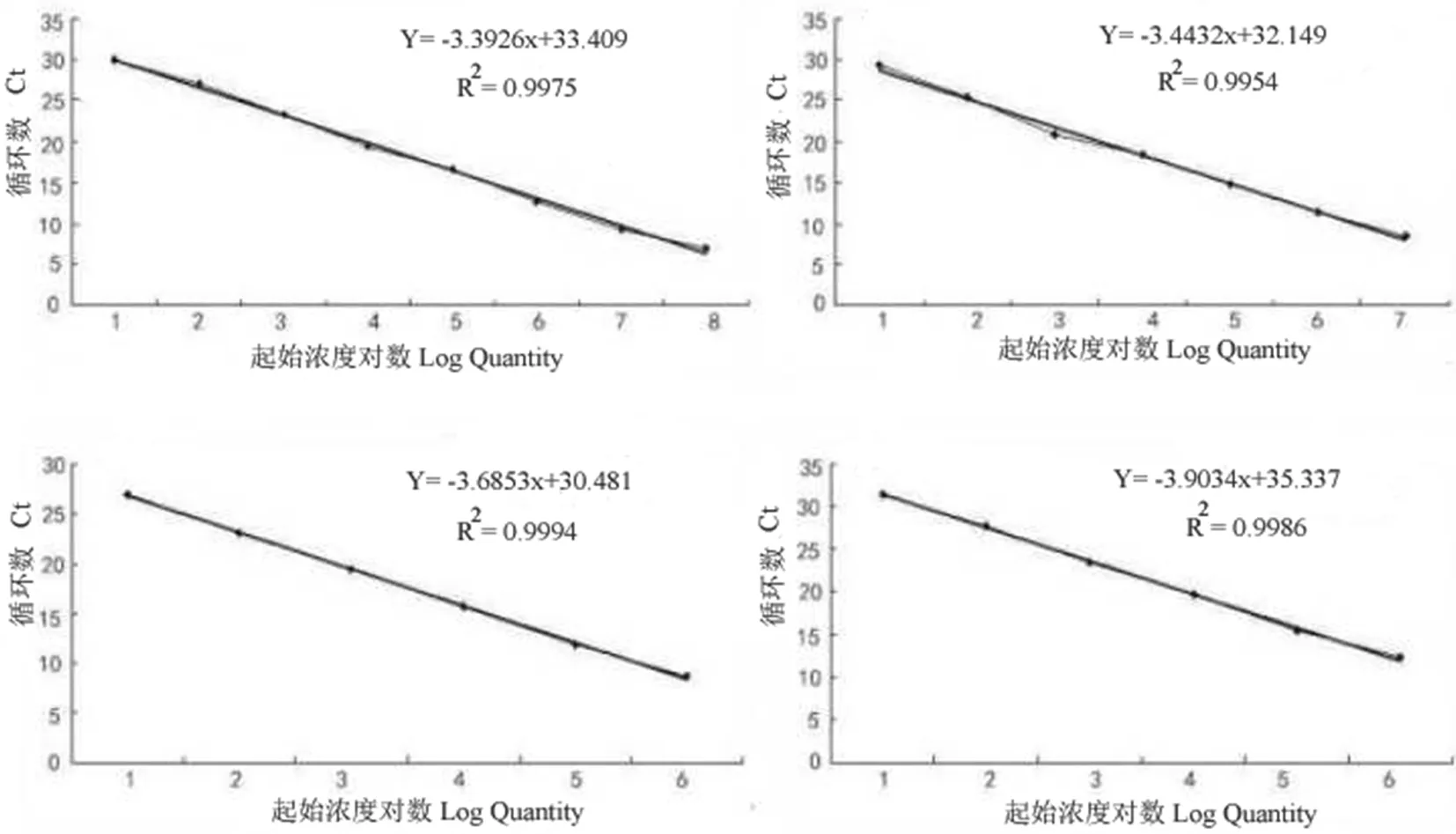
A. 55℃ β-actin1引物对扩增的β-actin基因的标准曲线; B. 58℃ β-actin1引物对扩增的β-actin基因的标准曲线; C. 55℃ β-actin2引物对扩增的β-actin的标准曲线;D. 58℃ β-actin2引物对扩增的β-actin2标准曲线
A. Standard curve ofβ-actinwith a pair of primers β-actin1 at the annealing temperature of 55 ℃; B. Standard curve ofβ-actinwith a pair of primers β-actin1 at the annealing temperature of 58 ℃; C. Standard curve ofβ-actinwith a pair of primers β-actin2 at the annealing temperature of 55 ℃; D. Standard curve ofβ-actinwith a pair of primers β-actin2 at the annealing temperature of 58 ℃
图3 在55和58℃退火温度下,两对引物β-actin1和β-actin2扩增β-actin的标准曲线
Fig.3 Standard curves ofβ-actinwith two pairs of primers β-actin1 and β-actin2 at the annealing temperature 55℃ and 58℃
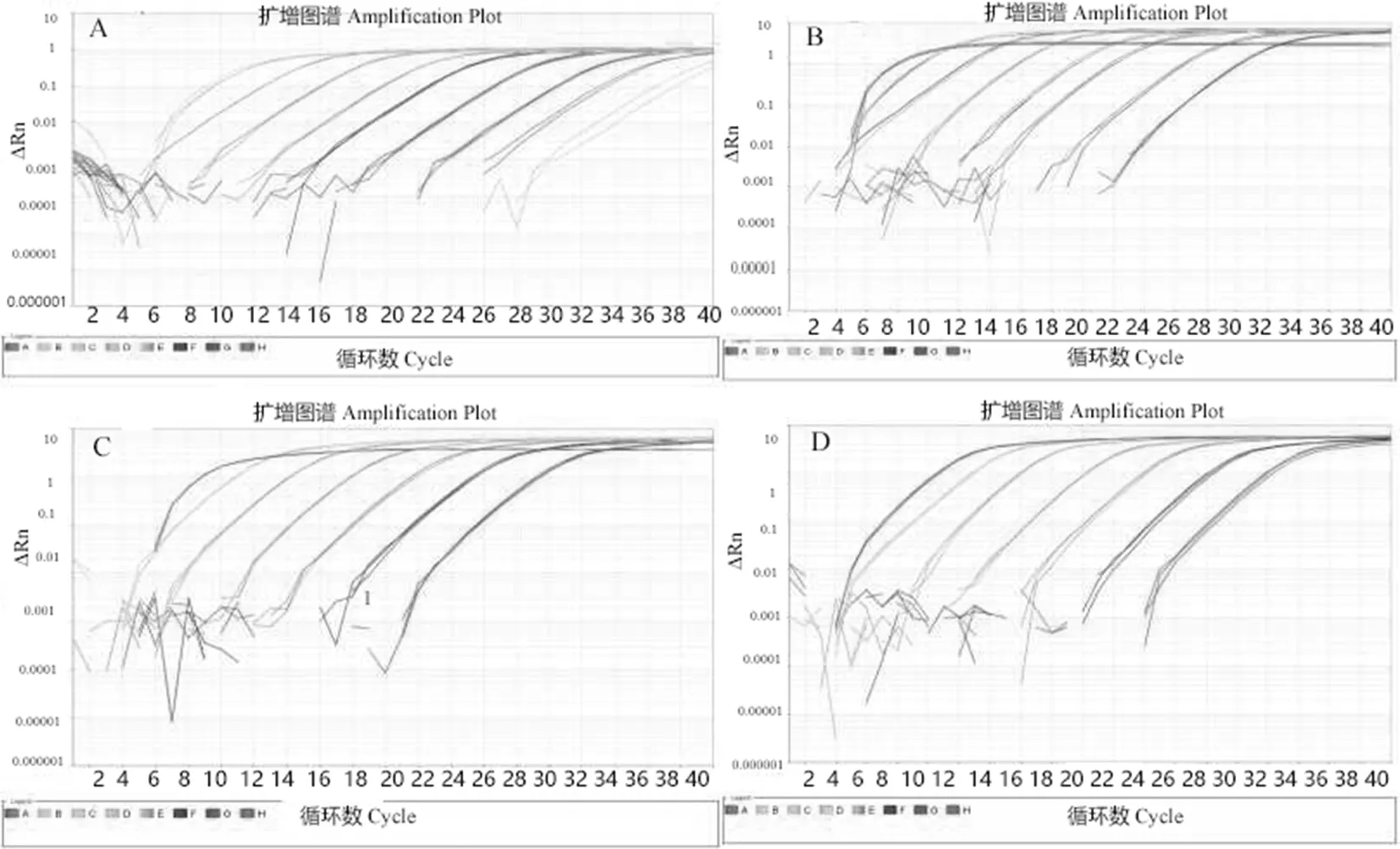
A. 55℃ β-actin1扩增β-actin的扩增曲线;B. 58℃下β-actin1扩增β-actin的扩增曲线;C. 55℃下β-actin2扩增β-actin的扩增曲线;D. 58℃ β-actin2扩增β-actin的扩增曲线
A. The amplification curve ofβ-actinwith a pair of primers β-actin1 at the annealing temperature of 55℃; B. The amplification curve ofβ-actinwith a pair of primers β-actin1 at the annealing temperature of 58℃; C. The amplification curve ofβ-actinwith a pair of primer β-actin2 at the annealing temperature of 55℃; D. The amplification curve ofβ-actinwith a pair of primers β-actin2 at the annealing temperature of 58℃
图4 在55和58℃退火温度下,2对引物β-actin1和β-actin2扩增β-actin的扩增曲线
Fig.4 The amplification curve ofβ-actinwith two pairs of primers β-actin1 and β-actin2
at the annealing temperature of 55 ℃ and 58℃

A. 55℃ β-actin1引物对扩增β-actin的熔解曲线;B. 58℃下β-actin1引物对扩增β-actin的熔解曲线;C. 55℃下β-actin2引物对扩增β-actin的熔解曲线;D. 58℃ β-actin2引物对扩增β-actin的熔解曲线
1.At 55℃, the melting curve ofβ-actinwith a pair of primers β-actin1; B. At 58℃, the melting curve ofβ-actinwith a pair of primers β-actin1; C. At 55℃, the melting curve ofβ-actinwith a pair of primers β-actin2; D. At 58℃, the melting curve ofβ-actinwith a pair of primers actin2
图5 在55和58℃退火温度下,两对引物β-actin1和β-actin2扩增β-actin的熔解曲线
Fig.5 The melting curves ofβ-actinwith two pairs of primers β-actin1 and β-actin2 under the annealing temperatures of 55℃ or 58℃
2.3 标准曲线的制作以及引物差异性比较
在同一退火温度下,β-actin1引物对在55℃的扩增效率为E=10-1/-3.392 6-1=0.972 3,58℃时为E=10-1/-3.443 2-1=0.951 7,而β-actin2 引物对在55℃的扩增效率为E=10-1/-3.685 3-1=0.867 877,58℃时为E=10-1/-3.903 4-1=0.803 794。以上的结果可以总结为两点:首先在相同的退火温度下,引物对β-actin1扩增β-actin基因的扩增效率高于引物对β-actin2的扩增;第二,同一引物对,在55℃退火温度下的扩增效率要高于58℃。总体来讲,引物对β-actin1在55℃的退火温度下对β-actin基因的扩增效率较好。表3
表3β-actin基因在不同引物对及不同退火温度条件下扩增的标准曲线公式
Table 3 Standard curves formula ofβ-actingene at different pair of primers and annealing temperatures

引物名称Primername温度Temperature(℃)公式FormulaR2扩增效率E(amplificationefficiency)引物对β-actin1apairofβ-actin155Y=-33926x+33409099750972358Y=-34432x+321490995409517引物对β-actin2apairofβ-actin255Y=-36853x+30481099940867958Y=-39034x+353370998608038
在以盐穗木为材料,实时定量PCR过程中,引物对β-actin1扩增的Ct值大概在23左右,而引物对β-actin2的Ct值往往要很高,一般在28左右,这也说明β-actin1基因扩增效率上确实要大于β-actin2的扩增效率。
同时分别以这2对引物扩增β-actin作为内参基因,检测了一个盐穗木盐响应的基因 (POD)的相对表达量,结果为是目的基因的表达呈现一定的差异。退火温度为55℃时(图6A),根据Ct值绘制的盐穗木POD基因片段的标准曲线,R2=0.986 1,表明该基因标准曲线的线性化较好,并且基因的熔解曲线单一,无杂峰,说明设计的引物是特异的,没有引物二聚体和非特异扩增。该引物的扩增效率为0.986,在接受范围之内,该引物是可用的。
400 mM NaCl处理不同时间的盐穗木同化枝过氧化物酶基因(POD)的表达情况(图6B和6C),结果为利用β-actin1引物对扩增的β-actin作为内参基因,盐处理24 h时POD基因的最大表达倍数是对照的4倍,而利用β-actin2引物对扩增的β-actin作为内参基因,相应地,虽然POD基因在24 h表现为上调趋势,但相对表达量仅是1.5倍,与对照相比,基因的表达没有显著差异。说明不同的引物对于基因的扩增效率是不同的。不论是内参基因还是目的基因,设计优化的引物对于获得准确、可靠的实时定量PCR的结果是非常重要的。图6

注:小字母表示处理间显著差异P< 0.05
Note: The letters represent significant differences among treatment,P< 0.05
图6 盐穗木POD基因的标准曲线(A)和分别以不同引物β-actin1(B)和β-actin2(C)扩增的β-actin作为内参基因检测盐胁迫处理的盐穗木同化枝POD的表达水平(小字母表示处理间显著差异P< 0.05)
Fig.6 The standard curve ofHalostachyscaspicaPODgene(A) and its relative expression from this species' assimilating branches under the treatment of 400 mM NaCl withβ-actingene as a reference gene amplified with different primers β-actin1(B) and β-actin2(C)(The letters presented significant differences among different treatments,P< 0.05)
3 讨 论
实时定量PCR是在mRNA水平对基因的表达进行监控,可以对待测样品的起始模板浓度进行绝对和相对定量,实时检测目的基因mRNA水平的表达变化,是分子诊断学、生命科学、农学以及医学中非常重要的技术[13-14]。
同时在实时定量PCR过程中很多参数都会影响实验结果的准确性,如样品初始量,RNA完整性,cDNA合成的效率,引物的设计,退火温度等等[14]。扩增效率可以衡量实时定量PCR的过程,一般90%~107%的扩增效率属于正常范围,其中扩增效率对于引物是高度依赖的[15-16]。除了引物对扩增效率有影响,低的扩增效率(<90%)还有可能是由于Taq酶的活性低,抑制剂的污染,退火温度未优化,引物设计不合理或扩增产物含二级结构等造成的;过高扩增效率(>107%)的原因一般是由于引物二聚体或非特异性扩增引起的,不过因人为操作不当,移液器不准,离心不当等而影响扩增效率的高低也是经常发生的[13]。实验中尽量保持上述条件的一致,来研究引物和退火温度对扩增效率的影响。
研究构建了不同引物对扩增的盐穗木β-actin基因和特异性引物扩增的POD基因的标准质粒,采用SYBR Green I染料法进行qRT-PCR,通过熔解曲线分析扩增产物,排除非特异扩增,不论是内参基因还是目的基因的标准曲线的线性化良好(R2>0.986),实验也明确引物和退火温度的不同,对于实时定量PCR的扩增效率存在很大影响,分别在55和58℃建立了β-actin基因的标准曲线,发现二者的扩增效率确实存在差异,高温条件的扩增效率要低于低温的扩增效率,并且虽然引物对β-actin1较高退火温度的扩增效率低于较低的温度,但是也在可接受范围之内,为以后,实时定量PCR实验中,β-actin基因引物退火温度的选择方面扩大了范围。
4 结 论
影响实时定量PCR的因素有很多,研究了引物和退火温度对基因扩增效率的影响,以盐穗木的一个内参基因β-actin为例,在设计的两对引物中,β-actin1引物对在55℃退火温度下其标准曲线的扩增效率较高。并且在相同退火温度下,分别以引物对β-actin1和β-actin2扩增作为内参基因的β-actin,检测到的盐穗木盐响应的POD基因的相对表达量具有差异性。在实时荧光定量PCR之前一定要对引物进行优化,选择合适的退火温度等,这些对于准确检测靶基因的相对和绝对表达量非常重要。
References)
[1] 王虹,齐政,张富春. 不同浓度盐胁迫下盐穗木叶片结构的比较观察 [J]. 新疆农业科学, 2016, 53(11): 2 098-2 105.
WANG Hong, QI Zheng, ZHANG Fu - chun. (2016). Leaf anatomica structure ofHalostachyscaspicaunder different concentrations of salt stress[J].XinjiangAgriculturalSciences, 53(11): 2,098-2,105. (in Chinese)
[2] 周莲洁,杨中敏,张富春,等. 新疆盐穗木GRAS转录因子基因克隆及表达分析[J]. 西北植物学报, 2013,33(6):1 091-1 097.
ZHOU Lian-jie, YANG Zhong-min, ZHANG Fu-chun, et al. (2013). Expression analysis and cloning of GRAS transcripion factor gene fromHalostachyscaspica[J].ActaBotanicaBoreali-OccidentaliaSinica, 33(6):1,091-1,097. (in Chinese)
[3] 关波,胡有贞,张富春,等. 盐穗木甜菜碱醛脱氢酶基因(BADH)的克隆及其在盐胁迫下的表达分析 [J]. 植物生理学通讯, 2010,46(1):47-50.
GUAN Bo, HU You-zhen, ZHANG Fu-chun, et al. (2010). Molecular cloning and expression analysis of betaine-aldehyde dehydrogenase gene fromHalostachyscaspica(Bieb.) C. A. Mey [J].PlantPhysiologyCommunications, 46(1):47-50. (in Chinese)
[4] 赵恩峰,李玲,曾幼玲. 盐胁迫对盐生植物盐穗木生理特性的变化分析 [J]. 新疆农业科学, 2012,49(4):716-722.
ZHAO En-feng, LI Ling, ZENG You-ling. (2012). Analysis the change of physiological characteristics ofHalophytescaspicaunder salt stress [J].XinjiangAgriculturalSciences, 49(4):716-722. (in Chinese)
[5] 地丽热巴·地里夏提,张霞,庄淑珍,张富春. 盐穗木谷胱甘肽转硫酶基因的克隆和表达分析 [J]. 新疆农业科学, 2014, 51( 2): 318-324.
Dilraba Dilxat . Dilxat, ZHANG Xia, ZHUANG Shu - zhen, ZHANG Fu - chun. (2012). Molecular cloning and expression analysis glutathione S-transsulfurase gene in halophyteHalostachyscaspica[J].XinjiangAgriculturalSciences, 51( 2): 318 -324. (in Chinese)
[6] 胡昊,李进进,王彩云. 反转录实时定量PCR在植物基因表达分析上的研究进展 [J]. 中国农学通报, 2013, 29(15):127-134.
HU Hao, LI Jin-jin, WANG Cai-yun. (2013). Research advances of real-time quantitative reverse transcription PCR in plant gene expression [J].ChineseAgriculturalScienceBulletin, 29(15):127-134. (in Chinese)
[7] Valasek, M. A., & Repa, J. J. (2005). The power of real-time pcr.AdvancesinPhysiologyEducation, 29(3):151-159.
[8] Livak, K. J., & Schmittgen, T. D. (2001). Analysis of relative gene expression data using real-time quantitative pcr and the 2(-delta delta c(t)) method.Methods, 25(4):402-408.
[9] 王玉林,史进方,蔡惠芬,等. 内参基因β-actin质粒标准品的构建 [J]. 中国组织工程研究与临床康复, 2008,12(48):9 501-9 504.
WANG Yu-lin, SHI Jin-fang, CAI Hui-fen, et al. (2008). Plasmid construction of reference gene beta-actin [J].JournalofClinicalRehabilitativeTissueEngineeringResearch, 12(48):9,501-9,504. (in Chinese)
[10] Gorski, D. H., Leal, A. D., & Goydos, J. S. (2003). Differential expression of vascular endothelial growth factor-a isoforms at different stages of melanoma progression.JournaloftheAmericanCollegeofSurgeons, 197(3):408-418.
[11] Niklitschek, M., Alcaíno, J., Barahona, S., Sepúlveda, D., Lozano, C., & Carmona, M., et al. (2008). Genomic organization of the structural genes controlling the astaxanthin biosynthesis pathway of xanthophyllomyces dendrorhous.BiologicalResearch, 41(1):93-108.
[12] 余舜武,刘鸿艳,罗利军. 利用不同实时定量PCR方法分析相对基因表达差异 [J]. 作物学报, 2007,33(7):1 214-1 218.
YU Shun-wu, LIU Hong-yan, LUO Li -jun. (2007). Analysis of relative gene expression using different real-time quantitative PCR [J].ActaAgronomicaSinica, 33(7):1,214-1,218. (in Chinese)
[13] 李天丽,郑晨华,李利君,等. 实时定量PCR构建法夫酵母内参基因β-actin、gpd、18S rRNA标准品质粒和标准曲线 [J]. 激光生物学报, 2013,22(4):379-384.
LI Tian - li, ZHENG Chen - hua, LI Li - jun, et al. (2013). Establishment of standard curves and standard plasmids for β-actin, gpd and 18S rRNA genes ofphaffiarhodozymausingreal-timePCR [J].ActaLaserBiologySinica, 22(4):379-384. (in Chinese)
[14] Andersen, C. L., Jensen, J. L., & Ørntoft, T. F. (2004). Normalization of real-time quantitative reverse transcription-pcr data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets.CancerResearch, 64(15):5,245-5,250.
[15] Johnson, G. L., Bibby, D. F., Wong, S., Agrawal, S. G., & Bustin, S. A. (2012). A miqe-compliant real-time pcr assay for aspergillus detection.PlosOne, 7(7):e40022.
[16] Bustin, S. A., Benes, V., Garson, J. A., Hellemans, J., Huggett, J., & Kubista, M., et al. (2009). The miqe guidelines: minimum information for publication of quantitative real-time pcr experiments.ClinicalChemistry, 55(4):611-622.
Supported by:the Natural Science Foundation of Xinjiang Uygur Autonomous Region "The correlation analysis of some candidate miRNAs and target genes in the halophyteHalostachyscaspicaunder high salt intensity"(2015211C274)
Effects of Different Primers and Annealing Tempearatures on the Amplification Eefficiency of Real-Time PCR Reference Gene β-actin in the HalophyteHalostachysCaspica
BAI Xue-qin, YANG Rui-rui, ZENG You-ling
(XinjiangKeyLaboratoryofBiologicalResourcesandGeneticEngineering,CollegeofLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China)
【Objective】 To study the effects of different primers and annealing temperatures on real quantitative PCR amplification efficiency of reference gene β-actin with the halophyteHalostachyscaspicaas research material.【Method】Standard curves of β-actin and peroxidase gene,POD(representative gene responding to salt stress)from this species were built with well-designed two pairs of primers named β-actin1 and β-actin2 for β-actin as internal reference gene, and a pair of primers forPODgene and amplification curves were obtained under different conditions for these genes.【Result】Results showed that the amplification efficiency of the primers β-actin1 was higher than that of the primers β-actin2 in theHalostachyscaspicabranches under the 55℃ or 58℃ annealing temperature, and amplification efficiency at 55℃ annealing temperature was higher than that at 58℃. On the other hand, it was found there were some differences in the relative expression levels ofHalostachyscaspicaPODgene using the internal reference gene β-actin with two pairs of primers β-actin1 and β-actin2 under the 55℃ annealing temperature.【Conclusion】The research indicates that primers and annealing temperatures can influence the fluorescence quantitative PCR amplification efficiency and then affect relative expression level of candidate genes at a certain extend.
Halostachyscaspica; different primers and annealing temperatures; β-actin; amplification efficiency
10.6048/j.issn.1001-4330.2017.02.019
2016-11-21
新疆维吾尔自治区自然科学基金"极端耐盐植物盐穗木高盐胁迫下一些差异表达候选的miRNA与靶向基因的相关性分析"(2015211C274)
白雪芹(1989-),女,甘肃人,硕士研究生,研究方向为植物抗逆生理和分子机制,(E-mail)1621654925@qq.com
曾幼玲(1971- ),女,四川人,副教授,研究方向为植物抗逆生理和分子机制,(E-mail)zeng_ylxju@126.com
Q786
A
1001-4330(2017)02-0352-09
