三种鸡胚绒膜尿囊膜移植瘤模型对比分析
2017-04-13费东亮岳金金马鸣潇
费东亮,胡 影,岳金金,马鸣潇
(锦州医科大学生命科学研究院, 锦州 121001)
研究报告
三种鸡胚绒膜尿囊膜移植瘤模型对比分析
费东亮,胡 影,岳金金,马鸣潇*
(锦州医科大学生命科学研究院, 锦州 121001)
目的 通过比较三种不同癌细胞株在鸡胚绒毛尿囊膜(chick chorioallantoic membrane,CAM)上的生长情况,从中筛选最佳移植癌细胞株,建立移植瘤模型并观察生物学特性。方法 分别将人肺癌A549株、舌鳞癌TCA8113株与人肝癌QGY7703株接种于7日龄鸡胚CAM上,对各自鸡胚成活率、瘤株成活、成瘤率和诱导血管生成情况等指标进行检测,并观察筛选移植瘤模型生长特性。结果 与人肺癌A549株和肝癌QGY7703株接种组相比,舌鳞癌TCA8113株接种组成瘤率最高(P< 0.05),为最佳移植癌细胞株,最佳接种癌细胞数量为8.0×106/个,接种后瘤体最佳生长周期为4 ~ 8 d,最佳实验时间为接种后第7 天。结论 筛选建立了舌鳞癌TCA-CAM移植瘤模型,为深入研究肿瘤生长生物学特性、血管生成机制、侵袭转移机制和筛选抗肿瘤药物提供了良好的实验动物模型。
鸡胚绒毛尿囊膜;移植瘤;A549细胞株;TCA8113细胞株;QGY7703细胞株
在肿瘤治疗研究中,Folkman于1972年首次提出了血管增生抑制抗肿瘤理论[1]。血管增生是毛细血管萌生新生和从已有血管中形成心血管网的过程,在肿瘤生长、侵袭、转移中起着重要的作用[2]。根据这一理论,抗肿瘤血管生成已成为抗肿瘤研究的热点之一[3]。而鸡胚绒毛尿囊膜(chick chorioallantoic membrane,CAM)在发育初期,伴随着旺盛的新生血管的产生及动静脉血管网形成,同时尚未形成完整的免疫系统,大大降低了因排异反应造成的瘤体或组织不易形成和生长,成为研究血管生成及抑制的理想体内模型[4]。自1977年Kinighon等建立CAM模型以来,因其取材方便、操作简单、便于动态观察等优点,已被广泛应用于肿瘤模型制备、血管生成及抗血管生成药物等方面的研究[5]。本研究通过选取舌鳞癌TCA8113、肺癌A549、肝癌QGY7703细胞株作为CAM移植对象,进行瘤模型对比研究,筛选得到最佳的CAM移植瘤株,建立一种模拟体内肿瘤血管新生的方法,以期为抗肿瘤药物的筛选提供良好的实验模型。
1 材料和方法
1.1 材料
1.1.1 细胞株与主要试剂
舌鳞癌TCA8113株、肺癌A549株与肝癌QGY7703细胞株由锦州医科大学生命科学研究院冻存,SPF鸡胚由辽宁益康生物制品厂提供【SCXK(辽)2011-0001】;小牛血清(Hyclone公司),DMEM 培养液(Gibco 公司),胰酶(上海生工生物工程有限公司),SZX7体视显微镜(日本奥林巴斯有限公司)。
1.1.2 细胞株培养及鸡胚孵育
将复苏冻存的人舌鳞癌TCA8113株、肺癌A549株、肝癌QGY7703株3种细胞分别置于含10 mL/L胎牛血清(FBS)的DMEM养基进行常规培养,用胰酶消化收集对数生长期的细胞备用。受精种蛋用酒精消毒后置于37℃、相对湿度60%~80%的恒温孵育箱中孵育至7日龄,气室端向上,呈45度倾斜,每天翻动3次。
1.2 方法
1.2.1 CAM的制备及癌细胞接种
参照文献[6]方法进行CAM制备。在超净工作台上用照卵灯确定气室的具体位置,75%乙醇消毒后将胚蛋置于操作蛋架上,在气室上方开直径约3 mm小孔,在用洗耳球将掉落在气室内壳膜上的蛋壳碎片吹出,开口直径约1.5 cm大小,在开窗处分离壳摸。然后,将选取的癌细胞株分别接种于鸡胚的CAM膜上相对无血管区。接种后用无菌透明胶带封闭窗口,继续孵育。
1.2.2 最佳移植瘤株的优选
取孵育良好的7日龄胚蛋45只,随机分为3组,每组15只。将培养好的3种肿瘤细胞数调整为每40 μL含6×106个,分别接种于前期处理好的鸡胚的CAM相对无血管区,用无菌胶布封闭窗口,继续孵育7~10 d,对鸡胚存活、瘤株成活、成瘤率和诱导血管生成情况进行观察,其中以肉眼见移植瘤直径 ≥ 2 mm者为成瘤阳性,计算成瘤率。同时,CAM移植瘤标本用4%多聚甲醛原位固定后,将其取出。在解剖显微镜下观察肿瘤区新生血管情况,并计算出以肿瘤组织为中心直径0.5 cm范围内呈放射状网状分布的血管数量[7]。
1.2.3 最佳接种肿瘤细胞数的确定
取生长良好的7日龄鸡胚99只,随机分为9组,其中8个细胞组和1个阴性对照组(PBS组),每组11个。用PBS缓冲溶液将肿瘤细胞调整为每20 μL分别含有1×106、2×106、4×106、6×106、8×106、1×107、1.2×107、1.4×107个。然后参照1.3中的方法,在暴露出鸡胚尿囊膜的相对无血管区接种20 μL细胞悬液,封闭后继续培养7 d,观察指标同上。
1.2.4 移植瘤生物学特性观察
将舌鳞癌TCA8113株细胞数量调整为8×106/20 μL接种于7日龄鸡胚30个后,每天取出4个,在体视显微镜下观察移植瘤生长情况并拍照(×20倍),然后用游标卡尺测量移植瘤长、短径,计算其体积[V=1/2(长径×短径2)],绘制生长曲线。取移植瘤样本,经甲醛固定、石蜡包埋、切片及HE染色后光镜下观察。
1.2.5 统计学处理
2 结果
2.1 最佳移植瘤优选试验结果
2.1.1 接种不同瘤株后鸡胚的存活和成瘤情况
3种肿瘤细胞分别以每20 μL含4×106个细胞数进行接种,7日龄的鸡胚接种后孵育8 d的CAM存活及成瘤情况见表1。接种孵育8 d后,三组鸡胚都存活良好,各组间鸡胚存活率差异不是特别明显。从成瘤鸡胚数来看,人肺癌A549株成瘤鸡胚数最少,为4枚;人肝癌QGY7703株成瘤鸡胚数为6枚;舌鳞癌TCA8113株8113株成瘤鸡胚数为7枚。从成瘤率来看,肺癌A549组成瘤率最低为30.8%,肝癌QGY7703组成瘤率为42.9%,舌鳞癌TCA8113组鸡胚成瘤率最高为53.8%,且与肝癌QGY7703组和肺癌A549组间差异显著(P< 0.05)。

表1 不同瘤株接种于CAM 后的鸡胚存活率和成瘤率情况
2.1.2 接种3种瘤株后CAM上诱导血管生成情况
将3种癌细胞按照每20 μL含4×106个细胞数分别进行接种于7日龄鸡胚,然后继续孵育8天后,3种瘤株诱导CAM血管生成情况见图1和表2。从表2可知,其中舌鳞癌TCA8113株诱导血管生成能力最强(52.83±8.17),人肺癌A549株诱导血管生成能力次之(47.88±7.52),而人肝癌QGY7703株诱导血管生成能力最弱(38.54±4.68)。TCA8113组与A549组相比,差异有显著性(P< 0.05),而与QGY7703组差异无显著性(P> 0.05)。

表2 3种不同瘤株接种于CAM后诱导血管生成数统计表(n=6)Tab.2 Statistical analysis of the number of blood vessels induced by CAM inoculated with the three types of tumor cells
2.2 最佳接种肿瘤细胞数试验结果
2.2.1 不同肿瘤细胞数接种CAM后鸡胚存活及成瘤情况
接种1×106~1.4×107个/只舌鳞癌TCA8113株细胞与存活鸡胚数和成瘤鸡胚数的关系见表3。从鸡胚存活率与接种细胞数量来看,呈负相关,当接种细胞数量大于1.0×107后,鸡胚存活率明显降低。与B组相比,E、F、G组差异有显著性(P< 0.05)。舌鳞癌TCA8113株移植瘤成瘤率与细胞接种数量呈正相关:在接种细胞数低于2.0×106时,成瘤率较低,与对照组差异无显著性(P> 0.05)。随着接种瘤细胞数的增加,成瘤率也相应增加,在接种瘤细胞数大于8.0×106时,与接种B组、组和D组差异有显著性(P< 0.05)。当接种瘤细胞数达到1.4×107时,成瘤率为100%,与A组、B组、C组和D组,差异有显著性(P< 0.05),而与E组、F组、G组差异无显著性(P< 0.05)。结合存活鸡胚数,将最佳接种细胞数确定为8.0×106个。

表3 不同细胞数的舌鳞癌TCA8113株接种于CAM 后的鸡胚存活及成瘤情况(n=11)
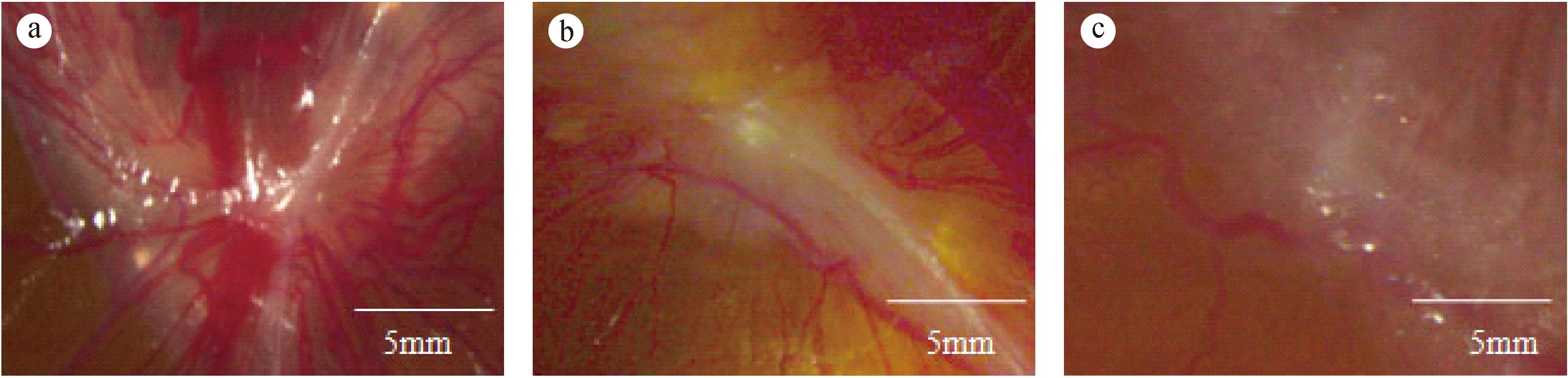
注:a:舌鳞癌TCA8113株;b:肺癌A549细胞株;c:肝癌QGY7703细胞株。图1 不同瘤株接种于CAM后的移植瘤形态图Note. a: Tongue squamous cell line TCA8113; b: Lung cancer cell line A549; c: Human liver cancer cell line QGY7703.Fig.1 Morphology of the transplanted tumors after CAM inoculation

注:a:H.E染色(×200倍);b:H.E染色(×400倍)。图3 舌鳞癌TCA-CAM移植瘤HE染色Note. a: H.E staining ×200; b: H.E staining ×400.Fig.3 Histology of the transplanted tumor induced by TCA-CAM cells
2.3 移植瘤对血管生成的诱导作用
在7日龄CAM上接种TAC细胞后,接种后第2 天出现细小的血管向瘤体方向靠近、弯曲;接种第3 天,瘤体周围血管逐渐变粗,且新生毛细血管增多,呈放射状向瘤体部位集中;接种第5 天,新生血管长入移植瘤内,且整个瘤体及其周围可见大量血管分布;对照组(PBS)接种部位血管与未接种区域血管相比无差别,均呈树枝状,血管舒展平滑。由CAM移植瘤瘤体生长曲线可知,在接种第1 ~ 3天,移植瘤生长缓慢;从第4 天开始,移植瘤生长速度迅速加快,在第7 天时候达到高峰(见图2)。
2.4 移植瘤的形态学结构
肉眼观舌鳞癌TCA8113株鸡胚移植瘤为乳白色,与鸡胚绒毛尿囊膜边界清晰,形态不太规则,新生血管长入移植瘤内。瘤组织质地坚实,切面呈灰红色(图3)。光镜下,可见鸡胚移植瘤组织瘤细胞形态和排列多样,形态不规则,细胞核大而浓染,核仁显著,细胞质少,且异型性明显,可见异常核分裂相,与人TAC组织结构相似。

图2 舌鳞癌TCA-CAM移植瘤不同时间诱导血管生成情况观察Fig.2 Angiogenesis induced by TCA-CAM transplanted tumor at different time
3 讨论
在抗肿瘤研究领域,抑制肿瘤血管生成是当今国际抗肿瘤研究的热点之一。研究表明,恶性肿瘤生长所需的营养物质主要通过新生血管来运输,在没有血管提供营养的情况下,肿瘤组织直径不会超过2 mm[8]。因此,寻找能够阻断肿瘤血管的生成的药物和方法,为抗肿瘤治疗研究提供了新的途径。鸡胚的CAM含有丰富的毛细血管丛,利于营养物质交换,可以模拟肿瘤在侵袭过程中的基底膜作用,同时鸡胚在发育初期的免疫系统尚不健全,异种排斥反应很小,有利于肿瘤的生长[9]。近年来,以鸡胚绒毛尿囊膜为研究对象建立的肿瘤移植模型已经广泛应用于新生血管生成、微循环、抗肿瘤药物研发等方面的研究[10-15]。
本研究通过将舌鳞癌TCA8113、肺癌A549与肝癌QGY7703 三种癌细胞株接种到CAM上,继续孵育7 d后,结果表明三组间鸡胚存活率和诱导CAM血管生成差异无显著性(P> 0.05),但舌鳞癌TCA8113组成瘤率最高,故选择舌鳞癌TCA8113株细胞为最佳移植瘤株。在最佳接种细胞数量上,将舌鳞癌TCA8113株细胞以1×106~1.4×106个/胚接种与7日龄鸡胚,经孵育后发现成瘤率与接种肿瘤细胞数量呈正相关,其中1.4×107个/胚的接种量成瘤率能够达到100%,但鸡胚成活率较低,同时所需细胞数量很大,增加了成批建模时细胞培养的工作量和难度,而8.0×106个/胚的细胞接种量成瘤率和存活率相对较高,也适于成批建模。因此, 8.0×106个/胚的接种细胞数量相对更加合适。在本试验中建立的模型中,发现在接种后第4 天,接种区域周围血管增粗增多,随着培养时间的延长,发现接种区域附件血管可明显的向肿瘤组织弯曲,表明接种的舌鳞癌TCA8113株肿瘤细胞有很强的诱导血管生成作用。肿瘤细胞接种鸡胚后血管生成的对数期越长,可干预的窗口越大,对抗肿瘤药物研究也更有价值,从舌鳞癌TCA8113株鸡胚肿瘤模型的血管生长曲线来看,选择接种7 d为移植瘤的最佳实验时间。
舌鳞癌TCA-CAM肿瘤模型的建立,有助于我们对肿瘤生长生物学特性、血管生成机制、侵袭转移机制和筛选抗肿瘤药物深入研究。但同时也应注意,鸡胚的各个组织器官尚未发育完全,其结构与代谢功能上,与人类肿瘤组织存在许多不同,需要研究中应该充分考虑这一客观因素。
[1] Folkman J. Anti-angiogenesis: new concept for therapy of solid tumors[J]. Ann Surg, 1972, 175(3): 409-416.
[2] Hagedorn M, Javerzat S, Gilges D, et al. Accessing key steps of human tumor progression in vivo by using an avian embryo model[J]. Proc Natl Acad Sci USA, 2005, 102(5): 1643-1648.
[3] Folkman J. Angiogenesis [J]. Annu Rev Med, 2006, 57: 1-18.
[4] 贺国安,罗进贤,张添元,等. 改进的鸡胚绒毛尿囊膜技术-无气室孵育法[J]. 中山大学学报(自然科学版),2003,42(2):126-128.
[5] Patel PH, Chaganti RS, Motzer RJ. Targeted therapy for metastatic renal cell carcinoma[J]. Br J Cancer, 2006, 94(5): 614-619.
[6] 张锦燕,黄光武. 新型肿瘤在体模型——鸡胚绒毛尿囊膜的研究进展[J]. 医学综述,2010,16(11):1639-1641.
[7] 张斌,阮喜云,陈杰,等. 人肾癌鸡胚模型的建立及其肿瘤生物学特性的研究[J]. 西安交通大学学报(医学版), 2012, 33(1):68-70.
[8] 朱雷,袁野,赵凤丽,等. 鸡胚尿囊膜移植瘤模型的优选及HepG2-CAM模型生物学特性研究[J]. 中成药, 2013, 35(12):2597-2602.
[9] 汤球,崔淑芳,蔡丽萍,等. 鸡胚宫颈癌模型的建立及其生物学特性[J]. 中国比较医学杂志, 2010, 20(10): 19-22.
[10] 王世军,孙静,张栋,等. 鸡胚尿囊膜血管生长的特点及观测方法[J]. 生物医学工程研究, 2005, 23(1): 38-40.
[11] 叶宇翔,周秦,李江超,等. 改良CAM 移植瘤模型的制备及其对肿瘤血管新生抑制药物的筛选效果[J]. 中国肿瘤生物治疗杂志, 2014, 21(2):187-191.
[12] 班立丽,李玛琳,张慧,等. 人肝癌鸡胚尿囊膜移植瘤及其血管生成模型的建立[J]. 肝胆外科杂志, 2009, 17( 3): 229-231.
[13] 张锦燕,黄光武. 新型肿瘤体内模型——鸡胚绒毛尿囊膜的研究进展[J]. 医学综述, 2010, 16(11): 1639-1640.
[14] Anderson H, Price P, Blomley M, et al. Measuring changes in human tumour vasculature in response to therapy using functional imaging techniques[J]. Br J Cancer, 2001, 85(8):1085-1093.
Contrastive Analysis of three transplanted tumor models in chick embryo chorioallantoic membrane
FEI Dong-liang, HU Ying, YUE Jin-jin, MA Ming-xiao*
(Institutes of Biological Sciences, Jinzhou Medical University, Jinzhou 121001, China)
Objective To compare the growth of three different cancer cell lines on chick chorioallantoic membrane (CAM), to select the best transplanted cancer cell line for establishing a transplanted tumor model and to observe the biological characteristics. Methods The human lung cancer cell line A549, human tongue cancer cell line TCA8113 and human liver cancer cell line QGY7703 were respectively inoculated into CAM at the 7th day of age. The chick embryo survival rate, tumor survival rate, tumor formation rate and induced angiogenesis were detected and the growth characteristics of the transplanted tumor model were observed. Results Compared with the groups inoculated with A549 cells and QGY7703 cells, the tumor formation rate of TCA8113 cells was the highest (P< 0.05), to be the best cancer cell line for transplanted tumor. The optimal inoculated number of cells was 8.0×106/chick embryo, the optimal growth period of the tumor was 4~8 d, and the best experiment time was 7 d after inoculation. Conclusion The TCA-CAM transplanted tumor model of tongue squamous cell cancer is successfully established for further study of the biological characteristics and mechanisms of tumor growth, angiogenesis, invasion and metastasis, and provide a good experimental animal model for anti-tumor drug screening.
Chick chorioallantoic membrane; Transplanted tumor; A549 cell line; TCA8113 cell line; QGY7703 cell line
辽西地区实验动物公共服务平台的推广及应用(2014408003)。
费东亮,男,副教授,硕士研究生,研究方向为分子病毒学、实验动物。E-mail:dlfei7712@126.com
马鸣潇,男,教授,博士,研究方向为实验动物、分子病毒学。E-mail:495218701@qq.com
R-33
A
1671-7856(2017) 03-0047-05
10.3969.j.issn.1671-7856. 2017.03.009
2016-07-24
