自拟葛花解酒涤脂汤对酒精性脂肪肝小鼠肝脏脂肪沉积及PXR表达的影响
2017-04-13游绍伟王硕石陆道敏
易 旭,游绍伟,龙 毅,王硕石,陆道敏
(1. 贵阳中医学院第二附属医院,中心实验室,贵阳 550003;2. 贵阳中医学院第二附属医院,消化内科,贵阳 550003)
研究报告
自拟葛花解酒涤脂汤对酒精性脂肪肝小鼠肝脏脂肪沉积及PXR表达的影响
易 旭1,游绍伟2*,龙 毅1,王硕石1,陆道敏1
(1. 贵阳中医学院第二附属医院,中心实验室,贵阳 550003;2. 贵阳中医学院第二附属医院,消化内科,贵阳 550003)
目的 了解自拟葛花解酒涤脂汤对酒精性脂肪肝(AFLD)小鼠肝脏脂肪沉积的影响,并观察其对肝组织孕烷受体(PXR)及其调控靶基因CYP3A11、CYP3A25蛋白及mRNA表达的影响。方法 将29只雄性C57BL/6J小鼠随机分为正常组(5只),模型组(8只),高剂量干预组(8只)、低剂量干预组(8只)。采用美国国立卫生研究院酒精滥用和酒精中毒研究所(NIAAA)方法制备AFLD小鼠模型,分别灌胃给予高、低剂量葛花解酒涤脂汤水煎剂干预,连续9 d。采用酶联免疫吸附法检测血清中谷丙转氨酶(ALT)及谷草转氨酶(AST)水平,组织病理学油红O染色检测肝脏脂肪沉积情况;实时荧光定量PCR及免疫组织化学方法分别检测PXR、CYP3A11、CYP3A25 mRNA及PXR蛋白的表达。结果 与模型组比较,干预组小鼠肝脏脂肪沉积显著减轻,呈剂量依赖性,具有比模型组和正常组显著增加的PXR、CYP3A25表达水平(P< 0.01);模型组小鼠血清ALT水平显著增加(P< 0.01),其余各组相似;各组CYP3A11mRNA转录水平差异无显著性(P≥ 0.05)。结论 自拟葛花解酒涤脂汤对实验小鼠AFLD具有明显的治疗作用,可能与促进PXR及其靶基因CYP3A25表达有关。
酒精性脂肪肝;葛花解酒涤脂汤;孕烷受体;CYP3A11;CYP3A25
酒精性脂肪肝(alcoholic fatty liver disease,AFLD)是由于过多的酒精摄入引起的肝细胞损伤性疾病,表现为脂肪变性与过量脂肪沉积,为目前临床常见的疾病之一,也是酒精性肝病(alcoholic liver disease,ALD)病情发展的重要因素,可逆转也可进行性发展为酒精性肝炎、肝纤维化、肝硬化,甚至肝细胞癌[1]。随着现代化生活方式的转变,酒精和/或代谢因素诱导的肝病以及相关性疾病在迅速增加,酒精滥用和依赖已成为日益严重、国际社会越来越关注的公共卫生问题。针对AFLD的治疗,目前尚无疗效确切的化学药物,并且多有肝肾功能损伤等副作用。研究发现,中医药干预酒精性肝损伤具有良好的临床疗效,对AFLD的治疗效果优于现代医药,然而基础研究也还未能阐释其内在的作用机制[2, 3]。同时,由于AFLD证型繁杂,尚未寻找到实用的、可遵循的、较统一的方药。课题组经过长期临床积累,对AFLD辩证立法、遣方用药的经验加以归纳总结,自拟出由葛花、白茯苓、绵茵陈、小青皮、粉葛、决明子、山楂、明矾、甘草等9味药组成的葛花解酒涤脂汤,葛花为君药,治疗上以解酒毒为先,拟通过制备AFLD小鼠模型及实施干预研究,探讨该方药对小鼠AFLD的影响,为临床应用奠定初步的实验室依据。孕烷X受体(PXR)被特征性地认为是异生物质或有害异物感受器,主要通过调控细胞色素酶P4503A(CYP3A)基因的表达抵御外源性物质引起的肝脏损伤[4-6]。因此,本文从PXR及其调控的CYP3A的角度探讨葛花解酒涤脂汤对实验小鼠AFLD干预作用的可能机制,现报道如下。
1 材料和方法
1.1 实验动物
SPF级雄性C57BL/6J小鼠29只,体重(21±2)g,由北京华阜康生物科技股份有限公司提供【SCXK(京)2014-0004】。饲养于贵州医科大学实验动物中心带有IVC系统的饲养房内【SYXK(黔)2015-0001】,SPF级小鼠用饲料喂养,自由饮用灭菌自来水,恒温20~23℃。
1.2 试剂
葛花解酒涤脂汤(葛花,白茯苓,绵茵陈,小青皮,粉葛,决明子,山楂,明矾,甘草,由本院药剂室提供,共计114 g,一煎加药材量的10倍水,沸腾后煎30 min,过滤,二煎加药材量的8倍水,沸腾后煎20 min,过滤,两煎所得溶液混合,相当于生药0.228 g/mL;Lieber-DeCarli酒精液体饲料及其对照液体饲料(南通特洛菲);95%药用酒精(C1526008,上海阿拉丁);ALT、AST酶联免疫吸附检测试剂盒(CSB-E16539m,CSB-E12649m,武汉华美),组织总RNA提取试剂盒(N3117,北京天根),RNA逆转录试剂盒(00238763,美国Thermo),SYBR Green Master Mix(A25742,美国Applied Biosystems),抗-PXR抗体(ab192579,英国Abcam),Envision免疫组化检测试剂盒(GK500710,上海基因),GAPDH、PXR、CYP3A11及CYP3A25上、下游引物由上海生工生物工程股份有限公司合成。
1.3 实验动物分组及处理
29只C57BL/6J小鼠适应性喂养7 d后,按数字随机表法分为正常组(5只),模型组(8只),高剂量干预组(8只),低剂量干预组(8只)。参考文献[7],采用美国国立卫生研究院酒精滥用和酒精中毒研究所(NIAAA)方法制备AFLD小鼠模型,共计16 d。第17天起,参照实验小鼠与人临床用药剂量体重换算标准,高剂量干预组与低剂量干预组小鼠分别按4.9、2.45 g/kg灌胃给予葛花解酒涤脂汤汤药,正常组、模型组给予等量灭菌自来水灌胃,每天1次,共9次,正常SPF饲料喂养及自由饮用灭菌自来水。9 d后收集小鼠血液及肝组织样本备用。
1.4 检测指标和检测方法
1.4.1 肝组织脂肪沉积镜检
肝组织样本置于4%中性甲醛内固定24~48 h后,常规石蜡包埋,制成4 μm切片,行油红O染色,光学显微镜下观察肝组织脂肪沉积情况(由贵州医科大学病理科协助完成)。
1.4.2 血清ALT、AST含量测定
小鼠血液经3000 r/min离心10~15 min后分离血清,参考试剂盒说明书采用双抗体夹心酶联免疫吸附法,经酶标仪检测并计算样品ALT、AST实际浓度(U/L)。
1.4.3 肝组织PXR、CYP3A11、CYP3A25基因转录水平
提取、纯化小鼠肝组织总RNA,以1 μg总RNA于10 μL逆转录体系中进行逆转录;cDNA产物10倍稀释后进行实时荧光定量PCR检测,程序为:50℃ 2 min(1个循环),95℃ 10 min(1个循环),95℃ 15 s,60℃ 1 min(40个循环)。目的基因Ct值经同一样本的内参基因校正后计算各组间每个基因的ΔCt,通过2-ΔCt计算组间对应基因的表达差异。GAPDH、PXR、CYP3A11及CYP3A25基因引物序列如下:
GAPDH F5’-AACTTTGGCATTGTGGAAGG,R5’-GGATGCAGGGATGATGTTCT-3’;PXR F5’-CCCATC AACGTAGAGGAGGA-3’,R5’-TCTGAAAAACCCCT TGCATC-3’;CYP3A11 F5’- AGGGAAGCATTGAGG AGGAT-3’,R5’- GGTAGAGGAGCACCAAGCTG-3’;CYP3A25 F5’- GCCTTGCTTCAAACCAGAAG-3’,R5’- CATCATAGCCCCCGAAGATA-3’。
1.4.4 肝组织PXR蛋白表达的免疫组织化学检测
参考DAKO公司EnVision免疫组化检测试剂盒说明,肝组织切片经脱蜡、水化、抗原热修复、3%H2O2灭活内源性过氧化物酶后,5%羊血清封闭20 min,滴加抗-PXR(Abcam公司,英国)4℃孵育过夜(阴性对照PBS液代替一抗),次日滴加EnVision偶联二抗,DAB显色,苏木素复染,氨水返蓝,透明,封片。显微镜下观察、计数阳性细胞百分比及着色程度,采用十三点评分法分析免疫组化结果[8](即以0-4分来判定阳性细胞的百分比:0分,没有阳性细胞;1分,阳性细胞百分比小于10%; 2分,阳性细胞百分比大于10%但小于50%;3分,阳性细胞百分比大于50%但小于80%;4分,阳性细胞百分比大于80%;染色强度按阴性、弱、中、强染色分别评为0-3分。最终的评分是两个指标的乘积)。
1.5 统计学方法
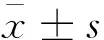
2 结果
2.1 小鼠一般情况观察
AFLD小鼠模型制备过程中,精神状态良好,毛色光滑,体重稍有减轻(变化范围在1.7±0.3 g)。葛花解酒涤脂汤汤药处理后,小鼠体重逐渐恢复并增至25.7±1.2 g,与正常组相似。整个实验过程中无一只小鼠死亡。
2.2 小鼠肝脏脂肪沉积情况
正常组小鼠肝细胞油红O染色后可见极少量脂滴沉积。模型组小鼠肝组织可见橘红色的脂滴布满镜下视野。干预组肝脏脂肪沉积较模型组显著减少,高剂量组尤其显著,橘红色的脂滴零星分布于肝组织。见图1
2.3 血清ALT、AST水平
与正常组比较,模型组小鼠ALT水平显著增加(P< 0.01),高剂量干预组及低剂量干预组ALT含量与正常组相似(P≥ 0.05)。模型组AST含量较其余各组有轻度增加,但差异无显著性(P≥ 0.05)。见表1
2.4 肝组织PXR、CYP3A11与CYP3A25 mRNA水平
与正常组和模型组比较,高、低剂量干预组均具有显著上调的肝组织PXR及CYP3A25 mRNA转录水平(P< 0.01);各组间CYP3A11mRNA转录水平相似,差异无显著性(P≥ 0.05)。见图2
2.5 肝组织PXR表达免疫组化检测
与模型组比较,正常组小鼠肝细胞内可见弱阳性PXR表达,药物干预组可见显著的PXR阳性表达,尤其高剂量干预组。见图3,表2
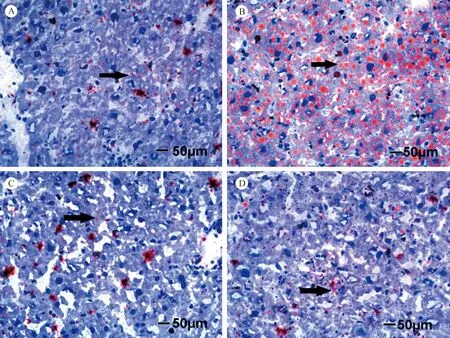
注:A:正常组;B:模型组;C:高剂量干预组;D:低剂量干预组。(下图同)箭头示肝组织内呈红色的脂滴。(Bar=50 μm)图1 各组小鼠肝组织油红O染色镜下结果Note. A: control group; B: Model group; C: High dose group; D: Low dose group. (The sama as in Fig.2)Arrows indicate the red lipid droplets in the liver tissue.Fig.1 The results of oil red staining in liver tissue of each group
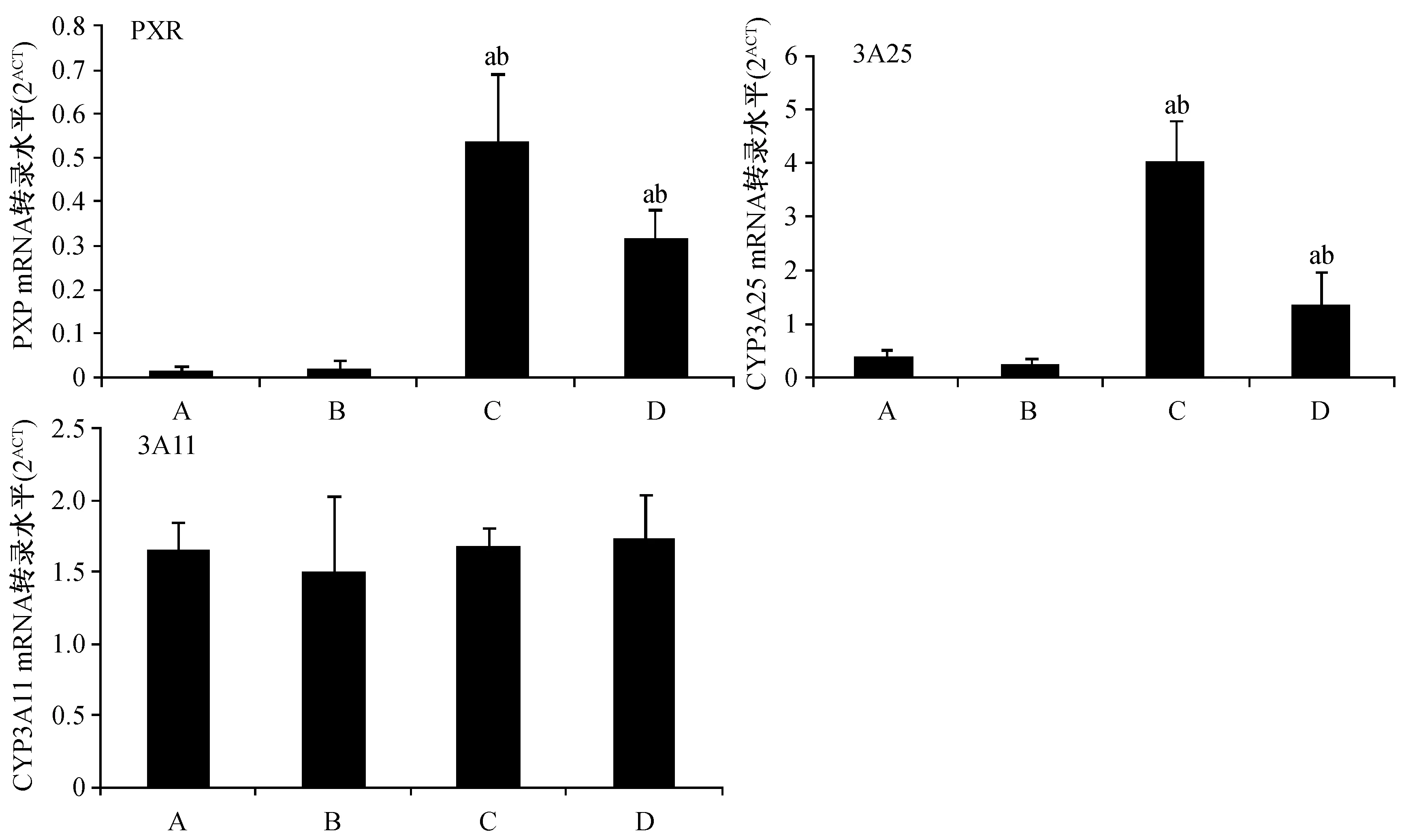
注:与正常组比较,aP < 0.01;与模型组比较,bP < 0.01。图2 各组小鼠肝脏PXR、CYP3A11及CYP3A25 基因表达的实时荧光定量PCR分析Note. compared with the control group, a P < 0.01; compared with the model group, bP < 0.01.Fig.2 Analysis the mRNA expression of PXR, CYP3A11and CYP3A25 by real-time fluorescent quantitative PCR in the liver tissues of mice in each group

注:A:正常组;B:模型组;C:高剂量干预组;D:低剂量干预组。箭头示PXR表达阳性。(Bar=50 μm)图3 各组小鼠肝脏PXR免疫组化表达情况Note. A: control group; B: Model group;C: High dose group;D: Low dose group. Allows indicate PXR expression positive. Fig.3 PXR expression through Immunohistochemistry in the liver tissues of mice in each group

表1 血清ALT、AST水平
注:与正常组比较,aP<0.01;与模型组比较,bP<0.01。
Note. Compared with the control group,aP<0.01; Compared with the model group,bP<0.01.
3 讨论
酒精性脂肪肝(AFLD)属现代医学概念,中医学并无此病名。根据AFLD的临床表现,当属中医学伤酒、酒积、症瘕、胁病、积聚等之范畴。酒性大热,其气彪悍,有毒,又为湿热之物。长期过度饮酒、嗜食肥甘,致湿热内蕴,脾失健运,肝络受损,气血不和,日久气血、湿热、脂浊相互胶结,瘀于胁下所致。本证初起多为实证,若调治不善或渐损气血,耗竭肝肾之阴,则易致肝肾阴虚,晚期多为虚实夹杂之证。针对AFLD的治疗,现代医学尚无特征性的、突出的治疗方法,主要采取戒酒、合理膳食,配以常规护肝、降酶和控制血脂,但总体疗效不理想。基于AFLD的治疗现状,我们紧密结合AFLD病因、病机,力求辩证施治,发挥中医药在AFLD治疗中的独特优势。本文以动物实验为基础,采用病理、分子生物学等方法,探讨自拟葛花解酒涤脂汤对ALFD的干预作用,期待为AFLD治疗提供有效的治疗方剂。葛花与葛根用于解酒在我国已有悠久的历史,其解酒的研究涉及到了影响酒精吸收代谢、抗氧化、保肝及保护中枢神经系统方面等多个方面[9, 10]。综合现代医学研究的结果,认为葛花适用于酒精中毒和醉酒,葛根含ALDH2 成分,可用于治疗酒精依赖和戒酒戒断症状[11],故本方以葛花为君药,以解酒中之苛毒。方中粉葛为葛花之根,作为佐药,与葛花一首一尾而施效;白茯苓作为辅君治疗由脾虚湿痰壅盛而致的各种症候群;绵茵陈辅佐葛花位居臣药,对于湿热内结所致诸证用而不疑;此方特选小青皮作为辅治肝郁气滞的臣药;决明子具有清肝明目,润肠通便、降低血清胆固醇作用,佐助君药以解目疾等症;山楂具有消食化积,活血化瘀,降压通痹之效,力佐君药建功;明矾为佐药,少量内服能祛痰燥湿,清污澄浊;甘草既是使药又是佐药,具有健脾和中,调和诸药之功效。诸药合力,共建健脾渗湿、清热解毒、疏肝解郁、消食理气、化瘀通络、和胃降浊、生津止渴、涤脂荡肪之功。本文运用此方熬制的汤药灌胃给予AFLD小鼠后,从组织病理学和血清生化结果来看,汤药处理后AFLD小鼠肝脏脂肪变性显著减轻,高剂量药物组尤其显著,甚至比正常组小鼠更少的肝细胞脂肪沉积。血清ALT、AST水平作为肝脏损伤评价参数已普遍用于临床[12],本文发现葛花解酒涤脂汤处理可使AFLD小鼠血清ALT水平恢复正常。因此,本文结果首先证实了葛花解酒涤脂汤能够呈剂量依赖性地显著改善AFLD小鼠的肝脏脂肪变性及肝功能的损伤。

表2 各组小鼠肝组织PXR免疫组化评分情况
注:与正常组比较,aP< 0.01;与模型组比较,bP< 0.01。
Note. Compared with the control group,aP< 0.01; Compared with the model group,bP< 0.01.
酒精对于肝脏的危害在于肝脏是其代谢的主要场所,长期的酒精摄入经其代谢产物乙醛的毒性作用及改变的氧化还原状态、氧化应激引起持续的肝细胞破坏以及肝脏脂质、碳水化合物、蛋白质、乳糖和尿酸代谢的改变。然而,导致这些变化的分子机制仍没有完全了解[13,14]。近年来大量的证据表明核受体(NRs)涉及酒精诱导的肝脏损伤,改变的NRs表达水平可能决定其靶基因表达水平和对酒精性肝病的敏感性。PXR属于NRs家族的非类固醇激素受体,参与机体内环境稳态重要调节,在机体适应环境中具有重要作用[5, 6]。综合国内外文献,尚未见PXR与AFLD发生相关性的报道。已知PXR定位于肝细胞质,当活化后转移到细胞核,与RXRα形成异二聚体,结合到靶基因异生物质反应元件以增强其转录。PXR调控的靶基因包括Ⅰ相、Ⅱ相药物代谢酶及一些药物转运体家族成员[5]。CYP3A11和CYP3A25是小鼠肝脏两个重要的Ⅰ相异生代谢关键酶,为PXR所调节,在药物代谢过程中起了重要作用[15]。CYP3A11的诱导在对乙酰氨基酚引起的肝毒性中起来重要的保护作用[16]。Lu Yuan-Fu等调查了安宫牛黄丸的长期使用对小鼠肝脏P450酶的影响,结果发现,肝组织中CYP3A11和CYP3A25表达的增强参与了安宫牛黄丸所含汞对小鼠肝毒性的保护作用[17]。考虑到CYP3A在药物代谢中的重要作用及其与PXR的密切相关性,设想其诱导在改善酒精引起的肝脏脂肪变性等毒性病变中具有重要的影响。从本文实时荧光定量PCR和免疫组化结果来看,模型组小鼠具有同正常组小鼠相似的PXR、CYP3A11及CYP3A25 mRNA转录水平,经葛花解酒涤脂汤处理后,PXR与CYP3A25mRNA表达水平均显著升高,一致地,PXR蛋白表达水平也显著增加;各组间CYP3A11 mRNA转录水平没有差异。结果提示肝脏PXR、CYP3A25表达水平的上调可能参与了葛花解酒涤脂汤对小鼠AFLD的改善作用,但其如何调节肝脏脂质代谢紊乱的机制需要进一步了解。
本文研究结果表明,葛花解酒涤脂汤具有显著改善实验酒精性脂肪肝小鼠肝脏脂肪沉积的作用,其作用可能与增加PXR及其调控的靶基因CYP3A25表达水平有关。本文结果为葛花解酒涤脂汤的临床应用与推广奠定了初步的实验室依据,为AFLD的治疗策略提供了新的思路。
[1] Day CP, James OF. Hepatic steatosis: innocent bystander or guilty party? [J]. Hepatology, 1998, 27: 1463-1466.
[2] 郭文平,王建华,王玉果. 酒精性脂肪肝中医药治疗进展[J]. 辽宁中医药大学学报, 2012,14(5): 257-258.
[3] 周步高. 中医药干预酒精性肝损伤的实验研究进展[J]. 时珍国医国药, 2014, 25(3): 709-711.
[4] 王宇光,张娴勰,李晗,等. 以PXR受体为靶点的中药活性成分筛选及相关药理学研究[J]. 中国中药杂志, 2015, 40(17): 3444-3449.
[5] Jia YZ, Viswakarma N, Reddy JK. Med1 subunit of the mediator complex in nuclear receptor-regulated energy metabolism, liver regeneration,and hepatocarcinogenesis[J]. Gene Expr, 2014, 16(2): 63-75.
[6] Gyamfi MA, Wan YJ. Pathogenesis of alcoholic liver disease: the role of nuclear receptors[J]. Exp Biol Med, 2010, 235: 547-560.
[7] Bertola A, Mathews S, KiSH, et al. Mouse model of chronic and binge ethanol feeding (the NIAAA model) [J]. Nat Protoc, 2013, 8(3): 627-637.
[8] Scharl A, Vierbuchen M,Conradt B, et al. Immunohistochemical detection of progesterone receptor in formalin-fixed and paraffin-embedded breast cancer tissue using a monoclonal antibody [J]. Arch Gynecol Obstet, 1990, 247:63-71.
[ 9] 张蓉蓉,吴大正. 野葛解酒机制的研究进展[J]. 上海中医药大学学报,2007, 21(2):80-83.
[10] Rezvani AH, Overstreet DH, Perfumi M, et al. Plant derivatives in the treatment of alcohol dependency[J]. Pharmacol Biochem Behav, 2003, 75(3): 593-606.
[11] 曾明,邸晓辉. 葛根及葛花对酒精代谢的研究[J]. 医药论坛杂志. 2010, 31(23): 203-206.
[12] Kaplan MM. Understanding serum enzyme tests in clinical liver disease.In: Davidson CS, ed. Problems in liver diseases[M]. New York: Stratton Intercontinental Medical Book, 1979, 79-85.
[13] Lands WE. Cellular signals in alcohol-induced liver injury: a review[J]. Alcohol Clin Exp Res, 1995, 19: 928-938.
[14] Voigt MD. Alcohol in hepatocellular cancer [J]. Clin Liver Dis, 2005, 9:151-169.
[15] Thunnllel KE, Wilkinson GR. In vitro and in vivo durg interactions involving human CYP3A [J]. Annu Rev Phannacol Toxieol, 1998, 38: 389-430.
[16] Guo GL, Moffit JS, Nicol CJ, et al. Enhanced acetaminophen toxicity by activation of the pregnane X receptor[J]. Toxicol Sci. 2004, 82: 374-380.
[17] Yuan FL, Qin W, Shi XL. Evaluation of hepatotoxicity potential of cinnabar-containing An-Gong-Niu-Huang Wan, a patent traditional Chinese medicine [J]. Regul Toxicol Pharmacol, 2011, 60: 206-211.
Effect of Gehua Jiejue Dizhi decoction on the liver fatty deposition and expression of PXR in themousealcoholic fatty liver
YI Xu1, YOU Shao-wei2*, LONG Yi1, WANG Shuo-shi1, LU Dao-min1
(1. Central Laboratory, 2. Department of Gastroenterology, the Second Hospital Affiliated to Guiyang College of Traditional Chinese Medicine, Guiyang 550003, China)
Objective To explore the effect of a herbalcompound Gehua Jiejue Dizhi Decoction (GJDD) on the liver fat deposition and the expression of PXR, and the mRNA and protein expression of its target genes CYP3A11 and CYP3A25in the liver tissues of mouse models of alcoholic fatty liver. Methods Twenty-nine healthy male C57BL/6J mice were randomly divided into control group (n=5), model group (n=8), high dose GJDD group (n=8)and low dose GJDD group (n=8). The mouse model of alcoholic fatty liver was prepared according to the National Institute on Alcohol Abuse and Alcoholism (NIAAA) method. Then, the mice were treated with the high dose and low dose GJDD for 9 days. Serum glutamic-pyruvic transaminase (AST) and aspartate aminotransferase (AST) were detected by enzyme-linked immunosorbent assay (ELISA). Liver fat deposition was detected by oil red O staining. Real-time RT-PCR and immunohistochemistry were performed to examine the expressions of PXR, CYP3A11 and CYP3A25. Results Compared with the model group, the liver fat deposition in the intervention groups was significantly reduced in a dose-dependent manner, with a significant increase of the expression of PXR and CYP3A25 (P< 0.01). The serum ALT level was significantly reduced in the model group (P< 0.01), while the transcriptional levels of CYP3A11 mRNA in the groups were similar (P≥ 0.05). Conclusions Gehua Jiejue Dizhi Decoction has obvious therapeutic effect on the AFLD in mice, which may be related to the activation of PXR and its target genes CYP3A25.
Alcoholic fatty liver; Gehua Jiejue Dizhi Decoction; PXR; CYP3A11; CYP3A25
贵州省中医药管理局中医药、民族医药科学技术课题研究 (No. Qzyy-2-14-008)。
易旭(1976-),女,研究方向:肝病的基础研究。
游绍伟 (1978-),男研究方向:消化道疾病的临床与基础研究。E-mail:yixu2013@yeah.net
R-33
A
1671-7856(2017) 03-0036-07
10.3969.j.issn.1671-7856. 2017.03.007
2016-07-15
