束缚-应激联合辣素灌胃建立大鼠腹泻型肠易激综合征模型及评价
2017-04-13方健松黄晓燕马媛萍
张 涛,方健松,黄晓燕,马媛萍, 刘 畅,潘 锋
(1. 广西中医药大学附属瑞康医院消化科,南宁 530011;2. 广西中医药大学第一附属医院消化科,南宁 530011;3. 浙江省中西医结合医院消化科,杭州 310003)
研究报告
束缚-应激联合辣素灌胃建立大鼠腹泻型肠易激综合征模型及评价
张 涛1,方健松1,黄晓燕2,马媛萍1, 刘 畅1,潘 锋3
(1. 广西中医药大学附属瑞康医院消化科,南宁 530011;2. 广西中医药大学第一附属医院消化科,南宁 530011;3. 浙江省中西医结合医院消化科,杭州 310003)
目的 基于观察大鼠症状学、组织病理学、内脏敏感性、肥大细胞活化、自噬、Beclin-1及Claudin-2等相关指标变化,评价束缚-应激联合辣素灌胃建立一种新的腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome,D-IBS)模型研究。方法 清洁级雄性SD大鼠40只,按体重分为正常组、模型I组、模型II组及模型III组,每组10只。模型组均采用束缚-夹尾应激联合辣素(I组0.125%、II组0.250%、III组0.500%)灌胃制备D-IBS模型,正常组予等剂量生理盐水灌胃处理,连续2周。分别应用Power lab仪检测大鼠腹壁收缩次数及弓背次数变化,肥大细胞染色液(醛品红-橙黄G法)检测肥大细胞活化情况,采用光镜、电镜检测大鼠结肠组织病理学及其自噬变化,应用免疫组化SABC法检测大鼠结肠黏膜Beclin-1及Claudin-2表达变化。结果 模型III组大鼠全部死亡,模型II组大鼠大便次数增多,内脏敏感性阈值降低,与正常组及模型I组比较,差异有显著性(P< 0.05);各组大鼠结肠黏膜、黏膜上皮绒毛及腺体形态正常,未见黏膜下血管扩张及弥漫性炎症浸润改变;正常组除外,模型I组、II组大鼠结肠组织黏膜间质或黏膜下层可见类圆形紫红至深紫色染色点,提示肥大细胞表达增多;模型II组大鼠结肠肠上皮细胞自噬、Beclin-1及Claudin-2表达明显增多,与正常组及模型I组相比,差异有显著性(P< 0.05)。结论 束缚-应激联合0.25%辣素灌胃建立的大鼠D-IBS模型以腹泻增多、内脏高敏感、肥大细胞表达增高、肠上皮细胞自噬增加、肠黏膜屏障破坏等表现为特点,与人IBS较为相似,该方法简单易行,值得推广应用。
腹泻型肠易激综合征;束缚-应激;辣素;内脏敏感性;自噬
肠易激综合征(irritable bowel syndrome,IBS)作为消化科常见病、多发病,约占门诊就诊患者30%以上,耗费大量医疗资源,并严重影响患者生活质量而备受重视。IBS尽管病因不明,但是研究发现食物不耐受、小肠细菌过度生长、炎症感染、精神因素及幼年不良刺激等与IBS发病密切相关,其中内脏高敏感、胃肠运动紊乱以及脑肠互动被认为是IBS的主要发病机制[1, 2]。“脑-肠-菌群轴”尤其是最近研究发现肠上皮细胞通透性增加及肠黏膜屏障破坏在IBS发病中占据重要地位[3, 4]。课题组从上述思路出发,拟通过应用辣素刺激肠道敏感性增高,导致肠道处于弱炎症状态,又加以束缚-应激精神刺激,联合多因素建立IBS模型,通过检测大鼠肠道病理生理学变化、大鼠内脏敏感性、肥大细胞活化、自噬及其相关基因Beclin-1和紧密连接蛋白Claudin-2表达等综合评估该模型。
1 材料和方法
1.1 实验动物
清洁级雄性5周龄SD大鼠40只,体重(180±20)g,购自广西医科大学实验动物中心【SCXK(桂)2014-0002】。饲养于广西中医药大学实验动物中心【SYXK(桂)2014-0011】,恒温(23±2)℃、恒湿(50±10)%、昼夜循环(12 h/12 h)条件下适应性喂养1 周后,再开始正式分组实验。大鼠组织取材于广西中医药大学实验动物中心实验设施内进行,并按实验动物使用的3R原则给予人道的关怀。
1.2 试剂与仪器
HE染色试剂,电镜固定液,液氮,购自广西博仁生物试剂公司,Beclin-1、Claudin-2一抗购自美国R&D公司(货号分别为AF5295、RDC0078),辣素(capsaicin)购自美国Sigma公司(货号MSDS 360376),醛品红-橙黄G染色液购自上海钰森生物试剂公司,自动包埋机,莱卡自动切片机(Leica RM-2265),倒置相差显微镜(德国蔡司LSM-800),H-600透射电镜(日本-Hitachi公司)、PowerLab仪(ML-780上海埃德仪器贸易公司)均由广西中医药大学实验中心提供。
1.3 方法
1.3.1 模型制备
清洁级雄性SD大鼠40只,适应性喂养1周,采用随机数字表法,按体重随机分为正常组、模型Ⅰ组、模型Ⅱ组及模型Ⅲ组,每组10只。第2周起,模型组均采用辣素灌胃联合束缚-夹尾应激制备D-IBS模型,每天上午10点分别予模型Ⅰ组0.125%辣素、Ⅱ组0.25%辣素及Ⅲ组0.50%辣素灌胃,给药体积为2 mL/100 g,灌胃后60 min予金属夹夹尾,每次30 min,连续刺激,1次/日;下午3点予宽胶带绑住前爪及后爪,每次30 min,1次/日,连续2周;正常组予等剂量生理盐水灌胃处理,连续2周。第3周末禁食不禁水12 h,在10%水合氯醛0.33 mL/100 g腹腔麻醉处死所有大鼠,截取3~5 cm的结肠组织,沿肠系膜纵轴剪开,用生理盐水冲洗干净后,分瓶存储备测。
1.3.2 指标检测
(1)IBS大鼠结肠组织病理学检测
采用HE染色法检测各组大鼠结肠组织病理学改变,具体步骤严格按说明操作,在光镜下观察标本病理学改变并摄片。
(2)IBS大鼠内脏敏感性检测
第2周末造模结束后,第3周起,参照文献报道[5],(1)采取直肠球囊扩张法(colorectal distension,CRD),观察引起大鼠腹部抬起以及背部拱起的容量阈值,评估大鼠腹部回撤反射(abdominal withdraw reflex,AWR)。(2)应用Power Lab仪检测腹壁收缩幅度,判断大鼠腹壁紧张度,综合评估内脏敏感性。
(3)IBS大鼠结肠肥大细胞活化检测
采用醛品红-橙黄G法检测结肠组织肥大细胞阳性表达,具体步骤严格按试剂盒说明操作。在普通光镜下观察结肠的病理组织学改变情况并摄片,随机选取5个400倍视野进行肥大细胞计数。
(4)IBS大鼠结肠上皮细胞自噬变化
采用H-600透射电镜检测各组大鼠结肠上皮细胞自噬变化,以及结肠黏膜组织超微结构特点,具体实验委托广州蓝吉生物技术有限公司完成。
(5)IBS大鼠结肠Beclin-1和Claudin-2表达
采用免疫组化SABC法检测各组大鼠结肠Beclin-1和Claudin-2表达变化(购自美国R&D公司,货号分别为AF5295、RDC0078),具体步骤严格按试剂盒说明操作,借助Image Pro-Plus 6.0软件分析结果,以细胞呈棕褐色染色为阳性结果,对照组采用PBS代替一抗。
1.4 统计学分析

2 结果
2.1 大鼠一般情况变化
正常组大鼠体重呈自然生长大便正常,耗食量正常;模型III组大鼠在灌胃辣素后2 d内全部死亡(死因不详),模型I组大便偏烂,模型II组大鼠腹泻较明显,肛门较污秽,毛发稀疏,耗食量下降,拱背蜷卧、萎靡少动、喜欢扎推,但体重未见明显下降。
2.2 IBS大鼠结肠组织病理学变化
光镜下可观察到各组大鼠结肠组织黏膜完整及排列正常的黏膜上皮绒毛,未见黏膜下血管扩张及弥漫性炎症浸润改变,腺体结构、排列正常。说明模型I组、II组大鼠结肠均不存在器质性病变,符合IBS模型表现(见图1)。
2.3 IBS大鼠内脏敏感性检测
2.3.1 大鼠腹部回缩反射
正常组引起大鼠腹部抬高容量阈值为(0.66±0.07) mL,背部拱起的扩张容量阈值为(1.06±0.15) mL; 模型I组腹部抬高容量阈值为(0.37±0.03) mL,背部拱起阈值为和(0.58±0.05) mL;模型II组腹部抬高容量阈值为(0.32±0.02) mL,背部拱起阈值为和(0.45±0.06) mL(见表1)。
2.3.2 大鼠腹壁紧张度
向球囊充气前,大鼠腹壁外斜肌未见肌电活动,5 min记录期间可记录到较小幅度的腹壁收缩反应,考虑与大鼠身体移动有关。在0.3 mL容量时,正常组未见明显腹壁收缩;模型I组腹壁收缩数目达(1.67±0.22)次/5 min, 差异有显著性(P< 0.05);模型Ⅱ组腹壁收缩数目达(2.67±0.24)次/ 5 min;0.6 mL扩张容量下,模型I组及II组腹壁收缩活动均显著增高正常组,收缩数目达(7.57±1.30)次/5 min(P< 0.05);1.2 mL扩张容量下各组大鼠的腹壁收缩数目差异无显著性(P> 0.05)(见表2)。
2.4 IBS大鼠结肠肥大细胞活化比较
镜下见正常组大鼠结肠组织为淡黄色,偶见紫红染色点,模型I组和模型II组大鼠结肠黏膜间质和黏膜下层可见多个类圆形紫红至深紫色染色点,尤以模型Ⅱ组较多,提示肥大细胞阳性表达增高、数目增多(见图2)。
2.5 IBS大鼠结肠肠上皮细胞自噬比较
在透射电镜下可见正常组存在数个自噬体,考虑为正常生理现象;模型组可见线粒体、内质网片段等损伤的细胞器膨胀变性,其周围出现空泡状双层膜样、胞浆物质结构完整的自噬囊泡,亦可见单层膜样含有不同程度降解的胞浆成分的降解自噬囊泡,其中模型Ⅱ组较多,并且与模型Ⅰ组有差异(见图3)。


组别Groups腹部抬高阈值/mLAbdominalelevationthreshold弓背阈值/mLCamponotusthreshold正常组controlgroup0.66±0.071.06±0.15模型Ⅰ组ModelgroupI0.37±0.03*0.58±0.05*模型Ⅱ组ModelgroupII0.32±0.02▲0.45±0.06▲
注:模型组与正常组相比,*P< 0.05;▲P< 0.05。
Note. Model group vs. the control group,*P< 0.05;▲P< 0.05.

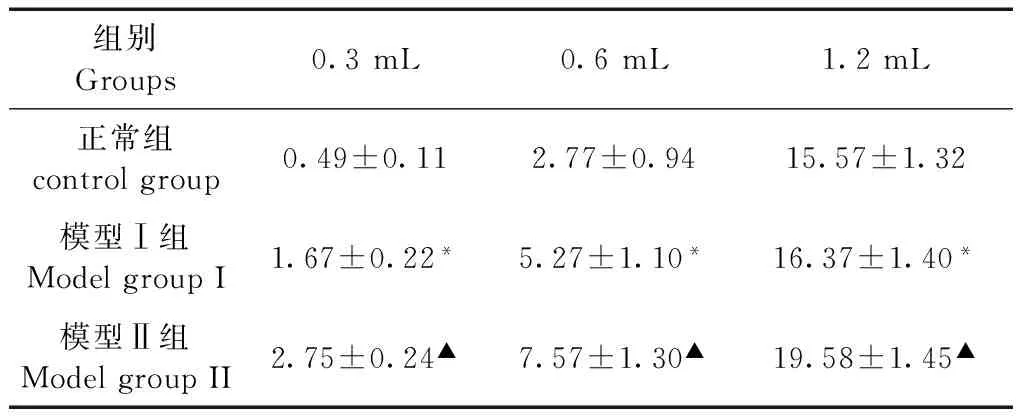
组别Groups0.3mL0.6mL1.2mL正常组controlgroup0.49±0.112.77±0.9415.57±1.32模型Ⅰ组ModelgroupI1.67±0.22*5.27±1.10*16.37±1.40*模型Ⅱ组ModelgroupII2.75±0.24▲7.57±1.30▲19.58±1.45▲
注:模型组与正常组相比,*P< 0.05;▲P< 0.05。
Note. Model group vs. the control group,*P< 0.05;▲P< 0.05.
2.6 IBS大鼠结肠Beclin-1和Claudin-2表达分布阳性比较
Beclin-1是评估自噬活化的重要指标,Claudin-2蛋白是组成紧密连接的蛋白之一,模型组Beclin-1及Claudin-2表达(棕褐色染色为阳性)均高于正常组,其中模型II组高于I组,差异有显著性(P<0.05)(见表3,图4-5)。

注:A为正常组;B为模型I组;C为模型II组。大鼠结肠组织黏膜完整及排列正常的黏膜上皮绒毛,未见黏膜下血管扩张及弥漫性炎症浸润改变。(×20, 4 μm)图1 各组大鼠结肠组织病理学变化Note. A: Normal group; B: Model group I; C: Model group II. The rat colonic mucosa is intact, intestinal villi are regularly arranged, and no submucosal vasodilation and diffuse inflammatory infiltration are observed.Fig.1 Histopathological changes of the colonic tissues in the rats in each group

注: A:正常组;B:模I组;C:模型II组。肥大细胞阳性染色阳性呈紫红色。(×20, 4 μm)图2 各组大鼠结肠肥大细胞活化Note. A: control group; B: Model group I; C: Model group II. The positive mast cells are stained purple. Fig.2 Mast cell activation in the colon tissue of rats of each group

注:A为正常组,自噬作用不明显,细胞内可见数个自噬体;B为模型I组,自噬作用不甚明显,细胞内可见多个自噬体;C为模型II组,自噬作用明显,细胞内可见大量自噬体。(×10 000,bar=500 nm)图3 各组大鼠结肠上皮细胞自噬变化Note. A: Control group. Autophagy is not obvious, several autophagosomes can be seen; B: Model group I. Autophagy is not very obvious, a number of autophagosomes can be seen; C: Model group II. Autophagy is obvious, and numerous autophagosomes can be seen in the cell. Fig.3 Changes of autophagy in the colonic epithelial cells of rats in each group

注:Beclin-1阳性染色以细胞核染呈棕褐色为主,A:正常组,黏膜层见少许棕褐色阳性染色;B:模型I组,黏膜层见较多棕褐色阳性染色,以细胞膜及细胞核为主;C:模型II组,黏膜层见较多棕褐色阳性染色,以细胞膜及细胞核为主。(×20,bar=4 μm)图4 各组大鼠结肠Beclin-1阳性表达Note. The positive expression of Beclin-1 in cell nuclei are stained brown color. A: Control group. Sparse brown spots can be seen in the mucosal layer. B: Model group I. More positive brown-staining is present in the mucosal layer, mainly, the cell membrane and nuclei. C: Model group II. Much more positive brown-stained cell membrane and the nuclei can be seen in the mucosal layer. Fig.4 Positive expression of Beclin-1 in the colon tissue of rats in each group
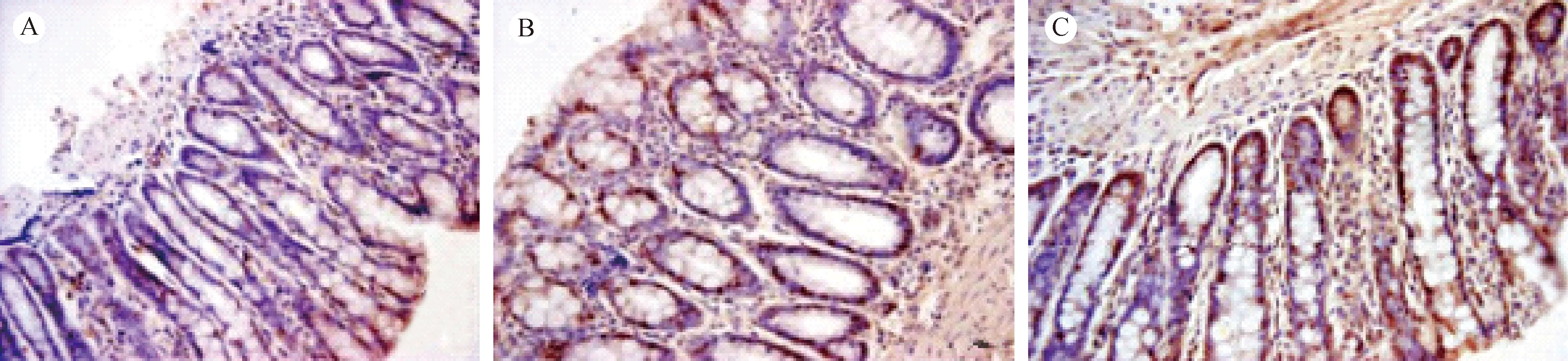
注:Claudin-2 阳性染色以细胞核染呈棕褐色为主,A:正常组黏膜层见少许棕褐色阳性染色;B:模型Ⅰ组黏膜层见较多棕褐色阳性染色,以细胞膜及细胞核为主;C:模型Ⅱ组黏膜层见较多棕褐色阳性染色,以细胞膜及细胞核为主。(×20,bar=4 μm)图5 各组大鼠结肠Claudin-2表达Note. Claudin-2 is positively stained brown in the cell nuclei. A: Control group. A few brown positive staining in the mucosal layer. B: Blank group I. More positive brown-stained cell membrane and nuclei in the colon mucosa. C: Blank group II. Much more brown positive staining to the cell membrane and the nucleus in the mucosa.Fig.5 Positive expression of Claudin-2 in the colon tissue of rats of each group

正常组Normalgroup112.41±30.25321.26±110.65模型Ⅰ组blankgroupI674.31±110.47*1042.28±140.46*模型Ⅱ组blankgroupII976.56±90.59*1135.31±167.11*
注:正常组与模型组相比,模型I组与模型II组相比,*P< 0.05。
Note. Normal group vs. the blank group, blank group I vs. the blank group II,*P<0.05.
3 讨论
IBS是由多种因素共同作用引起的功能性肠道疾病,可能和结肠收缩的增强、推进运动的加大、基础电节律的改变等有关,有文献研究证实束缚-应激可以抑制大鼠小肠的转运,但促进结肠活动,导致排便次数增加。晚近研究证实肠上皮细胞通透性增加及肠黏膜屏障破坏是IBS重要的病理生理变化。尤其是食物不耐受、过敏原刺激以及炎症感染后IBS发生与上述机理密切相关。肥大细胞广泛分布于皮肤及内脏粘膜下的微血管周围。分泌多种细胞因子,参与免疫调节(TB细胞,APC细胞活化)。表达MHC分子,B7分子,具有APC功能。表达大量的IgE Fc 受体,释放过敏介质,具有弱吞噬功能,和血液的嗜碱粒细胞同样,具有强嗜碱性颗粒的组织细胞。肥大细胞在弱炎症刺激下、食物抗原不耐受及心理应激因素作用下,可能通过大量释放5-HT,局部改变肠黏膜通透性、刺激肠道蠕动,是破坏肠黏膜屏障的关键因素,通过血脑屏障后使得大脑不断发出神经冲动指令,破坏肠道敏感性阈值,从而与腹痛、腹泻等症状相关[6]。本研究结果亦发现模型组大鼠内脏敏感性增高,伴见黏膜层及黏膜下层肥大细胞活化数目增加,说明肥大细胞活化在IBS发病中可能占据重要地位。
辣素(capsaicin,CAP)是从辣椒中提取的一种天然呈辣的香草酰胺类植物碱,小剂量辣素具有保护黏膜作用;当超过适应性保护剂量达到50 mg/kg时,则可引起传入神经纤维变性、坏死,甚至神经元细胞损伤等“去神经”作用[7]。本研究中模型I组、II组及III组分别予0.125%、0.25%、0.50% 辣素灌胃,结果模型III组大鼠全部死亡(具体死因不明,可能与辣素剂量相关,但缺乏相应证据佐证)。同时,研究发现模型I组及II组大鼠内脏敏感性增高,腹泻明显,肛门污秽,说明辣素具有刺激肠道蠕动,损伤神经元细胞作用。
肠上皮细胞是肠黏膜屏障的主体,它与细胞间紧密连接等是肠黏膜屏障功能的主要决定者。Claudin-2蛋白是组成紧密连接的蛋白之一,在肠炎的活动期表达活跃,可增加某些阳离子通过,被称为孔形成(poreforming)蛋白,亦被认为是肠炎导致腹泻的分子学机制之一[8]。当机体受到外源刺激时细胞即做出适应性反应,上调紧密连接蛋白的表达,以保护肠黏膜屏障。自噬作为机体的一种自稳机制,可以清除细胞内氧化应激产物、受损细胞器以及细菌、内毒素等物质,减少肠道过度炎症反应及肠道损伤。有研究表明[9],脓毒症大鼠肠上皮细胞自噬活性较高,早期炎症反应明显,随着病程进展自噬被抑制。Beclin-1是自噬体形成过程中的一个必需分子,依赖于Beclin1-PI3KC 3复合体,促进吞噬泡的聚集与组装,参与自噬体的形成[10]。因此,Beclin-1被认为是自噬活化的重要标志。Beclin-1也是自噬重要的调节分子,可能是调控自噬/凋亡互反馈作用的交汇点,参与调节Vps-34,促进形成Beclin1-Vps34-Vps15核心复合物,诱导自噬的发生[11,12]。若自噬受抑制,细胞内氧化应激产物、受损细胞器等物质不能够及时清除,会使细胞内环境紊乱,肠上皮细胞功能受损[13-15]。此外,研究者用伤寒沙门氏菌感染小鼠,发现自噬相关基因Atg16L1缺陷的小鼠炎症比正常小鼠严重,且出现肠道细菌易位。表明自噬参与炎症反应,可防止肠道细菌易位所致的全身感染[16,17]。本研究结果中,模型I组及II组自噬体数量及Beclin-1和Claudin-2阳性表达均比正常组增多,其中模型Ⅱ组最为明显,与各组比较差异有显著性(P< 0.05)。由此推测模型组大鼠存在肠上皮细胞自噬增加,肠黏膜通透性增加,肠黏膜屏障破坏的组织学变化,该变化与IBS-D发病相关。
[1] 寇会玲,宗立永,孙元熙. 肠易激综合征流行病学与发病机制研究新进展[J]. 医学理论与实践, 2015, 28(18): 2448-2452.
[2] Yu YB, Zuo XL, Zhao QJ, et al. Brain-derived neurotrophic factor contributes to abdominal pain in irritable bowel syndrome [J]. Gut, 2012, 61(5): 685-694.
[3] 朱孟华,史立军. 肠道菌群在肠易激综合征中的病理生理作用[J]. 胃肠病学和肝病学杂志, 2016, 25(1): 105-107.
[4] 赵迎盼,王凤云,唐旭东. 基于脑-肠互动异常的肠易激综合征发病机制的研究进展[J]. 中华医学杂志, 2015, 95(8): 637-640.
[5] 黄适,张涛,陈远能. TPRV1、TPRV2在腹泻型肠易激综合征大鼠中的表达及其与内脏敏感性的关系[J].世界华人消化杂志, 2013, 21(36): 4133-4139.
[6] 郝靖欣,段丽萍. 肠黏膜屏障功能与肠易激综合征发病关系研究进展[J]. 中华医学杂志, 2010, 30(11): 861-864.
[7] 郭峰,姜晓钟,赵云富. 辣素的作用机制及其镇痛应用[J]. 第二军医大学学报, 2002, 23(1): 96-98.
[8] 张峻,罗燕,孙权. Claudin-1和Claudin-2在大鼠急性结肠炎黏膜中的表达[J]. 中华实验外科杂志, 2011, 28(7): 1145-1147.
[9] 万晟霞,张宏泽,马爽,等. 脓毒症大鼠肠上皮细胞自噬水平的研究[J]. 肠外与肠内营养, 2014, 21(6): 368-376.
[10] 付俊,尚海旭,贾弘禔. Beclin1与自噬及肿瘤的关系[J]. 生理科学进展, 2012, 43(2): 156-158.
[11] Kang R, Zeh HJ. The Beclin 1 network regulates autophagy and apoptosis[J]. Cell Death Differ, 2011, 18(4): 571-580.
[12] Djavahenri-Mergny M, Maiuri MC, Kroemer G. Cross talk between apoptosis and autophagy by caspase-mediated cleavage of Beclin1[J]. Oncogene, 2010, 29(12): 1717-1719.
[13] 万晟霞,张宏泽,马爽,等. 脓毒症大鼠肠上皮细胞自噬水平的研究[J]. 肠外与肠内营养, 2014, 21(6): 368-376.
[14] Choi AJ, Ryter SW. Autophagy in inflammatory diseases[J]. Int J Cell Biol, 2011, 2011: 732798.
[15] Djavaheri MM, Amecoibi M, Mathieu T, et al. NF-kappa B activation represses tumor necrosis Factor-induced autophagy[J]. J Biol Chem, 2006, 281(41) : 30373-30382.
[16] Patel KK, Stappenbeck TS. Autophagy and Intestinal Homeostasis[J]. Annu Rev Physiol. 2013, 75: 241-262.
[17] Conway KL, Kuballa P, Song JH, et al. Atg 16L1 is required for autophagy in intestinal epithelial cells and protection of mice from Salmonella infection[J]. Gastroenterology, 2013, 145(6): 1347-1357.
Establishment and evaluation of a rat model of diarrhea-predominant irritable bowel syndrome by restraint-stress combined with capsaicin administration
ZHANG Tao1, FANG Jian-song1, HUANG Xiao-yan2, MA Yuan-ping1, LIU Chang1, PAN Feng3
(1.Department of Gastroenterology, Ruikang Hospital Affiliated of Guangxi University of TCM, Nanning 530011, China; 2. Department of Gastroenterology, The First Affiliated Hospital of Guangxi University of TCM, Nanning 530011; 3. Department of Gastroenterology, The Zhejiang Hospital of Integrated Chinese medicine and Western Medicine, Hangzhou 310003)
Objective Based on the observation of the changes of symptoms, histopathology, visceral sensitivity, mast cell activation, autophagy, and Beclin-1 and Claudin-2 expression in rats, we established and evaluated a new rat model of diarrhea-predominant irritable bowel syndrome (D-IBS) induced by restraint-stress combined with capsaicin (CAP) administration. Methods Forty healthy 5-week old male Sprague Dawley (SD) rats were randomly divided into normal group, model group I, model group II and model group III, with 10 rats in each group. The D-IBS model was established by restraint-stress combined with intragastric administration of CAP (2 mL/100 g body weight, 0.125% in group I, 0.250% in group II, 0.500% in group III), tail clipping and forelimb restriction for 30 minutes every day for 2 weeks. The rats in the control group were treated with saline for 2 weeks. The number of contraction of abdominal wall and arched back were measured by Power Lab instrument. The mast cell activation was detected using aldehyde-magenta-orange G staining. Light and electron microscopic examinations were performed to detect the morphology and autophagy of colonic tissues. The expressions of Beclin-1 and Claudin-2 in the colonic mucosa were detected by streptavidin-biotin complex (SABC) immunohistochemical staining. Results All rats in the model group III died during the experiment. Compared with the control group and model group I, the stool frequency was increased and the visceral sensitivity threshold decreased in the model group II, and there were statistically significant differences between the model group II and the control and model groups I (P< 0.05). The colonic mucosa, mucosal epithelium and glands in each group showed normal morphology and there was no submucosal vasodilatation and diffuse inflammatory cell infiltration. Except for the control group, round purple-reddish staining spots were observed in the rat mucosal stroma or submucosa in the model groups I and II, indicating an increased expression of mast cells. The autophagy, expressions of Beclin-1 and Claudin-2 in the colonic epithelium were significantly increased in the model group II compared with control group and model group I (P< 0.05). Conclusions The model of D-IBS induced by restraint-stress combined with capsaicin is characterized by increased diarrhea, visceral hypersensitivity, increased mast cell expression and autophagy of intestinal epithelial cells, and disruption of the intestinal mucosal barrier. This model is simple to set up and shows similar symptoms of human irritable bowel syndrome. Therefore, it is worthy of popularization and application.
Irritable bowel syndrome; Restraint stress; Capsaicin; Visceral hypersensitivity; Autophagy
国家自然科学基金(NO:81460724);广西自然科学基金(NO:2014GXNSFAA118212)。
张涛(1976- ), 男,博士后,主任医师,硕士研究生导师,从事消化系疾病中西医结合防治基础与临床研究。E-mail:327664246@qq.com
R-33
A
1671-7856(2017) 03-0001-07
10.3969.j.issn.1671-7856. 2017.03.001
2016-07-15
