施用生石灰对精养池塘浮游细菌群落结构和多样性的影响
2017-04-12玲李晓莉朱建强李谷李
陶 玲李晓莉朱建强李 谷李 荣
(1. 长江大学湿地生态与农业利用教育部工程研究中心, 荆州 434025; 2. 中国水产科学研究院长江水产研究所, 武汉 430223; 3. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070)
施用生石灰对精养池塘浮游细菌群落结构和多样性的影响
陶 玲1,2,3李晓莉2朱建强1李 谷2李 荣2
(1. 长江大学湿地生态与农业利用教育部工程研究中心, 荆州 434025; 2. 中国水产科学研究院长江水产研究所, 武汉 430223; 3. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070)
为研究施用生石灰对池塘浮游细菌群落结构和多样性的影响, 采用基于16S rRNA的高通量测序技术比较分析了施用生石灰前后精养池塘浮游细菌群落结构和多样性差异。研究结果显示, 施用生石灰进行处理1d后, 池塘优势浮游细菌在门和属水平上均与施用前相同, 但相对丰度产生变化。在门水平上, 蓝细菌门(Cyanobacteria)的相对丰度由53.80% 显著降低至47.57%, 拟杆菌门(Bacteroidetes)的相对丰度由7.00% 显著降低至5.24%, 变形菌门(Proteobacteria)的相对丰度由19.72%显著降低至17.60%, 而放线菌门(Actinobacteria)的相对丰度由6.76%显著上升至13.47%, 浮霉菌门(Planctomycetes)的相对丰度由8.24%显著上升至11.10%。另外, 在属水平上, 分枝杆菌属(Mycobacterium)的相对丰度由0.73% 显著降低至0.49%, 浮丝藻属(Planktothrix)的相对丰度由 0.041%显著降低至0.0074%。施用生石灰后池塘浮游细菌群落的物种丰富度指数(ACE和Chao 1)和Shannon多样性指数均显著提高, 且Simpon指数显著降低(P<0.05)。研究结果可为施用生石灰管理池塘水质和进行疾病预防提供理论解释, 并可为更加科学合理地利用生石灰管理池塘提供科学指导。
池塘养殖; 生石灰; 高通量测序; 浮游细菌; 水质修复
生石灰在水产养殖中通常用于清塘、水体消毒以及辅助其他药物用于防病、治病。其价格低廉, 无残留, 是养鱼的绿色环保药物之一, 在养殖池塘日常管理中得到普遍应用[1,2]。但日常消毒和疾病预防所使用的生石灰浓度对小球藻生长有较明显的抑制作用[3]。生石灰作为一种杀菌药物, 它不仅能杀灭有害的致病菌, 同时有益的细菌也可能一同被杀灭[4]。在养殖生态系统中, 细菌与养殖生物的健康生长以及养殖环境好坏关系密切, 稳定的微生物群落对维持池塘养殖系统生态平衡具有重要意义[5]。施用生石灰对养殖环境的影响应该是总和的效应。而用于水质日常管理和疾病预防用量的生石灰施用对养殖池塘浮游细菌群落结构影响的研究还未见报道。施用生石灰后池塘浮游细菌群落结构和多样性会产生怎样的变化尚不清楚。另外, 施用生石灰被公认为良好的水质管理手段, 其施用后池塘浮游细菌群落结构是否为较理想的状态, 是否可为其他池塘水质修复技术的应用效果评价提供借鉴, 这些问题都还有待研究。
传统的分子生物学方法, 如变性梯度凝胶电泳(DGGE)、末端限制性片段长度多态性分析(TRFLP)及克隆文库等方法只能检测到样品中的优势菌群, 很难检测到样品中含量较低的微生物, 无法获得样品中微生物群落结构的全面信息[6]。基于16S rRNA的高通量测序技术, 主要基于细菌16S rRNA基因在功能上的高度保守性以及对应序列不同位点的高变性, 能够真实全面地反映样品中微生物群落结构的基本特征, 检测到纯培养和其他非培养技术未能发现的低丰度微生物种类[7,8]。
本研究采用基于16S rRNA的高通量测序技术,对施用生石灰前后精养池塘浮游细菌群落结构及多样性进行全面比较分析, 以期为利用生石灰进行池塘水质修复和病害防控提供一定的理论解释, 并为池塘养殖过程中生石灰的合理使用提供科学依据。
1 材料与方法
1.1 样品采集
在湖北荆州一养殖场选择3口精养池塘开展实验。池塘面积为600 m2, 水深平均1.5 m。池塘主养草鱼, 放养规格和密度分别为100 g/尾和1200尾/ 667 m2。池塘配养鲢鳙, 鲢放养规格和密度分别为100 g/尾和120尾/667 m2, 鳙放养规格和密度分别为100 g/尾和12尾/667 m2。2015年5月22日10:00, 气温为27℃, 水温为23.5℃, 用无菌采样瓶采集3个池塘水样作为石灰消毒前样品。采完后, 对池塘施用生石灰进行疾病预防和水质调控, 施用量为20 mg/L (20 kg/667 m2)。于5月23日10:00, 气温为27℃, 水温为23.4℃, 采集3个池塘水样作为施用生石灰后样品。分别从每个池塘水样中取100 mL真空抽滤到0.22 μm的无菌纤维素滤膜上。将滤膜取出放置于10 mL的无菌离心管中, -20℃冰箱保存待用。
1.2 DNA提取与高通量测序
将滤膜剪碎, 用OMEGA公司的Water DNA Kit试剂盒按试验步骤提取浮游细菌总DNA, 并尽快送至上海美吉生物医药科技有限公司在Illumina Mi-Seq平台上进行高通量测序。
1.3 数据处理与分析
测序得到的原始数据存在一定比例的干扰数据, 为了使信息分析的结果更加准确、可靠, 首先对原始数据采用Flash软件融合双末端序列, 然后通过添加的barcode将序列拆分回归到相应样品, 并对序列进行预处理和质量控制, 去除引物序列及低质量序列, 然后进行序列分析。利用Usearch (Vsesion 7.1 http://drive5.com/uparse/)软件平台进行OTU聚类, 采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析, 并在各个水平上统计每个样品的群落组成。分别利用香农指数(Shannon)、辛普森指数(Simpson) 和物种丰富度指数(ACE和Chao 1)公式计算浮游细菌生态多样性指数。采用成组t-test检验施用生石灰前后不同分类水平上浮游细菌相对丰度差异, 以及群落多样性指数差异, 分析在SPSS 17.0软件中完成。
2 结果
2.1 门水平上浮游细菌群落组成变化
在门分类水平上, 实验期间检测到的池塘浮游细菌可分属20个类群(图 1)。其中, 蓝细菌门(Cyanobacteria)占总浮游细菌OTU数目的47.57%—53.80%, 变形菌门(Proteobacteria)占总OTU数目的17.61%—19.72%, 放线菌门(Actinobacteria)占总OTU数目的6.76%—13.47%, 浮霉菌门(Planctomycetes)占总OTU数目的8.24%—11.10%, 拟杆菌门(Bacteroidetes)占总OTU数目的5.24%—7.00%, 这5个门的浮游细菌相对丰度均>5. 0%, 且共计占了总OTU数目的95.00%—95.54%, 是池塘优势浮游细菌, 在生物降解中发挥了主要作用。其次还检测到绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、梭杆菌门(Fusobacteria)、疣微菌门(Verrucomicrobia)、芽单胞菌门(Gemmatimonadetes)、Armatimonadetes、螺旋体门(Spirochaetae)、厚壁菌门(Firmicutes)、WCHB1-60、异常球菌-栖热菌门(Deinococcus-Thermus)、Candidate_division_TM7、硝化螺菌门(Nitrospirae)和OC31。此外, 还有0.001%—0.04%的OTU分类地位尚不明确。
施用生石灰后池塘浮游细菌的优势门类没有变化, 但其相对丰度发生变化。其中, 蓝细菌门的相对丰度由53.80%显著降低至47.57%, 拟杆菌门相对丰度由7.00%显著降低至5.24%, 变形菌门相对丰度由19.72%显著降低至17.60%, 而放线菌门由6.76%显著增加至13.47%, 浮霉菌门由8.24%显著增加至11.10%。在非优势类群中, 酸杆菌门由0.28%显著增加至0.51%, Armatimonadetes由0.05% 显著增加至0.10%, 厚壁菌门由0.12% 显著增加0.29%, 硝化螺菌门由0.01%显著增加至0.02%, 芽单胞菌门由0.29% 显著降低至0.14%, 螺旋体门由0.020% 显著增加至0.037%。另外, 施用前检测到18个门类, 施用后检测到20个门类, 新增加的门类为Candidate_ division_TM7和OC31, 相对丰度分别为0.014%和0.007%。
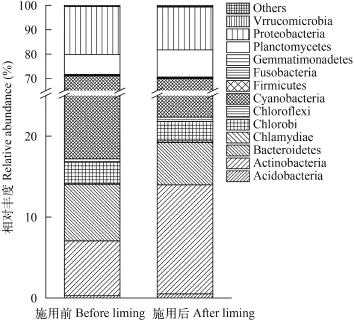
图 1 门水平上浮游细菌组成变化Fig. 1 Shifts in the proportions of dominate bacteriophankton at phylum level
2.2 属水平上浮游细菌群落组成变化
在属水平上对施用生石灰后浮游细菌优势属的变化进行统计分析(图 2)。可见, 施用生石灰前后池塘浮游细菌优势属一致, 均是聚球菌属(Synechococcus)、SubsectionI_FamilyI_unclassified、Cyanobacteria_norank、CL500_3、CL500-29_marine_group、丛毛单胞菌科未分类的新属(Comamonadaceae_unclassified)、hgcI_clade、Pirellula、腐螺旋菌科未分类的新属(Saprospiraceae_uncultured)、多核杆菌属(Polynucleobacter)、黄色单胞菌科未分类的新属(Xanthomonadales_uncultured)以及MNG7_norank, 这些属分别占总浮游细菌总OTU数目超过1%。但施用生石灰后, 各优势属相对丰度发生变化。聚球菌属的相对丰度由34.07%显著降低至29.67%, SubsectionI_FamilyI_unclassified由12.43%显著降低至9.97%, CL500-3由3.93%显著提高至7.01%, CL500-29_marine_group由2.89%显著提高至7.12%, hgcI_clade由0.90%显著提高至2.87%, Saprospiraceae_uncultured由2.27%显著降低至1.11%, MNG7_norank由1.11%显著降低至0.68% (P<0.05)。Cyanobacteria_norank、Comamonadaceae_unclassified、Pirellula、多核杆菌属、Xanthomonadales_uncultured等优势属的相对丰度变化差异不显著(P>0.05)。
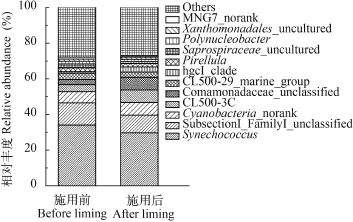
图 2 属水平上优势浮游细菌变化Fig. 2 The various proportions of dominate bacteriophankton at genus level
图 3列出了施用生石灰前后相对丰度变化大于60%的浮游细菌属。这些属的浮游细菌在施用前后的相对丰度均较低, 除了hgcI_clade均不是优势属, 但有18个属浮游细菌在施用生石灰前后相对丰度变化大于60%。
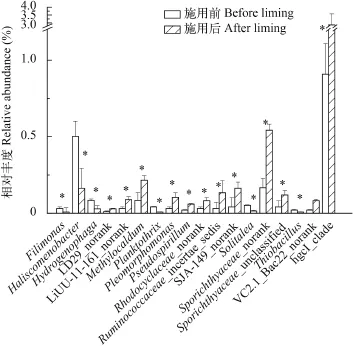
图 3 相对丰度变化幅度>60%的细菌属Fig. 3 The proportions of bacteriophankton >60% at genus level*表示施用前后差异显著(P<0.05); 下同* indicates significant difference by quicklime application (P<0.05). The same applies below
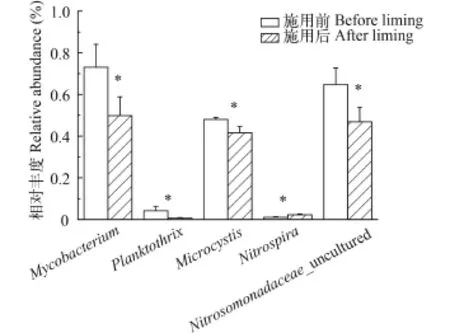
图 4 浮游细菌特定属相对丰度变化Fig. 4 The various proportions of the specilized bacteriophankton at genus level
图 4列出了潜在致病性细菌、与氮代谢相关的功能菌以及有害蓝细菌等特定浮游细菌在施用生石灰前后的相对丰度变化。可以看出, 样品中可检测到的潜在致病性细菌为分枝杆菌属(Mycobacterium), 有害蓝细菌包括浮丝藻属(Planktothrix)和微囊藻属(Microcystis)。与硝化功能相关的属包括硝化螺旋菌属(Nitrospira)和亚硝化单胞菌科(Nitrosomonadaceae_uncultured)。其中, 微囊藻和浮丝藻的相对丰度均显著降低, 分别由0.48%降低至0.42%和由0.041%降低至0.0074%。硝化螺旋菌属的相对丰度由0.010%显著上升至0.022%, 而Nitrosomonadaceae_uncultured的相对丰度由0.064%显著降低至0.047%。分支杆菌属相对丰度由0.73%显著降低至0.49%(P<0.05)。
2.3 池塘浮游细菌相似性比较
生石灰施用前后养殖池塘浮游细菌划分到相同OTU的数量为332个, 生石灰施用前独有的OTU数量为34个, 施用后独有的OTU的数量为100个。这表明生石灰施用后养殖池塘浮游细菌种类产生较大程度变化, 且施用后能检测到更多OTU。由表 1可以看出, 有37个属的浮游细菌在施用前检测不到而在施用后才检测到, 有5个属浮游细菌在施用前检测到但施用后检测不到。
2.4 池塘浮游细菌群落多样性变化
比较分析了施用生石灰后养殖池塘浮游细菌群落多样性指数变化特征(表 2)。可以看出, 施用生石灰前池塘浮游细菌的物种丰富度指数(ACE和Chao 1)、Shannon多样性指数和Simpson指数分别为409、411、3.95和0.074, 施用生石灰后分别为491、503、4.09和0.055。施用生石灰后池塘浮游细菌的物种丰富度(ACE和Chao 1)和Shannon多样性指数显著提高, 且Simpon指数显著降低(P<0.05)。
3 讨论
3.1 施用生石灰后精养池塘浮游细菌群落结构变化特征
浮游细菌是水域生态系统重要的矿化者, 同时也作为初级生产力成为部分微型浮游动物的饵料,其活跃的代谢促进了系统中的物质循环和能量流动, 维系着一个系统的正常运转。养殖池塘中的细菌群落与池塘中营养物质循环、水质状况以及养殖生物的健康状况等均具有重要的关系[9]。在本研究中检测到池塘浮游细菌优势门类为蓝细菌门, 变形菌门, 放线菌门, 浮霉菌门和拟杆菌门, 与已报道的草鱼养殖水体优势浮游细菌一致[10,11]。草鱼投饵量大, 残饵和粪便产生量多, 由此造成的过多的营养物质输入可能是造成蓝细菌门相对丰度较大的原因。草鱼养殖池塘水体中假单胞菌(Pseudomonas)和气单胞(Aeromonas)是主要的优势菌[12]。在本研究中检测到池塘水体中的优势属不尽相同,可能原因是不同养殖区域养殖池塘浮游细菌本底状况不同, 也有可能是样品采集季节及研究方法不同。

表 1 生石灰施用前后浮游细菌差异Tab. 1 The effects of quicklime on the bacteriophankton
草鱼养殖池塘添加枯草芽孢杆菌、光合细菌和复合菌等不同益生菌后, 水体中拟杆菌和放线菌增加[13]。在添加复合益生菌后, 草鱼养殖水体中厚壁菌门和变形菌门分别减少了91.21%和21.75%, 拟杆菌、放线菌和蓝细菌分别增加了288%、435%和848%[14]。在本研究中施用生石灰处理后, 池塘水中蓝细菌门、变形菌门和拟杆菌门等优势浮游细菌的相对丰度显著降低, 放线菌门和浮霉菌门相对丰度显著提高, 表明生态调控措施对池塘浮游细菌群落结构具有一定的调控作用, 且浮游细菌群落结构对不同调控措施的响应程度不一致。

表 2 浮游细菌群落多样性指数Tab. 2 The diversity index of bacterioplankon communities
pH是决定细菌群落结构的关键因子, 湖泊水体细菌群落结构和多样性随着水体pH变化而发生显著变化[15,16]。pH可以通过影响不同种类细菌的生长状况(包括绝灭、繁衍、种的形成等)直接影响多样性, 也可通过影响生态系统中的其他环境因子(如有机物质的分子结构)来间接影响水体细菌群落的结构和多样性[17]。在本研究中, 优势浮游细菌聚球菌属等相对丰度显著变化, 还有18个属浮游细菌在施用生石灰前后相对丰度变化大于60%。这可能跟施用生石灰后水体pH迅速提高有关, pH变化可能影响了对pH敏感的浮游细菌种类, 使其相对丰度产生变化。
利用生石灰作为消毒剂杀灭养殖环境中有害细菌的报道较多[18,19]。当池塘出现水质恶化、氨氮和亚硝酸盐含量偏高等情况时, 有害细菌会大量繁殖, 达到一定数量就会使鱼致病。本实验塘未检测到养殖草鱼常见的细菌病病原, 如葖光假单胞菌(Pseudomonas fluorescens)、柱状黄杆菌(Flavobacterium columnare)、温和气单胞菌(Aeromonas sobria)、嗜水气单胞菌(Aeromonas hydrophila) 以及点状气单胞菌(Aeromonas punctata)等[20]。这表明采样期间养殖池塘中具有较好的微生物环境, 也有可能是在池塘浮游菌群中所占比例很小而未被检测到。但可检测到分枝杆菌属(Mycobacterium), 其相对丰度达到0.73%。分枝杆菌病也是鱼类常见的细菌性疾病之一, 目前已经在150多种鱼类中发现了分枝杆菌病, 鱼源分枝杆菌对人类的健康也存在威胁[21,22]。因此, 本养殖池塘中威胁鱼类健康的主要有害病菌可能是分枝杆菌属。养殖过程中日常消毒和疾病预防的生石灰使用浓度一般为15—25 mg/L[3]。在本研究中20 mg/L用量的生石灰处理使分枝杆菌属相对丰度由0.73%显著降低为0.49%,降低了31.8%, 有效减少分枝杆菌属相对丰度, 起到一定的抑制作用。本研究仅检测到氮循环功能菌硝化螺菌属和亚硝化单胞菌科的相对丰度也产生显著变化。但由于与氮循环相关的功能菌的种类很多, 施用生石灰对池塘水中氮循环功能菌的影响还需要进一步试验验证。
浮丝藻和微囊藻均为蓝藻水华种类[23]。施用生石灰后浮丝藻和微囊藻的相对丰度显著降低, 浮丝藻的降低幅度达到82.2%。这与袁春营等[24]报道生石灰对微囊藻的生长促进作用结果不一致。原因可能是本研究仅分析了施用生石灰1d后浮游细菌丰度变化, 而该研究跟踪了施用后至7d的变化。施用生石灰后形成的胶体物质能凝集水中的有机质、细菌、碎屑等, 使悬浮胶状有机杂质、泥末胶结和吸附沉底。浮丝藻和微囊藻的相对丰度降低可能与藻体被胶体吸附沉淀相关, 降低了其在水中的含量。生石灰对调节藻相组成有一定作用, 新月藻、色球藻和盘星藻受石灰的影响较大[3]。进行日常消毒和疾病预防所使用的生石灰对小球藻生长产生抑制作用, 应在使用生石灰后及时对水体中小球藻的量进行补充[25]。本研究仅对原核蓝藻类的相对丰度变化进行了研究, 表明施用生石灰后蓝藻门的相对丰度降低, 且有害蓝藻浮丝藻和微囊藻生长受到一定抑制, 但施用生石灰后池塘藻相的全面变化还需要进一步研究。
3.2 施用生石灰后精养池塘浮游细菌群落多样性变化特征
多样性指数是评价微生物群落多样性的有效方法[26]。多样性指数的变化与水体环境的变化有关, 当群落结构从多样性指数较高的稳定结构向多样性指数较低的不稳定结构转变, 对应的环境变得相对脆弱, 增大养殖病害暴发的几率[27]。施用益生菌使养殖水体微生物多样性提高[28]。在本研究中施用生石灰后池塘水中浮游细菌的物种丰富度(ACE和Chao 1)和Shannon多样性指数显著提高, 且Simpson指数显著降低, 表明生石灰施用后池塘中浮游细菌的多样性和丰富度提高, 浮游细菌群落结构更加稳定。其原因可能是生石灰施用后池塘水中pH等理化指标产生变化, 为更多浮游细菌种类提供合适的生长条件, 促进了之前不能生长的浮游细菌种类生长繁殖, 从而使水中物种丰富度提高, 但具体作用和机理还有待进一步验证。另外, 生石灰施用后池塘水中分枝杆菌等致病菌受到抑制, 可能是其在细菌性疾病预防中具有较好应用效果的原因之一, 这可为池塘水质调控效果评价提供借鉴。
养殖水体中蕴藏着极其丰富、复杂的微生物种群[5]。MiSeq测序平台在微生物多样性和群落结构研究方面已获得了广大科研人员的认可, 基于细菌16S rRNA基因测序技术能够产生覆盖深度更大的数据量, 检测到养殖环境中鲜见报道的菌群[29,30]。本研究全面了解了生石灰施用前后水体浮游细菌群落结构和多样性变化, 不仅检测到优势浮游细菌相对丰度的差异, 在一些相对丰度较小的属水平上也检测到一些差异, 为我们提供了更为细微的信息。但由于此次试验仅在生石灰施用后1d采样, 今后应该连续监测生石灰施用前后浮游细菌群落和水质的变化, 及对浮游植物和浮游动物的影响, 全面了解水体各功能群体动态变化。另外, 养殖池塘水质日常管理时, 除施用生石灰还往往结合其他消毒剂使用。为科学的调控水质, 保持池塘良好的微生态环境, 还需研究生石灰配合多种消毒剂施用条件下, 以及不同气候条件和水体离子背景值下浮游细菌群落结构变化。
4 结论
(1)采用基于16S rRNA的高通量测序技术分析了生石灰施用前及施用1d后精养池塘浮游细菌群落结构和多样性差异。结果显示, 施用20 mg/L生石灰1d后, 池塘浮游细菌的物种丰富度(ACE和Chao 1)和Shannon多样性指数显著提高, 且Simpson指数显著降低(P<0.05)。这表明施用生石灰提高了池塘浮游细菌的丰富度和多样性, 浮游细菌群落结构更加稳定, 这可能也是施用生石灰改良池塘水质并对疾病预防起到一定作用的原因之一。(2)施用生石灰后池塘浮游细菌群落结构发生了变化。其中, 门水平上, 蓝细菌门的相对丰度由53.80%显著降低至47.57%, 拟杆菌门相对丰度由7.00%显著降低至5.24%, 变形菌门相对丰度由19.72%显著降低至17.60%, 放线菌门由6.76%显著上升至13.47%, 浮霉菌门由8.24%显著上升至11.10%。另外, 属水平上, 分枝杆菌属的相对丰度由0.73%显著降低为0.49%, 微囊藻属的相对丰度由0.041%显著降低至0.0074%(P<0.05)。(3)本研究在相对较高的检测分辨率下全面解析了生石灰施用前后精养池塘浮游细菌群落组成变化, 结果可为生石灰调控池塘水质和疾病预防提供可能的理论解释, 并可为池塘水质调控效果评价提供借鉴。
[1]Zhou T T, Chang G L, Wu N, et al. Effects of quicklime on the activities of digestive enzymes and immunity function in Eriocheir sinensis [J]. Journal of Huaiyin Teachers College (Natural Science Edition), 2015, 14(1): 56—59 [周彤彤, 常国亮, 吴楠, 等. 生石灰对中华绒螯蟹消化酶活性及免疫功能的影响. 淮阴师范学院学报(自然科学版), 2015, 14(1): 56—59]
[2]Boyd C, Daniels H. Liming and fertilization of brackishwater shrimp ponds [J]. Journal of Applied Aquaculture, 1994, 2(3—4): 221—234
[3]Wang X Y, Zhou J H. Studies on the effects of quicklime and bleaching powder in water bodies on the growth inhibition of chlorella [J]. Journal of Hydroecology, 2009, (2): 145—147 [王秀英, 周军辉. 水体中生石灰和漂白粉对小球藻生长抑制的研究. 水生态学杂志, 2009, (2): 145—147]
[4]Zhu Y J, Bai Y S, Chen W G. Preliminary study on the effect of quicklime on the pond water quality [J]. Freshwater Fisheries, 1998, 28(1): 27—28 [朱永久, 白遗胜,陈万光. 生石灰对池塘水质影响的初步研究. 淡水渔业, 1998, 28(1): 27—28]
[5]Zhang H. The dynamic changes of microbial communities in aquaculture environment and interactions with water environment [D]. Suzhou: Soochow University. 2015 [张皓. 养殖环境微生物群落的动态变化及与水环境的互作. 苏州: 苏州大学. 2015]
[6]van der Gast C J, Ager D, Lilley A K. Temporal scaling of bacterial taxa is influenced by both stochastic and deterministic ecological factors [J]. Environmental Microbiology, 2008, 10(6): 1411—1418
[7]Xia W W, Jia Z J. Comparative analysis of soil microbial communities by pyrosequencing and DGGE [J]. Acta Microbiologica Sinica, 2014, 54(12): 1489—1499 [夏围围,贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价. 微生物学报, 2014, 54(12): 1489—1499]
[8]Williams S T, Foster P G, Littlewood D T J. The com-plete mitochondrial genome of a turbinid vetigastropod from MiSeq Illumina sequencing of genomic DNA and steps towards a resolved gastropod phylogeny [J]. Gene, 2013, 533(1): 38—47
[9]Moriarty D J W. The role of microorganisms in aquaculture ponds [J]. Aquaculture, 1997, 151(1): 333—349
[10]Zheng Y Z. Annual dynamics of microbial diversity and several important bacteria in the grass carp culture pond [D]. Beijing: University of Chinese Academy of Sciences. 2011 [郑英珍. 主养草鱼池塘水体微生物多样性与几种重要细菌的周年动态研究. 北京: 中国科学院大学. 2011]
[11]Wu S D, Wang G T, Angert E R, et al. Composition, diversity, and origin of the bacterial community in grass carp intestine [J]. PLoS One, 2012, 7(2): e30440
[12]Zheng Z L, Wang G J, Zheng S M. Effects of chlorine dioxide on the number of heterotrophic bacteria and flora composition in grass carp (Ctenopharyngodon idellus) pond [J]. Progress in Veterinary Medicine, 2015, 36(6): 68—73 [郑宗林, 王广军, 郑曙明. 二氧化氯对草鱼池塘环境异养菌数量及区系组成的影响. 动物医学进展, 2015, 36(6): 68—73]
[13]Zhang X P, Wang Y B, Deng B, et al. Comparative analysis of microbial community from grass carp culture water supplementation with different probiotics [J]. Acta Hydrobiologica Sinica, 2014, 38(3): 459—466 [张小平, 王一冰, 邓斌, 等. 添加不同益生菌对草鱼养殖水体菌群结构的影响. 水生生物学报, 2014, 38(3): 459—466]
[14]Zheng J J, Peng L S, Zhang X P, et al. Effects of complex probiotics on water quality and microbial communities in grass carp (Ctenopharyngodon idellus) culture [J]. Journal of Fisheries of China, 2013, 37(3): 457—464 [郑佳佳, 彭丽莎, 张小平, 等. 复合益生菌对草鱼养殖水体水质和菌群结构的影响. 水产学报, 2013, 37(3): 457—464]
[15]Lindström E S, Kamst-Van Agterveld M P, Zwart G. Distribution of typical freshwater bacterial groups is associated with pH, temperature, and lake water retention time [J]. Applied and Environmental Microbiology, 2005, 71(12): 8201—8206
[16]Yannarell A C, Triplett E W. Geographic and environmental sources of variation in lake bacterial community composition [J]. Applied and Environmental Microbiology, 2005, 71(1): 227—239
[17]Langenheder S, Lindström E S, Tranvik L J. Structure and function of bacterial communities emerging from different sources under identical conditions [J]. Applied and Environmental Microbiology, 2006, 72(1): 212—220
[18]Wang Y T, Wang Y G, Zhang G B, et al. The effect of six disinfectants on the causative pathogens of skin ulcer syndrome in Apostichopus japonicas [J]. Marine Fisheries Research, 2008, 29(6): 90—94 [王友涛, 王印庚, 张国兵,等. 几种消毒剂对养殖刺参“腐皮综合征”主要致病菌杀灭试验的研究. 海洋水产研究, 2008, 29(6): 90—94]
[19]Shen Z X, Fan J D, Xu Q Z, et al. The study of the changes in physical and chemical factors and the optimum time to stock in breeding ponds after using calcium oxide [J]. Journal of Fujian Fisheries, 2012, 34(4): 284—289 [沈正雄, 樊均德, 许勤智, 等. 生石灰清塘后主要理化因子变化与鱼种适宜下塘时间的研究. 福建水产, 2012, 34(4): 284—289]
[20]Nie D S, Wang J G. Biology and Diseases of Grass Carp [M]. Beijing: Science Press. 1999, 278 [倪达书, 汪建国.草鱼生物学与疾病. 北京: 科学出版社. 1999, 278]
[21]Nigrelli R F, Vogel H. Spontaneous tuberculosis in fishes and in other cold-blooded vertebrates with special reference to Mycobacterium fortuitum Cruz from fish and human lesions [J]. Zoologica, 1963, 48(9): 131—143
[22]Zhang D F, Li A H, Gong X N. Research on the mycobacteriosis and its pathogen in sturgeons [J]. Acta Hydrobiologica Sinica, 2014, 38(3): 495—504 [张德锋, 李爱华, 龚小宁. 鲟分枝杆菌病及其病原研究. 水生生物学报, 2014, 38(3): 495—504]
[23]Zhang J Y, Zhu B C. Study on the species and the succession of cyanobacteria bloom in Taihu (Wuli Lake) [C]. Proceedings of the Annual Conference of the Chinese Society of Environmental Science. 2012, 1495—1499 [张军毅, 朱冰川. 太湖(五里湖)蓝藻水华种类及其演替规律研究 [C]. 中国环境科学学会学术年会论文集(第二卷). 2012, 1495—1499]
[24]Yuan C Y, Cui Q M, Cheng X D. The effect of copper sulface and calcium on the growth of the mycrocystis [J]. Hebei Fisheries, 2000, (5): 9—10 [袁春营, 崔青曼, 程旭东. 硫酸铜、生石灰对微囊藻生长的影响. 河北渔业, 2000, (5): 9—10]
[25]Lai Z N, Shi C B. Preliminary study on the effect of quicklime on the water ecological factors [J]. China Aquaculture, 1999, (12): 24—25 [赖子尼, 石存斌. 生石灰对水体生态因子的影响初探. 中国水产, 1999, (12): 24—25]
[26]Stam M C, Mason P R D, Pallud C, et al. Sulfate reducing activity and sulfur isotope fractionation by natural microbial communities insediments of a hypersaline soda lake (Mono Lake, California) [J]. Chemical Geology, 2010, 278(1/2): 23—30
[27]Qiu Q F, Zhang D M, Ye X S, et al. The bacterial community of coastal sediments influenced by cage culture in Xiangshan Bay, Zhejiang, China [J]. Acta Ecologica Si-nica, 2013, 33(2): 483—491 [裘琼芬, 张德民, 叶仙森,等. 象山港网箱养殖对近海沉积物细菌群落的影响. 生态学报, 2013, 33(2) : 483—491]
[28]Li Z J, Lin L, Yang Y Y, et al. Influence of bacillus on the microbial communities in shrimp ponds [J]. Journal of Agro-Environment Science, 2007, 26(3): 1183—1189 [李卓佳, 林亮, 杨莺莺, 等. 芽孢杆菌制剂对虾池环境微生物群落的影响. 农业环境科学学报, 2007, 26(3): 1183—1189]
[29]Zhao X W, Ding J, Dou Y, et al. Bacterial diversity in the breeding environment of Takifugu rubripes revealed by MiSeq sequencing [J]. Chinese Journal of Ecology, 2015, 34(10): 2965—2970 [赵晓伟, 丁君, 窦妍, 等. MiS-eq测序技术分析红鳍东方鲀养殖环境菌群多样性. 生态学杂志, 2015, 34(10): 2965—2970]
[30]Dong Y. Microbial community structure and its relationship with environmental variations in typical areas of the Yellow Sea and East China Sea [D]. Beijing: University of Chinese Academy of Sciences. 2013 [董逸. 我国黄、东海典型海域微生物群落结构及其与环境变化的关系.北京: 中国科学院大学. 2013]
EFFECTS OF QUICKLIME APPLICATION ON COMMUNITY STRUCTURE AND DIVERSITY OF BACTERIOPLANKTON IN INTENSIVE CULTURE PONDS
TAO Ling1,2,3, LI Xiao-Li2, ZHU Jian-Qiang1, LI Gu2and LI Rong2
(1. Engineering Research Center on Ecology of Wetland and Agricultural Use, Ministry of Education, Yangtze University, Jingzhou 434025, China; 2. Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China; 3. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, China)
The current study investigated the effects of quicklime on community structure and diversity of bacterioplankton in intensive culture ponds using the 16S rRNA based high-throughput sequencing technology. The dominant bacterioplankton at both the phylum and genus level did not change by quicklime, but their abundance were significantly changed. The relative abundance of Cyanobacteria, Bacteroidetes and Proteobacteria decreased significantly from 53.80% to 47.57%, 7.00% to 5.24% and 19.72% to 17.60% respectively, whereas the relative abundance of Actinobacteria and Planctomycetes increased significantly from 6.76% to 13.47% and 8.24% to 11.10% respectively. Similarly, at genus level, the relative abundance of Mycobacterium and Planktothrix decreased significantly from 0.73% to 0.49% and 0.041% to 0.0074% respectively. Quicklime application remarkably increased the species richness of bacterioplankton communities in terms of ACE and Chao 1 index as well as Shannon index and decreased the Simpon index (P<0.05). The results provide mechanisms on the water remediation and disease prevention of quicklime application and valuable insight into improved and more comprehensive management of liming in intensive culture ponds.
Pond aquaculture; Quicklime; High-throughput DNA sequencing; Bacterioplankton; Water bioremediation
Q145+.2
A
1000-3207(2017)02-0399-08
10.7541/2017.49
2016-05-04;
2016-09-29
“十二五”国家科技支撑计划(2015BAD13B03, 2012BAD25B05); 现代农业产业技术体系建设专项资金(CARS-46); 中国水产科学研究院基本科研业务费(2016ZD0702)资助 [Supported by the National Key Technology Research and Development Program of the Ministry of Science and Technology of China (2015BAD13B03, 2012BAD25B05); Earmarked Fund for Modern Agro-industry Technology Research System (CARS-46); Special Scientific Research Funds for Central Non-profit Institutes, Chinese Academy of Fishery Sciences (2016ZD0702)]
陶玲(1981—), 女, 四川什邡人; 助理研究员; 主要从事池塘生态养殖研究。E-mail: taolingcjs@yfi.ac.cn
朱建强(1963—), 男, 陕西周至人; 教授, 博士生导师; 主要从事农业水土环境方面研究。E-mail: zyjb@sina.com
