杂交鲇恶臭假单胞菌的分离鉴定及其病理损伤研究
2017-04-12段亚佼黄小丽詹瑰然樊威段靖赵一璘邓永强耿毅陈德芳汪开毓
段亚佼黄小丽詹瑰然樊 威段 靖赵一璘邓永强耿 毅陈德芳汪开毓
(1. 四川农业大学动物科技学院水产系, 成都 611130; 2. 云南省会泽县水产工作站, 曲靖 654200; 3. 四川省内江市农业科学院,内江 641000; 4. 四川省动物疫病预防控制中心, 成都 610041; 5. 四川农业大学动物医学院, 成都 611130)
杂交鲇恶臭假单胞菌的分离鉴定及其病理损伤研究
段亚佼1黄小丽1詹瑰然2樊 威3段 靖1赵一璘1邓永强4耿 毅5陈德芳1汪开毓5
(1. 四川农业大学动物科技学院水产系, 成都 611130; 2. 云南省会泽县水产工作站, 曲靖 654200; 3. 四川省内江市农业科学院,内江 641000; 4. 四川省动物疫病预防控制中心, 成都 610041; 5. 四川农业大学动物医学院, 成都 611130)
为确定一起杂交鲇皮肤溃疡症的病原, 实验从病鱼体内分离到几株优势菌(DYJ140914-DYJ140917), 根据4株分离菌的形态、生理生化特性, 结合16S rRNA和gyrB基因序列测定(GenBank登录号分别为KP693689和KP693690)与系统发育分析, 将其鉴定为恶臭假单胞菌(Pseudomonas putida)。在此基础上以腹腔注射的方式进行人工感染试验, 证实其为杂交鲇溃疡症的病原菌。病鱼组织器官具有典型的病理变化, 其主要靶器官为肝脏、皮肤肌肉以及肾间质, 分别引起多灶性坏死性肝炎、坏死性肌炎及坏死性间质性肾炎。此外, 还可引起心外膜、心内膜炎及坏死性脾炎。药敏结果显示该菌对强力霉素、诺氟沙星和左氧氟沙星等药物敏感; 对青霉素、氟苯尼考、磺胺甲基异恶唑、头孢西丁、阿奇霉素等药物耐药。
杂交鲇; 恶臭假单胞菌; 16S rRNA; gyrB; 病理损伤
恶臭假单胞菌(Pseudomonas putida)为一种革兰氏阴性、需氧短杆菌, 隶属于假单胞菌科(Pseudomonadaceae)、假单胞菌属(Pseudomonas), 是一种具有腐化作用的细菌, 常常存在于含氧的土壤及水环境中[1], 多为葡萄球菌性烫伤样皮肤综合征[2]、败血症[3]、化脓性中耳炎, 角膜巩膜炎和由食物中毒导致的痢疾样腹泻等[4]人类感染性疾病的病原体。该菌极易感染粒细胞缺乏癌患者[5,6]和新生儿[2]等免疫功能低下者, 并且还可以引起眼部及耳部感染、伤口感染等[7,8]。研究表明, 恶臭假单胞菌不仅可引起人类临床感染, 而且也可引起水生动物感染发病。可导致香鱼(Plecoglossus altivelis)、黄鳍短须石首鱼(Umbrina roncador)、(Seriola quinqueradiata)[9]、大黄鱼(Larimichthys crocea)、大鲵(Andrias davidianus)大规模死亡[10,11], 也可引起黑鲷(Sparus macrocephlus)肠胃炎[12], 欧洲鳗鲡(Anguilla anguilla)烂鳃病[13], 罗氏沼虾(Macrobra'chiumrosenbergiideman)黄鳃、黑鳃病[14], 虹鳟(Oncorhynchus mykiss)皮肤严重溃疡[15]等。
杂交鲇(Hybrid catfish)是国内近年兴起的养殖品种, 是由南方大口鲇(Silurus soldatovi meridionalis Chen, ♂)和本地鲇(Silurus asotus Linnaeus, ♀)杂交而成, 杂交优势明显[16], 既具有大口鲇父本固有的个体大、生长快、摄食力强和肉味鲜美的特点, 又具有鲇母本固有的性情较温和、同类相残力较弱、养殖成活率较高的特点[17]。因其肉质鲜美, 嫩滑少刺而备受广大消费者青睐。但随着养殖规模的不断扩大, 杂交鲇的病害问题日渐突出, 已经严重影响了杂交鲇养殖产业的健康发展[18]。
2014年9月, 四川省眉山某养殖场养殖的杂交鲇出现了以皮肤褪色、溃烂为主要特征的疾病, 发病率达到85%以上, 死亡率达70%以上。为明确该病病原, 本研究从患病杂交鲇中分离出一株高致病性病原菌, 采用常规生理生化鉴定结合病理学诊断进行初步鉴定, 对16S rRNA、gyrB基因进行测序并构建系统发育树, 对该菌做进一步鉴定, 最终确诊为恶臭假单胞菌感染, 同时检测了药物敏感性, 旨在为杂交鲇溃疡病的正确诊断以及防控提供参考。
1 材料与方法
1.1 材料
试验动物具有典型患病症状的杂交鲇15尾, 取自四川眉山杂交鲇养殖场, 体长26—30 cm,用于剖检观察、病料采集和病原菌分离; 健康杂交鲇120尾(体长20—25 cm), 取自四川农业大学水产养殖实验基地, 用于回归实验。
主要试剂脑心浸液培养基(BHI)、水解酪蛋白琼脂培养基(MH)、大豆酪蛋白琼脂培养基(TSA)、细菌生化微量鉴定管及抗生素药敏纸片均购自杭州天和微生物试剂有限公司; 细菌基因组DNA提取试剂盒(Tiangen); PCR扩增试剂盒购自上海生工生物工程技术服务有限公司。
1.2 尸检
将患病杂交鲇用MS222麻醉后剖解, 依次观察腹腔、胸腔、围心腔内各内脏器官黏膜及大体病变情况。将鳃丝、消化道内容物、体表黏液等置于载玻片上压片镜检; 同时取肾脏于洁净载玻片上制作组织触片, 风干后进行diff-quick染色, 油镜检查。
1.3 病原菌分离
取具有典型症状的病鱼, 用无菌生理盐水对病鱼的体表进行冲洗, 然后用灭菌剪刀打开腹腔, 无菌环境下从肾和脾取样, 于BHI平板上划线, 28℃培养24—48h, 观察细菌生长状况。挑取形态一致的优势菌落进一步划线纯化, 获得细菌纯培养菌株, 4℃保存备用。
1.4 分离菌生理生化鉴定
用BHI培养基, 28℃培养病原菌18—24h, 对细菌进行革兰氏染色, 在显微镜下观察; 用接种针接种到细菌生化反应微量鉴定管中, 28℃恒温培养24h, 按照《常见细菌系统鉴定手册》[19]的方法进行主要理化特性检测。
1.5 16S rRNA及gyrB基因序列测定和分析
病原菌DNA提取取对数生长期的新鲜菌液, 离心收集菌体, 使用细菌基因组DNA提取试剂盒对病原菌基因组DNA进行提取。
PCR扩增与测序及系统发育分析采用16S rRNA的通用引物[20](上游引物: 5′-AGAGTTTG ATCCTGGCTCAG-3′, 下游引物: 5′-GGCTACCT TGTTACGACTT-3′)和gyrB基因通用引物[21](上游引物: 5′-GAAGGCGGNACNCAYGAAG-3′, 下游引物: 5′-CTTCRTGNGTNCCGCCTTC-3′)(Y代表C/T, R代表A/G, N代表A、T、C或G)分别进行PCR扩增, PCR反应条件为: 94℃ 5min; 94℃ 1min, 54℃ 1min, 72℃ 2min, 30个循环; 72℃ 10min。反应结束后取5 μL PCR产物进行1%的琼脂糖凝胶电泳检测。预期扩增片段大小分别约为1500与1200 bp。PCR产物经电泳检测为预期目的条带后进行纯化,然后连接到pMD19-T载体(TaKaRa)并转化到DH5α感受态大肠杆菌中, 送北京六合华大基因科技股份有限公司测定核苷酸序列。将病原菌的16S rRNA和gryB基因序列和已知GenBank数据库中的核酸序列进行Blast比对, 同时保存同属菌株的16S rRNA及gyrB序列信息, 利用MEGA 4.1和DNA Star 5.0软件进行序列同源性分析, 并用Neighbor-Joining法构建系统进化树。
1.6 分离菌回归感染实验
将菌株接种于BHI肉汤, 28℃摇床培养24h, 用麦氏比浊管将菌液浓度调至3.4×108、3.4×107、3.4×106、3.4×105和3.4×104CFU/mL, 分别经腹腔注射健康的杂交鲇, 注射剂量0.1 mL/尾, 20尾/组。另选20尾鱼每尾注射0.1 mL 0.65%无菌生理盐水作为对照组。每天正常喂养、通气换水, 并把实验组水温控制在(20±1)℃, 详细观察鱼的临床表现并统计死亡情况, 连续观察7d。
1.7 药敏试验
采用琼脂扩散法(K-B法)测定分离菌株对11种抗菌素的药物敏感性。无菌环境下将菌接种在BHI肉汤中, 用麦氏比浊管调菌液浓度至1.5×108CFU/ m,然后将稀释后的菌液涂布于BHI平板上, 贴上药敏纸片, 28℃培养24h后, 测定抑菌圈直径并判定结果, 敏感度根据杭州天和微生物试剂有限公司提供的标准进行判定。
1.8 组织病理损伤观察
取患病症状明显杂交鲇的皮肤肌肉、脑、心脏、鳃、肾、肝、脾、胃肠道等内脏器官组织, 用10%的中性缓冲福尔马林固定液固定, 酒精梯度脱水,二甲苯透明, 石蜡包埋、切片, 苏木精-伊红(HE)染色, 中性树脂胶封片后, 显微镜观察、拍照。
2 结果
2.1 尸检
患病杂交鲇鱼体体表大面积多处褪色, 出现典型溃疡灶; 眼睛周围皮肤出血褪色, 严重溃疡(图1A); 鱼体背部皮肤发白严重, 大面积深度溃烂(图1B); 尾部出现溃疡灶, 尾鳍溃烂(图 1C); 剖解后观察到肝脏肿大, 边缘光滑, 质硬; 脾脏边缘钝圆, 肿大。肾脏组织触片diff-quick染色可见细胞间隙中存在多量杆状细菌, 未观察到寄生虫(图 1D)。

图 1 杂交鲇感染恶臭假单胞菌的主要剖解症状及肾脏触片观察Fig. 1 Major anatomy symptoms and kidney imprint of Pseudomonas putida infected with hybrid catfishA. 眼周溃疡灶(★); B. 背部肌肉深度溃疡(★), 出血; C. 尾鳍溃烂(★); D.肾脏触片可见短杆菌(→)A. Ulceration of the skin around the eyes (★); B. Ulceration and discoloration of the dorsum skin (★); C. Caudal fin rot (★); D. Some bacterias and inflammatory cells in the Intercellular (→)
2.2 病原菌的分离纯化与形态学特性
从患病15尾杂交鲇肾和脾中均分离获得大量细菌, 其菌落形态基本一致, 在BHI平板上, 28℃培养24h后, 形成边缘整齐, 湿润, 呈圆形, 中央隆起,直径1—2 mm淡黄色半透明的圆形菌落, 革兰氏染色结果显示为阴性, 短杆状。选择形态一致, 纯度较高的优势菌保种备用, 共获得4株分离菌, 分别命名为: DYJ140914、DYJ140915、DYJ140916、DYJ140917。
2.3 生化鉴定结果
结果表明, 4株分离菌的主要生化特性一致(表1), 根据其生长特性及生理生化特征, 初步判定为恶臭假单胞菌(P. putida)。
2.4 16S rRNA和gyrB基因序列测定结果和系统发育分析
由于4株菌的主要生理生化特性完全一致, 故选择其中一株菌(编号为DYJ140914)进行16S rRNA和gyrB基因测序, 利用PCR技术扩增出16S rRNA和 gyrB基因片段, 产物经琼脂糖电泳检测, 结果显示该片段大小约为1427和1149 bp, 与预期相符。GenBank登录号分别为KP693689和KP693690, 测序结果表明该产物序列与GenBank数据中心上的恶臭假单胞菌P. putida的同源性最高, 在以分离菌16S rRNA和gyrB序列及其GenBank中同源性较高的恶臭假单胞菌属细菌16S rRNA及gyrB序列构建的系统发育树上(图 2), 分离菌与恶臭假单胞菌聚为一族, 与来源与其他水生动物的恶臭假单胞菌同源性达99.2%以上。
2.5 人工感染试验
在分离菌株经人工感染后, 对杂交鲇有较强致病力。接种感染8h后, 杂交鲇呼吸频率加快, 游动缓慢无力, 在水中呈垂悬姿势游动, 随病情发展, 部分杂交鲇体表出现不同程度的皮肤发白、糜烂。
菌液浓度3.4×108CFU/mL组杂交鲇第2天出现死亡, 在感染6d内死亡率达85%; 3.4×107CFU/mL组第2天开始死亡, 死亡率60%; 3.4×106CFU/mL组第3天开始死亡, 死亡率45%; 对照组杂交鲇在观察期内均表现正常, 无死亡情况(表 2)。对人工感染发病的杂交鲇进行细菌学分离检测, 获得与分离菌株DYJ140914形态及理化特征相同的细菌。

表 1 分离菌的生化特性Tab. 1 Biochemical characteristics of the isolated strain
2.6 药敏性检测
由表 3可知, 分离菌对强力霉素、诺氟沙星和左氧氟沙星敏感, 对新霉素中度敏感, 对氨苄青霉素、青霉素、氟苯尼考、磺胺甲基异恶唑、头孢西丁、阿奇霉素、利福平耐药。
2.7 组织病理损伤
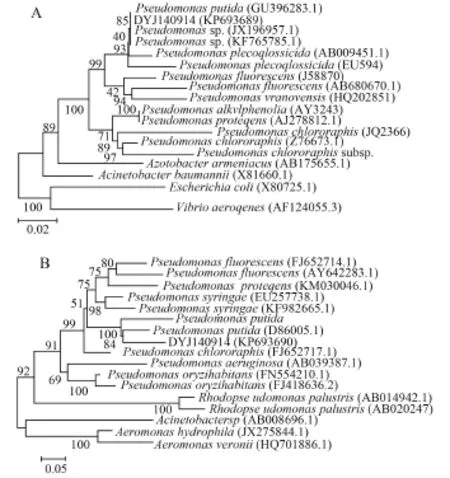
图 2 菌株DYJ140914的16S rRNA基因序列(A)、gyrB基因序列(B)及相关菌株构建的系统发育树Fig. 2 Phylogenetic trees were generated using MEGA5.0 based on alignment for 16S rRNA (A) and gyrB gene (B) sequence of the isolate strain DYJ140914 and other related species in Pseudomonas genus
恶臭假单胞菌(Pseudomonas putida)感染杂交鲇造成的病理损伤主要集中在肝、皮肤肌肉、肾、脾和心脏。其中主要以肝脏、皮肤肌肉、肾间质的病变最为明显。肝脏出现多灶性坏死(图3A), 坏死灶内细胞浓缩, 胞核碎裂甚至消失, 崩解的组织间隙内存在较多杆状菌(图 3B); 皮肤表皮坏死脱落(图 3C), 肌纤维和肌浆凝固, 呈蜂窝状, 炎症细胞浸润, 肌纤维内及肌纤维间可见大量杆状菌(图 3D); 肾间质多灶性坏死(图 3E), 间质内大量中性白细胞浸润, 大量红细胞积聚, 细胞间隙可见大量杆状菌(图 3F); 除了以上较为严重的典型病变,脾脏和心脏也有一定程度的病变: 其中脾脏淋巴细胞坏死崩解可见少量杆状菌(图 3G), 心外膜及心内膜大量炎性细胞浸润(图 3H), 心脏动脉球外膜外膜空泡样极度扩张(图 3I)。
3 讨论
在本研究中恶臭假单胞菌感染可引起杂交鲇出现体表皮肤肌肉溃疡症, 其溃疡主要特征为体表出现典型的溃疡灶, 严重者裸露脊柱, 尤以背部肌肉最为明显。在一定程度上与柱状黄杆菌(Flavobacterium columnare)引起的柱形病、嗜冷黄杆菌(Flavobacterium psychrophilum)引起的冷水病、运动型气单胞菌(Aeromonas hydrophila)引起的败血症症状相似[15]。但柱状黄杆菌引起的感染主要在鳍条和鳃部, 以烂鳍和烂鳃为主要表现, 皮肤深度溃疡较少见[22]; 嗜冷黄杆菌引起的冷水病虽然以表皮苍白褪色、皮肤溃疡为主要症状, 但该病多发生在水温较低时(发病水温范围4—10℃, 水温15℃时最为严重)[23], 而本病发病水温在20℃左右, 与嗜冷黄杆菌引起的溃疡病有明显的流行病学差异; 运动型气单胞菌感染引起的疾病多以败血症为主要表现, 体表溃疡症状较少见[24], 而本病例中除了内脏器官有出血表现外, 还可见体表明显溃疡。
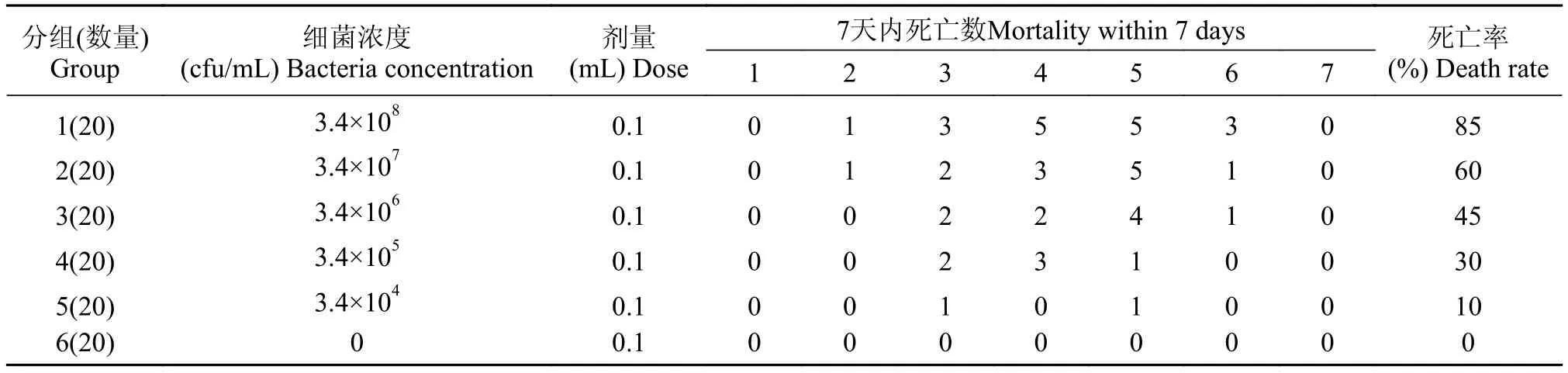
表 2 病原菌人工感染健康杂交鲇实验结果Tab. 2 The mortality of hybrid catfish challenged (intraperitoneal injection) with different doses of the isolate DYJ140914

表 3 菌株DYJ140914的药敏试验结果Tab. 3 The sensitivity of isolate bacteria DYJ140914 from a disease outbreak in hybrid catfish to various antimicrobial agents
鲇体表溃疡症是危害鲇养殖的主要疾病。从目前研究报道来看, 包括嗜水气单胞菌(Aeromonas hydrophila)[25]、维氏气单胞菌(Aeromonas veronii)[26]、豚鼠气单胞菌(Aeromonas caviae)[27]、拟态弧菌(Vibrio mimicus)[28]、柱状黄杆菌(Flavobacterium cloumnare)[29]等多种病原均可引起鲇体表溃疡症状。本研究通过组织病理学技术, 发现皮肤肌肉、肝和肾间组织为本病的主要损伤靶器官, 且在这些组织中明显可见大量杆状细菌, 加之肾脏组织触片中也观察到相同的杆菌, 故可确定为细菌感染;同时利用生理生化、16S rRNA和gryB基因分析对分离的病原进行进一步鉴定, 最终确定为恶臭假单胞菌感染致病。迄今为止, 恶臭假单胞菌感染引起杂交鲇体表溃疡的报道, 在国内外尚属首次。
在假单胞菌属中, 铜绿假单胞菌(Pseudomonas aeruginosa)和荧光假单胞菌(Pseudomonas fluorescens)已经被确认为条件致病性病原菌[30—32]。然而,假单胞菌属的其他菌种也可能是严重的条件致病菌, 例如: 分离于日本鳗鲡(Anguilla japonica)的鳗败血假单胞菌(Pseudonas anguilliseptica)[33], 红点鲑鳟(Oncorhynchus rhodurus)上分离的绿针假单胞菌(Pseudonas chlororaphis)[34], 香鱼(P. altivelis)上分离的变形假单胞菌(Pseudonas plecoglossicida)[35]等, 均可感染水生动物而致病。本研究结果表明,恶臭假单胞菌也可感染杂交鲇, 并且有较强的致病性, 由此表明在目前高密度人工养殖条件下, 恶臭假单胞菌正在逐渐获得感染水生动物的能力, 可能演变为一种潜在的水产条件致病菌。
此外, 药敏试验结果显示恶臭假单胞菌只对受试的强力霉素、诺氟沙星和左氧氟沙星3种抗生素敏感, 而对β-内酰胺类、氯霉素类、利福霉素类、头孢菌素类抗生素均具有较强耐药性。在这3种敏感的抗生素当中, 诺氟沙星已经禁用, 左氧氟沙星未批准使用于水产动物, 仅强力霉素允许用于水产养殖动物, 故强力霉素可作为治疗该病的推荐用药。但相关研究表明, 假单胞菌属增长速度极快,能快速适应不同的环境条件, 抗生素抗性基因产生迅速。由于在目前中国水产养殖中, 使用抗生素是主要的防病治病策略, 故其不利影响可能持续扩大,使治疗更加困难。因此, 构建健康养殖环境, 开发针对性疫苗, 或环境友好的中药制剂等是防控该病的理想策略。

图 3 杂交鲇恶臭假单胞菌感染的病理组织学损伤(HE×100, 200, 400, 1000, 标尺=10, 100, 200 μm)Fig. 3 Pathohistological lesions of hybrid catfish infected with Pseudomonas putida (HE×100, 200, 400, 1000)A. 肝脏多灶性坏死; B. 肝细胞间隙内大量杆状菌; C. 皮肤表皮坏死脱落; D. 肌纤维和肌浆凝固, 间隙内大量短杆菌; E. 肾间质多灶性坏死; F. 间质内大量中性白细胞浸润, 大量红细胞积聚, 细胞间隙可见杆状菌; G. 脾脏淋巴细胞坏死, 少量杆状菌; H. 心外膜及心内膜炎性细胞浸润; I. 心脏动脉球外膜空泡样极度扩张A. Multifocal necrosis in liver; B. Rod-shaped bacteria can observed in the intercellular of liver; C. Epidermis of skin necrosis and shedding; D. Muscle fibers and sarcoplasmic with solidification and honeycomb and many filamentous bacteria exist in muscle fibers; E. Severe focal necrosis in renal interstitium; F. Many erythrocytes, inflammatory cells and rod-shaped bacteria in intercellular of kidney; G. Splenocytes necrosis and with some rod-shaped bacterias; H. Infiltration of inflammatory cells in epicardium and endocardium; I. Adventitia of aortic bulb extreme expansion
[1]Lemanceau P. Beneficial-effects of rhizobacteria on plants-example of fluorescent Pseudomonas spp [J]. Agronomie, 1992, 12(6): 413—437
[2]Ladhani S, Bhutta Z A. Neonatal Pseudomonas putida infection presenting as staphylococcal scalded skin syndrome [J]. European Journal of Clinical Microbiology and Infectious Diseases, 1998, 17(9): 642—644
[3]Tan Z C, Wang C Y, Tong Y W. A case of aeruginosa caused by pseudomonas putida in children [J]. Chinese Journal of Pediatrics, 2000, 38(4): 238—238 [覃章纯, 汪崇阳, 童杨雯. 恶臭假单胞菌致小儿败血症一例. 中华儿科杂志, 2000, 38(4): 238—238]
[4]Li Q S, Xing R Y. The discovery of food-poisoning gaused by pseudomonas putida for the first time [J]. China Public Health, 2000, 16(1): 50—51 [李庆山, 邢瑞云. 首次发现恶臭假单胞菌引起的食物中毒. 中国公共卫生, 2000, 16(1): 50—51]
[5]Anaissie E, Fainstein V, Miller P, et al. Pseudomonas putida: newly recognized pathogen in patients with cancer [J]. The American Journal of Medicine, 1987, 82(6): 1191—1194
[6]Taylor M, Keane C T, Falkiner F R. Pseudomonas putidain transfused blood [J]. The Lancet, 1984, 324(8394): 107
[7]Lombardi G, Luzzaro F, Docquier J D,et al. Nosocomial infections caused by multidrug-resistant isolates of Pseudomonas putida producing VIM-1 metallo-βlactamase [J]. Journal of Clinical Microbiology, 2002, 40(11): 4051—4055
[8]Iwalokun B A, Akinsinde K A, Lanlenhin O, et al. Bacteriocinogenicity and production of pyocins from Pseudomonas species isolated in Lagos, Nigeria [J]. African Journal of Biotechnology, 2009, 5(11): 1072—1077
[9]Wakabayashi H, Sawada K, Ninomiya K, et al. Bacterial hemorrhagic ascites of ayu caused by Pseudomonas sp [J]. Gyobyo Kenkyu=Fish Pathology, 1996, 31(4): 239—240
[10]Ren Y, Chen X G, Liu P W, et al. Isolation, identification and the sensitivity to antimicrobial agents of Pseudomonassis pathogen from Great yellow croaker (Pseudosciaena crocea) [J]. Guangdong Agricultural Sciences, 2012, 39(18): 151—154 [任燕, 陈献稿, 刘鹏威, 等. 大黄鱼假单胞菌病病原的分离鉴定及药物敏感试验. 广东农业科学, 2012, 39(18): 151—154]
[11]Zhao H, Zhang P, Chen J H, et al. Isolation and identification of Pseudomonas putida of Andrias davidianus [J]. Henan Fisheries, 2008, 77(4): 40—41 [赵虎, 张鹏, 陈玖华, 等. 大鲵恶臭假单胞菌的分离及鉴定. 河南水产, 2008, 77(4): 40—41]
[12]Mao Z J, Wang M Z, Chen J G, et al. Isolation and characterization of Pseudomonas putida, a causative agent of gastroenteritis in black sea bream, Sparus macrocephalus [J]. Progress in Fishery Sciences, 2010, 31(3): 23—28 [毛芝娟, 王美珍, 陈吉刚, 等. 黑鲷肠炎病原恶臭假单胞菌的分离和鉴定. 渔业科学进展, 2010, 31(3) : 23—28]
[13]Fan H P. Study on the gill-rot disease of Anguilla anguilla infected by Pseudomonas putida [J]. Journal of Fisheries of China, 2001, 25(2): 147—150 [樊海平. 恶臭假单胞菌引起的欧洲鳗鲡烂鳃病. 水产学报, 2001, 25(2): 147—150]
[14]Tao B H, Shi H R, Huang J W, et al. Studied on yellow and black gills of Macrobrachium rosenbergii caused by Pseudoonas [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2000, 39(1): 255—259 [陶保华, 石和荣,黄俊文, 等. 假单胞菌引起罗氏沼虾黄鳃, 黑鳃病的研究. 中山大学学报: 自然科学版, 2000, 39(1): 255—259]
[15]Altinok I, Kayis S, Capkin E. Pseudomonas putida infection in rainbow trout [J]. Aquaculture, 2006, 261(3): 850—855
[16]Xu Z P. Hybrid catfish farming techniques [J]. Scientific Fish Farming, 1998, 3(4): 15 [许镇平. 杂交鲶的养殖技术. 科学养鱼, 1998, 3(4): 15]
[17]Wan S L. Several methods of prevention and treatment of catfish common diseases [J]. Studies on Fish Diseases, 1994, 16(2): 18—18 [万松良. 沟鲶几种常见疾病的防治方法. 鱼类病害研究, 1994, 16(2): 18—18]
[18]Lu L W. Evention and treatment of common channel catfish diseases [J]. Beijing Agriculture, 2011, 18(9): 76 [鲁伦文. 沟鲶养殖中常见病害的防治. 北京农业, 2011, 18(9): 76]
[19]Dong X Z, Cai M Y. Common System and Identification of Bacteria [M]. Beijing: Science Press. 2001, 1(1): 166—167 [东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社. 2001, 1(1): 166—167]
[20]Li R, Debella H J, Carmichael W W. Isolates identifiable as Arthrospira maxima and Arthrospira fusiformis (Oscillatoriales, Cyanobacteria) appear identical on the basis of a morphological study in culture and 16S rRNA gene sequences [J]. Phycologia, 2001, 40(4): 367—371
[21]Yamamoto S, Harayama S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains [J]. Applied and Environmental Microbiology, 1995, 61(3): 1104—1109
[22]Liu L H, Li N Q, Shi C B, et al. Isolafion and classification of pathogenic bacterium caused by gill-rot disease in channel catfish (Ictalunes punctatus) [J]. Journal of Anhui Agricultural Sciences, 2008, 36(17): 7124—7126 [刘礼辉, 李宁求, 石存斌, 等. 斑点叉尾烂鳃病病原柱状黄杆菌的分离及鉴定. 安徽农业科学, 2008, 36(17): 7124—7126]
[23]Weng S G. Diagnosis and treatment of Bacterial coldwater disease [J]. Scientific Fish Farming, 2013, 28(4): 60—61 [翁善钢. 细菌性冷水病的诊治. 科学养鱼, 2013, 28(4): 60—61]
[24]Plumb J A, Hanson L A. Tilapia Bacterial Diseases [M]. Health Maintenance and Principal Microbial Diseases of Cultured Fishes, Third Edition. 1999, 3(1): 445—463
[25]Yang Y B, Xiao G C, Ou R J, et al. A case of catfish diagnosis and treatment of skin fester disease [J]. Scientific Fish Farming, 2013, 28(6): 64—65 [杨移斌, 肖国初, 欧仁建, 等. 一例大口鲶体表溃烂病的诊断与治疗. 科学养鱼, 2013, 28(6): 64—65]
[26]Yang T, Xiao D, Liu T Q, et al. Catfish Vickers gas occurrence, diagnosis and treatment of disease caused by Aeromonas veronii [J]. Current Fisheries, 2014, 41(11): 79—79 [阳涛, 肖丹, 刘天强, 等. 大口鲶维氏气单胞菌病发生与诊治. 当代水产, 2014,41(11): 79—79]
[27]Ji L L, Wang K Y, Xiao D, et al. Isolation and identification of pathogenic bacteria causing ulcer disease of Silurus meriordinalis Chen [J]. Freshwater Fisheries, 2008, 38(3): 68—72 [吉莉莉, 汪开毓, 肖丹, 等. 南方鲇溃疡综合症病原菌的分离与鉴定. 淡水渔业, 2008, 38(3): 68—72]
[28]Geng Y, Liu D, Han S, et al. Outbreaks of vibriosis associated with Vibrio mimicus in freshwater catfish in China [J]. Aquaculture, 2014, 433(2014): 82—84
[29]Huang J L, Wang K Y, Jiang T T, et al. The biological characteristics of bacterium Flavo bacterium columnare[J]. Journal of Dalian Ocean University, 2010, 25(6): 506—510 [黄锦炉, 汪开毓, 姜婷婷, 等. 柱状黄杆菌部分生物学特性的研究. 大连海洋大学学报, 2010, 25(6): 506—510]
[30]Shiose J, Wakabayashi H, Egusa S, et al. A report on a disease of cultured carp due to a capsulated Pseudomonas [J]. Fish Pathology (Japan), 1974, 9(1): 79—83
[31]Alderman D J, Polglase J L, Holdich D M, et al. Pathogens, parasites and commensals [J]. Freshwater Crayfish. Biology, Management and Exploitation, 1988, 1(1): 167—212
[32]Angelini N M, Seigneur G N. Disease of the fins of Rhamdia sapo. Isolation of the etiological agents and experimental infection [J]. Revista Argentina de Microbiologia, 1987, 20(1): 37—48
[33]Wakabayashi H, Egusa S. Characteristics of a Pseudomonas sp. from an epizootic of pond-cultured eels (Anguilla japonica) [J]. Bulletin of the Japanese Society of Scientific Fisheries, 1972, 38(6): 577—587
[34]Hatai K, Egusa S, Nakajima M, et al. Pseudomonas chlororaphis as a fish pathogen [J]. Bulletin of the Japanese Society of Scientific Fisheries, 1975, 41(11): 1203
[35]Kobayashi T, Imai M, Ishitaka Y, et al. Histopathological studies of bacterial haemorrhagic ascites of ayu, Plecoglossus altivelis (Temminck & Schlegel) [J]. Journal of Fish Diseases, 2004, 27(8): 451—457
ISOLATION, IDENTIFICATION AND PATHOLOGICAL LESIONS OF PSEUDOMONAS PUTIDA FROM HYBRID CATFISH
DUAN Ya-Jiao1, HUANG Xiao-Li1, ZHAN Gui-Ran2, FAN Wei3, DUAN Jing1, ZHAO Yi-Lin1, DENG Yong-Qiang4, GENG Yi5, CHEN De-Fang1and WANG Kai-Yu5
(1. College of Animal Science and Technology, Sichuan Agricultural University, Chengdu 611130, China; 2. Fisheries Station of Huize County of Yunnan Province, Qujing 654200, China; 3. Neijiang City Academy of Agricultural Sciences, Neijiang 641000, China; 4. Animal Disease Prevention and Control Center of Sichuan, Chengdu 610041, China; 5. College of Veterinary Medicine, Sichuan Agricultural University, Chengdu 611130, China)
In order to identify the pathogens of the skin ulcer disease in hybrid catfish, several strains of dominant bacteria (DYJ140914-DYJ140917) were isolated from the diseased fish. They were identified as Pseudomonas putida based on morphology, biochemical, physiology characteristics and sequencing of 16S rRNA and gyrase B subunit (gyrB) gene (GeneBank accession number were KP693689 and KP693690 respectively). They were also proved to be the pathogen of the disease by artificial infection experiment. Histologically, liver, skin, muscle, and renal interstitial were the target organs of the disease, which characterized by multifocal necrotic hepatitis, necrotic myositis, and necrotizing interstitial nephritis. Moreover, it could also lead to mild epicardial and endocardial inflammation, and mild necrotic splenitis. The result of drug sensitivity test showed that the isolates were sensitive to the Doxycycline, Norfloxacin, and Levofloxacin, but were resistant to Ampicillin, Azithromycin, Florfenicol, Sinomin, Mefoxin, Penicillin.
Hybrid catfish; Pseudomonas putida; 16S rRNA; gyrB gene; Pathological lesion
S941.1
A
1000-3207(2017)02-0371-08
10.7541/2017.45
2016-02-24;
2016-06-18
四川省科技支撑项目(2014NZ0027)资助 [Supported by the Science and Technology Support Project of Sichuan Province (No. 2014NZ0027)]
段亚佼(1992—), 女, 甘肃庆阳人; 硕士研究生; 研究方向水生动物疾病学。E-mail: michelle0118@163.com
黄小丽(1979—), 女, 重庆人; 副教授; 主要从事水生动物疾病学的教学与研究工作。E-mail: hxldyq@126.com
