板栗壳乙酸乙酯提取物活性研究及其化合物结构分析
2017-04-12史玲玲王建中刘玉军李怡婧代建蓉滕婉昭
史玲玲 王建中 刘玉军 马 超 李怡婧 代建蓉 曹 阳 滕婉昭
(北京林业大学生物科学与技术学院,北京 100083)
板栗壳乙酸乙酯提取物活性研究及其化合物结构分析
史玲玲 王建中 刘玉军 马 超 李怡婧 代建蓉 曹 阳 滕婉昭
(北京林业大学生物科学与技术学院,北京 100083)
为了研究板栗壳乙酸乙酯提取物体外活性,并分析其活性成分,依次采用DPPH法、ABTS法测定板栗壳乙酸乙酯提取物的抗氧化活性;PNPG法测定其体外抑制α-葡萄糖苷酶活性;超高效液相色谱—质谱联用技术(UPLC—MS/MS)对其成分进行分析。结果表明:板栗壳乙酸乙酯提取物具有较强的清除DPPH自由基、ABTS自由基的能力且可显著地抑制α-葡萄糖苷酶的活性,其有效成分主要为脂溶性黄酮类化合物。
板栗壳;乙酸乙酯提取物;抗氧化活性;α-葡萄糖苷酶;化合物结构
板栗(CastaneamollissimaBlume)是壳斗科栗属植物,原产、主产于中国,有“干果之王”的美称[1]。板栗壳作为板栗加工业中的废弃物,近年来也越来越引起人们的关注。研究[2-4]报道板栗壳可以作为水溶液中农药、铜、铅、镉以及其他重金属的吸附剂。由于板栗壳中含有酚类、有机酸、多糖、内酯、香豆素、鞣质、甾体和黄酮等活性成分[5-6],其水提取物具有多种功能,如抗氧化作用和保肝作用[7-8],因此有必要对板栗壳进行研究以考察其在食品、药品或保健品等方面的应用潜力。对板栗壳的研究虽有报道,但多集中于板栗壳中多酚的提取,色素的提取工艺及其抗氧化研究[9-12];而研究板栗壳提取物抑制α-葡萄糖苷酶活性的报道仅限于板栗壳的正丁醇提取物[13],未见对板栗壳乙酸乙酯提取物的体外抗氧化活性、抑制α-葡萄糖苷酶活性以及对活性成分进行深入分析的系统研究,因此,本研究拟采用DPPH法和ABTS法,研究板栗壳乙酸乙酯提取物的抗氧化活性,采用PNPG法测定其对体外α-葡萄糖苷酶活性的抑制作用;同时,应用UPLC—MS/MS分析板栗壳乙酸乙酯提取物的活性成分,寻找其潜在的应用价值,旨在为板栗壳的综合开发利用提供理论依据。
1 材料与方法
1.1 材料
板栗壳:收集于河北省迁西县(迁西板栗的主产区)。
1.2 试剂
DPPH、ABTS、水溶性维生素E(Trolox):≥98.0%,美国Sigma-Aldrich有限公司;
高硫酸钾:分析纯,国药集团化学试剂有限公司;
对硝基苯-α-D-葡萄糖苷(PNPG):≥99.0%,美国Sigma-Aldrich有限公司;
α-葡萄糖苷酶:10 units/mg,美国Sigma-Aldrich有限公司;
阿卡波糖:≥99.0%,武汉远成医药有限公司;
甲醇:色谱纯,美国Thermo Fisher Scientific公司;
甲酸:色谱纯,北京迈瑞达科技有限公司。
1.3 仪器与设备
光吸收全波长酶标仪:TECAN M200 PRO型,瑞士TECAN公司;
电子天平:ML104型,梅特勒-托利多公司;
串联四极杆质谱系统:QTRAP 5500型,美国AB SCIEX公司;
液相色谱仪:Agilent 1260 型,美国安捷伦公司。
1.4 试验方法
1.4.1 提取物的制备 干燥的板栗壳经除杂、粉碎后,以料液比1∶9(g/mL)的比例添加75%乙醇溶液对板栗壳粉末进行加热回流提取2 h,转移提取液至另一容器内,药渣部分重复提取一次,合并提取液,过滤,对乙醇提取液进行旋蒸,接着对乙醇蒸干后剩余的水相部分用蒸馏水以1∶1比例进行稀释,之后依次采用与稀释液等体积的乙酸乙酯萃取两次,得到板栗壳乙酸乙酯萃取溶液,经旋蒸得到乙酸乙酯提取物的浸膏。
1.4.2 板栗壳乙酸乙酯提取物的抗氧化活性测定 精确称取乙酸乙酯提取物浸膏0.05 g,用95%乙醇定容到25 mL,得到溶液质量浓度为2 mg/mL的溶液,再将各溶液分别稀释为0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8 mg/mL的待测样品溶液。
(1) 对DPPH自由基清除能力测定:量取0.01 mL不同质量浓度的样品溶液,加入0.2 mL甲醇,以及0.025 mL 1 mmol/L的DPPH乙醇溶液于96微孔板中,混匀后室温避光放置30 min。分别测定其在517 nm处的吸光度值。以甲醇为空白对照,以0.025 mL甲醇替代抗氧化剂溶液做空白试验。以Trolox(水溶性维生素E)作为阳性对照,根据文献[14]按式(1)计算板栗壳乙酸乙酯提取物对DPPH自由基的清除能力。
(1)
式中:
k——DPPH自由基清除率,%;
Ac——未加样品溶液的DPPH自由基吸光度值;
Ai——加入样品溶液反应后的DPPH自由基吸光度值。
(2) 对ABTS自由基清除能力测定:将7 mmol/L的ABTS溶液和140 mmol/L的高硫酸钾溶液以62.5∶1的比例混合,室温避光静置16 h,形成ABTS自由基储备液。用无水甲醇稀释该储备液,使其在734 nm下吸光度为0.70±0.02。分别取0.015 mL不同质量浓度的样品甲醇溶液与0.285 mL ABTS+工作液于96微孔板中混合10 s,30 ℃下静置6~10 min,以无水甲醇为空白在734 nm波长下测吸光度。板栗壳乙酸乙酯提取物对ABTS自由基的清除能力按式(2)计算:
(2)
式中:
c——ABTS自由基清除率,%;
Ao——未加样品溶液的ABTS自由基吸光度值;
As——加入样品溶液反应后的ABTS自由基吸光度值。
半数抑制率(IC50)的计算:以样品的浓度对自由基清除率作图并进行线性拟合,并计算(IC50)值。其中,IC50值定义为清除率为50%时所需抗氧化剂的浓度。
1.4.3 板栗壳乙酸乙酯提取物对α-葡萄糖苷酶抑制活性的测定 采用PNPG法,根据文献[15],反应体系改进如下:量取50 μL不同质量浓度的板栗壳乙酸乙酯提取物溶液于96微孔板中,加入1 U/mL的α-葡萄糖苷酶溶液,混匀,37 ℃ 恒温 10 min 后,加入2 mmol/L PNPG溶液30 μL,用0.1 mmol/L 磷酸钠缓冲液(pH 6.8)定容至250 μL。反应过程在37 ℃下进行,每隔15 min测定一次405 nm处的吸光度值,直至反应完全。以阿卡波糖为阳性对照,同时设定阴性对照组(缓冲液+酶液+底物),空白对照组(缓冲液)。酶抑制活性按式(3)计算:
(3)
式中:
I——酶抑制活性,%;
AX——样品OD值-样品空白OD值;
An——阴性对照OD值。
半数抑制浓度(IC50)的计算:以样品的浓度对酶抑制活性作图并进行线性拟合,并计算IC50值。其中,IC50值定义为抑制率为50%时所需酶抑制剂的浓度。
1.4.4 板栗壳乙酸乙酯提取物成分分析 精密称取乙酸乙酯提取物浸膏5 mg,用色谱甲醇溶解,定容至10 mL;超声辅助溶解完全后经0.45 μm微孔滤膜过滤后备用。
分析条件:根据文献[16]修改如下:Diamonsil C18(2)色谱柱,(250 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:流动相A为甲醇,流动相B为超纯水(用甲酸调pH为2.05);梯度洗脱,采样时间80 min;流速0.6 mL/min;自动进样器进样量:20 μL;二极管阵列检测器(DAD)全扫描波长:190~400 nm。紫外检测波长280 nm。质谱条件:采用电喷雾离子源(ESI),负离子模式离子扫描范围:100~1 000m/z;离子原温度(TEM):550 ℃;离子原电压:-4 500 V;裂解电压(DP):-60 V;碰撞能量(CE):-35 eV;碰撞能量扩展(CES):15 eV。雾化气体:氮气,辅助气1为379.225 kPa,辅助气2为344.75 kPa;数据采集所用软件:Analyst 1.5 software。流动相由pH 2.05的甲酸溶液(A)和甲醇溶液(B)组成,梯度洗脱以15%的甲醇开始15 min,之后的25 min内增长到25%甲醇,65 min时增长至75%甲醇,之后在70 min时减少至15%甲醇,以此浓度再持续洗脱10 min。
2 结果与分析
2.1 板栗壳乙酸乙酯提取物的抗氧化活性
2.1.1 清除DPPH自由基能力 由图1可知,板栗壳乙酸乙酯提取物在一定浓度范围内(0.1~0.8 mg/mL),自由基的清除率与样品浓度呈正相关,随着样品溶液浓度的升高,其对自由基的清除率也越来越高。其中当溶液浓度为0.6 mg/mL时,板栗壳乙酸乙酯提取物对DPPH自由基的清除率达到70%以上。但其对DPPH自由基的清除能力弱于阳性对照品Trolox,当Trolox达到一定浓度(0.4 mg/mL)后对DPPH自由基的清除率可达到90%以上,之后趋于平缓。板栗壳乙酸乙酯提取物以及Trolox对DPPH自由基的抑制中浓度(IC50)分别为(0.326±0.050),(0.160±0.250) mg/mL。
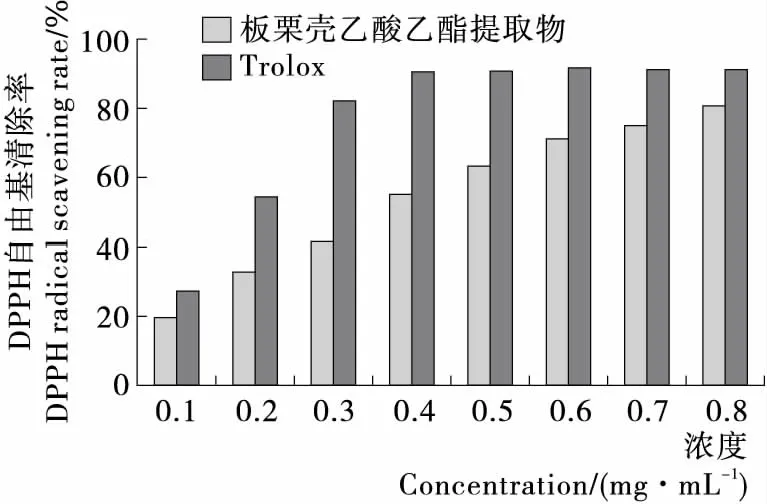
图1 板栗壳乙酸乙酯提取物对DPPH自由基的清除能力
Figure 1 Scavenging capacity of DPPH free radical from ethyl acetate extracts of Chestnut shell
2.1.2 板栗壳乙酸乙酯提取物清除ABTS自由基能力 由图2可知,板栗壳乙酸乙酯提取物具有清除ABTS自由基的能力,在一定浓度范围内(0.1~0.5 mg/mL),自由基的清除率与样品浓度呈正相关。其中当溶液浓度为0.5 mg/mL时,乙酸乙酯提取物对ABTS自由基的清除率达到90%以上。但在一定浓度范围内(0.1~0.4 mg/mL),板栗壳乙酸乙酯提取物对ABTS自由基的清除能力弱于阳性对照Trolox,但当样品溶液浓度高于0.5 mg/mL时,二者清除ABTS自由基能力相当。板栗壳乙酸乙酯提取物以及Trolox对ABTS自由基的抑制中浓度(IC50)分别为(0.164±0.050),(0.099±0.150) mg/mL。
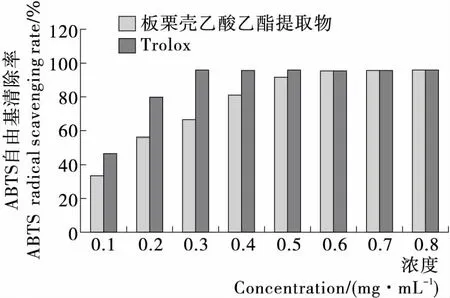
图2 板栗壳乙酸乙酯提取物对ABTS自由基的清除能力
Figure 2 Scavenging capacity of ABTS free radical from ethyl acetate extracts of Chestnut shell
2.2 板栗壳乙酸乙酯提取物抑制α-葡萄糖苷酶活性能力
对硝基苯-α-D-葡萄糖苷(PNPG)经α-葡萄糖苷酶水解可产生对硝基苯酚,其在水溶液中显黄色,于405 nm处呈特异性吸收。因此可以通过检测对硝基苯酚的生成量而检测α-葡萄糖苷酶的活性[17]。
由图3、4可知,在反应时间165 min内,酶反应完全。板栗壳乙酸乙酯提取物在2.5~12.5 μg/mL时,随样品浓度的增加,其对α-葡萄糖苷酶的抑制作用也不断增加。当样品浓度高于10 μg/mL时,其对α-葡萄糖苷酶的抑制率达80%以上,远高于对照品阿卡波糖对α-葡萄糖苷酶的抑制率;板栗壳乙酸乙酯提取物的IC50为 2.536 μg/mL,而市售阿卡波糖的IC50为200 μg/mL,表明板栗壳乙酸乙酯提取物对α-葡萄糖苷酶的抑制活性明显高于阿卡波糖。本研究表明板栗壳乙酸乙酯提取物可显著地抑制α-葡萄糖苷酶的活性,但目前还仅限于体外试验,板栗壳乙酸乙酯提取物活性成分较为复杂,需要进一步研究。
2.3 板栗壳醇提物乙酸乙酯提取物成分的UPLC—MS/MS分析
板栗壳乙酸乙酯提取物的色谱图见图5。
在ESI负离子模式下,通过对板栗壳乙酸乙酯提取物样品的总离子色谱图进行离子色谱图提取,根据主要化合物的质谱数据[M-H]-m/z和[M-H]-2m/z值与化合物的相对分子质量的对比,并结合文献对照,对化合物进行分析鉴别,初步推测出板栗壳中10种化合物。化合物1的准分子离子峰[M-H]-m/z为179,说明该化合物的分子量为180,与咖啡酸的分子量相同。且有碎片离子m/z147.1,与文献[18]报道的咖啡酸一致。因此可以推断该化合物是咖啡酸;化合物2的准分子离子峰[M-H]-m/z为353,所以得出其分子量为354。并且有m/z147.1的碎片离子,与文献[18]报道的绿原酸一致,可推测该化合物为绿原酸;化合物3的准分子离子峰[M-H]-m/z285,分子量为286,二级质谱图中碎片有m/z284.8,与文献[19]报道的山奈酚的特征峰一致,因此该化合物可能是山奈酚;化合物4的准分子离子峰[M-H]-m/z为169,说明其分子量为170,与没食子酸的分子量一致,且有m/z79.0的碎片离子,符合文献[20]报道的没食子酸的裂解峰,因此化合物可能是没食子酸;化合物5的准分子离子峰[M-H]-m/z是317,故分子量是318。且有碎片离子m/z137.0,与文献[21]报道的杨梅素一致,由此可以初步假设该化合物是杨梅素;化合物6的准分子离子峰[M-H]-为m/z301,故分子量为302,符合槲皮素的分子量。且产生的二级质谱图中有m/z255.0,与文献[22]报道的槲皮素裂解特征一致,因此初步推断该化合物为槲皮素;化合物7的准分子离子峰[M-H]-m/z是 163,说明该化合物的分子量为164,与4-香豆酸的分子量相同。MS2有m/z93碎片,与文献[23]报道的4-香豆酸一致。由此可初推测该化合物是4-香豆酸;化合物8的准分子离子峰[M-H]-m/z是283,故分子量为284,与大黄酸的分子量一致。且有碎片离子m/z为211.3,与文献[24]报道的大黄酸较一致。所以该化合物可能是大黄酸;化合物9的准分子离子峰[M-H]-m/z是137,故分子量为138,且有碎片离子92.2,符合文献[25]报道的4-羟基苯甲酸标准品的裂解峰。故可以推断该化合物是4-羟基苯甲酸;化合物10的准分子离子峰[M-H]-m/z为165,故分子量为166。且有m/z121.0的碎片,与文献[26]报道的邻苯二甲酸一致,可推测该化合物为邻苯二甲酸。具体见表1。
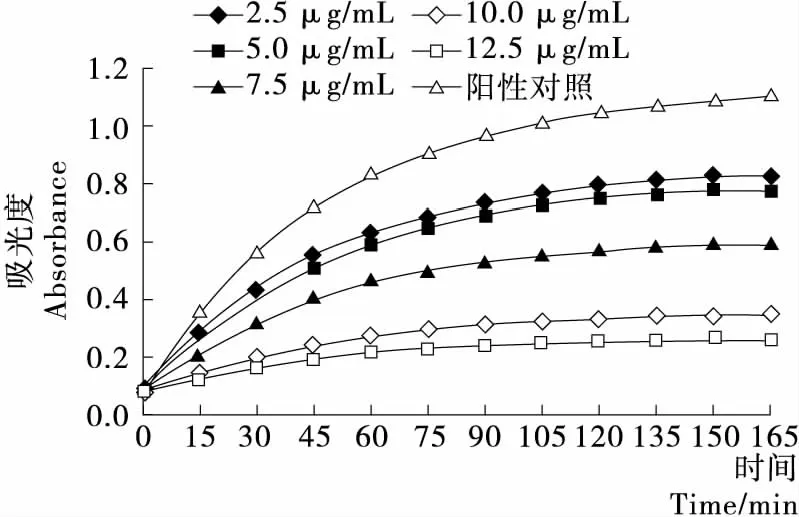
图3 不同浓度板栗壳乙酸乙酯提取物对α-葡萄糖苷酶的抑制作用
Figure 3 Inhibitory activity ofα-glucosidase by ethyl acetate extracts of Chestnut shell at different concentrations
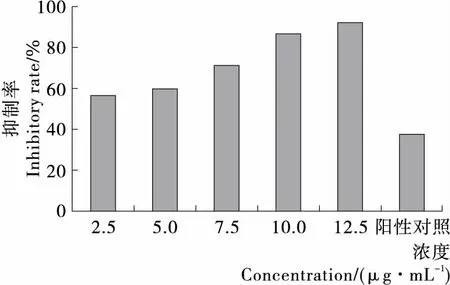
图4 不同浓度板栗壳乙酸乙酯提取物对α-葡萄糖苷酶的抑制率
Figure 4 The inhibition rate ofα-glucosidase by ethyl acetate extracts of chestnut shell at different concentrations
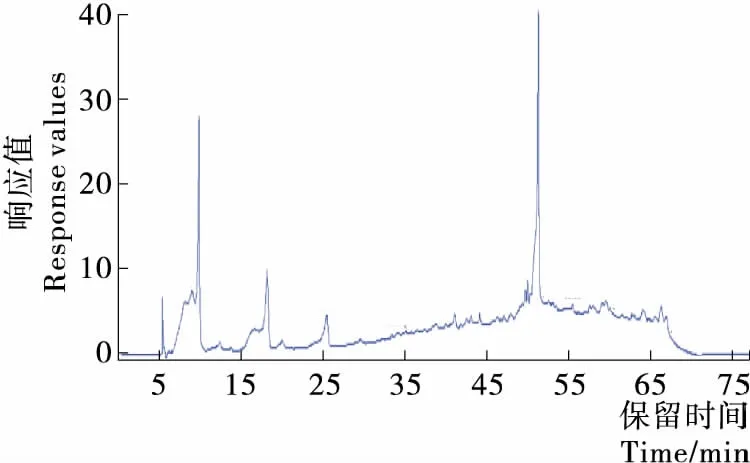
图5 板栗壳样品UPLC图Figure 5 UPLC chromatogram of chestnut shell
3 结论
本试验系统地研究了板栗壳中乙酸乙酯提取物的体外抗氧化活性和α-葡萄糖苷酶抑制活性,结果表明板栗壳乙酸乙酯提取物具有较强的抗氧化活性和显著的α-葡萄糖苷酶抑制活性。进一步推测了这些活性成分主要为脂溶性黄酮类化合物,为板栗壳作为天然产物的开发与利用提供了理论和试验依据。板栗壳提取物具有较强的天然产物活性,有着广阔的发展和应用前景。近年来,板栗壳中有效成分的提取工艺已成为研究热点,但是对于板栗壳中成分的研究和纯化以及体内试验等还有待于进一步研究,这也将成为相关研究领域的研究热点。
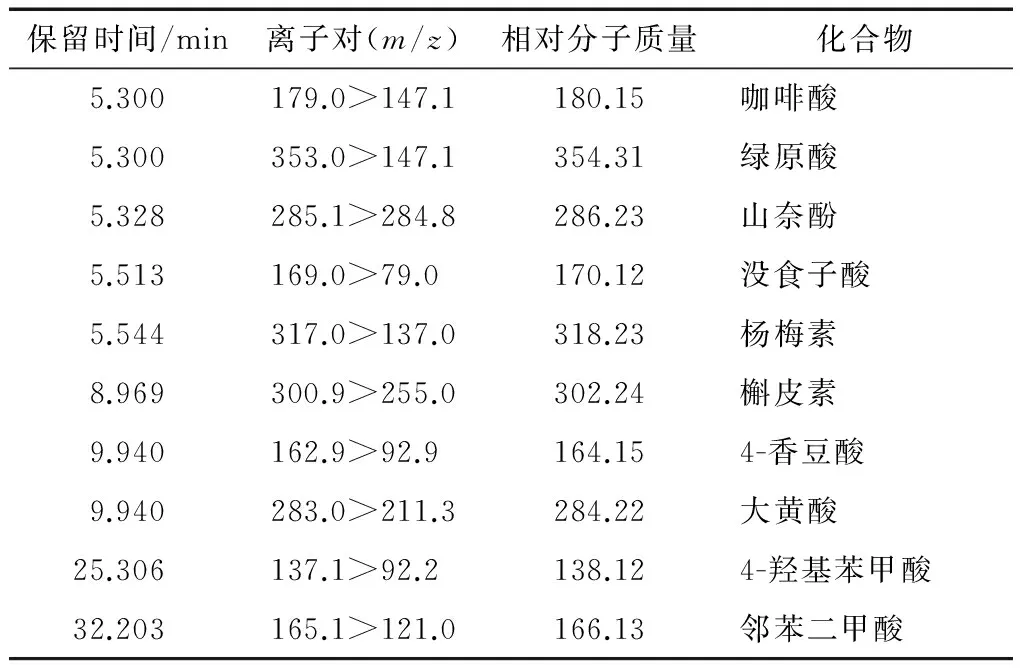
表1 板栗壳乙酸乙酯提取物中化合物结构推断Table 1 Constructions in Ethyl acetate extracts of chestnut shell
[1] 周丹, 洪珊茹, 赵巧娇, 等. 板栗栗蓉的制作研究[J]. 食品科技, 2014, 39(3): 61-64.
[2] YAO Zeng-yu, QI Jian-hua, WANG Li-hua. Equilibrium, kinetic and thermodynamic studies on the biosorption of Cu(II) onto chestnut shell[J]. Journal of Hazardous Materials, 2010, 174(1/3): 137-143.
[3] DONG Ya-chen, DAI Yi-ning, XU Teng-yang, et al. Biodegradation of chestnut shell and lignin-modifying enzymes production by the white-rot fungi Dichomitus squalens, Phlebia radiata[J]. Bioprocess and Biosystems Engineering, 2014, 37(5): 755-764.
[4] PIRRA A, LUCAS M S, PERES J A. Aerobic Biological Treatment of Chestnut Processing Wastewater[J]. Water, Air, & Soil Pollution, 2012, 223(7): 3 721-3 728.
[5] 赵德义, 高文海, 花成文, 等. 板栗壳化学成分的初步研究[J]. 陕西林业科技, 2003(2): 1-3.
[6] 郑佳欣, 李怡婧, 汪晨阳, 等. 板栗壳鞣质提取及其对DPPH自由基清除活性的研究[J]. 食品工业科技, 2016, 37(3): 211-215.
[7] NOH J R, KIM Y H, GANG G T, et al. Hepatoprotective effects of chestnut (Castanea crenata) inner shell extract against chronic ethanol-induced oxidative stress in C57BL/6 mice[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2011, 49(7): 1 537-1 543.
[9] 李莉, 顾欣, 崔洁, 等. 板栗壳棕色素抗氧化性研究与红外光谱分析[J]. 食品与发酵工业, 2011, 37(3): 41-45.
[10] 王慧. 板栗壳色素提取工艺研究[J]. 食品研究与开发, 2014, 35(2): 47-50.
[12] YOU Ting-ting, ZHOU Su-kun, WEN Jia-long, et al. Chemical composition, properties, and antimicrobial activity of the water-soluble pigments from Castanea mollissima shells[J]. Journal of Agricultural & Food Chemistry, 2014, 62(8): 1 936-1 944.
[13] 刘莉, 唐新玥, 张欣珂, 等. 板栗壳中多酚的提取纯化及其抑制α-葡萄糖苷酶活性的研究[J]. 食品工业科技, 2015, 36(6): 265-268.
[14] LUO Jian-guang, LI Lu, KONG Ling-yi. Preparative separation of phenylpropenoid glycerides from the bulbs of Lilium lancifolium, by high-speed counter-current chromatography and evaluation of their antioxidant activities[J]. Food Chemistry, 2012, 131(3): 1 056-1 062.
[15] CHAPDELAINE P, TREMBLAY R R, DUBÉ J Y. P-Nitrophenol-alpha-D-glucopyranoside as substrate for measurement of maltase activity in human semen[J]. Clinical Chemistry, 1978, 24(2): 208-211.
[16] 焦中高, 刘杰超, 周红平, 等. 枣果中酚类物质的高效液相色谱分析[J]. 食品与发酵工业, 2008, 34(3): 133-136.
[17] 钱瑾, 黎明, 吴嘉瑞, 等. 消渴丸中药成分对α-葡萄糖苷酶抑制作用的研究[J]. 中国实验方剂学杂志, 2012, 18(7): 173-176.
[18] 单鸣秋, 钱雯, 高静, 等. UPLC—MS分析侧柏叶中黄酮类化合物[J]. 中国中药杂志, 2011, 36(12): 1 626-1 629.
[19] 李亭亭, 徐新房, 王子健, 等. 牵牛子生品、炒品酚酸类成分的HPLC—MS分析[J]. 中医药学报, 2016, 44(1): 11-14.
[20] 梁艳, 于世锋, 陈卫军, 等. 山奈酚的电喷雾质谱裂解途径[J]. 应用化学, 2009, 26(10): 1 250-1 252.
[21] 朱慧明. 基于液质联用技术的芪苈强心胶囊中多组分分析与药代动力学研究[D]. 石家庄: 河北医科大学, 2014: 126-128.
[22] 师仁丽, 翟龙飞, 于文龙, 等. 利用DAD—HPLC和LC—MS法检测金丝小枣中黄酮类化合物[J]. 食品科学, 2016, 37(16): 123-127.
[23] 李宇航, 戴海学, 汪明明, 等. 槲皮素的电喷雾离子阱质谱分析[J]. 质谱学报, 2009, 30(6): 374-378.
[24] 朱瑞芝, 王凯, 吴新华, 等. 超高效液相色谱—质谱法同时快速测定烟叶中的几种芳香酸和酚酸[J]. 分析试验室, 2009, 28(10): 108-112.
[25] 罗益远, 刘娟秀, 刘廷, 等. UPLC—MS/MS法同时测定何首乌中二苯乙烯、蒽醌、黄酮及酚酸类成分[J]. 质谱学报, 2016, 37(4): 327-335.
[26] 方玲玲, 肖作兵, 牛云蔚, 等. 超高效液相色谱串联质谱法测定樱桃酒中的5种酚酸[J]. 食品与发酵工业, 2011, 37(6): 172-176.
Study on acivity and structure analysis of ectracts from Chinese chestnut shell by ethyl acetate
SHI Ling-lingWANGJian-zhongLIUYu-junMAChaoLIYi-jingDAIJian-rongCAOYangTENGWan-zhao
(CollegeofBiologicalScienceandBiotechnology,BeijingForestryUniversity,Beijing100083,China)
Investigated and analyzed the activity of ethyl acetate extract of chestnut shell and the components by UPLC—MS/MS. Antioxidant activities were carried out by DPPH radical scavenging assays and ABTS radical scavenging assays. The inhibitory activity of alpha glycosidase enzymes was measured by PNPG method. Qualitative analysis was performed by UPLC—MS/MS for analysis of major active components in ethyl acetate extracts. It determined that ethyl acetate extracts of Chestnut shell possessed remarkable DPPH radical scavenging activity, ABTS radical scavenging activity and high inhibitory activity of alpha glycosidase enzymes owing to the fat-soluble flavonoids are the main active components.
Chestnut shell; ethyl acetate extracts; antioxidant activity; alpha glycosidase enzymes inhibitory activity; UPLC—MS/MS
国家林业公益性行业科研专项(编号:201204401)
史玲玲,女,北京林业大学中级实验师,在读博士研究生。
王建中(1951—),男,北京林业大学教授,硕士。 E-mail:w62338221@163.com
2016—12—15
10.13652/j.issn.1003-5788.2017.02.028
