两种检测还原糖方法的比较
2017-04-12张学英黄忠意章发盛
张学英 黄忠意 章发盛 石 艳 黄 静
(1. 湘西自治州食品药品检验所,湖南 吉首 416000;2. 湖南省食品监督检测研究院,湖南 长沙 410000)
两种检测还原糖方法的比较
张学英1黄忠意2章发盛1石 艳1黄 静1
(1. 湘西自治州食品药品检验所,湖南 吉首 416000;2. 湖南省食品监督检测研究院,湖南 长沙 410000)
采用费林试剂滴定法和3,5-二硝基水杨酸比色法测定湘西野生菊芋中还原糖(及总糖)含量,分析比较二者的测定结果及可操作性等。结果表明,费林试剂滴定法平行样检测RSD值为2.00%,精密度为8%~13%;3,5-二硝基水杨酸比色法平行样检测RSD值为1.68%,精密度为2.5%~4.0%;费林试剂滴定法易受终点计量等因素的干扰,特别是对于糖含量低的样品检测误差较大,但较适用于自带颜色产品的检测;3,5-二硝基水杨酸比色法操作简单、快速、适宜批量处理,其显色反应体系在135 min内同一标准点RSD值为0.55%,且显色反应体系相当稳定,客观因素对其低浓度样品影响较小,检测结果准确度较高。
3,5-二硝基水杨酸比色法;费林试剂滴定法;菊芋;还原糖
菊芋,又名洋姜,为菊科向日葵属多年生宿根性草本植物,地下块茎富含菊糖,因菊糖对人体内糖含量有双重调节作用,故菊糖是食品、保健食品和医药领域重要的加工原料。其地上茎秆既可作为造纸的原料,也可作为生物发电的燃料,同时由于其生长适应性强,近年在风沙治理领域运用广泛[1-2]。菊芋在食品加工领域主要用于制作酱腌菜、蜜饯等食品,在食品精细加工及保健食品研究方面主要是对块茎中菊糖、低聚果糖、高果糖浆等提纯及应用,新鲜菊芋的总糖含量高达20%~35%,其中鲜菊芋中菊糖含量也较高达15%~20%[2-3]。
食品中还原糖(及总糖)的含量测定,有旋光法、气相色谱法、液相色谱法、分光光度计法和化学滴定法,一般现常见有高锰酸钾滴定法(但操作复杂、费时,需高锰酸钾法糖类检索表)、费林试剂滴定法(含直接滴定法和返滴定法)、浓硫酸苯酚法(此法因使用有强腐蚀性的浓硫酸,且检测过程中比色样液量太少而不宜使用)和3,5-二硝基水杨酸比色法等方法。实验室常用的方法有费林试剂滴定法和3,5-二硝基水杨酸比色法。前人曾对滴定法、比色法两种测糖法进行过研究,如王欢等[4]固态发酵食醋中还原糖、总糖含量测定,董林青等[5]应用不同方法测定发酵液中糖的含量,何红梅等[6]在食品中还原糖含量测量的不确定度评估,邱晓红等[7]在富含脂肪食品总糖含量的测定,研究了检测方法、不确定度、前处理方法等。但对两种检测方法的对比研究较少,特别是检测方法适用性研究较少,本试验拟通过对菊芋鲜品样品进行总糖和还原糖含量检测方法研究,比较分析费林试剂滴定法和3,5-二硝基水杨酸比色法在实际应用中的利弊,并分析糖含量高低对于检测结果的影响及方法的适用性,旨在为食品质量安全检验和食品企业指导生产服务。
1 材料与方法
1.1 试验材料
本试验用湘西野生菊芋和网购菊芋(浙江金华县)作为检测对象。
1.2 试剂
盐酸、氢氧化钠:优级纯,国药集团化学试剂有限公司;
葡萄糖:分析纯,天津市科密欧化学试剂有限公司;
五水硫酸铜:分析纯,广东省化学试剂工程技术研究开发中心;
酒石酸钾钠:分析纯,湖南汇虹试剂有限公司;
3,5-二硝基水杨酸试剂:化学纯,国药集团化学试剂有限公司。
1.3 设备与仪器
紫外可见分光光度计:UV-2500型,岛津仪器(苏州)有限公司;
分析天平:BSA 224S型,长沙康源科技开发有限公司;
电热恒温水浴锅:DZKW-S型,北京市永光明医疗仪器有限公司。
1.4 样品检测
1.4.1 样品前处理
(1) 制样:样品洗净、阴干、取可食部分,用均质器均质3 min,制成均匀样品备用。
(2) 样品中还原糖检测:称取均匀样品5~6 g置于250 mL 三角瓶中,直接用50 mL水振荡提取(必要时加入乙酸锌和亚铁氰化钾各5 mL,用于去除蛋白质和脂肪),然后用水定容至250 mL过滤即可。
(3) 样品中总糖的检测:称取约样品2 g置于250 mL三角瓶中,加入盐酸水溶液(3∶20)130 mL,于三角瓶上加1 m长玻璃回流管,沸水浴中酸水解15 min,然后冷水冷却,用6 mol/L 氢氧化钠溶液调pH至中性(必要时加入乙酸锌和亚铁氰化钾各5 mL,用于去除蛋白质和脂肪),并用水定容至250 mL用滤纸过滤,得总糖水解液。
1.4.2 费林试剂滴定法(简称滴定法)
(1) 费林AB液标定:准确吸取费林A、B溶液各5 mL放入预先加入20 mL水的200 mL锥形瓶中(可预先加入一定量的标准葡萄糖液,一般加入9~10 mL),摇匀后置于电炉上加热至沸腾(为使三角瓶受热均匀及易于观察终点颜色,可在电炉上加一石棉网),用1.0 mg/mL葡萄糖标液滴定至终点(蓝色刚好消失),记录消耗葡萄糖标准溶液的体积,即得K值(即费林AB液各5 mL相当于1.0 mg/mL葡萄糖标准液量)。
(2) 样品预滴定:准确吸取费林A、B溶液各5 mL放入预先加入20 mL水的200 mL锥形瓶中,摇匀后置于电炉上加热至沸腾,用样品水解液滴定至终点,记录消耗水解液的体积。
(3) 样品正式滴定:准确吸取费林A、B溶液各5 mL放入预先加入20 mL水的200 mL锥形瓶中,加入比预滴定少1 mL的样品水解液,摇匀后置于电炉上加热至沸腾,用样品水解液滴定至终点,记录消耗水解液的体积(注:整个滴定过程控制在2 min内完成)。
(4) 还原糖(以葡萄糖计)含量计算:
(1)
式中:
X——试样中还原糖的含量,%;
K——费林AB液各5.0 mL相当于1.0 mg/mL葡萄糖标准液量,mL;
250——样品检测过程定容体积,mL;
V——试样滴定费林AB时消耗的体积,mL;
M——样品重量,g。
1.4.3 3,5-二硝基水杨酸比色法(简称比色法)
(1) 样品及标准液前处理:按表 1试验设计取不同体积的1.0 mg/mL葡萄糖标准溶液和样品处理液放入25 mL比色管中,并补足水量至3 mL,各比色管中加入显色试剂2.0 mL,沸水浴中加热5 min,冰水浴中冷却后定容至25 mL摇匀(注:沸水浴及冰水冷却条件尽量一致),比色反应30 min 后在540 nm波长处测定其吸光度Abs值,由葡萄糖标准液浓度(质量含量)与吸光度Abs值作标准曲线。
(2) 还原糖(以葡萄糖计)含量计算:
(2)
式中:
X——试样中还原糖的含量,%;
m'——根据标准曲线计算得的比色液中葡萄糖含量,mg;
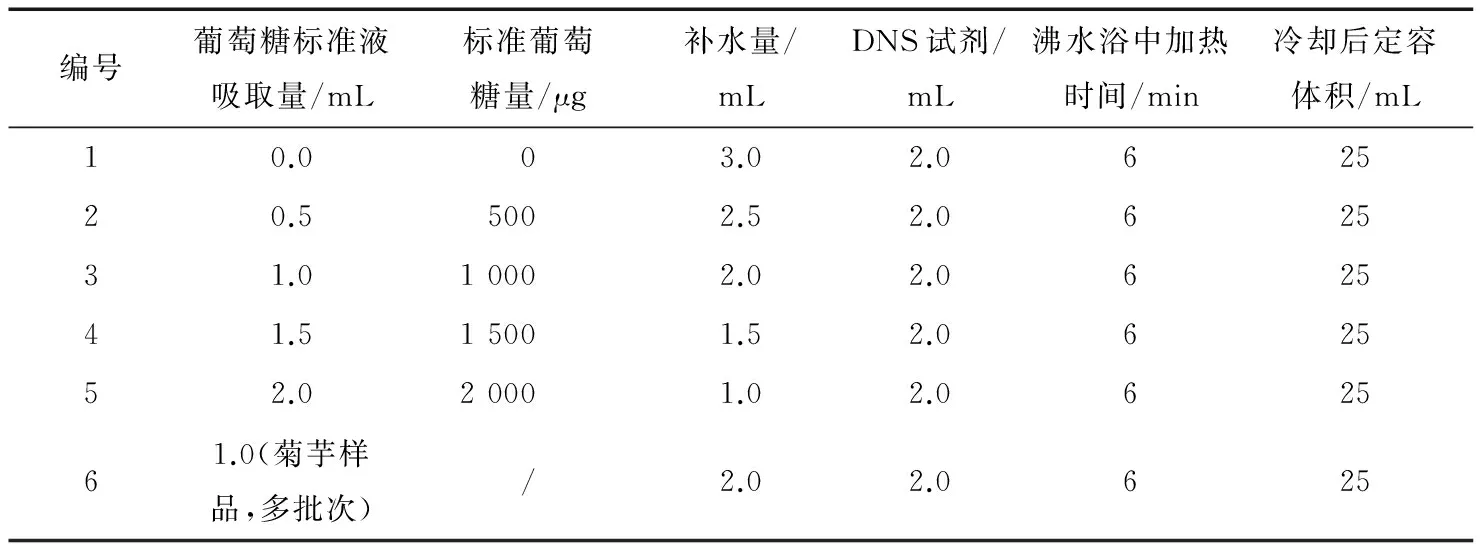
表1 样品及标准液前处理设计表†Table 1 Liquid samples and standards before processing design table
† 沸水浴完成后,于冰水中快速冷却至室温。
250——样品检测过程定容体积,mL;
f——稀释倍数;
v——比色测定时移取试样待测液的体积,mL;
m——样品重量,g。
2 检测结果与数据分析
2.1 吸收光谱波长的选择
经查王欢等[4]、董林青等[5]等论文资料,及NY/T 2332—2013《红参中总糖含量的测定 分光光度法》等标准,对DNS比色法检测波长通常为490,500,510,520,540 nm,本试验通过对标准系列中间点1 500 μg 在400~600 nm进行光谱扫描,发现在540 nm处吸收最为明显且稳定,故本试验检测波长用540 nm。
2.2 显色反应体系的稳定性
通过对标准系列中间点1 500 μg在不同时间段内吸光值及标准物含量的检测,检测结果及数据分析见表2。
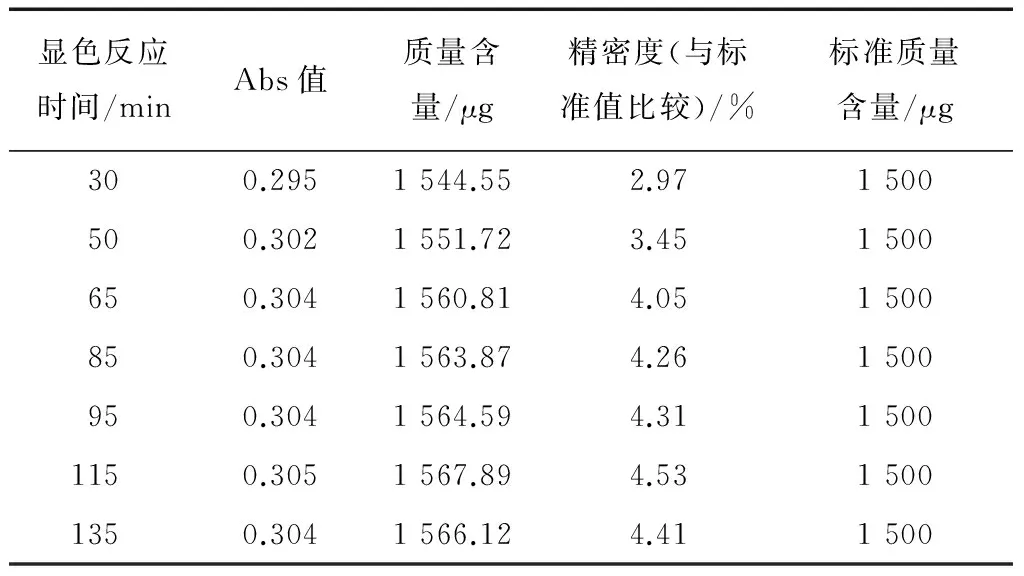
表2 显色反应体系的稳定性†Table 2 The stability of chromogenic reaction system
† 数据分析:平均值1 559.93 μg,极差值21.57 μg,SD值8.60,RSD值0.55%。
由表2可知,标准葡萄糖1 500 μg显色反应体系的稳定性很高,30~135 min显色反应体系非常稳定,平均值1 559.93 μg,极差值21.57 μg,精密度均大于95%以上,RSD值0.55%。
2.3 标准曲线的情况
按表1设计所得葡萄糖标准曲线为X1=6 392.070 57Y+12.233 5,相关系数R2=0.999,估计的标准误差为45.539 7;残余标准偏差为40.732 0(仪器系统提供的数据);本试验同时用果糖作为标准品进行比色法测定,其标准曲线为X2=5 272.656 2Y-9.275 7,相关系数R2=0.999,说明两种标准品得出的标准曲线均非常理想,标准液检测结果及数据分析见表3。
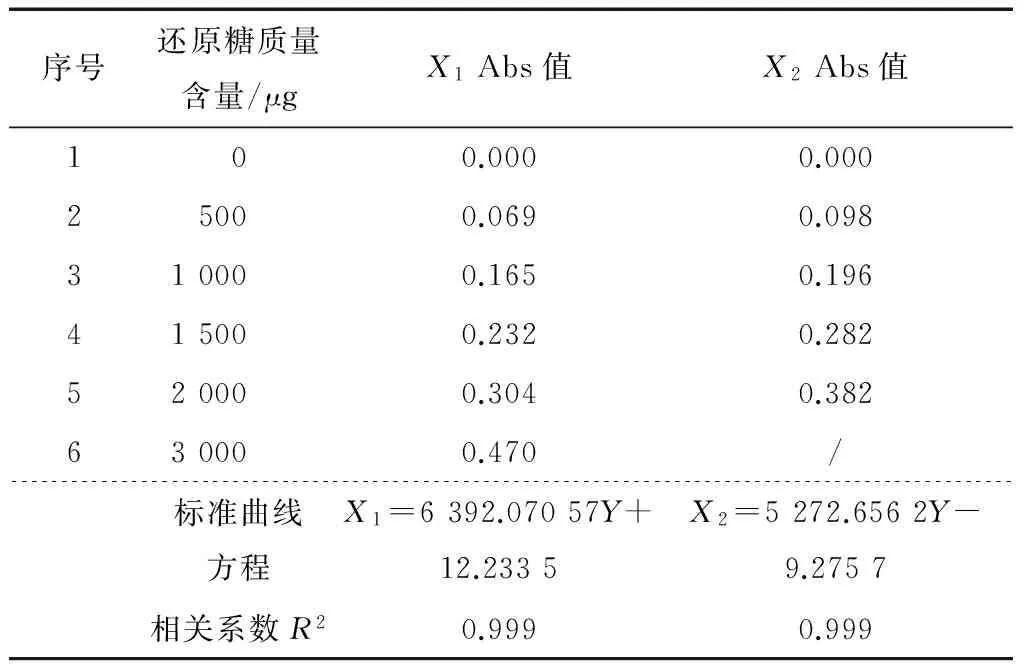
表3 标准液检测结果及数据分析Table 3 Standard test results and data analysis
2.4 样品总糖检测
用两种不同检测方法对同一样品总糖进行5次平行检测,所得检测结果及相对平均偏差、相对标准偏差等数据分析见表4。
由表4可知,样品总糖检测直接滴定法重复测定5次,通过计算测定结果,相对平均偏差为1.59%,RSD为2.00%,说明其精密度比较高。用比色法对同一样品重复测定5次,由表4中“对应比色液糖含量”和样品检测结果分析可知,相对平均偏差为1.37%,RSD为1.68%(因为数据分析要考虑样品称样量及处理过程稀释倍数等因素,故在此只分析检测结果数据而不分析比色液糖含量数据),说明样品比色液糖含量1 500 μg以上的样品,比色法的精密度也很高。
2.5 样品还原糖检测
用两种不同检测方法对5个样品进行还原糖项目的检测,所得结果及数据分析见表5。
由表5可知,比色液糖含量低于1 500 μg的样品滴定法检测样品平行性较差(因为数据分析要考虑样品称样量及处理过程稀释倍数等因素,故在此只分析检测结果数据而不分析比色液糖含量数据),精密度一般在8%~13%,而比色法精密度一般在2.0%~4.5%,说明比色液糖含量低于1 500 μg 样品的检测比色法比滴定法平行性和重现性均高很多。
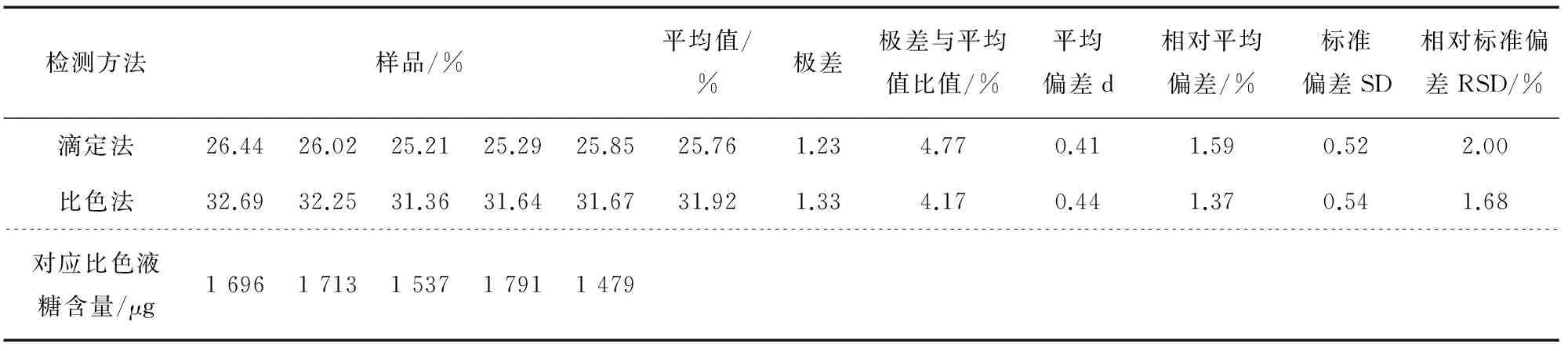
表4 样品总糖检测结果及数据分析Table 4 Samples of total sugar test results and data analysis
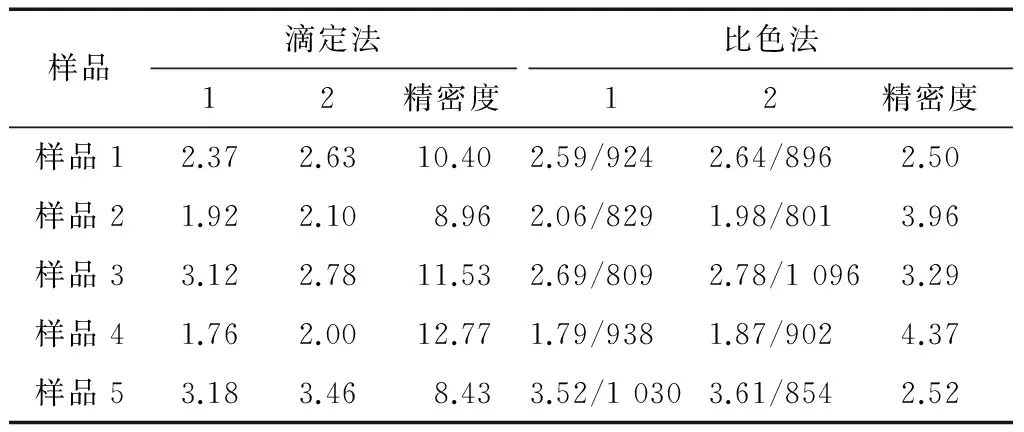
表5 样品还原糖检测结果及数据分析†Table 5 Sample reducing sugar test results and data analysis %
† 样品1、3、5为湘西野生菊芋;样品2、4为浙江金华菊芋;精密度是指在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的5%。“/”后数据为对应比色液糖含量,单位为μg。
2.6 不同浓度葡萄糖标液的检测
用两种检测方法检测不同溶度标准葡萄糖液,所测结果及数据分析见表6。
由表6可知,采用直接滴定法测定不同浓度(或质量含量)的葡萄糖标液含量,1 500 μg标准葡萄糖液RSD值滴定法为1.86%,比色法为3.04%,而150 μg葡萄糖标准液RSD值滴定法为5.04%,比色法3.27%,可见滴定法较适宜于检测高浓度样品,与2.4和2.5的分析一致。综上可知,① 两种方法检测样品的重复性均较好,但滴定法在检测较低浓度样品时其精密度和相对标准偏差较大,如表5中样品1、3、4,以及表6中的150 μg的标准液,因为费林试剂滴定法影响因素较多如玻璃仪器、滴定时间、化学反应、人员因素等,且滴定法终点计量控制为1滴或半滴,而没有更准确的计量方法,从而导致的误差对于低浓度样品则更为突显。而比色法对高低浓度的检测精密度控制均在于其氨基化合物的生成量,以化学量比关系反应作为计量方法,故浓度高低对于检测结果影响不大(只要保证显色剂过量和Abs值在标准曲线范围内即可);② 在比色法检测过程中发现,相同浓度的标准点其每次的吸光度Abs值相差较大,故要求每次检测样品必同时做相同条件的标准曲线,比色法对于受热程度、煮沸时间、冷却时间等控制要求一致,并且每批次检测必做相同条件的标准曲线;③ 滴定法检测适用于高浓度样品的检测,其对于自带颜色产品检测又有其特定优势,比色法检测适用于高浓度和低浓度样品检测,但对于自带颜色样品的检测受干扰影响较大。
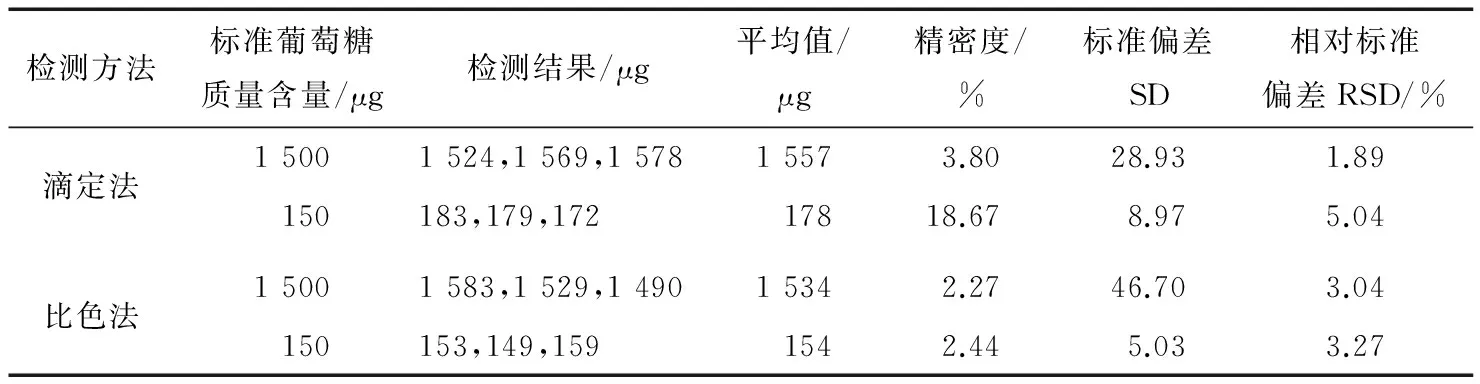
表6 不同浓度葡萄糖标液测定结果及数据分析†Table 6 Different concentrations of glucose standard solution determination results and data analysis
† 精密度指检测平均值减去标准值的差值与标准值比值,反应检测值与标准值的相符性或接近性。
3 结论
试验证明1 500 μg标准葡萄糖显色反应体系在常温下稳定性很高,平均值1 559.93 μg,极差值21.57 μg,精密度均大于95%以上,RSD值0.55%,标准曲线相关系数R2=0.999。在测定菊芋中总糖和还原糖含量时,费林试剂滴定法和3,5-二硝基水杨酸比色法均适用于较高浓度(比色液糖含量1 500 μg以上)样品的检测,滴定法RSD为2.00%,比色法RSD为1.68%;但对于浓度较低(比色液糖含量低于1 500 μg 以下)样品的检测宜使用比色法,滴定法检测样品平行性较差,精密度一般在8%~13%,而比色法精密度一般在2.0%~4.5%。3,5-二硝基水杨酸比色法应用较为广泛,处理过程简单可控,可用于大批量检测,适用于不同含量样品的检测,但不适用于自带颜色样品的检测。
[1] 郭洪涛, 郭衍银. 菊芋资源开发与利用研究进展[J]. 山东农业科学, 2011(11): 69-70.
[2] 乌日娜, 朱铁霞, 于永奇, 等. 菊芋的研究现状及开发潜力[J]. 草业科学, 2013(8): 1 295-1 300.
[3] 赵琳静, 燕方龙, 宋小平, 等. 菊芋菊糖的研究进展[J]. 食品研究与开发, 2008(4): 186-187.
[4] 王欢, 卢红梅, 张义明, 等. 固态发酵食醋中还原糖、总糖含量测定[J]. 中国酿造, 2011(9): 172-174.
[5] 董林青, 牛国文, 刘志毅, 等. 应用不同方法测定发酵液中的糖含量[J]. 广东化工, 2009(9): 177-178.
[6] 何红梅, 陈利国, 黄辉, 等. 食品中还原糖含量测量的不确定度评估[J]. 食品与机械, 2007, 23(3): 96-97, 107.
[7] 邱晓红, 周炳全. 富含脂肪食品总糖含量的测定[J]. 食品与机械, 2005, 21(6): 55-57.
Comparative study on two methods for sugar detection in Jerusalem artichoke
ZHANG Xue-ying1HUANGZhong-yi2ZHANHFa-sheng1SHIYan1HUANGJing1
(1.XiangxiAutonomousPrefecture,TheFoodandDrugInspection,Jishou,Hunan416000,China; 2.HunanFoodSupervisionandInspectionInstitute,Changsha,Hunan410000,China)
This paper compared the pros and cons, the operability of two methodology, by using the Fenlin reagent titration and the 3,5-dinitrosalicylic acid colorimetry, to determine the reducing sugar content and the total sugar content in the wildJerusalemartichokefrom Xiangxi. The RSD value is 2.00% by using Fenlin reagent titration and the precision is 8%~13%, while, the RSD value is 1.68% by using 3,5-dinitrosalicylic acid colorimetry and the precision is 2.5%~4.0%. It is concluded that the Fenlin reagent titration method is susceptible to the finish measurement etc factors, especially for samples with low sugar content, but is more suitable for detection of sample with color, while the 3,5-dinitrosalicylic acid colorimetric method is simple, fast and suitable for batch processing, the RSD value is 0.55% when the color reaction system is in 135 min, the color reaction system is quite stable, little effect on the low concentration sample, and the result is more accurate.
3, 5-2 nitro salicylic acid colorimetry; the fehling reagent titration; inulin; reducing sugar
张学英(1975-),女,湘西自治州食品药品检验所高级工程师,硕士。E-mail: 1760013691@qq.com
2017-01-03
10.13652/j.issn.1003-5788.2017.02.014
