多因素与大肠杆菌蛋氨酸合成代径的关系
2017-04-12孟青高海军
孟青,高海军
(北京理工大学生命学院,北京,100081)
多因素与大肠杆菌蛋氨酸合成代径的关系
孟青,高海军
(北京理工大学生命学院,北京,100081)
蛋氨酸是人体必需的8种基本氨基酸之一。蛋氨酸生物合成途径受多因素作用,包括水解酶,维生素B12,硫供应平衡的调控,末端代谢产物对合成关键基因的阻遏及抑制,阻遏蛋白MetJ和乳酸对蛋氨酸代谢合成的阻遏及抑制,及蛋氨酸在菌体内的转运等。本文介绍了与蛋氨酸生物合成相关的影响因素。
蛋氨酸;生物合成;调控机制;硫平衡;转运机制
蛋氨酸又名甲硫氨酸,是8种必需氨基酸中的唯一含硫氨基酸。它在代谢过程中能维持机体氮平衡,促进肝内脂肪代谢,临床被用于脂肪肝、慢性肝炎的预防和治疗,还用于砷、苯中毒的辅助治疗。蛋氨酸是家禽玉米一豆粕型饲粮中限制性氨基酸[1],添加适当蛋氨酸,能有效改善家禽的免疫状况、生长性能、血液生化指标状况及繁殖性能[2,3]。蛋氨酸被推广了到饲料生产、食品、医疗、保健等多个行业。近年来,全球市场对蛋氨酸的需求量不断增长。
蛋氨酸的主要生产方法为化学法:一是海因法,为日本曹达公司、住友化学公司、德国的迪高沙公司采用,产品为固态DL-氨基酸;另一种是氰醇法,为美国的NOVUS国际公司采用,产品为液体蛋氨酸羟基类似物(Methionine hydroxyl analogue,MHA)[4]。化学法生产蛋氨酸经济指标低,排污大。微生物发酵法已廉价获得了许多氨基酸,但蛋氨酸难以大量发酵合成,故研究微生物发酵法合成蛋氨酸具有巨大意义[5, 6, 7]。
1 蛋氨酸生物合成的基本途径
蛋氨酸属于天冬族氨基酸,它以草酰乙酸或天冬氨酸为原料(如图1)合成。蛋氨酸的直接合成途径涉及到的合成酶有MetL、MetA、MetB、MetC、MetE、MetH等,蛋氨酸合成的分支途径赖氨酸合成途径涉及的酶包括DapA、DapB、LysA,另一个分支途径苏氨酸合成途径涉及的酶为ThrB、ThrC、IlvA、IlvB、IlvC、IlvD、IlvE,蛋氨酸合成的硫底物赖氨酸到胱硫醚涉及的酶为CysE、CysK、CysM。合成的蛋氨酸可经蛋氨酸甲基转移酶(MetK)催化生成S-腺苷甲硫氨酸。
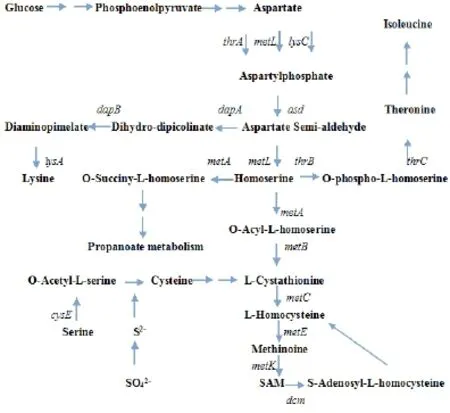
图1 蛋氨酸合成途径及相关基因
2 大肠杆菌中影响蛋氨酸合成的因素
2.1 蛋氨酸合成酶的稳定性
在大肠杆菌中,蛋氨酸生物合成途径中发挥作用的第一个酶是高丝氨酸琥珀酰转移酶(MetA)[8]。它不同于大多数稳定的细菌蛋白,对许多极端条件(高温、强氧化、过酸)都很敏感[9,10]。温度高于25℃时,MetA活性降低且蛋白结构趋向展开,大肠杆菌出现蛋氨酸营养缺陷型生长。温度超过44℃时,MetA发生完全不可逆的聚集沉淀,导致菌体生长受限[11]。蛋白质的稳定性是由N端残基决定的(即N端法则)[12]。Dvora Biran以缬氨酸代替MetA的N端残基脯氨酸后,发现MetA的稳定性并无改变,证明了MetA的稳定性并不遵循N端法则[12]。Mordukhova报道了MetA蛋白的稳定性与它的两个残基——异亮氨酸299和天冬氨酸267有关,将这两个残基替换以后,MetA稳性增加[13]。化学分子伴侣氧化三甲胺也可增加MetA的稳定性并使菌体在较高的温度下正常生长[14]。由于MetA极易倾向于聚集状态,有学者建议将其归纳为分子伴侣的第三类底物,Mordukhova发现大肠杆菌突变菌株在去除分子伴侣或是ATP依赖蛋白后,其MetA在37℃(正常生理温度条件下)出现异常构象而影响菌体生长,在突变菌株的培养基中加入蛋氨酸后,菌株恢复正常生长[15]。
2.2 蛋氨酸合成酶的分子的调控
MetJ是属于ribbon-helix-helix家族蛋氨酸合成阻遏蛋白。它通过两股反向β折叠与DNA的大沟结合[16],两个外部的α螺旋和与DNA邻近的蛋白质相互作用。MetJ以二聚体的形式识别并绑定到DNA上一段共有的8bp的DNA回文序列上[17],这段序列被称为met-box。MetJ能通过协助扩散作用迅速找到作用靶位点[18],而S-腺苷蛋氨酸是蛋氨酸代谢途径的最终产物,它作为MetJ的辅阻遏物能增强这种识别作用。S-腺苷蛋氨酸在与MetJ的结合过程中,能与DNA的磷酸骨架产生很强的静电作用,从而使MetJ与DNA的作用增强100倍[19]。受MetJ调控的基因在自身的调控序列中一般含有2-5个连续的可与MetJ相互作用的met-box[20]。在蛋氨酸合成途径中,受到MetJ调控作用的基因有ahpC, ahpF, folE, metA, metB, metC, metE, metF, metI, metK, metL, metN, metQ, metR, yeiB,另外,metJ基因自身也受到MetJ的阻遏作用。
MetR是蛋氨酸合成中的激活调节蛋白。Urbanowski1986年提出了MetR作为反式激活因子对MetE和MetH都具有调控作用[21]。在大肠杆菌中,metR经测序确定有317个氨基酸[22],包含一个与真核生物DNA结合蛋白特征相同的亮氨酸拉链。Maxon将MetR蛋白中亮氨酸拉链区域的两个亮氨酸替换或是把其中一个用脯氨酸代替时MetR失去生物活性,并确定了MetR的一个区域与同型半胱氨酸共激活metE相关[23],在metE和metH转录过程中,需要依靠MetR激活蛋白的作用。MetR在溶解状态下是一个二聚体,绑定DNA到共有序列5’-TGAANNTNNTTCA-3’上[24]。MetR以同型半胱氨酸作为共激活剂,可以使metE表达提高200倍。而metH的表达则不需要同型半胱氨酸的共激活作用。
2.3 维生素B12和锌指在甲基转移过程的作用
蛋氨酸的生物合成主要涉及两条途径,一条途径形成同型半胱氨酸,另一条则形成甲基供体-N5-甲基四氢叶酸。蛋氨酸合成的最后一步是由N5-甲基四氢叶酸提供一碳单位转移到同型半胱氨酸的甲基转移作用[25]。在大肠杆菌中,存在两种酶催化此反应,一种酶是metH的基因产物,被称为B12依赖型的甲基转移酶,包含一个与甲基转移相关的钴胺酰胺辅基;另一种酶是metE的基因产物,是一种B12非依赖型的甲基转移酶,它主要是大肠杆菌在脱阻遏条件下表达[26]。metE基因表达的调控过程非常复杂,像其他met基因(除metH外)一样,它也被生长培养基中高水平的蛋氨酸浓度抑制[27,28,29,]。编码甲基四氢叶酸的基因metF间接调控metE,在维生素B12及其派生物存在时,metE和metF的基因表达受到抑制。B12抑制metE的原理是损耗了共激活剂同型半胱氨酸而降低了MetR的激活作用。在MetH全酶形成甲基-B12酶时,甲基四氢叶酸对于甲基转移到B12是必须的,催化甲基化这一过程发生的MetH蛋白对metE的表达具有调控作用[30] 。YagD是锌指依赖的甲基转移酶,其催化机制与MetH相似,它催化S-甲基蛋氨酸或S-腺苷蛋氨酸与同型半胱氨酸合成蛋氨酸,YagD由MetJ-S-腺苷蛋氨酸系统调控[31]。
2.4 硫平衡
硫元素广泛存在于蛋白质和其他重要的生物分子中,对生物机体非常重要。蛋氨酸作为甲基供体s-腺苷甲硫氨酸的前体,是生物体重要的含硫氨基酸。细菌、真菌和植物可以利用无机硫(SO4、H2S等)合成半胱氨酸进而合成蛋氨酸[32,33]。从化学基础的角度分析,天冬氨酸直接合成蛋氨酸需要消耗1个ATP和2个NADPH,再结合被氧化的无机硫,需要另外消耗2个ATP,一个GTP和4个NADPH,由此可见硫底物影响很大。如果减少硫底物同化作用的耗能(如以气态甲硫醇或是液态二甲基-二硫醚代替无机硫),极有可能提高蛋氨酸的产量[34]。同化硫的途径和与之相关的酶已经在大肠杆菌中研究的较为清楚,其中CysZ是大肠杆菌内膜蛋白,负责转运用于合成半胱氨酸的硫酸盐[35],在硫酸盐浓度较低的条件下,菌体尤其依赖cysZ基因。另外,CysZ与半胱氨酸生物合成的中间物亚硫酸盐的相互作用比它与硫酸盐的相互作用更为密切,当亚硫酸盐存在时会抑制硫酸盐的转运,说明亚硫酸盐可通过反馈调节机制通过CysZ调控硫酸盐的摄入。硫酸盐的摄入过程依靠质子梯度[36]。大多数与硫同化途径相关的基因都被转录因子CysB调控,在细胞缺乏半胱氨酸时,该转录因子激活调节子使细胞产生应答[37]。YciW是cysB的调节子,近年来,有研究通过在大肠杆菌中对yciW过表达,成功的积累了同型半胱氨酸,也表明了yciW与蛋氨酸的生物合成途径相关[38]。
2.5 蛋氨酸的转运
尽管野生型大肠杆菌能从头合成蛋氨酸,仍需要额外的蛋氨酸或是蛋氨酸类似物来满足细胞生长。大肠杆菌的蛋氨酸转运系统与蛋氨酸机体内部与外部的浓度有关[39]。细胞内部蛋氨酸聚集或是外部浓度偏高会使蛋氨酸摄取比率降低,相反,蛋氨酸匮乏的营养缺陷型菌会增加对外部蛋氨酸的运输[39]。研究表明蛋氨酸进入大肠杆菌涉及两种特殊的转运蛋白-高亲和力的MetD转运系统和低亲和力的MetP转运系统[40](如图2),他们都受到细胞内部蛋氨酸浓度的调控。D-蛋氨酸的转运既依赖ATP又对渗透
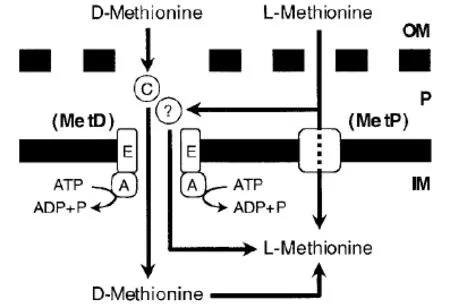
图2[57]蛋氨酸转运到大肠杆菌模式图
压敏感,对渗透压的敏感与周质蛋白有关[41],这些属性是典型的ABC转运体的特征。尽管MetD和MetP都能转运L-蛋氨酸,但只有MetD能转运D-蛋氨酸[57]。MetD包括ATP酶、透性酶YaeE、底物结合蛋白YaeC,它的表达受L-蛋氨酸和MetJ的抑制作用。L型蛋氨酸阻遏D型的摄取,而D型对L型异构体的摄取无影响[42]。根据Kadner的实验,MetD对于两种蛋氨酸异构体拥有不同的基质绑定位点。蛋氨酸可在MetD的协助下,利用浓度梯度转运(吸收过程属于温度敏感型),蛋氨酸的浓度梯度及温度对蛋氨酸摄取的影响表明蛋氨酸进入细菌细胞的过程是需能的激活转运过程。摄取系统均由菌体内蛋氨酸水平调控,不同情况下在亲和力上至少相差400倍[40,42]。在大肠杆菌中,转运至细胞的蛋氨酸以s-腺苷蛋氨酸的形式积累,主动运输会在添加叠氮化物或氟化物时会受到抑制[40]。在L-蛋氨酸摄取初始时期,培养基中加入α-酮基-λ-甲基丁酸、D-蛋氨酸,或蛋氨酸亚砜时对L-蛋氨酸的摄入并无影响,而加入蛋氨酸类似物或蛋氨酸合成前体物质时,L-蛋氨酸的摄入量减少[39]。
2.6 蛋氨酸生物合成分支代谢产物的调控
蛋氨酸生物合成的分支代谢途径主要终产物是赖氨酸、苏氨酸和异亮氨酸。因此,赖氨酸营养缺陷型、苏氨酸营养缺陷型和异亮氨酸营养缺陷型都可使蛋氨酸合成途径去阻遏,并使碳流向蛋氨酸,有利于蛋氨酸的过表达[43]。天冬氨酸激酶是天冬氨酸族氨基酸合成代谢途径的第一个酶,存在三个不同的天冬氨酸激酶,天冬氨酸激酶Ⅰ(ThrA) 受到苏氨酸和异亮氨酸的阻遏和抑制作用;天冬氨酸激酶Ⅱ(MetL)受到蛋氨酸的阻遏和抑制作用而天冬氨酸激酶Ⅲ(LysC) 受到赖氨酸的阻遏和抑制作用。另外,高丝氨酸酰基转移酶(MetA)同时受到蛋氨酸及S-腺苷蛋氨酸的抑制作用。
2.7 其他分子对蛋氨酸合成的影响
弱酸能抑制蛋氨酸的合成。几千年前人们就开发利用了弱酸的防腐作用,其机理为:未解离的酸能自由穿过磷脂双分子层,在胞质中释放质子并积累,降低pH[44],从而抑制细胞的生长。细胞对弱酸的应答非常复杂。Pomposiello等用5 mM的水杨酸盐处理细胞发现基因的转录受到影响[45]。Han在发酵过程中发现蛋氨酸能解除乙酸对大肠杆菌生长的抑制作用[46]。Roe 对此做了进一步研究,发现在乙酸环境中生长的大肠杆菌细胞体内的蛋氨酸生物合成代谢中间产物同型半胱氨酸含量大大增加,说明弱酸抑制了此中间产物的下游代谢过程,进而抑制了蛋氨酸合成,中间代谢物堆积造成的毒性及低pH也导致了细胞生长的抑制[47]。
3 蛋氨酸生产中相关问题的研究及展望
自然界中可以在植物或动物中存在少量L-蛋氨酸,高水平蛋氨酸在蛋(卵清蛋白,5%)和种子(巴西坚果,12%)中存在,动物蛋白如昆虫及其幼虫中也含较多蛋氨酸,但通过加工动物残余物(肉粉、鱼粉、骨粉、羽毛粉)来获得蛋氨酸因安全原因(疯牛病、禽流感)在许多国家是被严格控制的。1970年科研人员对利用单细胞蛋白生产蛋氨酸进行了广泛的研究,研究的菌体大部分为酵母、藻类、甲基营养菌等,但是存在如一些污染物产生霉毒素,酵母中蛋氨酸含量不足等问题。考虑到环境及经济原因,植物作为研究对象更加适合。葡萄糖胺也是一种非常有潜能的蛋氨酸发酵原材料,它是几丁质(地球生最丰富的生物高聚物)的降解物[48]。还有许多出版物及专利尝试利用代谢工程改造菌体,优化能量和氧化还原平衡、硫供应平衡,使用特殊的前体细胞,增加向胞外转运产物或向胞内转运基质产物的效率等办法提高蛋氨酸的产量[49-53]。通过基因操作技术来改造蛋氨酸合成的途径是一个非常热门的课题,第一次尝试是在植物中进行基因操作以提高种子蛋白中蛋氨酸含量[54]。在80年代中期开始对细菌和酵母菌实施改造,同时也出现了许多针对在大肠杆菌和谷氨酸棒杆菌中蛋氨酸生物合成相关的综述[50,55]。Figge持有的许多专利成为法国迈陀保利克公司改造大肠杆菌发酵L-蛋氨酸的依据[52,56]。随着生物工程代谢研究的深入,有望通过构建蛋氨酸的高产菌株实现普遍的蛋氨酸发酵的工业化。
[1] Bunchasak C. Role of dietary methionine in poultry production [J]. Journal of Poultry Science, 2009, 46(3):169-179.
[2] Rama Rao S V, Praharaj N K, Ramasubba R V,et al. Interaction between genotype and dietary concentrations of methionine for immune function in commercial broilers [J]. British Poultry Science, 2003, 44(1):104-112.
[3] Hickling D, Guenter W, Jackson M E. The effects of dietary methionine and lysine on broiler chicken performance and breast meat yield [J]. Canadian Journal of Animal Science, 1990, 70(2):673-678.
[4] 任少锋, 阎淑萍 ,张士莹等. 蛋氨酸的生产及其应用[J]. 河北化工,1996,(01):37-40.
[5] Pham C B, Galvez C F, Padolina W G. Methionine fermentation by batch fermentation from various carbohydrates [J]. ASEAN Food Journal,1992;7:34-7.
[6] Umerie S C, Ekwealor I A, Nawabo I O. Lysine production from various carbohydrates and seed meals [J]. Bioresour Technol ,2000;75:249-52.
[7] Odunfa S A, Adeniran S A, Teniola,et al. Evaluation of lysine and methionine production in some Lactobacilli and yeasts from ogi. [J]. International Journal of Food Microbiology, 2001, 63(1-2):159-163.
[8] Dvora B, Eyal G, Leora G,et al. Control of methionine biosynthesis in Escherichia coli by proteolysis [J]. Molecular Microbiology, 2000, 37(6):1436-1443.
[9] Price C M, Fazzio T G, Vallbona E I,et al. Polyphosphate kinase protects Salmonella enterica from weak organic acid stress[J]. Journal of Bacteriology, 2005, 187(9):3088-3099.
[10] Ron E Z, Davis B D. Growth rate of Escherichia coli at elevated temperatures: limitation by methionine.[J]. Journal of Bacteriology, 1971, 107(2):391-396.
[11] Gur E, Biran D, Gazit E,et al. In vivo aggregation of a single enzyme limits growth of Escherichia coli at elevated temperatures.[J]. Molecular Microbiology, 2002, 46(5):1391-1397.
[12] Tobias J W, Shrader T E, Rocap G,et al. The N-end rule in bacteria.[J]. Science, 1991, 254(5036):1374-7.
[13] Mordukhova E A, Lee H S, Pan J G. Improved thermostability and acetic acid tolerance of Escherichia coli via directed evolution of homoserine o-succinyltransferase.[J]. Applied & Environmental Microbiology, 2008, 74(74):7660-8.
[14] AmChem. The chemical chaperone trimethylamine oxide reduces insoluble MetA accumulation and improves E. coli growth at elevated temperatures Osborne TB Sulphur in protein bodies [J]. Soc, 1902,24:140-167
[15] Mordukhova E A, Kim D, Pan J G. Stabilized homoserine o-succinyltransferases (MetA) or L-methionine partially recovers the growth defect in Escherichia coli, lacking ATP-dependent proteases or the DnaK chaperone [J]. BMC Microbiology, 2013, 9(1):1-13.
[16] Somers W S. Crystal structures of methionine repressor of E. coli and its complex with operator.[J]. University of Leeds, 1990.
[17] Smith A A, Greene R C, Kirby T W,et al. Isolation and characterization of the product of the methionine-regulatory gene metJ of E.coli K12[J]. Proceedings of the National Academy of Sciences, 1985, 82(18):6104-6108.
[18] Augustus A M, Reardon P N, Spicer L D. MetJ repressor interactions with DNA probed by in-cell NMR.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(13):5065-5069.
[19] Phillips K, Phillips S E. Electrostatic activation of Escherichia coli methionine repressor.[J]. Structure, 1994, 2(4):309-316.
[20] Old I G, Phillips S E, Stockley P G,et al. Regulation of methionine biosynthesis in the Enterobacteriaceae.[J]. Progress in Biophysics & Molecular Biology, 1991, 56(56):145-185.
[21] Urbanowski M L, Stauffer L T, Plamann L S,et al. A new methionine locus, metR, that encodes a trans-acting protein required for activation of metE and metH in Escherichia coli and Salmonella typhimurium.[J]. Journal of Bacteriology, 1987, 169(4):1391-1397.
[22] Plamann L S, Stauffer G V. Nucleotide sequence of the Salmonella typhimurium metR gene and the metR-metE control region.[J]. Journal of Bacteriology, 1987, 169(9):3932-3937.
[23] Maxon M E, Wigboldus J, Brot N,et al. Structure-functionstudies on Escherichia coli MetR protein, a putative prokaryotic leucine zipper protein.[J]. Proceedings of the National Academy of Sciences, 1990, 87(18):7076-7079.
[24] Urbanowski M L, Stauffer G V. Genetic and biochemical analysis of the MetR activator-binding site in the metE metR control region of[J]. Journal of Bacteriology, 1989, 171(10):5620-5629.
[25] Taylor R T, Weissbach H. 4 N 5 -Methyltetrahydrofolate-Homocysteine Meihyltransferases [J]. Enzymes, 1973, 9:121-165.
[26] Whitfield C D, Jr S E, Weissbach H. Purification and properties of 5-methyltetrahydropteroyltriglutamate-homocysteine transmethylase.[J]. Journal of Biological Chemistry, 1970, 245(2):390-401.
[27] Ahmed A. Mechanism of repression of methionine biosynthesis in Escherichia coli. I. The role of methionine, s-adenosylmethionine, and methionyl-transfer ribonucleic acid in repression.[J]. Molecular Genetics and Genomics, 1973, 123(4):325-331.
[28] Dawes J, Foster M A. Vitamin B 12, and methionine synthesis in Escherichia coli [J]. Biochimica et Biophysica Acta (BBA) -General Subjects, 1971, 237(3):455-464.
考虑到锡石多金属硫化矿中黄铁矿含量较高,下面以黄铁矿与脉石为例分析微波加热预处理微波选择性加热过程应力的产生机理,以及如何对微波助磨产生影响。
[29] Greene R C, Williams R D, Kung H F,et al. Effect of methionine and vitamin B-12 on the activities of methionine biosynthetic enzymes in metJ mutants of Escherichia coli K12.[J]. Archives of Biochemistry & Biophysics, 1973, 158(1):249-256.
[30] Cai X Y, Maxon M E, Redfield B,et al. Methionine synthesis in Escherichia coli: effect of the MetR protein on metE and metH expression.[J]. Proceedings of the National Academy of Sciences, 1989, 86(12):4407-4411.
[31] Thanbichler M, Neuhierl B, Bōck A. S-methylmethionine metabolism in Escherichia coli.[J]. Journal of Bacteriology, 1999, 181(2):662-665.
[32] Ravilious G E, Jez J M. Structural biology of plant sulfur metabolism: from assimilation to biosynthesis.[J]. Natural Product Reports, 2012, 29(10):1138-1152.
[33] Nakatani T. Enhancement of thioredoxin/glutaredoxinmediated L-cysteine synthesis from S -sulfocysteine increases L-cysteine production in Escherichia coli [J]. Microbial Cell Factories, 2012, 11(1):1-9.
[34] Bolten C J, Schrōder H, Dickschat J,et al. Towards methionine overproduction in Corynebacterium glutamicum--methanethiol and dimethyldisulfide as reduced sulfur sources.[J]. Journal of Microbiology & Biotechnology, 2010, 20(8):1196-1203.
[35] Parra F, Britton P, Castle C,et al. Two Separate Genes Involved In Sulphate Transport In Escherichia coli K12[J]. Journal of General Microbiology, 1983, 129(2):357-358.
[37] Kredich N M. The molecular basis for positive regulation of cys promoters in Salmonella typhimurium and Escherichia coli.[J]. Molecular Microbiology, 1992, 6(19):2747-2753.
[38] Kawano Y, Ohtsu I, Ai T,et al. Involvement of the yciW, gene in l -cysteine and l -methionine metabolism in Escherichia coli [J]. Journal of Bioscience & Bioengineering, 2014, 119(3):310-313.
[39] Kadner R J. Regulation of methionine transport activity in Escherichia coli.[J]. Journal of Bacteriology, 1975, 122(1):110-119.
[40] Kadner R J. Transport systems for L-methionine in Escherichia coli.[J]. Journal of Bacteriology, 1974, 117(1):232-241.
[41] Kadner R J, Winkler H H. Energy coupling for methionine transport in Escherichia coli.[J]. Journal of Bacteriology, 1975, 123(3):985-91.
[42] Kadner R J. Transport and utilization of D-methionine and other methionine sources in Escherichia coli.[J]. Journal of Bacteriology, 1977, 129(1):207-216.
[43] Gomes J, Kumar D. Production of l -methionine by submerged fermentation: A review[J]. Enzyme & Microbial Technology, 2005, 37(1):3-18.
[44] Russell J B, Diez G F. The Effects of Fermentation Acids on Bacterial Growth[J]. Advances in Microbial Physiology, 1998, 39: 205-234.
[45] Pomposiello P J, Bennik M H, Demple B. Genome-wide transcriptional profiling of the Escherichia coli responses to superoxide stress and sodium salicylate[J]. Journal of Bacteriology, 2001, 183(13): 3890-3902.
[46] Han k, Hong J, Lim H C. Relieving effects of glycine and methionine from acetic acid inhibition in Escherichia coli fermentation. Biotechnol Bioeng ,1993, 41: 316-324.
[47] Roe A J O, Byrne C, McLaggan D, Boot .I R. Inhibition of Escherichia coli growth by acetic acid:a problem with methionine biosynthesis and homocysteine toxicity. Microbiology, 2002, 148:2215-2222.
[48] Himmel M E, Ding S Y, Johnson D K,et al. Biomass recalcitrance: engineering plants and enzymes for biofuels production[J]. Science, 2007, 315(5813): 804-807.
[49] Trōtschel C, Deutenberg D, Bathe B,et al. Characterization of methionine export in Corynebacterium glutamicum.[J]. Journal of Bacteriology, 2005, 187(11):3786-3794.
[50] Figge R M. Methionine Biosynthesis in Escherichia coli, and Corynebacterium glutamicum[J]. Microbiology Monographs, 2006, 5:163-193.
[51] Figge R, Soucaille P, Barbier G, Bestel-Corre G, Boisart C, Chateau M. Patent to MetabolicExplorer: Increasing methionine yield. 2009WO2009/043372(A1)
[52] Dischert W, Figge R (2013a). Patent to MetabolicExplorer: A microorganism for methionine production with enhanced glucose import.WO2013/001055(A1)
[33] Ikeda M, Takeno S. Amino Acid Production by Corynebacterium glutamicum [M]// Corynebacterium glutamicum. Springer Berlin Heidelberg, 2012:107-147.
[54] Altenbach S B, Pearson K W, Meeker G,et al. Enhancement of the methionine content of seed proteins by the expression of a chimeric gene encoding a methionine-rich protein in transgenic plants [J]. Plant Molecular Biology, 1989, 13(5): 513-522.
[50] Woo H M, Park J B. Recent progress in development of synthetic biology platforms and metabolic engineering of Corynebacterium glutamicum[J]. Journal of Biotechnology, 2014, 180(15): 43-51.
[56] Dischert W, Vasseur P, Boisart C,et al. Increasing NADPH availability for methionine production: US, US9034611[P]. 2015.
[57] Merlin C, Gardiner G, Durand S,et al. The Escherichia coli metD locus encodes an ABC transporter which includes Abc (MetN), YaeE (MetI), and YaeC (MetQ)[J]. Journal of Bacteriology, 2002, 184(19):5513-5517.
Relationship Between Multifactors and Metabolism of Methionine Synthesis in Escherichia Coli
Meng Qing, Gao Haijun
(School of Life Science, Beijing Institute of Technology, Beijing 100081)
methionine is one of the eight basic amino acids necessary for human body. Methionine biosynthesis pathway is a ff ected by many factors including hydrolase, vitamin B12, regulation of sulfur supply balance, repression and inhibition of key metabolites by synthetic metabolites, repression and inhibition of methionine metabolism by MetJ and lactate, and methionine transport in bacteria. The factors associated with methionine biosynthesis is des cribed in this paper.
methionine; biosynthesis; regulation mechanism; Sulfur balance; transport mechanism
Q815
A
10. 11967/2017150102
Q815
A DOI:10. 11967/201715010102
孟青,女,理学硕士,Email:wanyanhaianxian@163.com
高海军,男,副教授,硕士生导师,Email:hj_gao@bit.edu.cn
