核桃叶片内多酚黄酮类成分对低温胁迫的响应
2017-04-12宋静武殷德松赵弟广齐贝贝陈莹莹周玲彭磊
宋静武,殷德松,赵弟广,齐贝贝,陈莹莹,周玲,彭磊
(1 云南农业大学 园林园艺学院, 云南 昆明 650201;2 云南农业大学 龙润普洱茶学院, 云南 昆明 650201;3 中国农业科学院 郑州果树研究所,河南 郑州 450009)
核桃叶片内多酚黄酮类成分对低温胁迫的响应
宋静武1,殷德松1,赵弟广3,齐贝贝1,陈莹莹1,周玲2,彭磊1
(1 云南农业大学 园林园艺学院, 云南 昆明 650201;2 云南农业大学 龙润普洱茶学院, 云南 昆明 650201;3 中国农业科学院 郑州果树研究所,河南 郑州 450009)
作为植物体内重要的次生代谢物,植物多酚对研究植物防御极端环境的基础有重要作用。为了了解核桃内多酚类成分对不同寒冷温度响应的含量变化,采用0℃、-2℃、-4℃、-6℃、-8℃几个低温进行处理,研究了在不同时间核桃叶片多种成分(多酚、黄酮、花青素、还原型VC)对低温胁迫响应的规律。结果表明:核桃叶片黄酮、茶多酚、花青素含量在不同低温胁迫下呈先降后升的变化规律,还原型VC含量在不同的低温胁迫下呈先升后降的变化规律;黄酮含量在-8℃胁迫24 h后达最高值23.64 mg/g,多酚含量在-6℃胁迫72 h后达到最高值36.71%,花青素含量在-6℃胁迫48 h后达到最高值5.22 mg/g,还原型VC含量在-2℃胁迫72 h后达到最高值193.60 mg/100g。这些结果表明,核桃叶片内源物质含量和低温胁迫有较强的相关性。
核桃叶片;低温胁迫;黄酮;多酚;花青素;还原型VC
核桃(JuglansregiaL.)是我国重要的药源植物,其青皮和叶在中药方面均有重要价值。近些年来,关于核桃内黄酮和多酚类物质的研究一直在进行。通过对核桃的全基因组测序,Martínez-García等发现了可以合成非结构性多酚的基因, 并证实了这些基因的多样性[1]。 S Eghbaliferiz 和M Iranshahi总结了黄酮、多酚这些物质的良好的抗氧化机能及其分解金属离子的机制[2]。
低温是影响植物地理分布和生长发育的一个重要生态因子,低温会影响植物的生理生化过程并且通过生理生化变化给予植物抗寒能力,低温对植物抗寒性的影响要远大于其他环境因素[3]。在年度零点以下的天气,植物的自然迁移并不受低温胁迫的影响,但低温仍然是寒冷气候下造成植株直接伤害的最显著的非生物胁迫影响因子[4]。低温会诱导相关抗逆基因表达,使细胞膜脂成分发生变化,激活活化抗氧化系统和积累渗透调节物质等,从而缓解低温对其造成的机械损伤和生理伤害。核桃叶片中含有大量的黄酮、多酚、花青素和还原型VC等物质,而这些物质被证实在不同植物中,会在转录水平上受到低温胁迫的影响。高丹丹发现温度骤降处理后, 3种杨树(PopulusL.)叶片中的总酚、黄酮、木质素的含量均无显著变化,但研究也发现抗冻性较弱的中绥杨(P.deltoides×P.cathangana)叶片中的总酚和木质素含量较低[5]。Zhang C等通过对葡萄(VitisviniferaL.)在4°C 和25°C不同温度下处理24 h、48 h、72 h 和 96 h,发现在葡萄表皮中花青素含量有显著提高,而多酚与黄酮类物质含量却有所下降[6]。王勇等对核桃1 a生枝条的抗寒性指标进行了测定分析,对抗寒性指标进行分析比较发现,品种间抗寒性差异较大时可用电导率法测定,此法既简便又节省费用;抗寒性差异小时可用总酚、黄酮类物质、可溶性糖和淀粉含量进行抗寒性综合鉴定[7]。黄酮、多酚、花青素、还原型VC这些内源性物质的变化可能因为触动了控制调节这些物质的多个信号通路,调节了不同基因在转录或翻译水平上的表达[8]。大量研究表明,在一定温度范围条件影响下,植物叶片均具有较强的生理调节能力,在低温胁迫下,对低温胁迫敏感的植物细胞中活性氧的产生加速,而清除活性氧的能力下降,导致活性氧水平升高,这同时会使植物体内活性氧清除系统中抗氧化剂含量(多酚、黄酮、VC等物质)和抗氧化酶活性提高[9]。活性氧是涉及电子传递生化过程中的正常代谢产物,必须及时清除,保持一定的低水平的动态平衡,否则会导致细胞受伤害,严重时死亡[10]。多酚类物质结构中具有邻二酚羟基,容易被氧化,且对活性氧等自由基有较强的捕捉能力。在温度初降时保护酶系实施保护作用,而随着温度的持续下降,保护酶系受低温伤害而保护功能降低,植物受到低温寒害[11]。酶活性降低导致调节物质的合成受到阻碍,因此低温胁迫与核桃叶片内黄酮、多酚、花青素等物质含量的变化是密切相关的[12]。植物体内源物质变化的研究是基础中的基础,是十分重要的,对基础的研究也能够给分子研究提供更多数据支持。近年来,分子研究越来越发达,反而越来越需要基础试验研究结果来支持试验的发现。然而,目前对核桃叶片抗寒性的基础研究还比较贫乏。因此,以核桃叶片为供试材料, 研究叶片内各种抗氧化物质对核桃抗寒性的影响,旨在为黄酮多酚类物质在农业中的应用和相关分子实验研究提供依据。
1 试验材料与方法
1.1 试验材料
试验于2015年6—7月在云南农业大学园林园艺学院果树生理实验室进行。此时是树体叶片、果实速生期,适于试验材料的采摘和收集,同时也为后续抗逆基因在极端低温条件下表达量的研究提供数据参考。
试验材料为采自云南农业大学后山果园新鲜漾濞泡核桃叶梢对生叶片,树龄12 a,处于盛果期,树高5 m,没有严重病害,长势良好。采集试验材料后在恒温冰箱内处理后进行杀青、晒干,研磨成粉状进行保存。
1.2 试验方法
1.2.1 温度处理 试验设0℃、-2℃、-4℃、-6℃、-8℃的5个胁迫温度水平,每个水平温度分别胁迫24 h、48 h、72 h。每次处理重复3次。对照温度(CK)为室温(25℃)。将不同低温、不同处理时间的样品分别编号,并做好标记。
1.2.2 化学成分含量测定方法 还原型VC含量测定采用靛酚法,黄酮类化合物含量测定使用三氯化铝比色法,茶多酚类物质含量测定使用酒石酸铁比色法,花青素含量测定使用分光光度法[13]。使用DPS数据处理软件对试验结果进行分析处理。
2 结果与分析
2.1 低温胁迫对黄酮含量的影响
核桃叶片采摘后相同温度内不同时间处理后黄酮的含量变化见表1。

表1 相同温度下不同时间处理核桃叶片采摘后黄酮平均含量Table 1 The content of flavonoids of from Juglans regia leaves after harvest in different time periods at the same temperature mg/g
注:不同字母表示 Duncan’s 新复极差测验达 5%显著水平。
由表1可知,在对照温度下 (CK),黄酮含量平均值为16.94 mg/g, 并且在一定时间变化内(24 h,48 h和72 h)保持稳定;在0℃时随着时间变化黄酮含量先降低后升高,并在72 h时达到最高值14.87 mg/g;-2℃时,黄酮变化规律与0℃时相同,在72 h时达到最高值17.28 mg/g, -2℃时的48 h处理与72 h处理相比差异显著;-4℃时,黄酮含量先升高后降低,在48 h时达到最高值16.44 mg/g,-4℃时72 h 与24 h、48 h处理相比较差异显著;-6℃时,黄酮含量随时间降低,并在24 h处理时达到最高值22.62 mg/g;-8℃时,黄酮含量随时间降低,并在24 h处理时达到最高值23.64 mg/g,-8℃时24 h与48 h、72 h处理相比差异显著。由此可以看出,随着时间推移,越低的温度核桃黄酮含量最大值出现的时间越早,说明核桃内黄酮对寒冷的响应温度越低响应需要的时间越短。其中,-8℃时48 h和72 h处理的黄酮含量相比较变化不大。这说明这个处理时间段内叶片细胞组织已经开始被破坏,黄酮含量趋于稳定。
核桃叶片采摘后相同时间内不同温度处理后黄酮含量的变化见表2。
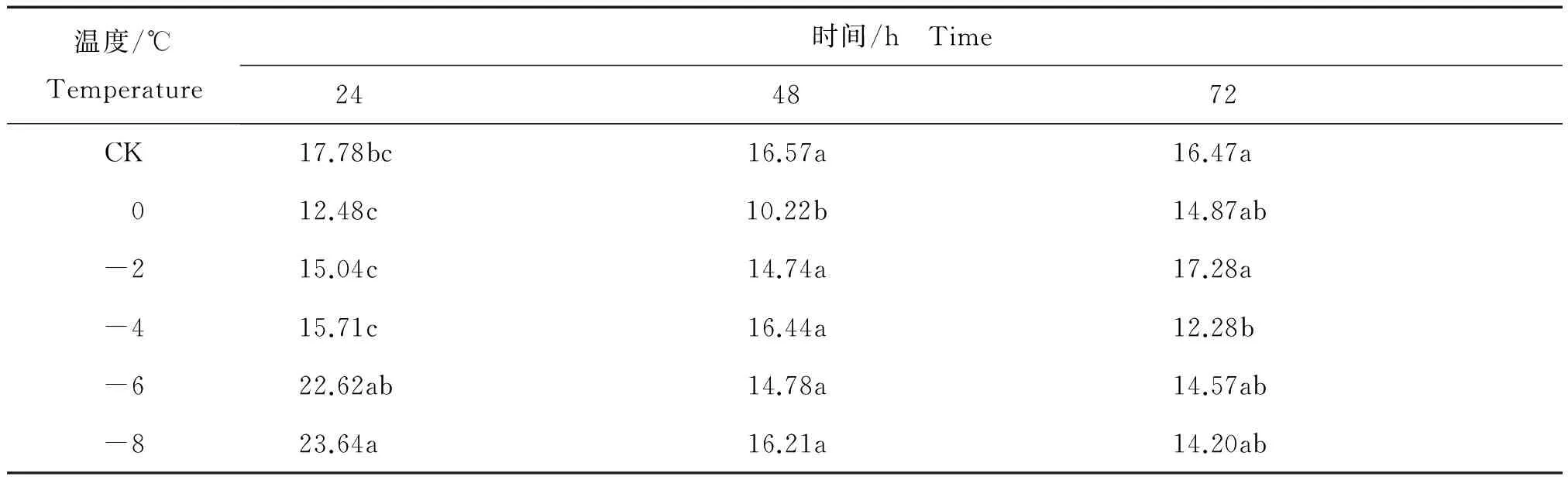
表2 相同时间内不同温度处理核桃叶片采摘后黄酮平均含量Table 2 The content of flavonoids of from Juglans regia leaves after harvest in different temperature at the same time mg/g
注:不同字母表示 Duncan’s 新复极差测验达 5%显著水平。
由表2可知,低温胁迫24 h后, 黄酮的含量在0℃处理达到了最低值12.48 mg/g,然后随着温度降低有了极为明显的回升。其中,黄酮含量在-8℃处理达到的最高值与在0℃处理达到的最低值相比,高出11.16 mg/g。-6℃处理后核桃叶片细胞内黄酮含量与0℃、-2℃、-4℃处理后黄酮含量相比,差异显著;-8℃处理后核桃叶片细胞内黄酮含量与CK、0℃、-2℃、-4℃处理后黄酮含量相比,差异显著。低温胁迫48 h后,黄酮含量在0℃达到最低值10.22 mg/g,随着温度变化黄酮含量在小范围内浮动,黄酮在0℃达到的最低值与48 h其他温度的黄酮数值相比,差异显著。低温胁迫72 h后,黄酮含量变化先降后升然后再降,到-6℃后趋于稳定,黄酮含量在-4℃时达到最低值12.28 mg/g。这个最低值与CK、-2℃处理的黄酮含量相比,差异显著。由此可以看出,在24 h短时间处理后温度越低黄酮含量变化越明显,而经过48 h和72 h长时间处理后黄酮含量有变化但变化稳定在一个范围内。
这些结果表明,采摘后核桃叶片中黄酮的含量在低温胁迫过程中,时间和温度都是影响叶片抗寒内源物质黄酮变化的条件。在低温条件下,植物自身抗寒系统体系开始运转,抗寒相关物质含量提升;而在过低温度或者过久的时间处理后黄酮含量并无明显变化,由此推断处理时间较长和处理温度过低时均会造成植物细胞结构的物理损伤,自身抗寒系统被破坏,导致相关抗寒物质含量无明显变化。通过查阅文献发现,尉芹等采用不同溶剂提取核桃叶中的抗氧化物质并发现核桃叶中提取物均有很强的抗氧化作用,核桃叶提取物的抗氧化有效成分主要是单宁、黄酮及萜类化合物[14]。胡博路等研究发现,核桃叶能有效地清除O2-及·OH[15]。张运红等发现冷害胁迫后,喷施竹叶黄酮后的辣椒(CapsicumannuumL.)叶片超氧化物歧化酶(SOD)活性显著高于对照,说明喷施竹叶黄酮能提高其抗寒性[16]。这些结论都有力说明核桃叶片自身有很强的抗寒性,而抗寒性的来源是因为叶片内含有大量的黄酮类等物质。试验结果说明,黄酮在核桃受到低温胁迫的情况下,会在短时间内迅速变化来响应寒冷。
2.2 低温胁迫对核桃多酚含量的影响
核桃叶片采摘后相同温度内不同时间处理后多酚含量的变化见表3。

表3 相同温度内不同时间处理核桃叶片采摘后多酚平均含量Table 3 The content of polyphenols of from Juglans regia leaves after harvest in different time periods at the same temperature %
注:不同字母表示 Duncan’s 新复极差测验达 5%显著水平。
由表3可知,在对照温度下 (CK),多酚含量在一定时间范围内(24 h,48 h和72 h)有小幅度的下降而后升高,在72 h达到最高值33.85%。在0℃处理下,多酚含量随着处理时间的延长呈大幅度下降趋势,并在24 h达到最高值29.49%,0℃处理24 h与48 h、72 h间多酚含量差异显著。在-8℃处理下,多酚含量变化与0℃时变化相似,并在24 h达到最高值26.48%, -8℃处理24 h与48 h、72 h间多酚含量差异显著。在-2℃处理下,随着时间推移核桃叶片多酚含量变化趋势为先升高后降低,48 h处理时多酚含量达到最高值26.48%,-2℃处理下48 h与24 h、72 h相比多酚含量差异显著。在-4℃处理下,多酚含量变化与-2℃时变化相似,48 h处理时含量达到最高值21.09%,-4℃处理下48 h与24 h、72 h相比多酚含量差异显著。而在更低温度 (-6℃)处理下,多酚含量却有先下降后升高的趋势,并在胁迫72 h后达到最高36.71%,-6℃处理下72 h与24 h、48 h相比多酚含量差异显著。
核桃叶片采摘后相同时间内不同温度处理后多酚的变化见表4。
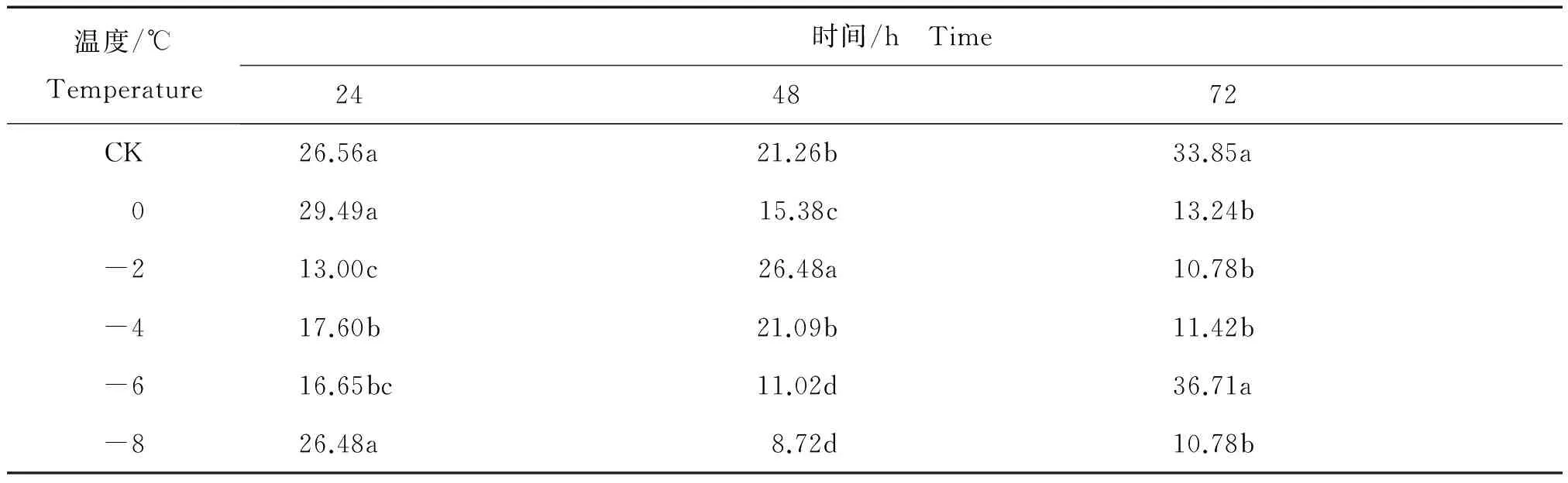
表4 相同时间内不同温度处理核桃叶片采摘后多酚平均含量Table 4 The content of polyphenols of from Juglans regia leaves after harvest in different temperature at the same time %
注:不同字母表示 Duncan’s 新复极差测验达 5%显著水平。
由表4可知,低温胁迫24 h后,多酚含量先升后降,然后又有所升高。多酚含量在0℃达到了最高值29.49%,与多酚在-2℃达到的最低值13.00%相比高了16.49个百分点。0℃处理的核桃叶片细胞内多酚含量与-2℃、-4℃、-6℃处理的多酚含量相比,差异显著。低温胁迫48 h后,-2℃处理时多酚含量达到最高值26.48%,与多酚在-8℃达到的最低值8.72%相比高了17.76个百分点,其中-2℃的多酚含量与CK、0℃、-4℃、-6℃、-8℃的多酚含量相比差异显著。在低温胁迫72 h后,多酚含量先降低后升高,最后在-8℃下达到10.78%;其中,多酚含量在-6℃胁迫后达到的含量最高值36.71%与在-8℃胁迫达到的最低值10.78%相比,高出25.93个百分点。-6℃时的多酚含量与0℃、-2℃、-4℃、-8℃的多酚含量相比较差异显著。
这些结果表明,采摘后核桃叶片中多酚的含量随着温度降低而大幅度波动, 说明温度对核桃内多酚含量变化影响很大,72 h处理-6℃时多酚含量达到最高值, 而-8℃处理使多酚含量显著降低。这些结果说明,当植物转入0℃时植物本身抗寒系统开始相应的运作,而-6℃是一个核桃冻害的临界值,-8℃低温经过48 h和72 h长时间处理已经对植物组织本身造成不可逆的伤害。宋宇琴等发现不同品种核桃枝条中多酚和黄酮类物质含量最高的品种抗寒能力最强[17]。冷平等发现,原产日本中部的栽培柿(DiospyroskakiL.f)‘富有’和原产于亚热带台湾的台东豆柿在自然低温条件下多酚类物质和黄酮类物质含量均有明显的提高,表明柿属植物树体内酚类物质组成及含量与其抗寒力的获得有一定关系[18]。李春明等发现杨树(PopulusL.)叶片中总酚、黄酮、缩合单宁、水杨苷、特里杨苷含量的季节动态与最低气温变化之间呈较强负相关[19]。这说明低温会提高叶片内多酚物质的含量来响应抗寒生理,且核桃作为叶片内多酚含量较高的树种,更能抵抗低温胁迫,这也说明为什么-6℃胁迫48 h后叶片内多酚含量依然会升高。
2.3 低温胁迫对花青素含量的影响
核桃叶片采摘后相同温度内不同时间处理后花青素含量的变化见表5。
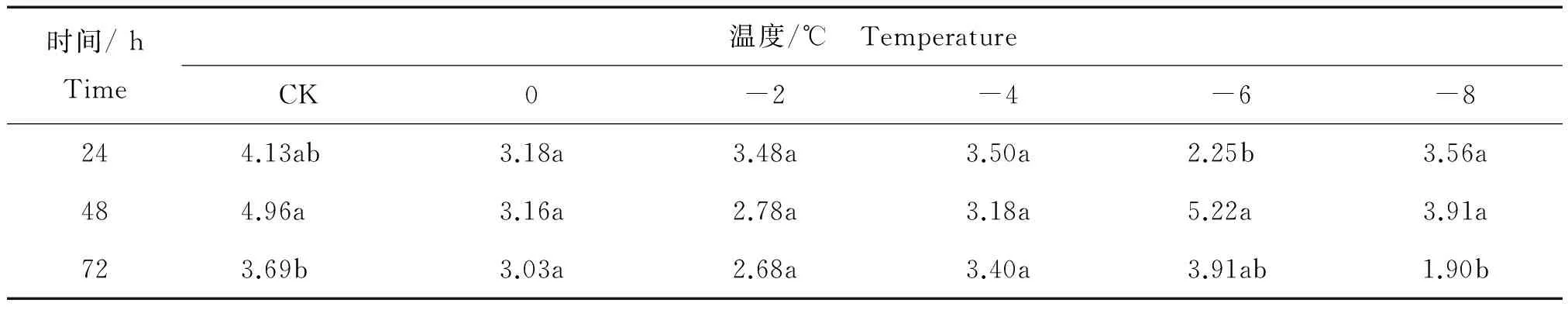
表5 相同温度内不同时间处理核桃叶片采摘后花青素平均含量Table 5 The content of anthocyanin of from Juglans regia leaves after harvest in different time periods at the same temperature mg/g
注:不同字母表示 Duncan’s 新复极差测验达 5%显著水平。
由表5可知,在对照温度下 (CK),花青素含量在一定时间变化内(24 h,48 h和72 h)有小幅度的升高而后下降。0℃和-4℃内花青素含量随时间并没有显著变化,-2℃内花青素含量也没有显著变化,但是随着时间的推移有下降的趋势。在较低温度的处理下(-6℃和-8℃),花青素含量均呈现先升高后降低的变化,并在处理48 h后分别达到了最高值5.22 mg/g和3.91 mg/g。由此可以看出,-6℃或-8℃是花青素相应抗寒的一个临界温度。
核桃叶片采摘后相同时间内不同温度处理后花青素含量的变化见表6。
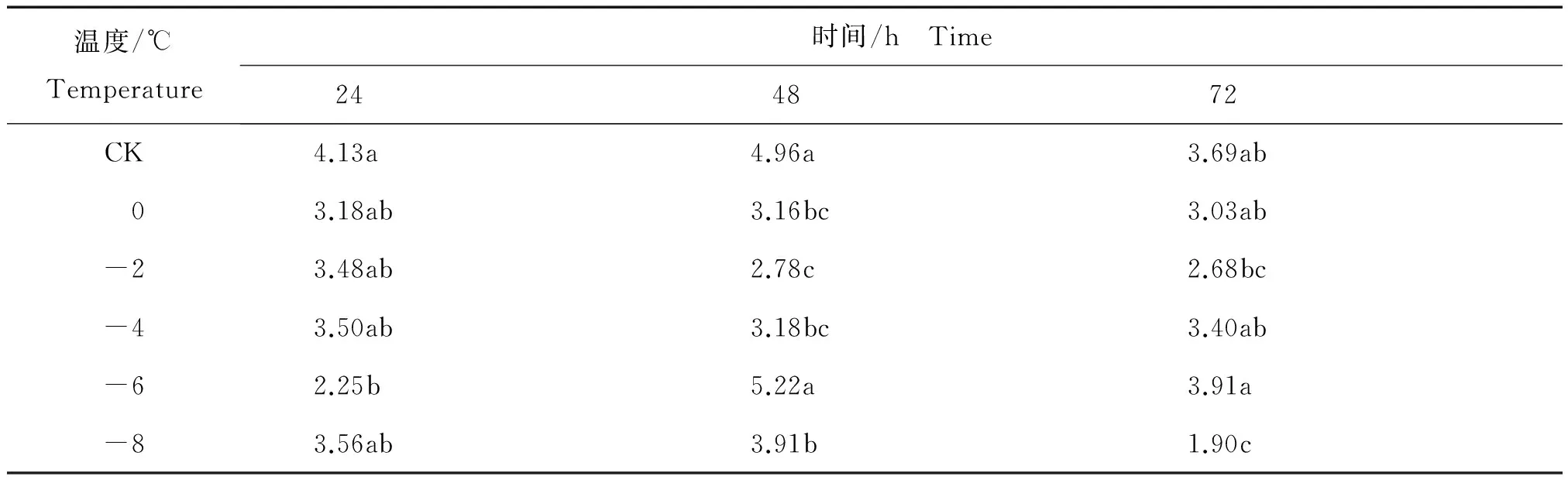
表6 相同时间内不同温度处理核桃叶片采摘后花青素平均含量Table 6 The content of anthocyanin of from Juglans regia leaves after harvest in different temperature at the same time mg/g
注:不同字母表示 Duncan’s 新复极差测验达 5%显著水平。
由表6可知,在低温胁迫24 h处理中,花青素含量变化处于一个小幅下降的趋势,其中-6℃花青素含量达到最低值2.25 mg/g,与对照CK相比差异显著。在低温胁迫48 h处理中,花青素的含量在-2℃(2.78 mg/g)比对照CK(4.96 mg/g)有了明显下降,然后随着温度降低又有了极为明显的回升 (在-6℃时达到了5.22 mg/g),并在更低温处理下下降至较低水平。其中,花青素含量在-6℃胁迫48 h后达到的最高值与在-2℃达到的最低值相比,高出2.44 mg/g,-2℃花青素达到的最低值与对照CK相比差异显著。在低温胁迫72 h处理中,花青素含量呈先降低后升高再降低的变化,并在-8℃达到最低值1.90 mg/g,-8℃与CK、0℃、-4℃、-6℃的花青素含量存在显著差异。
与多酚含量变化类似,花青素含量在0到-4℃区间内,不同处理时间均呈现小幅度波动和缓慢下降趋势。在-6℃处理72 h和48 h时花青素含量均达到处理组内最高值, 而-8℃处理使花青素含量显著降低。由此推断,-6℃可能是花青素类物质响应低温胁迫的一个临界温度,低于-6℃后花青素含量随着温度和时间的相互作用逐渐趋于稳定。花青素含量不同也说明植物叶片组织发生了不同程度的损伤。这些结果说明,花青素响应低温胁迫。
2.4 低温胁迫对还原型VC含量的影响
核桃叶片采摘后相同温度内不同时间处理后还原型VC含量的变化见表7。
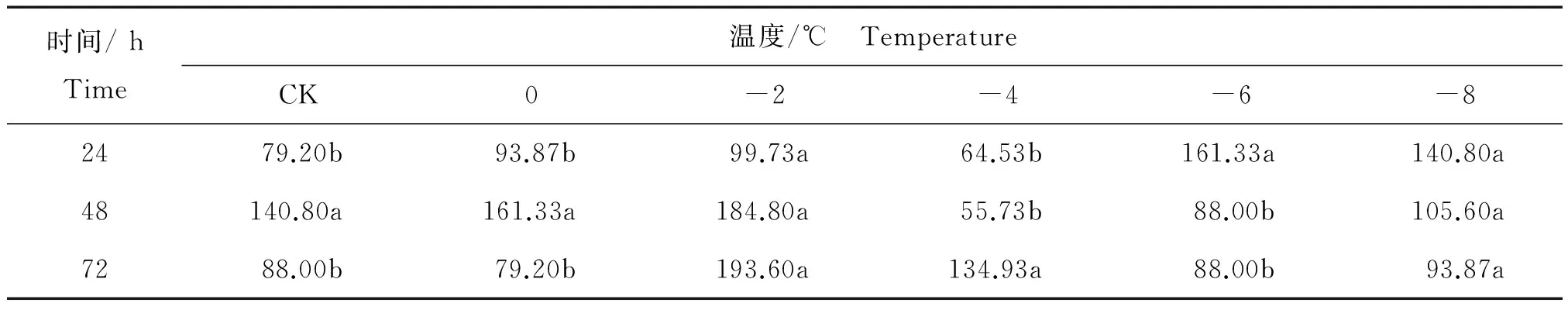
表7 相同温度内不同时间处理核桃叶片采摘后还原型VC平均含量Table 7 The content of reducing vitamin C of from Juglans regia leaves after harvest in different time periods at the same temperature mg/100g
注:不同字母表示 Duncan’s 新复极差测验达 5%显著水平。
由表7可知,在对照温度下 (CK),还原型VC含量在一定时间内(24 h,48 h和72 h)先升高而后下降。0℃处理,还原型VC含量也出现先升高后降低的趋势,其中48 h处理还原型VC含量达到最高值161.33 mg/100g,与24 h、72 h处理相比差异显著。而在-2℃处理下,还原型VC含量随着时间的变化有所提升,从24 h的99.73 mg/100g 升至72小时的最高值193.60 mg/100g。-4℃处理后,还原型VC含量先降低后升高,在72 h时达到最高值134.93 mg/100g,与24 h、48 h时相比差异显著。值得一提的是,在-6℃处理下,还原型VC含量随时间推移大幅度下降,至48 h后趋于稳定,其中还原型VC含量在24 h时达到最高值161.33 mg/100g。而在-8℃处理下,还原型VC含量随时间推移逐渐下降,24 h时达到最大值140.8 mg/100g。-6℃与-8℃还原型VC含量变化趋势相似,说明在较低温度下核桃叶片组织已经出现损伤,处理48 h后还原型VC含量基本趋于稳定。
核桃叶片采摘后相同时间内不同温度处理还原型VC含量的变化见表8。
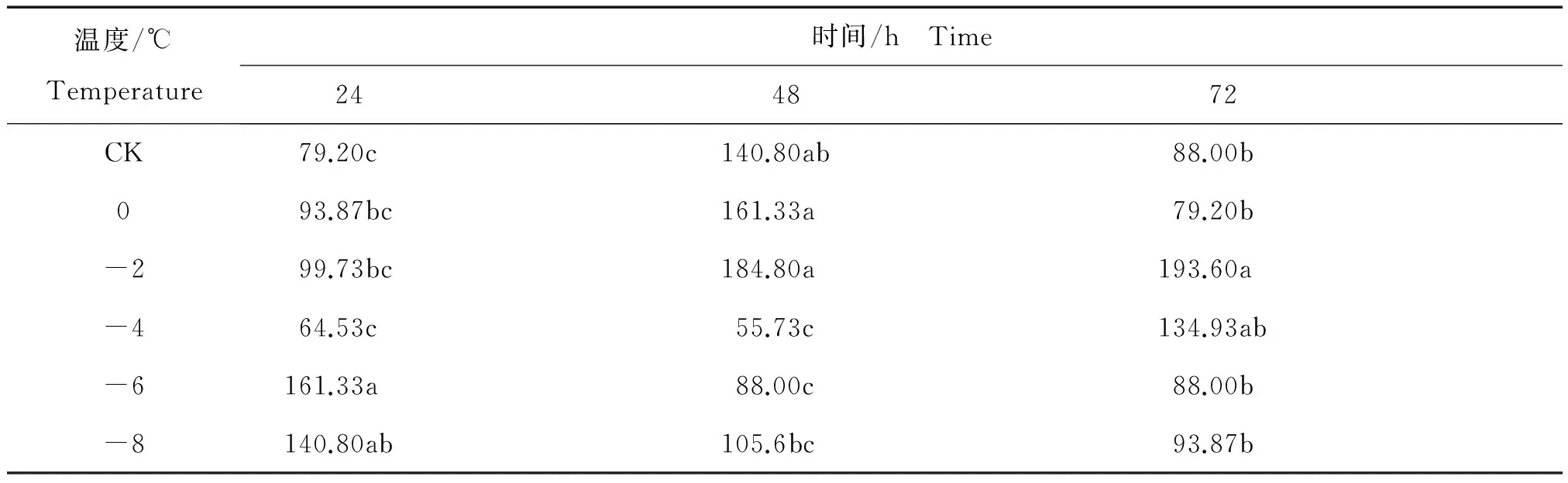
表8 相同时间内不同温度处理核桃叶片采摘后还原型VC平均含量Table 8 The content of reducing vitamin C of from Juglans regia leaves after harvest in different temperature at the same time mg/100g
注:不同字母表示 Duncan’s 新复极差测验达 5%显著水平。
由表8可知,在低温胁迫24 h处理中, 还原型VC含量在较高温度处理下均无明显变化,然后随着温度降低(-6℃和-8℃)有了极为明显的回升,在-6℃达到最高值161.33 mg/100g,-6℃还原型VC含量与CK、0℃、-2℃、-4℃处理相比差异显著。在低温胁迫48 h中,还原型VC的含量随着处理温度的降低呈现出先升高后降低的变化趋势,其中-2℃处理时还原型VC含量达到最大值184.80 mg/100g,与-4℃、-6℃、-8℃处理相比差异显著。在低温胁迫72 h中,还原型VC含量随着处理温度的降低呈现出与48 h处理类似的先升高后降低的变化趋势,并在-2℃处理达到最高值193.60 mg/100g,与CK、0℃、-6℃、-8℃处理相比差异显著。这些结果表明,还原型VC平均含量在不同处理时间下,不同温度对其含量有着极大的影响。其中,在24 h胁迫下,还原型VC含量在-6℃时达到最高值,而在48 h和72 h胁迫下,还原型VC含量在-2℃时达到最高值。这也说明在温度和时间的相互叠加作用下最高值的点会随着这个叠加影响推移。在短时间内处理,叶片内抗寒机制在极低温度 (-6℃)下仍然可以促使还原型VC含量迅速变化以此来抵抗低温环境。然而,长时间的低温处理使叶片产生了较弱的低温耐受性,表现为-2℃时的还原型VC含量就急速上升。-6℃和-8℃同时间段内的低温处理还原型VC含量变化维持较低水平,据推测是因为长时间低温叶片已受到严重的机械损伤。Riverapastrana D等也在木瓜[Chaenomelessinensis(Thouin) Koehne]中发现了低温处理对于VC等抗氧化物含量变化的影响[20]。说明核桃叶内还原型VC含量的变化是为了提高叶片内的抗氧化性,以此来响应低温胁迫。
3 结论与讨论
研究发现,在核桃叶片分别经过0℃、-2℃、-4℃、-6℃、-8℃低温水平下胁迫不同时间后,其多酚类物质、黄酮、花青素、还原型VC含量均会随着温度降低以及处理时间的延长有不同程度的升高和降低。其中,-6℃或-8℃是核桃叶片内源物质不再改变的临界温度。当低于这个温度后,这些内源物质基本不再发生变化。黄酮含量在-8℃胁迫24 h后达到最高值23.64 mg/g,多酚含量在-6℃胁迫72 h后达到最高值36.71%,花青素含量在-6℃胁迫48 h后达到最高值5.22 mg/g,还原型VC含量在-2℃胁迫72 h后达到最高值193.60 mg/100g。这些结果表明,核桃叶片内源物质含量和低温胁迫有较强的相关性。
本试验中发现的黄酮与多酚含量变化规律与参考文献中的变化规律相近,在超过植物体能够承受的低温后,抗寒机制中的抗氧化物质含量被消耗降低,当植物组织被冰晶破坏,这些物质的含量最终趋于稳定。黄酮、VC、多酚类物质等的含量变化在植物抗寒过程中有重要的作用。通过试验结果可知,清除或控制由低温逆境所产生的生物自由基可能是酚类物质及黄酮类物质等保护植物机体免受损伤的重要机理之一。植物体内酚类物质、黄酮物质等结构复杂、种类繁多,是哪些种类在树体抗低温逆境中起主要作用、其生理生化机制的详细过程是如何进行的、是由哪些抗性基因进行调控等问题还有待今后进一步研究。
[1]PJ Martínez‐García,MW Crepeau,D Puiu,etal. The walnut (Juglansregia) genome sequence reveals diversity in genes coding for the biosynthesis of nonstructural polyphenols[J]. Plant Journal, 2016,87(5):507-532.
[2]S Eghbaliferiz,M Iranshahi. Prooxidant activity of polyphenols, flavonoids, anthocyanins and carotenoids: Updated Review of Mechanisms and Catalyzing Metals[J]. Phytotherapy Research,2016,30(9): 1379-1381.
[3]Alden J, Hermann R. Aspects of the cold-hardiness mechanism in plants[J]. The Botanical Review,1971,37(1): 37-142.
[4]Campana R. Noninfectious tree diseases, part I. Effect of cold injuiy and freezing[J]. Weed & Turf,1964,3(8):10-11.
[5]高丹丹. 杨树叶片酚类物质对秋季温度骤降的相应[J].东北林业大学学报,2009,37(5):4-6.
[6]Zhang C, Jia H, Wu W,etal. Functional conservation analysis and expression modes of grape anthocyanin synthesis genes responsive to low temperature stress[J]. Gene, 2015, 574(1):168-177.
[7]王勇,田建保,程恩明,等. 核桃枝条电解质渗出率与抗寒性的关系[J]. 江西农业大学学报,2007,29(2):230-233.
[8]Sivankalyani V, Sela N, Feygenberg O,etal.Transcriptome dynamics in mango fruit peel reveals mechanisms of chilling stress[J]. Front Plant Sci, 2016,20(7):1579.
[9]徐呈祥. 提高植物抗寒性的机理研究进展[J]. 生态学报,2012,32(24):7966-7979.
[10]吴惠俐,李雪平,高健,等. 禾本科植物抗寒机理的研究进展[J]. 竹子研究汇刊,2014,33(1):7-11.
[11]万正敏. 核桃青皮中多酚类物质及其抗氧化性的分析[D]. 呼和浩特:内蒙古农业大学,2007.
[12]Salerno R., Casale F., Calandruccio C,etal. Characterization of flavonoids inCitrusbergamia(Bergamot) polyphenolic fraction by liquid chromatography-high resolution mass spectrometry (LCHRMS)[J]. Pharma Nutrition,2015(4):S1-S7.
[13]黄意欢.茶学实验技术[M].北京:中国农业出版社,1997:124-133.
[14]尉芹,马希汉,韩学文,等. 核桃叶抗氧化作用的研究[J]. 食品科学,2001,22(7):81-83.
[15]胡博路,杭瑚. 核桃清除活性氧自由基的研究[J]. 中草药,2002,33(3):227-228.
[16]张运红,任珊露,和爱玲,等. 喷施竹叶黄酮对辣椒生长及抗寒性的影响[J]. 长江蔬菜,2015(24):65-68.
[17]宋宇琴,阎伟,杨芳,等. 核桃枝条酚类物质含量与其抗性的关系[J]. 河南农业科学,2010(6):98-101.
[18]冷平,张国军,吴晓云,等. 秋冬季节柿属植物树体内酚类物质含量的变化[J]. 中国农业大学学报,2001, 6(1): 63-67.
[19]李春明. 杨树中酚类物质含量季节动态的研究[D].哈尔滨:东北林业大学,2007.
[20]DM Riverapastrana,AA Gardea,EM Yahia,etal. Effect of UV-C irradiation and low temperature storage on bioactive compounds, antioxidant enzymes and radical scavenging activity of papaya fruit [J]. Journal of Food Science and Technology,2014,51(12):3821-3829.
(编辑 潘秀华)
The response of flavonoids and polyphenols injuglansregialeaves to low temperature stress
SONG Jingwu1, YIN Desong1,ZHAO Diguang3,QI Beibei1,CHEN Yingying1,ZHOU Ling2,PENG Lei1
(1CollegeofHorticultureandLandscape,YunnanAgriculturalUniversity,Kunming650201,China;2CollegeofLongrunPu’erTea,YunnanAgriculturalUniversity,Kunming650201,China;3ChineseAcademyofAgriculturalSciences,ZhengzhouFruitInstitute,Zhengzhou450009,China)
As an important secondary metabolite in plant, polyphenols have important ecological functions to resist extreme environment. In order to study the changes of the content of polyhenols in theJuglansregiain response to different low temperature stress, the experiment was carried out by using treatments of 0 ℃, -2℃, -4℃, -6℃ and -8℃ in different time period ( 24 h, 48 h, 72 h). We investigated the levels of polyphenols,flavonoids,anthocyanins and vitamin C content inJuglansleaf. Our results reveal that the content of flavonoids, polyphenols, anthocyanins inJuglansleaves under different low temperature stress decreased at first before the increase. The content of reducing vitamin C under different low temperature stress firstly rised and then fell. The content of flavonoids reached the highest point (23.64 mg/g) at -8℃ when treated for 24 h. The content of polyphenols ar-rived at the highest point (36.71%) at -6℃ when treated for 72 h. The content of anthocyanins reached 5.22 mg/g at -6℃ when treated for 48 h. The content of reducing vitamin C arrived at the highest point (193.60 mg/100g) at -2℃ when treated for 72 h. Our study shows that the contents of substances fromJuglansleaf have strong correlation with the temperature changes.
Juglansleaf; low temperature stress; flavonois; polyphenol; anthocyanin; reducing vitamin C
1007-4961(2017)01-0034-08
10.13320/j.cnki.hjfor.2017.0007
2016-11-15;
2016-12-25
宋静武(1990-),男,河南郑州人,在读硕士研究生,主要从事果树栽培与生理研究。
通迅作者:彭磊(1969-),男,云南元江人,副教授,硕士生导师,主要从事果树育种及栽培生理研究。
S 664.1
A
