儿童幽门螺杆菌毒力基因与抗生素耐药相关性研究
2017-04-12张双红,谢勇,李弼民等
儿童幽门螺杆菌毒力基因与抗生素耐药相关性研究
张双红1谢 勇1李弼民1刘东升1万盛华2罗丽娟2李 红3易丽君3周 菁3朱 萱11.南昌大学第一附属医院消化科(江西南昌 330006); 2.江西省儿童医院消化科(江西南昌 330006);3.江西省儿童医院中心实验室(江西南昌 330006)
目的探讨儿童幽门螺杆菌(H. pylori)临床分离株毒力基因与抗生素耐药之间的关系。方法从具有上消化道症状的90例患儿胃窦黏膜中分离培养H. pylori阳性菌株,采用E-test法和K-B法检测H. pylori对抗生素耐药性,聚合酶链反应(PCR)检测H. pylori cagA、vacA及iceA基因。结果在胃窦黏膜分离培养的90株H. pylori菌株中,8株(8.9%)对克拉霉素耐药,31株(34.4%)对甲硝唑耐药,12株(13.3%)对克拉霉素和甲硝唑二重耐药,39株(43.3%)对抗生素均不耐药,未发现对阿莫西林和呋喃唑酮耐药的H. pylori菌株;cagA基因阳性检出率为93.3%(84/90),vacAs1a、vacAs1c、vacAm1和vacAm2基因阳性检出率分别为77.8%(70/90)、22.2%(20/90)、32.2%(29/90)和 67.8%(61/90),vacAs1a/m1、vacAs1a/m2、vacAs1c/m1和vacAs1c/m2基因阳性检出率分别为30.0%(27/90)、51.1%(46/90)、3.3%(3/90)和16.7%(15/90),iceA1和iceA2基因阳性检出率分别为87.7%(79/90)和7.8%(7/90)。H. pylori毒力基因型在克拉霉素耐药组、甲硝唑耐药组、克拉霉素+甲硝唑二重耐药组和对抗生素敏感组四组间的阳性检出率比较,差异均无统计学意义(P > 0.05)。结论儿童H. pylori临床分离菌株毒力基因型与抗生素耐药无相关性。
幽门螺杆菌; 毒力基因; 耐药性; 儿童
儿童幽门螺杆菌(Helicobacter pylori,H. pylori)感染首先推荐的根除治疗方案是采用含质子泵抑制剂(proton pump inhibitor,PPI)加2种抗生素的三联疗法。但是H. pylori根除率呈逐渐降低趋势,出现了抗H. pylori根除治疗失败的情况[1,2]。在临床中,三联疗法根除治疗失败是由多种因素所致,其中,H. pylori菌株毒力基因和H. pylori对抗生素耐药是导致根除治疗失败的两个重要原因[3,4]。本研究通过检测具有上消化道症状儿童所感染的H. pylori临床分离菌株cagA、vacA及iceA基因和H. pylori对抗生素耐药性,探讨H. pylori毒力基因与抗生素耐药的关系。
1 临床资料
选取2014年7月至2015年8月因腹痛、呕吐、嗳气、呕血及黑便等上消化道症状在江西省儿童医院就诊并接受胃镜检查的患儿,共90例。其中男67例、女23例,年龄1岁9个月~14岁,中位年龄10岁。诊断为慢性胃炎28例,十二指肠球炎13例和消化性溃疡49例。全部病例胃镜检查前未接受过H. pylori根除治疗,排除胃镜检查前4周内服用PPI、H2受体拮抗剂、非甾体类消炎药、铋剂或抗生素者。本研究通过了医院医学伦理委员会批准(No.JXSETYY-2016003),并获家属知情同意。
将上述患儿胃窦黏膜标本用匀浆器研磨后,均匀涂布于Karmali培养基(英国Oxoid公司,批号:1468121)上,在微需氧条件(温度37℃,5%O2,10%CO2,85%N2)下培养3~7 d。找出光滑、边缘整齐、灰白、圆形、半透明的典型菌落进行传代和增菌培养获得H. pylori菌株,经革兰染色、快速尿素酶试验、显微镜下形态观察以及生化反应进行鉴定后,进一步采用H. pylori基因组DNA抽提试剂盒,分别提取各菌株的DNA,采用H. pylori ureA基因PCR扩增进行鉴定,将H. pylori阳性菌株于保存液中_80℃冰箱保存。H. pylori标准菌株NCTC11639获赠于南昌大学第一附属医院消化研究所。
采用E-test法检测阿莫西林、克拉霉素和甲硝唑3种抗生素对H. pylori的最低抑菌浓度(minimal inhibitory concentration,MIC);利用K-B法检测呋喃唑酮对H. pylori的敏感性。取200 µL菌悬液使用自动旋转涂布仪均匀涂布于直径90 mm Mueller-Hinton琼脂(英国Oxoid公司,批号:1344946)培养皿上,用无菌镊子将阿莫西林药敏试纸条(法国梅里埃生物公司,批号:1002516160)、克拉霉素药敏试纸条(法国梅里埃生物公司,批号:1000902370)、甲硝唑E-test药敏试纸条(法国梅里埃生物公司,批号:1003007690)和呋喃唑酮药敏试纸片(英国Oxoid公司,批号1426118)分别紧贴于琼脂培养基的表面,在微需氧条件下培养2~3 d后观察结果。椭圆形抑菌环与E-test试纸条的交界点药物浓度值即为MIC值;用直尺量取抑菌圈直径。H. pylori耐药判断标准:阿莫西林MIC ≥ 1 μg/mL为耐药,克拉霉素MIC ≥ 1 μg/ mL为耐药,甲硝唑MIC ≥ 8 μg/mL为耐药;K-B法抑菌圈直径 ≤ 7 mm为呋喃唑酮耐药。
在患儿胃窦黏膜分离培养的90株H. pylori菌株中,8株(8.9%)对克拉霉素耐药,31株(34.4%)对甲硝唑耐药,12株(13.3%)对克拉霉素和甲硝唑二重耐药,39株对抗生素均不耐药;未发现对阿莫西林和呋喃唑酮耐药的H. pylori菌株。
严格按照说明书使用基因组DNA提取试剂盒(德国Qiagen公司,批号:151022770)对所有H. pylori菌株进行基因组DNA 提取,避免样本之间的交叉污染,使用NanoDrop 2000超微量分光光度计(美国Thermo Scientific公司,型号:NanoDrop 2000)检测所提取H. pylori菌株基因组DNA的浓度。H. pylori菌株基因组DNA保存于_20℃冰箱待测。使用文献[5-8]中提供的检测H. pylori ureA、cagA、vacA和iceA的引物序列和扩增片段长度进行PCR 扩增,在90株菌株中可扩增出ureA、cagA、vacAs1、vacAs1a、vacAs1c、vacAm1、vacAm2、iceA1和ieeA2基因亚型阳性产物,但是在本组所有菌株中未扩增出vacAs1b和vacAs2基因的阳性产物。见图1。

图1 H. pylori ureA、cagA、vacA和iceA基因PCR扩增检测结果
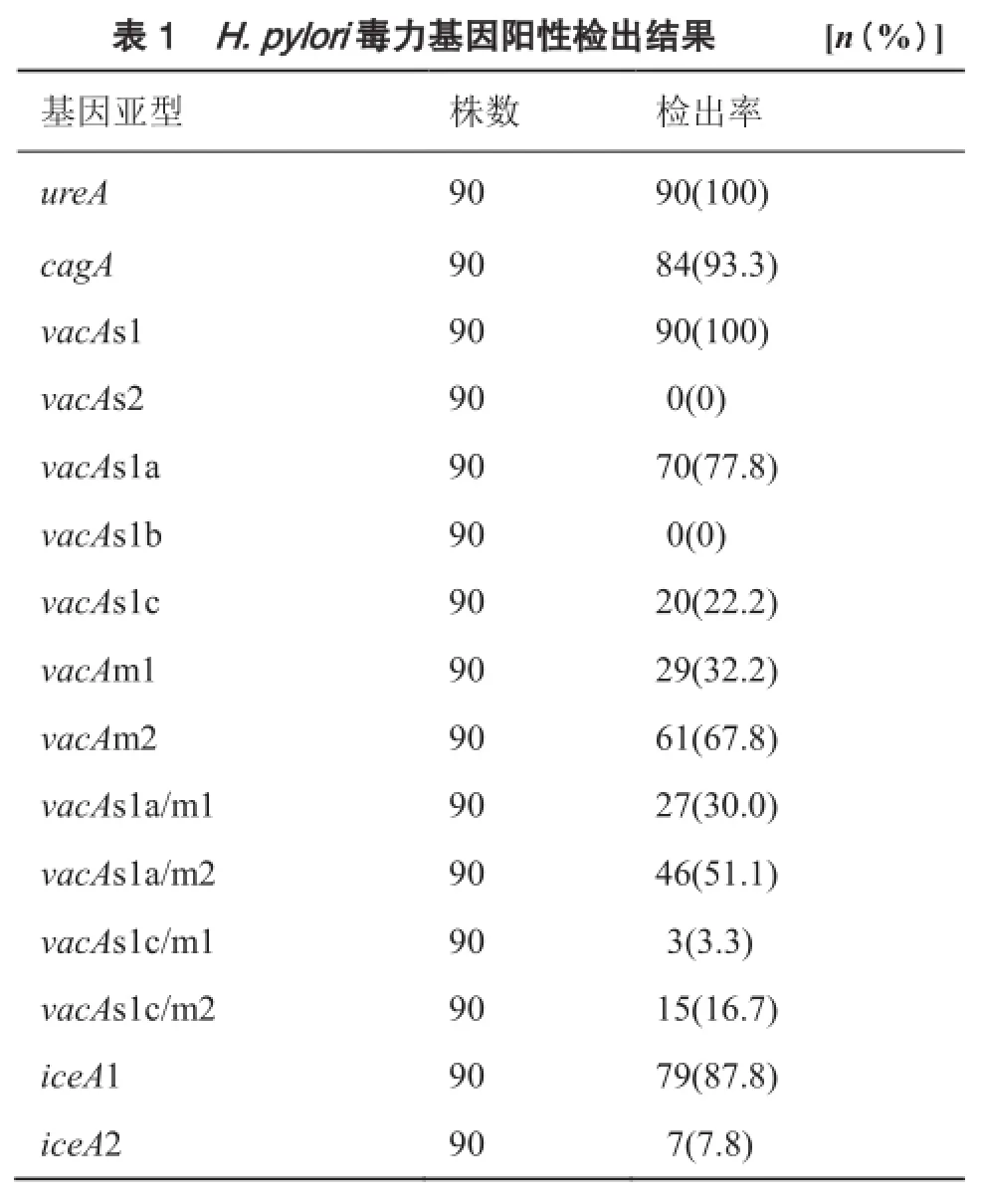
在90株H. pylori菌株中,ureA基因阳性检出率为100%(90/90),cagA基因阳性检出率为93.3%(84/90);vacA基因阳性检出率为100%(90/90),其中vacAs1a、vacAs1c、vacAm1和vacAm2基因阳性检出率分别为77.8%(70/90)、22.2%(20/90)、32.2%(29/90) 和67.8%(61/90);在vacA基因的嵌合体中,vacAs1a/m1,vacAs1a/m2,vacAs1c/m1和vacAs1c/m2基因阳性检出率分别为30.0%(27/90),51.1%(46/90),3.3%(3/90)和16.7%(15/90);iceA1和iceA2基因阳性检出率分别为87.8%(79/90)和7.8%(7/90)。见表1。
?
H. pylori毒力基因型在克拉霉素耐药组、甲硝唑耐药组、克拉霉素+甲硝唑二重耐药组和对抗生素敏感组四组间的阳性检出率比较,差异均无统计学意义(P>0.05)。见表2。

?
2 讨论
H. pylori是一种革兰阴性螺杆菌,寄生于人体胃黏膜内,在胃肠道疾病的发生中起重要作用,是导致儿童胃十二指肠疾病发生的重要病原菌[9]。在儿童时期,H. pylori感染后的临床结局主要受菌株类型、宿主遗传易感性和环境因素等影响,其中H. pylori毒力基因多态性和H. pylori耐药菌株的出现是两个重要原因。有研究表明,H. pylori毒力基因是影响临床根除治疗效果的重要因素[10]。目前,临床上可用于儿童感染H. pylori根除治疗的抗生素种类不多,主要有阿莫西林、克拉霉素及甲硝唑,而呋喃唑酮和氟喹诺酮类药物在儿童时期慎用。随着抗生素在儿童抗H. pylori根除治疗中的广泛应用,H. pylori对抗生素的耐药率,尤其是对甲硝唑和克拉霉素的耐药率正在逐渐上升,对阿莫西林的耐药率很低,不过也出现了增高的趋势,甚至在临床中出现了多重耐药菌株,使得儿童感染H. pylori的治疗根除率下降,严重影响了临床治疗效果[11]。本研究在患儿胃窦黏膜分离培养的90株H. pylori菌株中,8株(8.9%)对克拉霉素耐药,31株(34.4%)对甲硝唑耐药,12株(13.3%)对克拉霉素和甲硝唑二重耐药,39株对抗生素不耐药;未发现对阿莫西林和呋喃唑酮耐药的菌株,这与其他研究结果类似。有文献报道,H. pylori对甲硝唑耐药率达到13.9%~53.0%,对克拉霉素达到12.0%~34.7%,阿莫西林为0%~10.4%[12-15]。
本研究对具有上消化道症状儿童胃窦黏膜分离培养的H. pylori菌株毒力基因与抗生素耐药的相关性进行分析,结果显示,在90株H. pylori菌株中,cagA基因阳性检出率为93.3%;vacA基因阳性检出率为100%,其中vacAs1a、vacAs1c、vacAm1和vacAm2基因阳性检出率分别为77.8%、22.2%、32.2%和 67.8%;在vacA基因的嵌合体中,vacAs1a/m1,vacAs1a/m2,vacAs1c/m1和vacAs1c/m2基因阳性检出率分别为30.0%、51.1%、3.3%和16.7%;但在本组所有菌株中未检测出vacAs1b和vacAs2基因亚型;iceA1和iceA2基因阳性检出率分别为87.8%和7.8%。H. pylori毒力基因型在克拉霉素耐药组、甲硝唑耐药组、克拉霉素+甲硝唑二重耐药组和对抗生素敏感组四组间的阳性检出率比较,差异均无统计学意义(P>0.05),表明儿童H. pylori临床分离菌株毒力基因型与抗生素耐药无相关性。目前认为,H. pylori菌株毒力基因对H. pylori根除治疗有重要影响,但是其与H. pylori对抗生素耐药是否有关,国内外研究结果尚不一致。早期意大利的一项研究显示,H. pylori菌株毒力基因与抗生素耐药之间无相关性[16]。另一项研究结果也表明,H. pylori vacA基因分型与抗生素耐药无关[17]。但是,巴西一项研究对从217例患儿胃黏膜中培养的45例H. pylori菌株进行了毒力基因型与抗生素耐药关系的分析,发现H. pylori毒力基因与克拉霉素耐药有关[18]。有研究表明,H. pylori cagA基因与抗生素耐药有关[19]。另一项研究发现,H.pylori vacAs1a/m2基因与抗生素耐药率升高有关[20]。各项研究结果不一致的可能原因是:H. pylori毒力基因型分布特征存在明显的地区差异,不同国家和地区菌株的优势基因分布不同;H. pylori菌株本身对抗生素的耐药率也具有明显的地区差异;H. pylori菌株具有广泛的异质性,即不同菌株具有完全不同的基因型,不同患者感染基因型不同的菌株;H. pylori存在混合感染现象,即同一患者可同时感染1株以上的菌株,甚至同一部位也可同时存在不同的菌株,混合感染可以是菌株表型的不同,也可以是基因型的不同;此外,还可能与被检测的人群、胃黏膜活检采集的部位和数目不同有关[21-25]。
总之,本研究显示,儿童H. pylori临床分离菌株毒力基因型与抗生素耐药无相关性。由于本研究中病例来源不能完全做到完全随机,这是本研究的不足之处,上述结论尚需严格设计的大样本随机对照临床试验加以验证。
[1] Huang Y, Zhan X. Sequential therapy is superior to triple therapy forHelicobacter pyloriinfection in children: a metaanalysis [J]. Indian J Pediatr, 2016, 83(4):307-315.
[2] 刘风林, 甄丽娜, 赵煜, 等. 序贯疗法和标准三联疗法根除儿童幽门螺杆菌的疗效观察[J]. 临床儿科杂志, 2011, 29(10): 925-928.
[3] Sugimoto M, Yamaoka Y. Virulence factor genotypes ofHelicobacter pyloriaffect cure rates of eradication therapy [J]. Arch Immunol Ther Exp (Warsz), 2009, 57(1): 45-56.
[4] Kim SY, Choi DJ, Chung JW. Antibiotic treatment forHelicobacter pylori: is the end coming? [J]. World J Gastrointest Pharmacol Ther, 2015, 6(4):183-198.
[5] 周颖, 黄瑛, 邵彩虹, 等. 上海地区部分儿童幽门螺杆菌cagA、vacA、iceA基因型别分析[J]. 中国当代儿科杂志, 2010, 12(4): 267-271.
[6] De Gusmão VR, Nogueira Mendes E, De Magalhães Queiroz DM, et al.vacAgenotypes inHelicobacter pyloristrains isolated from children with and without duodenal ulcer in Brazil [J]. J Clin Microbiol, 2000, 38(8): 2853-2857.
[7] Yamaoka Y, Kodama T, Gutierrez O, et al. Relationship betweenHelicobacter pylori iceA,cagA, andvacAstatus and clinical outcome: studies in four different countries [J]. J Clin Microbiol, 1999, 37(7): 2274-2279.
[8] Ito Y, Azuma T, Ito S, et al. Analysis and typing of thevacAgene fromcagA-positive strains ofHelicobacter pyloriisolated in Japan [J]. J Clin Microbiol, 1997, 35(7):1710-1714.
[9] 余熠, 张寅, 王筱金, 等. 幽门螺杆菌感染与儿童慢性胃炎胃黏膜病理变化关系研究[J]. 中国实用儿科杂志, 2012, 27(9): 671-674.
[10] van Doorn LJ, Schneeberger PM, Nouhan N, et al. Importance ofHelicobacter pylori cagAandvacAstatus for the eff i cacy of antibiotic treatment [J]. Gut, 2000, 46(3): 321-326.
[11] Vanderpas J, Bontems P, Miendje Deyi VY, et al. Follow-up ofHelicobacter pyloriinfection in children over two decades (1988-2007): persistence, relapse and acquisition rates [J]. Epidemiol Infect, 2014, 142(4):767-775.
[12] 王玉环, 黄瑛, 王传清, 等. 儿童结节性胃炎幽门螺杆菌耐药性分析[J]. 临床儿科杂志, 2014, 32(10): 903-906.
[13] Camargo MC, García A, Riquelme A, et al. The problem ofHelicobacter pyloriresistance to antibiotics: a systematic review in Latin America [J]. Am J Gastroenterol, 2014, 109(4):485-495.
[14] Ogata SK, Godoy AP, da Silva Patricio FR, et al. HighHelicobacter pyloriresistance to metronidazole and clarithromycin in Brazilian children and adolescents [J]. J Pediatr Gastroenterol Nutr, 2013, 56(6):645-648.
[15] Montes M, Villalon FN, Eizaguirre FJ, et al.Helicobacter pyloriinfection in children. Antimicrobial resistance and treatment response [J]. Helicobacter, 2015, 20(3):169-175.
[16] De Francesco V, Margiotta M, Zullo A, et al. Claritromycin resistance andHelicobacter pylorigenotypes in Italy [J]. J Microbiol, 2006, 44(6): 660-664.
[17] Fasciana T, Calà C, Bonura C, et al. Resistance to clarithromycin and genotypes inHelicobacter pyloristrains isolated in Sicily [J]. J Med Microbiol, 2015, 64(11): 1408-1414.
[18] Garcia GT, Aranda KR, Gonçalves ME, et al. High prevalence of clarithromycin resistance andcagA, vacA, iceA2,andbabA2genotypes ofHelicobacter pyloriin Brazilian children [J]. J Clin Microbiol, 2010, 48(11): 4266-4268.
[19] Khan A, Farooqui A, Manzoor H, et al. Antibiotic resistance andcagAgene correlation: a looming crisis ofHelicobacter pylori[J]. World J Gastroenterol, 2012, 18(18):2245-2252.
[20] Karabiber H, Selimoglu MA, Otlu B, et al. Virulence factors and antibiotic resistance in children withHelicobacter pylorigastritis [J]. J Pediatr Gastroenterol Nutr, 2014, 58(5): 608-612.
[21] Yamaoka Y. Mechanisms of disease:Helicobacter pylorivirulence factors [J]. Nat Rev Gastroenterol Hepatol, 2010, 7(11):629-641.
[22] Kibria KM, Hossain me, Sultana J, et al. The prevalence of mixedHelicobacter pyloriinfections in symptomatic and asymptomatic subjects in Dhaka, Dangladesh [J]. Helicobacter, 2015, 20(5):397-404.
[23] Sayehmiri F, Kiani F, Sayehmiri K, et al. Prevalence ofcagAandvacAamongHelicobacter pylori-infected patients in Iran: a systematic review and meta-analysis [J]. J Infect Dev Ctries, 2015, 9(7):686-696.
[24] Cellini L, Grande R, Di Campli E, et al. Analysis of genetic variability, antimicrobial susceptibility and virulence markers inHelicobacter pyloriidentif i ed in Central Italy [J]. Scand J Gastroenterol, 2006, 41(3):280-287.
[25] Marzio L, Cellini L, Amitrano M, et al.Helicobacter pyloriisolates from proximal and distal stomach of patients never treated and already treated show genetic variability and discordant antibiotic resistance [J]. Eur J Gastroenterol Hepatol, 2011, 23(6):467-472.
The correlation of virulence genes and antibiotic resistance in Helicobacter pylori isolates in children
ZHANG Shuanghong1, XIE Yong1, LI Bimin1, LIU Dongsheng1, WAN Shenghua2, LUO Lijuan2, LI Hong3, YI Lijun3, ZHOU Jing3, ZHU Xuan1(1. Department of Gastroenterology, The First Affiliated Hospital of Nanchang University; 2. Department of Gastroenterology, Children's Hospital of Jiangxi; 3. Central Laboratory, Children's Hospital of Jiangxi, Nanchang 330006, Jiangxi, China)
ObjectiveTo explore the relationship between virulence genes and antibiotic resistance inHelicobacter pylori(H. pylori) isolates in children.MethodsThe stains ofH. pyloriwere isolated from antral mucosa in 90 pediatric patients with upper gastrointestinal symptoms. E-test and K-B test were used to detect the antibiotic resistance ofH. pyloriisolates. PCR was performed to detect thecagA,vacAandiceAgenes ofH. pylori.ResultsAmong these 90 strains ofH. pyloriisolated from antral mucosa, there were 8 strains (8.9%) resistant to clarithromycin, 31 strains (34.4%) resistant to metronidazole, 12 trains (13.3%) resistant to clarithromycin and metronidazole, and 39 strains (43.3%) not resistant to antibiotics. There were no strains resistant to amoxicillin or furazolidone. The positive detection rate ofcagAgene,vacAs1a, vacAs1c, vacAm1, and vacAm2genes were 93.3% (84/90), 77.8% (70/90), 22.2% (20/90), 32.2% (29/90), and 67.8% (61/90), respectively. The positive detection rates ofvacAs1a/m1, vacAs1a/m2, vacAs1c/m1, and vacAs1c/m2genes were 30.0% (27/90), 51.1% (46/90), 3.3% (3/90), and 16.7% (15/90), respectively. The positive detection rates oficeA1andiceA2genes were 87.7% (79/90) and 7.8% (7/90), respectively. There was no difference in positive detection rate ofH. pylorivirulence genes among clarithromycin resistance group, metronidazole resistant group, clarithromycin and metronidazole double resistance group and antibiotics sensitive group (P> 0.05).ConclusionThere was no relationship between virulence gene and antibiotic resistance inH. pyloriclinical isolates in children.
Helicobacter pylori; virulence genotypes; resistance; child
10.3969/j.issn.1000-3606.2017.01.016
2016-07-17)
(本文编辑: 邹 强)
江西省科技厅科技支撑计划立项(No. 20151BBG70092)
朱萱 电子信箱:jyyfyzx@163.com
