Na2CO3高温分解黑钨矿的热力学分析
2017-04-12李忠岐陈冬英
李忠岐,陈冬英,许 亮,洪 侃
(赣州有色冶金研究所,江西 赣州 341000)
Na2CO3高温分解黑钨矿的热力学分析
李忠岐,陈冬英,许 亮,洪 侃
(赣州有色冶金研究所,江西 赣州 341000)
本文对Na2CO3高温分解黑钨矿进行了热力学分析并进行了实验验证。首先通过反应式得出吉布斯自由能图,分析可知Na2CO3与MnWO4(FeWO4)在有氧参与条件下比无氧参与条件下更有利于反应的发生。然后通过热力学计算得出各反应平衡图,分别分析了在无氧条件下和在有氧条件下Na2CO3与MnWO4(FeWO4)的反应,得出增加Na2CO3的物质的量在有氧以及无氧条件下均有利于MnWO4(FeWO4)完全分解时反应温度的降低。最后进行了实验验证,通过Na2CO3与黑钨矿在有氧以及无氧条件下的对比试验,通过比较得出当温度升高时,黑钨矿分解率上升,在有氧化剂条件下,其分解率更高。
Na2CO3;高温分解;黑钨矿;热力学
0 引言
分解黑钨矿的方法目前主要有碳酸钠高压浸出法、氢氧化钠浸出法和Na2CO3高温烧结-水浸法[1-6]。Na2CO3高温分解黑钨矿是使用Na2CO3与黑钨矿在高温下反应生成钨酸钠的一种方法,适用范围广,既适用于处理黑钨精矿,也适用于处理白钨精矿或黑钨白钨混合的低品位中矿[7]。杨利群等[8]进行了苏打烧结法处理低品位钨矿和废钨渣的研究,研究表明这种方法对低品位、难处理黑白钨矿和废钨渣都能有效地使其分解,渣中钨的质量百分含量可降至0.5%以下。目前国内外对Na2CO3高温分解黑钨矿的工艺研究虽然较多,但Na2CO3分解黑钨矿的热力学分析未见报道。本文重点对Na2CO3高温分解黑钨矿进行热力学分析,通过热力学分析得出反应的吉布斯自由能图以及反应平衡图,并进行分析及实验验证。
1 热力学分析
1.1 Na2CO3与FeWO4(MnWO4)反应的吉布斯自由能图
黑钨矿的主要成分为FeWO4和MnWO4,因此参与的主要反应为Na2CO3与FeWO4(MnWO4)的反应。其中热力学数据均从实用无机物热力学数据手册[9]中查表可得。
在无氧化剂条件下,FeWO4(MnWO4)与Na2CO3在高温下可进行如下反应:

当有氧化剂条件下,氧化剂可以是O2或硝石,FeWO4(MnWO4)与Na2CO3在高温下可进行如下反应:
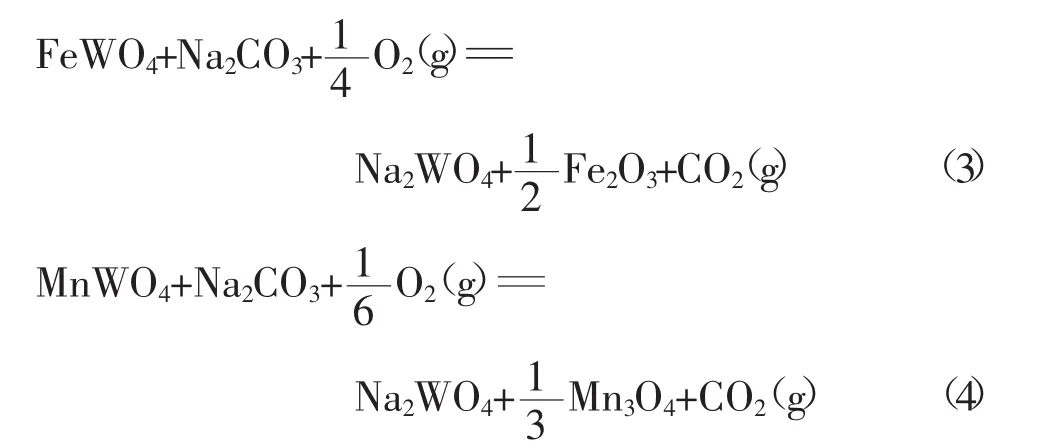
通过查表计算可得到图1,图1为FeWO4(MnWO4)与Na2CO3在常压下反应的吉布斯自由能图。由图1可知,反应(1)约在400℃以上时可以发生,反应(2)约在600℃以上时可以发生,反应(3)和反应(4)在常温下即可发生。由此分析可知,FeWO4(MnWO4)在有氧气条件下反应所需温度更低。
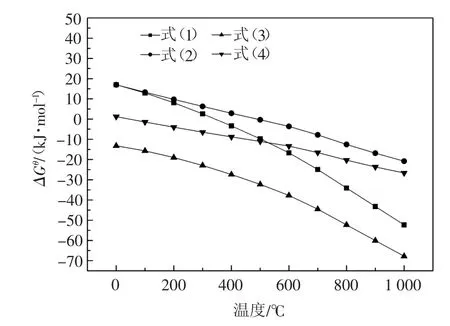
图1 FeWO4(MnWO4)与Na2CO3反应的标准吉布斯自由能图Fig.1 Standard Gibbs Free Energy Diagram for the reaction of wolframite and Na2CO3
1.2 Na2CO3与FeWO4(MnWO4)在无氧条件下的反应平衡图
通过对Na2CO3与FeWO4(MnWO4)在无氧条件下反应的吉布斯自由能图分析得出可以反应的温度条件,即温度约在600℃以上时,FeWO4(MnWO4)将均能够与Na2CO3进行反应。本文通过热力学计算其反应可进行的程度,Na2CO3与FeWO4(MnWO4)的摩尔比分别采用1∶1和1.5∶1来进行计算,通过计算可得出不同温度下反应进行的程度。
图2和图3是Na2CO3与钨酸铁在不同温度下反应平衡图,其物质摩尔比分别为1∶1和1.5∶1。由图2可以看出,反应在100℃左右开始进行,当温度上升到600℃时反应完全。由图3可以看出反应在100℃左右开始进行,当温度上升到500℃以上时反应完全。从热力学角度分析对比可知,在同样条件下,增加Na2CO3的物质的量有利于降低钨酸铁完全分解时的反应温度。

图2 Na2CO3与FeWO4(1∶1)在不同温度下反应平衡图Fig.2 Reaction equilibrium diagram of Na2CO3and FeWO(41∶1)at different temperatures
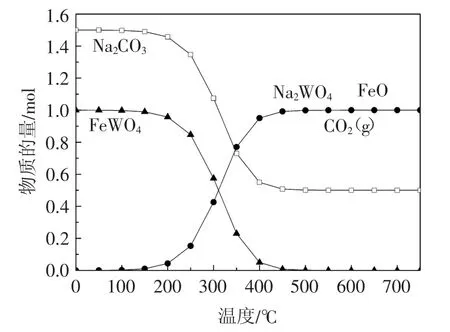
图3 Na2CO3与FeWO(41.5∶1)在不同温度下反应平衡图Fig.3 Reaction equilibrium diagram of Na2CO3and FeWO4(1.5∶1)at different temperatures
图4和图5是Na2CO3与MnWO4在不同温度下反应平衡图,其物质摩尔比分别为1∶1和1.5∶1。由图4可以看出,反应在200℃左右开始进行,当温度上升到1 200℃时反应完全。由图5可以看出反应在200℃左右开始进行,当温度上升到800℃时反应完全。从热力学角度分析可知,在同样条件下,增加Na2CO3的量有利于降低MnWO4完全分解时的反应温度。

图4 Na2CO3与MnWO4(1∶1)在不同温度下反应平衡图Fig.4 Reaction equilibrium diagram of Na2CO3and MnWO4(1∶1)at different temperatures
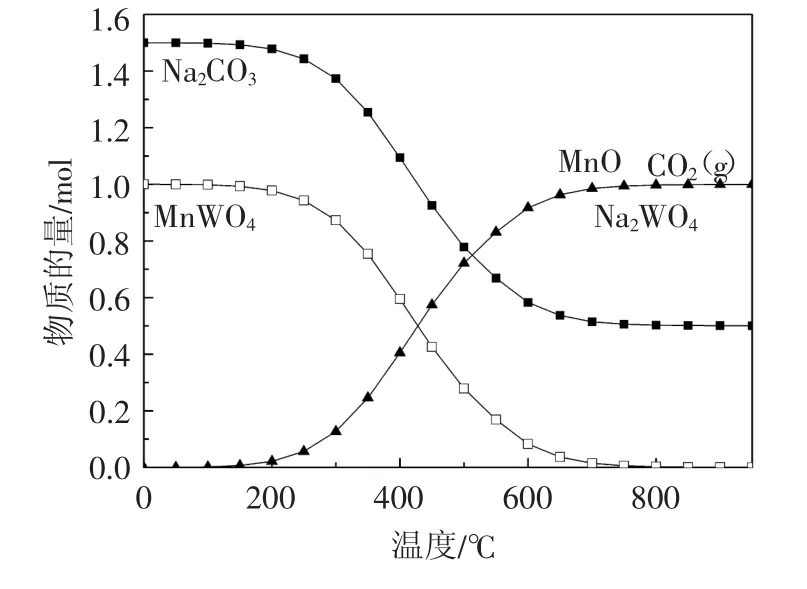
图5 Na2CO3与MnWO4(1.5∶1)在不同温度下反应平衡图Fig.5 ReactionequilibriumdiagramofNa2CO3andMnWO4(1.5:1)at different temperatures
1.3 Na2CO3与FeWO4(MnWO4)在有氧条件下的反应平衡图
通过对Na2CO3与FeWO4(MnWO4)在有氧条件下反应的吉布斯自由能图分析,可以得出温度约在25℃以上时,FeWO4(MnWO4)将均能够与Na2CO3进行反应,满足反应发生的热力学条件。为了证明其反应完全时的温度,本文通过热力学计算其反应的可进行的程度,Na2CO3与FeWO4(MnWO4)的比例分别采用1∶1和1.5∶1来进行计算,并且通氧气为1 mol,通过计算可得出不同温度下反应平衡图。
图6为在有氧条件下Na2CO3与FeWO4的反应平衡图,由图6可知,Na2CO3与FeWO4在理论上从0~900℃均可完全反应。结合图2分析可知,在有氧的条件下比无氧环境下反应所需要的温度更低。

图6 有氧条件下Na2CO3与FeWO(41∶1)反应平衡图Fig.6 ThereactionequilibriumdiagramofNa2CO3andFeWO(41∶1)at different temperatures in oxygen condition
图7和图8为在有氧条件下Na2CO3与MnWO4的反应平衡图。由图7可知,Na2CO3与MnWO4从常温下即可发生反应,在600℃以上可完全反应。由图8可知,Na2CO3与MnWO4从常温下即可发生反应,在240℃以上可完全反应。由图7与图8对比分析可知,当在同样条件下,增加Na2CO3的物质的量有利于降低MnWO4完全分解时的反应温度。由图7与图4对比可知,反应在有氧气的条件下比无氧环境下反应在常温下就可以发生,完全反应所需要的温度也更低。

图7 有氧条件下Na2CO3与MnWO(41∶1)反应平衡图Fig.7 Reaction equilibrium diagram of Na2CO3and MnWO4(1∶1)under oxygen condition

图8 有氧条件下Na2CO3与MnWO(41.5∶1)反应平衡图Fig.8 ReactionequilibriumdiagramofNa2CO3andMnWO4(1.5∶1) under oxygen condition
2 实验验证
2.1 实验原料及实验条件
实验原料为Na2CO3(分析纯)、黑钨精矿(WO3含量65%)以及硝石。实验设备为马弗炉、坩埚和球磨机等。
本实验首先将Na2CO3、黑钨精矿(WO3含量65%)以及硝石混合,其中Na2CO3与黑钨矿中钨含量的摩尔比分别选用1∶1和1.5∶1,加少量水(水质量约占固体质量的40%),混合均匀。然后将混合后的物质在马弗炉设备中进行焙烧,焙烧温度500~800℃。最后将焙烧过后的物质进行破碎球磨,放入水中进行浸出,得到钨酸钠溶液。最后进行一组不加硝石对比试验。实验后将含钨溶液样品中的钨的含量通过重量法进行检测,最终得出黑钨矿在不同温度下的分解率。
2.2 实验结果
为了验证理论分析,进行了Na2CO3与黑钨矿的在有氧化剂条件下及无氧条件下对比试验分析。试验中有氧条件选用硝石做氧化剂,采用Na2CO3与黑钨矿中钨有效成分摩尔比为1.5∶1,原料混合后在马弗炉中实验,压强为一个标准大气压;无氧条件是在放有混合矿样上方添加盖,以便隔绝空气,在马弗炉中实验,压强为一个标准大气压。
表1为Na2CO3与黑钨矿在有氧化剂条件下以及无氧条件下的对比试验结果。通过比较可以看出,当温度升高时,分解率上升;在有氧条件下,其分解率高于无氧条件,且在较低温度下即可达到较高的分解率。

表1 Na2CO3高温分解黑钨矿的对比试验Tab.1 Comparison experiment of wolframite decomposition by Na2CO3at high temperature
3 结语
本文通过热力学计算与实验比较得出Na2CO3高温分解黑钨矿的反应规律,通过反应式计算得出吉布斯自由能图,分析可知FeWO4(MnWO4)在有氧条件下比无氧条件下更有利于反应的发生。从热力学数据得出反应平衡图,表明当增加Na2CO3的物质的量时,FeWO4(MnWO4)完全分解时反应温度较低。通过Na2CO3与黑钨矿在有氧条件下以及无氧条件下的对比实验可以看出,当温度升高时,黑钨矿分解率有较大上升,在有氧条件下,其分解率在较低温度下即可达到较高的分解率。
[1] 赵中伟,梁 勇,刘旭恒,等.反应挤出法碱分解黑钨矿[J].中国有色金属学报,2011,21(11):2946-2951. ZHAOZhongwei,LIANGYong,LIUXuheng,et al.Sodium hydroxide digestion of wolframite by reactive extrusion[J].The Chinese Journal of Nonferrous Metals,2011,21(11):2946-2951.
[2] 何利华,刘旭恒,赵中伟,等.钨矿物原料碱分解的理论与工艺[J].中国钨业,2012,27(2):22-27. HE Lihua,LIU Xuheng,ZHAO Zhongwei,et al.Theory and technologies on the Alkali decomposition of tungsten ores[J].China Tungsten Industry,2012,27(2):22-27.
[3] 李洪桂,李运姣,孙培梅,等.钨矿物原料NaOH分解过程中抑制杂质的研究[J].中国工程科学,2000,2(3):59-61,72. LI Honggui,LI Yunjiao,SUN Peimei,etal.Studieson the inhibition of impurities in caustic decomposition of tungsten concentrates[J].Engineering Science,2000,2(3):59-61,72.
[4] LI H G.Production of high purity APT from scheelite and complex tungsten raw material with high Mo content[J].Transactions of Nonferrous Metals Society of China,2004,14(2):366-369.
[5] 史海燕,赵中伟.苛性钠分解黑钨矿的热力学分析 [J].中国钨业,2006,21(5):24-27. SHI Haiyan,ZHAO Zhongwei.Thermodynamics analysis on caustic sodium decomposition of wolframite[J].China Tungsten Industry,2006,21(5):24-27.
[6] 曹才放,赵中伟,刘旭恒,等.硅酸钠分解白钨矿的热力学研究[J].中国有色金属学报,2012,22(9):2636-2641. CAO Caifang,ZHAO Zhongwei,LIU Xuheng,et al.Thermodynamic study on decomposition of scheelite with sodium silicate[J].The ChineseJournalofNonferrousMetals,2012,22(9):2636-2641.
[7] 卢友中,曾青云,陈庆根.微波辅助碱分解低品位黑(白)钨精矿[J].矿产综合利用,2009(5):20-23. LU Youzhong,ZENG Qingyun,CHEN Qinggen.Alkaline decomposition of the combined concentrate of scheelite and wolframite under microwave-assistedcondition[J].MultipurposeUtilization of Mineral Resource,2009(5):20-23.
[8] 杨利群.苏打烧结法处理低品位钨矿及废钨渣的研究 [J].中国钼业,2008,32(4):25-27. YANG Liqun.Study of processing low-grade tungsten mineral and waste residue of tungsten by SODA Sintering[J].China Molybdenum Industry,2008,32(4):25-27.
[9] 叶大伦,胡建华.实用无机物热力学数据手册[M].北京:冶金工业出版社,2002:382-383,591-593,610,673. YE Dalun,HU Jianhua.Practical handbook of thermodynamic data for inorganic substances[M].BeiJing:Metallurgical Industry Press,2002:382-383,591-593,610,673.
Thermodynamic Analysis of Wolframite Decomposition by Na2CO3at high Temperature
LI Zhongqi,CHEN Dongying,XU Liang,HONG Kan
(Ganzhou Nonferrous Metallurgy Research Institute,Ganzhou 341000,Jiangxi,China)
This paper studies the thermodynamic analysis of wolframite decomposition by Na2CO3at high temperatures.The analysis of the Gibbs Free Energy Map showed that MnWO4and FeWO4were more liable to be reacted with Na2CO3under oxygen conditions than in oxygen-free conditions.The equilibrium diagram analysis of adding Na2CO3to MnWO4(FeWO4)shows that the increasing dosages of Na2CO3under oxygen and oxygen-free conditions are conductive to the reduced temperature during the complete reaction of MnWO4(FeWO4).The comparison experiments of adding Na2CO3to wolframite under oxygen and oxygen-free conditions show that the wolframite decomposition rate increases with the rising temperature.
Na2CO3;pyrolysis;wolframite;thermodynamics
TF111
A
10.3969/j.issn.1009-0622.2017.01.013
2016-12-23
李忠岐(1989-),男,河南林州人,硕士,研究方向:稀有金属冶金。
陈冬英(1967-),女,江西玉山人,教授级高级工程师,本刊编委,主要从事湿法冶金科技与管理工作。
