急性Stanford A型主动脉夹层动脉瘤手术死亡风险因素研究
2017-04-10贺继刚李洪荣李永武桂龙升
贺继刚,李洪荣,李永武,严 丹,王 平,桂龙升*
急性Stanford A型主动脉夹层动脉瘤手术死亡风险因素研究
贺继刚1,李洪荣1,李永武1,严 丹2,王 平1,桂龙升1*
目的 探讨急性Stanford A型主动脉夹层动脉瘤手术死亡风险因素。方法 选取2009年10月—2016年1月云南省第一人民医院收治的急性Stanford A型主动脉夹层动脉瘤患者167例,根据手术结果分为手术成功组(n=131)和术后死亡组(n=36)。采用回顾性研究方法,收集两组患者的一般资料〔包括性别、年龄、是否吸烟、是否行经皮冠状动脉介入术(PCI)、是否行胸部手术及有无慢性阻塞性肺疾病(COPD)、外周血管疾病、胸痛、恶心/呕吐、腹痛、低血压〕、实验室检查指标(包括血红蛋白、血小板)及术中停循环时间、弓部处理方式。结果 两组性别、吸烟率、PCI率及外周血管疾病、恶心/呕吐发生率间差异无统计学意义(P>0.05),而年龄、胸部手术率及COPD、胸痛、腹痛、低血压发生率间差异有统计学意义(P<0.05)。两组血红蛋白水平间差异无统计学意义(P>0.05),而血小板计数及其分布间差异有统计学意义(P<0.05)。两组术中停循环时间分布及弓部处理方式间差异均有统计学意义(P<0.05)。多因素Logistic回归分析结果显示,年龄、胸部手术、胸痛、腹痛、低血压、血小板计数、术中停循环时间、术中弓部处理方式是急性Stanford A型主动脉夹层动脉瘤手术死亡的风险因素(P<0.05)。结论 患者的年龄越大,既往行胸部手术,术前出现胸痛、腹痛和低血压,术前血小板计数偏低,术中停循环时间延长及弓部采用三分支吻合方式增加了急性Stanford A型主动脉夹层动脉瘤手术死亡风险。
主动脉;动脉瘤,夹层;外科手术;死亡;危险因素
贺继刚,李洪荣,李永武,等.急性Stanford A型主动脉夹层动脉瘤手术死亡风险因素研究[J].中国全科医学,2017,20(10):1196-1199.[www.chinagp.net]
HE J G,LI H R,LI Y W,et al.Mortality risk factors for acute Stanford A aortic dissection with surgical treatment[J].Chinese General Practice,2017,20(10):1196-1199.
急性Stanford A型主动脉夹层动脉瘤是一个威胁生命的急症。在发病最初的24~48 h,死亡率每小时可增加1%~2%[1]。未经治疗者,发病2周时死亡率达75%,1年时可达91%[1]。基于此,世界范围已经形成共识,急诊外科修复Stanford A型主动脉夹层在多数情况下是必要的[2]。尽管外科技巧及术前、术后护理有所改善,但Stanford A型主动脉夹层的病死率仍然较高,达10%~25%[3]。早前已有报道显示,年龄、内脏器官缺血、低血压、休克、肾衰竭、心包填塞及昏迷等因素与术后的死亡率相关[4]。但由于我国近年来的发病率逐年升高,且病因以高血压为主与西方不同[5]。故本研究回溯总结了167例手术治疗的急性Stanford A型主动脉夹层动脉瘤患者术前资料,分析其中与手术死亡风险相关的因素,以期能够在术前更好地评价该病患者的手术风险。
1 对象与方法
1.1 研究对象 选取2009年10月—2016年1月云南省第一人民医院收治的急性Stanford A型主动脉夹层动脉瘤患者167例。纳入标准:(1)均符合急性Stanford A型主动脉夹层动脉瘤的诊断标准[6];(2)均行手术治疗;(3)病因均为高血压。排除标准:不愿配合本研究者。根据手术结果将所有患者分为手术成功组(n=131)和术后死亡组(n=36)。其中手术成功组中,行Bentall+全弓置换+术中支架置入术62例,升主动脉置换+全弓置换+术中支架植入术31例,升主动脉置换+全弓置换26例,升主动脉置换+右半弓置换12例;术后死亡组中,行Bentall+全弓置换+术中支架置入术18例,升主动脉置换+全弓置换+术中支架植入术9例,升主动脉置换+全弓置换6例,升主动脉置换+右半弓置换3例;死于术后肾衰竭12例,术后肺部感染10例,术后突发心率失常9例,术后心排血量5例。本研究经云南省第一人民医院伦理委员会批准,患者或其家属知情同意。
1.2 研究方法 采用回顾性研究方法。收集患者以下资料:(1)一般资料,包括性别、年龄、是否吸烟(每天吸烟超过10支,连续吸食3年或以上)、是否行经皮冠状动脉介入术(PCI)、是否行胸部手术及有无慢性阻塞性肺疾病(COPD)、外周血管疾病、胸痛、恶心/呕吐、腹痛、低血压(以收缩压≤90 mm Hg为低血压,1 mm Hg=0.133 kPa[4])。(2)实验室指标:采用库尔特全自动血细胞分析仪完成患者血细胞分析,包括血红蛋白、血小板;(3)术中停循环时间、弓部处理方式,其中将患者弓部处理分为岛状吻合和三分支吻合。
本文要点:
急性主动脉夹层动脉瘤是急性主动脉综合征中最为常见及危险的疾病,尽管由于早期诊断和及时的外科处理,其临床预后已经得到了极大的改善、提高,但其早期的死亡率及远期再手术率仍然很高,主要原因在于病情危重、手术复杂。本文回顾性总结了单中心急性Stanford A型主动脉夹层动脉瘤手术死亡风险因素,结果显示年龄越大,既往行胸部手术,术前出现胸痛、腹痛和低血压,术前血小板计数偏低,术中停循环时间延长及弓部采用三分支吻合方式与术后死亡风险相关。提示临床早期可以从以上几个方面对急性Stanford A主动脉夹层动脉瘤患者进行有效评估,做好充分的准备,降低其术后死亡率。
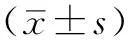
2 结果
2.1 两组一般资料比较 两组性别、吸烟率、PCI率及外周血管疾病、恶心/呕吐发生率间差异无统计学意义(P>0.05),而年龄、胸部手术率及COPD、胸痛、腹痛、低血压发生率间差异有统计学意义(P<0.05,见表1)。

表1 两组一般资料比较
注:a为t值;PCI=经皮冠状动脉介入术,COPD=慢性阻塞性肺疾病
2.2 两组实验室检查指标比较 两组血红蛋白水平间差异无统计学意义(P>0.05),而血小板计数及其分布间差异有统计学意义(P<0.05,见表2)。
2.3 两组术中停循环时间分布及弓部处理方式比较 两组术中停循环时间分布及弓部处理方式间差异均有统计学意义(P<0.05,见表3)。
2.4 急性Stanford A型主动脉夹层动脉瘤手术死亡风险因素的多因素Logistic回归分析 以术后是否死亡为因变量,以单因素分析差异有统计学意义的指标为自变量(变量赋值情况见表4),进行多因素Logistic回归分析。结果显示,年龄、胸部手术、胸痛、腹痛、低血压、血小板计数、术中停循环时间、术中弓部处理方式是急性Stanford A型主动脉夹层动脉瘤手术死亡的风险因素(P<0.05,见表5)。
表2 两组实验室检查指标比较
Table 2 Levels of laboratory markers of the survival and non-survival groups
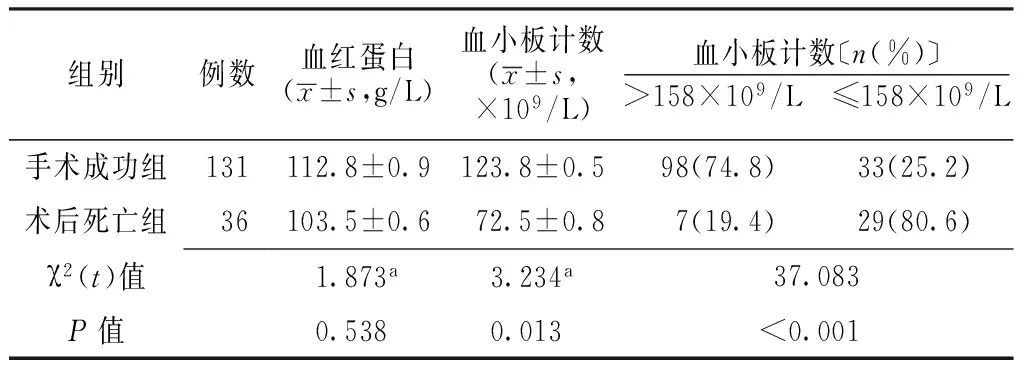
组别例数血红蛋白(x±s,g/L)血小板计数(x±s,×109/L)血小板计数〔n(%)〕>158×109/L ≤158×109/L手术成功组131112.8±0.9123.8±0.598(74.8)33(25.2)术后死亡组36103.5±0.672.5±0.87(19.4)29(80.6)χ2(t)值1.873a3.234a37.083P值0.5380.013<0.001
注:a为t值
表3 两组术中停循环时间分布及弓部处理方式比较〔n(%)〕
Table 3 Intraoperative duration of DHCA and aotic arch treatment approaches of the survival and non-survival groups
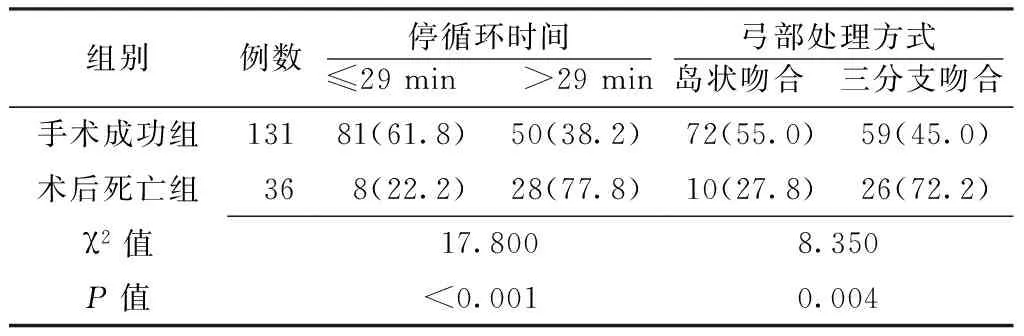
组别例数停循环时间≤29min >29min弓部处理方式岛状吻合 三分支吻合手术成功组13181(61.8)50(38.2)72(55.0)59(45.0)术后死亡组368(22.2)28(77.8)10(27.8)26(72.2)χ2值17.8008.350P值<0.0010.004
表4 变量及赋值情况
Table 4 Variables and assignments in multivariate Logistic regression analysis of the mortality risk factors for acute Stanford A aortic dissection with surgical treatment

变量赋值情况年龄(岁)≤50=0,>50=1胸部手术无=0,有=1COPD无=0,有=1胸痛无=0,有=1腹痛无=0,有=1低血压否=0,是=1血小板计数(×109/L)>158=0,≤158=1术中停循环时间(min)≤29=0,>29=1术中弓部处理方式岛状吻合=0,三分支吻合=1术后是否死亡否=0,是=1
表5 急性Stanford A型主动脉夹层动脉瘤手术死亡风险因素的多因素Logistic回归分析
Table 5 Multivariate Logistic regression analysis of the mortality risk factors for acute Stanford A aortic dissection with surgical treatment

变量bSEWaldχ2值P值OR年龄0.5980.01412.314<0.0011.818胸部手术0.7630.21812.2770.0012.145COPD0.1480.2010.4430.4151.159胸痛0.7440.15521.243<0.0012.116腹痛0.1280.03018.500<0.0011.147低血压0.5080.13810.648<0.0011.663血小板计数0.2710.0869.9430.0021.333术中停循环时间0.3850.04548.237<0.0011.466术中弓部处理方式0.4260.09439.215<0.0011.531
3 讨论
急性主动脉夹层动脉瘤是急性主动脉综合征中最为常见及危险的疾病,尽管由于早期诊断和及时的外科处理,其临床预后已经得到了极大的改善、提高,但其早期的死亡率及远期再手术率仍然很高,主要原因在于病情危重、手术复杂,如果早期能对急性Stanford A主动脉夹层动脉瘤进行有效评估,做好充分的准备,则可以降低其死亡率[6-7]。
急性Stanford A型主动脉夹层动脉瘤由于其高死亡率对外科而言仍然是一个挑战。目前有两种不同的标准对急性Stanford A型主动脉夹层动脉瘤的外科手术死亡率进行评估[8-9]。CENTOFANTI等[8]根据1980—2004年616例急性Stanford A型主动脉夹层动脉瘤患者的资料,筛选出了评估手术死亡率的危险因素,包括年龄、昏迷、急性肾衰竭、休克及再手术。RAMPOLDI等[9]则根据1996—2003年急性主动脉夹层国际注册数据库中的682例Stanford A型主动脉夹层动脉瘤患者的资料建立了另外一种评估模式,包括年龄>70岁、既往有心脏手术史、低血压、休克、转移性疼痛、心包填塞、脉搏缺失及心电图(ECG)上表现为心肌缺血损伤等危险因素。阜外医院的HUANG等[10]报道显示,如入院时血小板计数≤119×109/L,手术的风险也随之加大。由于目前我国Stanford A型主动脉夹层动脉瘤的发病率逐年增加,且病因以高血压为主与西方不同[5]。故本研究回溯总结了本院自2009年10月—2016年1月167例手术治疗的急性Stanford A型主动脉夹层动脉瘤患者术前及术中资料中与手术死亡风险的相关因素,发现胸部手术、胸痛、腹痛和低血压及术中弓部处理方式是术后死亡的风险因素。本研究还发现年龄越大,术前血小板计数≤158×109/L、停循环时间>29 min时手术死亡风险增加。本研究证实了血小板计数可以对手术死亡风险起到评估作用。
综上所述,年龄越大,既往行胸部手术,术前出现胸痛、腹痛和低血压,术前血小板计数偏低,术中停循环时间延长及弓部采用三分支吻合方式增加了急性Stanford A型主动脉夹层动脉瘤手术死亡风险。另外本研究目前为单中心分析结果,还需进一步加以验证。
作者贡献:贺继刚进行文章的构思与设计、研究的实施与可行性分析、数据收集与整理、统计学处理、结果的分析与解释、撰写论文及中英文修订,并负责文章的质量控制及审校;桂龙升进行文章的构思与设计、结果的分析与解释;严丹进行研究的实施与可行性分析、数据整理、统计学处理;王平进行研究的实施与可行性分析;李洪荣、李永武进行数据收集。
本文无利益冲突。
[1]HIRATZKA L F,BAKRIS G L,BECKMAN J A,et al.2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Guidelines for the diagnosis and management of patients with thoracic aortic disease.A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines,American Association for Thoracic Surgery,American College of Radiology,American Stroke Association,Society of Cardiovascular Anesthesiologists,Society for Cardiovascular Angiography and Interventions,Society of Interventional Radiology,Society of Thoracic Surgeons,and Society for Vascular Medicine[J].J Am Coll Cardiol,2010,55(14):e27-e129.DOI:10.1016/j.jacc.2010.02.015.
[2]CONZELMANN L O,KRUGER T,HOFFMANN I,et al.German registry for acute aortic dissection type A (GERAADA):initial results[J].Herz,2011,36(6):513-524.DOI:10.1007/s00059-011-3512-x.
[3]TSUKUBE T,HARAGUCHI T,OKADA Y,et al.Long-term outcomes after immediate aortic repair for acute type A aortic dissection complicated by coma[J].J Thorac Cardiovasc Surg,2014,148(3):1013-1018.DOI:10.1016/j.jtcvs.2014.06.053.
[4]EL-SAYED AHMAD A,PAPADOPOULOS N,DETHO F,et al.Surgical repair for acute type A aortic dissection in octogenarians[J].Ann Thorac Surg,2015,99(2):547-551.DOI:10.1016/j.athoracsur.2014.08.020.
[5]SUN L,QI R,ZHU J,et al.Total arch replacement combined with stented elephant trunk implantation:a new "standard" therapy for type a dissection involving repair of the aortic arch?[J].Circulation,2011,123(9):971-978.DOI:10.1161/CIRCULATIONAHA.110.015081.
[6]BEKKERS J A,RAAP G B,TAKKENBERG J J,er al.Acute type A aortic dissection:longterm results and reoperations [J].Eur J Cardiothorac Surg,2013,43(7):389-396.DOI:10.1093/ejcts/ezs342.
[7]PAGNI S,GANZEL B L,TRIVEDI J R,et al.Early and midterm outcomes following surgery for acute type A aortic dissection[J].J Card Surg,2013,28(5):543-549.DOI:10.1111/jocs.12170.
[8]CENTOFANTI P,FLOCCO R,CERESA F,et al.Is surgery always mandatory for type A aortic dissection?[J].Ann Thorac Surg,2006,82(5):1658-1663.DOI:10.1016/j.athoracsur.2006.05.065.
[9]RAMPOLDI V,TRIMARCHI S,EAGLE K A,et al.Simple risk models to predict surgical mortality in acute type A aortic dissection:the International Registry of Acute Aortic Dissection score[J].Ann Thorac Surg,2007,83(1):55-61.DOI:10.1016/j.athoracsur.2006.08.007.
[10]HUANG B,TIAN L,FAN X,et al.Low admission platelet counts predicts increased risk of in-hospital mortality in patients with type A acute aortic dissection[J].Int J Cardiol,2014,172(3):484-486.DOI:10.1016/j.ijcard.2014.01.001.
(本文编辑:崔沙沙)
Mortality Risk Factors for Acute Stanford A Aortic Dissection with Surgical Treatment
HEJi-gang1,LIHong-rong1,LIYong-wu1,YANDan2,WANGPing1,GUILong-sheng1*
1.DepartmentofCardiovascularSurgery,FirstPeople′sHospitalofYunnanProvince,Kunming650032,China2.DepartmentofIntensiveCareUnit,FirstPeople′sHospitalofYunnanProvince,Kunming650032,China
*Correspondingauthor:GUILong-sheng,Chiefphysician,Mastersupervisor;E-mail:jiganghe@sina.com
Objective To investigate the mortality risk factors for acute Stanford A aortic dissection with surgical treatment.Methods A retrospective method was used in this study.We selected 167 consecutive patients with acute Stanford type A aortic dissection treated with surgery in First People′s Hospital of Yunnan Province from October 2009 to January 2016 as the participants and divided them into the survival group (n=131) and non-survival group (n=36) based on the treatment outcome.We collected the baseline data of the participants for comparison and analysis,which included sex,age,smoking history,previous treatment histories of percutaneous coronary intervention(PCI),thoracic surgery,chronic obstructive pulmonary disease(COPD),peripheral vascular disease,chest pain,nausea/vomiting,abdominal pain and hypotension,status of laboratory markers(hemoglobin and platelet),intraoperative duration of deep hypothermic circulatory arrest(DHCA) and aortic arch treatment approaches.Results Age,proportions of patients with previous treatment histories of thoracic surgery,COPD,chest pain,abdominal pain,and hypotension differed significantly between the groups(P<0.05),while sex ratio,percentage of patients with smoking history,proportions of patients with previous treatment histories of PCI,peripheral vascular disease,and nausea/vomiting did not(P>0.05).The differences in platelet count and distribution width existed between the groups(P<0.05),while the difference in hemoglobin levels did not(P>0.05).The differences in both the intraoperative duration of DHCA and aortic arch treatment approaches were noted between the groups(P<0.05).Multivariate Logistic regression analysis showed that older age,previous treatment histories of thoracic surgery,chest pain,abdominal pain and hypotension,decreased platelet count before surgery,prolonged intraoperative duration of DHCA and intraoperative aortic arch treatment approaches were the mortality risk factors for acute Stanford A aortic dissection with surgical treatment(P<0.05).Conclusion Older age,previous treatment histories of thoracic surgery,chest pain,abdominal pain and hypotension,decreased platelet count before surgery,prolonged intraoperative duration of DHCA,and aortic arch reconstruction with triple-branched stent graft placement can increase the mortality risk of acute Stanford A aortic dissection with surgical treatment.
Aorta;Aneurysm,dissecting;Surgical procedures,operative;Death;Risk factors
国家自然科学基金资助项目(81460073);云南省科技厅-昆明医科大学应用基础研究联合专项 (2014FB089)
R 543.16
A
10.3969/j.issn.1007-9572.2017.10.011
2016-11-25;
2017-02-16)
1.650032云南省昆明市,云南省第一人民医院心脏大血管外科
2.650032云南省昆明市,云南省第一人民医院重症医学科
*通信作者:桂龙升,主任医师,硕士生导师;E-mail:jiganghe@sina.com
