MDSC在自身免疫疾病中的作用①
2017-04-10伊焕发杨永广
吴 昊 伊焕发 杨永广
(吉林大学第一医院转化医学研究院,吉林大学免疫研究所,长春130061)
·专家述评·
MDSC在自身免疫疾病中的作用①
吴 昊 伊焕发②杨永广②
(吉林大学第一医院转化医学研究院,吉林大学免疫研究所,长春130061)
髓系抑制细胞(Myeloid-derived suppressor cells,MDSC)是具有抑制功能的髓系来源的细胞群。在自身免疫疾病中,MDSC显著增多,并在体外有抑制功能,然而在体内研究中,MDSC的研究存在争议。最新研究发现具有抑制功能的MDSC的显著增多并不能有效缓解自身免疫疾病,而且在某些情况下甚至促进疾病的进展。因此,MDSC在自身免疫疾病的作用有待进一步研究。本文根据已有文献,综述了MDSC在不同的自身免疫疾病中的改变及机制。
髓系抑制细胞;自身免疫疾病;Th17分化

吴昊(1979年-),吉林大学第一医院肾病科主治医师。师从杨永广教授,2016年毕业于吉林大学第一医院转化医学院,获医学免疫学博士学位。研究方向是髓系抑制细胞在自身免疫疾病中的作用及机制。目前,在Sci Transl Med 等杂志发表SCI论文6篇,承担国家级自然科学基金及省级、院级科研项目5项。

伊焕发(1973年-),教授,博士生导师。2002年获北京大学医学部医学硕士,2007年获中国科学院动物研究所理学博士,随后在美国Roswell Park Cancer Institute和Virginia Commonwealth University从事博士后研究,2012年起任职于吉林大学第一医院。主要从事天然免疫抑制细胞与疾病研究。目前主持国家自然科学基金2项,参与科技部973项目(子课题负责人)及国家重大传染病专项“十二五”项目各1项,省部级课题3项。以第一作者或通讯作者在Sci Transl Med、Blood、J Immunol、Cancer Res、Transplantation等杂志发表文章13篇。

杨永广(1961年-),教授、博士生导师,中组部“千人计划”特聘专家,国家海外杰出青年基金获得者,现任吉林大学免疫学研究所所长,人类疾病动物模型国家地方联合工程实验室主任,科技部表观遗传药物与人类疾病动物模型国际联合研究中心主任,国家重大科学研究计划(973)及国家重大传染病专项“十二五”项目首席科学家。从事免疫学研究20余年,主要研究方向包括移植免疫、免疫耐受机制和诱导方法及免疫系统人源化动物的构建和应用;迄今发表SCI论文100余篇。研究工作曾获美国NIH等研究基金机构的资助,目前主持科技部国家重大科学研究计划(973)、国家自然科学基金面上项目及教育部创新团队等项目。
20世纪70年代末,人们在荷瘤小鼠和肿瘤患者体内发现一群具有免疫抑制功能的髓系来源的细胞,称为髓系抑制细胞(Myeloid-derived suppressor cells,MDSC)[1]。在肿瘤领域中,因MDSC有抑制功能可引起肿瘤逃逸而被广泛研究[1-3]。近年来MDSC在自身免疫疾病中的作用逐渐受到重视,但MDSC在自身免疫疾病中的作用尚不明确[4]。在多种自身免疫疾病小鼠模型中,外周血或脾脏内MDSC显著增多,在体外能抑制T细胞增殖,但其体内功能仍不一致,有研究认为其能通过抑制功能缓解疾病[5,6],也有研究认为其不能有效缓解疾病[7],甚至能促进疾病的进展[8-12]。深入研究MDSC在自身免疫疾病中的作用对疾病机制的理解及临床治疗具有重要意义。
1 MDSC的起源与表型
MDSC是由骨髓祖细胞和不成熟的髓系细胞(Immature myeloid cell,IMC)组成的异质细胞群。在骨髓发育过程中,正常生理条件下IMC会进一步发育为成熟的单核系、粒系及树突细胞。而当在肿瘤、炎症、创伤、自身免疫疾病等病理条件下,通过释放一些免疫抑制性因子,阻断IMC的分化,使髓系前体细胞不能发育成熟,使IMC数量显著增加,并迁出骨髓外,在外周血及脾脏或病变部位中大量集聚,形成MDSC(图1)[13,14]。
目前MDSC仍缺乏特异性的表面标志,使其难以与单核细胞或中性粒细胞区分。在小鼠中,通常以CD11b和Gr-1为MDSC的表面标记,即CD11b+Gr-l+细胞为MDSC,并根据 Gr-1表位特异性的抗体Ly6G和Ly6C表达及形态的差异,MDSC又可分为两个亚群:CD11b+Ly6G+Ly6Clow粒细胞样髓系抑制细胞 (Granulocytic myeloid-derived suppressor cells,G-MDSC) 和CD11b+Ly6G-Ly6Chigh单核细胞样髓系抑制性细胞 (Monocytic myeloid-derived suppressor cells,M-MDSC)[15]。在人类,MDSC表面主要表达CD11b和CD33两种分子,并缺乏人成熟细胞标记MHCⅡ分子HLA-DR,即以CD11b+CD33+HLA-DR-为标志[13,16]。此外,MDSC也缺乏谱系特异性抗原(Lineage specific antigens,Lin),包括CD3、CD19、CD56等,其表型可为CD11b+CD33+HLA-DR-Lin-[17]。人类的MDSC也可分为两个亚群:CD66b+或CD15+为表型的G-MDSC和CD14+为表型的M-MDSC。另外,有研究在脐血[18,19]或转移性小儿肉瘤患者外周血内[20]发现一个新的MDSC亚群,即纤维细胞样MDSC (Fibrocytic myeloid-derived suppres-sor cells,F-MDSC ), 其表型特点是 HLA-DR+、CD33+或CD33low/-[18-20],通过吲哚胺2,3双加氧酶(Indoleane-2,3-dioxygenase,IDO)诱导调节性T细胞(regulatory T cells,Treg)或直接抑制T细胞增殖。然而在小鼠肿瘤模型或其他肿瘤患者中尚未发现该亚群,还有待进一步研究。
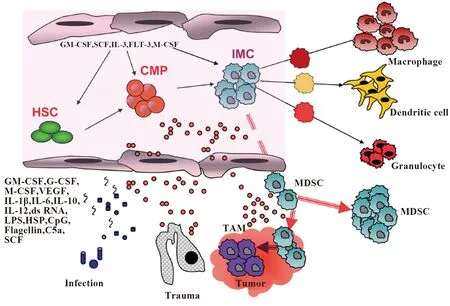
图1 MDSC的产生[13]Fig.1 Origin of MDSC[13]
2 MDSC的免疫抑制功能
MDSC的抑制作用研究大都集中在肿瘤领域[21]。在荷瘤小鼠和肿瘤患者体内,MDSC具有强大而广谱的免疫抑制功能,比如消耗淋巴细胞所需的氨基酸、产生氧化应激产物、促进Treg细胞的活化和扩增、干扰T细胞的迁移和活性等,过继回输MDSC能够显著促进小鼠体内肿瘤的生长[13,22]。
2.1 消耗淋巴细胞所需的氨基酸 MDSC分泌高活性的精氨酸酶(Arginase-1,Arg-1),Arg-1通过把L-精氨酸分解为尿素和鸟氨酸[13,23],造成了微环境中L-精氨酸的短缺,这种非必需氨基酸的缺乏可下调T细胞TCRξ-链的产生从而抑制T细胞的增殖[24]。此外,半胱氨酸是T细胞活化所必需的氨基酸。在生理状态下,抗原呈递细胞利用甲硫氨酸合成半胱氨酸,转运至T细胞内维持T细胞的正常活动。而MDSC不能将甲硫氨酸转化为半胱氨酸,因此它们完全依赖于摄入的胱氨酸转化为半胱氨酸。当MDSC出现大量聚集时,将会摄入大部分胱氨酸,从而剥夺抗原呈递细胞(Antigen presentation cells,APC)利用胱氨酸的能力,使APC产生的半胱氨酸减少;同时MDSC不能将产生的半胱氨酸转运至T细胞,使T细胞不能合成活化所需的蛋白质,从而阻断T细胞的活化[25,26]。
2.2 产生氧化应激产物 MDSC可产生氧化应激物质和活性氮等,是介导MDSC抑制T细胞功能的另一主要介质[13]。肿瘤分泌的TGF-β、IL-10、IL-3、IL-6、GM-CSF、血小板源性生长因子(Platelet derived growth factor,PDGF)等细胞因子可诱导MDSC产生活性氧簇(Reactive oxygen species,ROS)[27,28]。ROS能上调CD95L的表达,同时下调抗凋亡基因Bcl2的表达,直接诱导活化的T细胞凋亡[29]。MDSC与T细胞接触产生的过氧亚硝酸盐(Peroxynitrite,ONOO-)和过氧化氢等氧化应激物质也能抑制T细胞活性,机制包括抑制T细胞TCRξ链的表达,阻碍IL-2受体信号以及TCR的硝化作用[30-32]。此外,MDSC来源的诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)分解L-Arg 产生大量的NO,NO通过抑制Jak3/STAT5信号,减少MHCⅡ类分子的表达,诱导T细胞凋亡[26,33,34]。NO还可以封闭IL-2受体通路上重要的信号蛋白从而抑制T细胞活化[13,35]。
2.3 促进Treg细胞的活化和扩增 MDSC可促进抗原特异性Treg细胞的扩增和诱导幼稚CD4+T细胞转化为Treg细胞[36-42]。此外,IDO是色氨酸代谢的限速酶,MDSC在IDO的协同作用下,可诱导Treg分化而间接抑制免疫应答[18]。
2.4 干扰T细胞的迁移和活性 CD62L即L-选择素,是幼稚T细胞迁移到外周淋巴结所必需的。MDSC可通过下调CD62L导致CD8+和CD4+T细胞不能归巢到外周淋巴结中,从而不能被肿瘤抗原正常激活。另外,MDSC产生的过氧亚硝酸盐能硝化或亚硝基化CCL2,从而影响T细胞进入肿瘤部位。
2.5 其他 MDSC抑制机制也与细胞和细胞间的接触(CD40-CD40L接触)、产生IFN-γ、IL-10 和TGF-β细胞因子有关[40,43]。
3 MDSC在自身免疫疾病中的功能
研究表明MDSC在多种自身免疫疾病小鼠模型及病人中显著增多,但其功能存在争议[4,44,45]。一些研究认为MDSC因其抑制功能可以缓解疾病[5,6],而另一些研究认为MDSC在体内炎症状态下有促炎及促疾病作用[4,10,11]。以下我们对MDSC在各种自身免疫疾病中的作用加以详细阐述。
3.1 MDSC与多发性硬化 多发性硬化(Multiple sclerosis,MS)是中枢神经系统(Central nervous system,CNS)常见的自身免疫疾病,实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)小鼠模型是代表性的MS小鼠模型。EAE小鼠外周血和脾内MDSC比例显著增加,并在脑及脊髓内有大量MDSC浸润,数量随疾病演变而变化,即从无症状开始逐渐增加,在临床期数量达到顶峰,随后逐渐下降,慢性期时降至最低点。Zhu等[46]也发现CD11b+Ly6Chigh的M-MDSC在EAE小鼠外周血、脾和CNS中增多,并与发病症状的严重程度呈正相关,脾M-MDSC在体外能显著抑制CD4+CD8+T细胞的增殖[46]。用合成的维生素A类物质诱导EAE小鼠的MDSC分化后,脊髓中T细胞数量增多,且神经系统症状恶化,提示MDSC具有抑制作用[47]。Ioannou等[5]则认为仅CD11b+Ly6G+G-MDSC在外周血、淋巴结和脊髓中大量增多,并且转输G-MDSC 可缓解EAE小鼠疾病病情。此外,对MS患者MDSC的研究较少,有报道MS患者外周血中CD15+CD33+HLA-DRlowCD14-G-MDSC在外周血中增多,并在体外证明其具有抑制T细胞增殖的功能[5]。MDSC在MS中也通过上调iNOS、Arg-1表达等机制发挥抑制T细胞作用[6,46]。
尽管EAE小鼠体内MDSC增多,有研究认为可以通过抑制T细胞活性缓解疾病[5,6],但有些研究却发现转输CD11b+Ly6G-MDSC后EAE小鼠并无症状改善[7],而且有促进炎症及疾病进展的作用[8,12,48]。比如,King等[8]发现GM-CSF可促进CD11b+CD62L+Ly6ChighM-MDSC从骨髓中释放,这些细胞通过血脑屏障进入CNS,除了增加促炎因子分泌,还能向DC和巨噬细胞分化,使EAE症状及病情加重。Yi等[12]发现CD11b+Gr1+MDSC增多,尽管MDSC在体外可抑制T细胞增殖,但在体外IL-6和TGF-β等Th17极化的条件下可促进Th17细胞分化;MDSC促Th17分化的作用与其产生IL-1β有关,体内用吉西他滨选择性剔除MDSC或应用IL-1β抑制剂显著降低Th17细胞比例,缓解疾病症状。此外,在Theiler′s鼠脑脊髓炎病毒(Theiler′s murine encephalomyelitis virus,TMEV)感染所致的MS小鼠模型中发现,去除MDSC后脱髓鞘的症状减轻[48]。
上述研究得出相反结论可能与MDSC所处的炎症环境不同有关。MDSC在体外大都有着抑制功能,然而在体内复杂的炎症环境存在下,MDSC可能发生抑制作用减弱或分化为DC和巨噬细胞,从而促进炎症反应。
3.2 MDSC与类风湿关节炎 胶原蛋白诱导的关节炎(Collagen-induced arthritis,CIA)是类风湿性关节炎(Rheumatoid arthritis,RA)的常用动物模型。研究发现CIA小鼠脾脏中MDSC大量扩增,体外可抑制CD4+T细胞增殖,同时抑制CD4+T细胞分泌IFN-γ、IL-2、TNF-α和IL-6等促炎因子,抑制Th17细胞分化,促进IL-10的表达;转输MDSC到CIA小鼠中使疾病症状缓解[49]。此外,在CIA小鼠[50]和RA患者[51]的滑膜液中均发现G-MDSC增多,患者滑膜液中的MDSC可抑制T细胞的增殖,由此表明G-MDSC限制了T细胞向关节处的浸润。
然而,也有研究认为MDSC在RA中起促炎作用,并促进疾病的发展[9,10]。Guo等[9]发现,CIA中MDSC在体内扩增,CIA来源的MDSC产生高水平的IL-1β、TNF-α等促炎因子,并在体外促进Th17分化。当转输MDSC后小鼠疾病症状加重,而去除MDSC后疾病得到缓解。Zhang等[10]同样发现用抗Gr-1抗体去除MDSC后,血清中IL-17水平减少,T细胞增殖受抑。而当转输MDSC到去除MDSC的CIA小鼠中,关节炎症状加重,IL-17水平增多,提示MDSC可促进Th17分化和疾病进展。同样,在RA患者中发现MDSC在RA患者外周血显著增多,与疾病严重程度及Th17反应正相关[9,10]。由此可见,RA中MDSC发挥免疫抑制还是促炎的作用尚不完全明确,需进一步研究明确。
3.3 MDSC和SLE MRL-Fas/lpr是常用的小鼠SLE模型,Iwata等[52]发现在MRL-Fas/lpr小鼠的疾病发展过程中,CD11b+GR-1low细胞在外周血、脾、肾组织内被检测到,体外有抑制CD4+T细胞作用,机制与Arg-1有关。Trigunaite等[53]在SLE小鼠模型中观察到Gr-1+CD11b+细胞分布在脾脏B细胞滤泡结构周围,在体外可以抑制初始B细胞向浆细胞分化。在NZB×NZW F1遗传背景的SLE小鼠模型中,MDSC在体外可抑制幼稚T细胞向滤泡辅助T细胞(T follicular helper cell,Tfh)细胞分化[54]。由此表明MDSC可通过直接抑制B细胞作用和抑制Tfh细胞分化两种方式来抑制B细胞的免疫应答。
然而,也有研究认为MDSC在SLE中发挥了促进疾病进展的作用。在MRL/lpr小鼠模型中,Gr-1+CD11b+MDSC增多并可通过IL-1β促进Th17细胞及抑制Treg的产生,从而发挥致病作用[55]。而我们的研究发现MDSC及其两个亚群在SLE患者外周血中显著增多,并与病情正相关。在体外Th17极化条件下MDSC可通过分泌Arg-1促进Th17细胞分化,机制与下游GCN2-eIF2α及mTOR通路相关。而在人源化SLE小鼠中去除MDSC后,则Th17细胞减少,疾病症状减轻[11]。上述实验证明了MDSC通过Arg-1促Th17的产生在SLE发病中起了促进作用。
3.4 MDSC和自身免疫性肝炎 自身免疫性肝炎(Autoimmune hepatitis,AIH)是一种肝脏特异性的自身免疫病,其特点是肝门区及肝实质内有产生IFN-γ的T细胞聚集,导致肝细胞损伤和坏死。在Tgfb1-/-小鼠AIH模型中,肝脏Th1细胞增多的同时伴随有CD11b+Gr-1+的MDSC增多。从肝脏分离出的CD11b+Gr-1+的MDSC在体外能抑制CD4+T细胞,机制与NO、IFN-γ和细胞-细胞接触有关[56]。AIH病人外周血中有M-MDSC样细胞增多[57],肝活检提示有CD11b+细胞浸润,提示MDSC在外周血及肝组织中增殖,参与免疫应答[58]。
3.5 MDSC和炎症性肠病 炎症性肠病(Inflammatory bowel disease,IBD)是一组表现为肠道慢性非特异性炎症的自身免疫疾病,包括溃疡性结肠炎和Crohn′s病。研究表明MDSC参与调控IBD炎症反应,体外实验进一步表明CD11b+Gr-1+MDSC可通过iNOS来抑制CD8+T 细胞的增殖,转输CD11b+Gr-1+MDSC给IBD模型小鼠可减轻小鼠肠炎症状[59]。此外,研究还发现MDSC还能抑制IBD小鼠IFN-γ、GM-CSF、IL-17及TNF-α等细胞因子的表达[59]。而炎症性肠病患者的外周血中发现CD14+HLADR-/lowM-MDSC增多,体外有免疫抑制作用[59]。
3.6 MDSC和其他自身免疫疾病 此外,在Ⅰ型糖尿病模型中,MDSC在体外能促进Treg细胞的扩增,抑制T细胞的增殖,体内转输MDSC可缓解糖尿病的症状[60]。在实验性自身免疫性重症肌无力(Experimental autoimmune myasthenia gravis,EAMG)动物模型中,MDSC可在体外促进T细胞的凋亡[61]。在实验性自身免疫性葡萄膜炎(Experimental autoimmune uveitis,EAU)动物模型中,发现在眼部炎症的进展中有MDSC聚集,体外可抑制T细胞活化[62]。Marhaha等[63]在自身免疫性斑秃小鼠模型中发现重复接触致敏原导致小鼠皮肤和脾脏内Gr1+细胞增加,体外可抑制效应细胞增殖,体内可部分恢复毛发生长。
3.7 MDSC在自身免疫疾病的作用及机制 正如表1所示,不同自身免疫疾病小鼠模型中分离出的MDSC体外都具有抑制T细胞的功能,机制与表达iNOS、Arg-1或产生ROS等有关。但在体内研究中,MDSC的具体功能很难确定。有研究认为MDSC在体内有保护作用,例如在EAE[5]、RA[49]、IBD[59]、Ⅰ型糖尿病模型[60]中,转输MDSC后疾病得到缓解。也有研究发现,转输MDSC不能缓解疾病的症状[7],甚至引起疾病的恶化[9,10],而去除MDSC可缓解疾病的进展[9-12]。MDSC在自身免疫病中相互矛盾的结果,除了实验模型不同(诱导方式、发病机制不同),与MDSC的异质性、缺少特异的识别标志(导致分离纯化可能为不同的细胞)也有关系。另外,即使同样的模型,不同机构间小鼠遗传差异、疾病进展阶段不同、回输细胞的亚群、时间、方案的不同都可能导致实验结果差异。比如,同为CIA模型,Fujii等[49]的实验小鼠有明显的疾病缓解期,MDSC是在缓解期开始时分离的,表型是以G-MDSC为主;但Zhang等[10]和Guo等[9]的CIA小鼠关节炎症状逐渐加重,并且两者都通过loss-gain实验表明MDSC具有促炎症作用。另一方面,自身免疫炎症条件下内源性的MDSC可能失去抑制作用,Guo等[9]表明CIA后期(28 d)的MDSC比发病前(14 d)MDSC抑制功能减弱,同时CIA来源的MDSC比naïve小鼠MDSC产生更多的IL-1β。然而,是否不同模型炎症微环境的特殊因子活化了MDSC的某个亚群功能或分化通路,仍然需要更多更细致的实验去验证。由于在体内实验中MDSC显现出的非保护及促炎症作用,学者开始研究其促炎症作用的机制。Th17细胞是CD4+T细胞的亚群,以分泌IL-17A、IL-17F等细胞因子为特点[64,65],在MS、SLE等多种自身免疫疾病中有明确致病作用[66,67]。近几年来,MDSC与Th17细胞的关系的研究开始引起人们的关注。有报道IL-17因子可以促进MDSC的扩增及集聚[68,69]。有报道在肿瘤[70]及类风湿关节炎[9]中MDSC比例与IL-17因子水平呈正相关,然而,在类风湿关节炎患者中,也有报道MDSC与Th17细胞的水平没有相关性[71]。Yi等[12]在EAE小鼠模型中发现,MDSC在体外Th17极化条件及体内均能促进Th17分化,机制与IL-1β有关,而在体内实验中,吉西他滨去除MDSC后,Th17细胞减少并可以有效缓解病情,说明MDSC具有促炎及致病作用。此后,RA模型研究中也证明了CD11b+Gr1+细胞在体内外促进Th17分化功能,并能促进疾病进展,转输MDSC后疾病加重,去除MDSC后IL-17减少,疾病得到缓解[9,10]。而SLE患者和人源化小鼠中发现,MDSC可促Th17分化及疾病进展,机制与MDSC分泌的Arg-1有关[11],在SLE的MRL/lpr小鼠模型中,也同样发现MDSC显著增多,并可促Th17分化,机制与IL-1β有关[55]。这些实验说明了自身免疫疾病中MDSC可促Th17分化而导致疾病进展。
表1 MDSC在各种自身免疫疾病中的作用
Tab.1 Role of MDSC in different autoimmune disorders

HumandiseaseSpeciesCellphenotypeMechanismofsuppression(invitro)ProinflammatorymechanismFunctioninvivoReferenceMultiplesclerosisMouseCD11b+Ly6ChighLy6G-iNOS-NotdeterminedZhu[46]MouseCD11b+Ly6G+Notdetermined-ProtectiveIoannou[5]MouseArg-1+CD11b+Gr-1+M-CSF1R+Arg-1-ProtectiveMoline[6]MouseCD11b+Ly6G+iNOSandcell-contact-Non-protectiveSlaney[7]MouseCD11b+CD62L+Ly6ChighNotdeterminedIL-1βproductionPathogeneticKing[8]MouseCD11b+Gr1+NotdeterminedIL-1β-dependentTh17differentiationPathogeneticYi[12]MouseCD11b+Ly6C+Notdetermined-PathogeneticBowen[48]HumanCD15+CD33+HLA-DRlowCD14-Arg-1-PathogeneticIoannou[5]RheumatoidarthritisMouseCD11b+Gr1+Arg-1-ProtectiveFujii[49]MouseCD11b+Gr1+ROSandiNOS-NotdeterminedEgelston[50]MouseCD11b+Gr1+NotdeterminedIL-1β-dependentTh17differentiationPathogeneticZhang[10]Mouse/humanCD11b+Gr1+/CD11b+CD33+NotdeterminedIL-1β-dependentTh17differentiationPathogeneticGuo[9]MouseCD11b+Gr1lowArg-1-NotdeterminedIwata[25]HumanCD11b+CD33+HLA-DRlo/-Notdetermined-NotdeterminedKurko[51]SystemiclupuserythematosusMouseCD11b+Gr1lowNotdeterminedIL-1β-dependentTh17differentiationandPathogeneticJi[55]HumanizedmiceHLADR-CD11b+NotdeterminedArg1-dependentTh17differentiationPathogeneticWu[11]HumanHLADR-CD11b+NotdeterminedArg1-dependentTh17differentiationPathogeneticWu[11]InflammatoryboweldiseaseMouseCD31+CD11b+Gr1+iNOS-ProtectiveHaile[59]AutoimmunehepatitisMouseCD11b+Ly6ChighLy6G-iNOS-Non-protectiveCripps[56]MyatheniagravisMouseNotdeterminedTcellapoptosis-Non-protectiveMcIntosh[61]InflammatoryeyediseaseMouseCD11b+Gr1+Ly6G-TNFR-dependent-NotdeterminedKerr[62]AlopeciaareataMouseCD11b+Gr1+CD3ζdownregulation-ProtectiveMarhaba[63]Type1diabetesMouseGr1+CD115+Notdetermined-ProtectiveYin[60]
4 展望
综上所述,自身免疫中MDSC大量扩增并参与了自身免疫疾病的免疫反应过程,在体外也有抑制T细胞的功能。然而在自身免疫疾病动物模型体内,这些大量扩增的MDSC却不能有效阻止疾病的进展,MDSC在体内是否仍发挥抑制作用尚存在争议[4,44]。我们及其他研究人员发现尽管MDSC在体外有抑制功能,但在体外及体内也有促Th17分化的作用[9-12]。综上认为,在自身免疫疾病中,一方面,MDSC通过抑制T细胞发挥抗炎及缓解疾病的作用,另一方面在持续炎症条件下反而促进Th17细胞分化发挥促进炎症及疾病进展的作用。由于缺少特异的表面标志,一定程度上阻碍了对MDSC复杂发育过程的理解,我们仍然难以确定的是MDSC在疾病不同阶段还是其不同亚群发挥了促Th17分化和抑制T细胞增殖截然不同功能;另外MDSC促进Th17分化的下游分子通路仍然不明确,亟待进一步研究。解决这些问题将有助于优化MDSC抑制免疫应答的功能,减少其促炎作用,为基于MDSC有效治疗自身免疫疾病提供新的治疗措施和干预靶点。
[1] Talmadge JE,Gabrilovich DI.History of myeloid-derived suppressor cells[J].Nat Rev Cancer,2013,13(10):739-752.
[2] Parker KH,Beury DW,Ostrand-Rosenberg S.Myeloid-derived suppressor cells: Critical cells driving immune suppression in the tumor microenvironment[J].Adv Cancer Res,2015,128:95-139.
[3] Gantt S,Gervassi A,Jaspan H,etal.The role of myeloid-derived suppressor cells in immune ontogeny[J].Front Immunol,2014,5:387.
[4] Boros P,Ochando J,Zeher M.Myeloid derived suppressor cells and autoimmunity[J].Hum Immunol,2016,77(8):631-636.
[5] Ioannou M,Alissafi T,Lazaridis I,etal.Crucial role of granulocytic myeloid-derived suppressor cells in the regulation of central nervous system autoimmune disease[J].J Immunol,2012,188(3):1136-1146.
[6] Moline-Velazquez V,Cuervo H,Vila-Del Sol V,etal.Myeloid-derived suppressor cells limit the inflammation by promoting t lymphocyte apoptosis in the spinal cord of a murine model of multiple sclerosis[J].Brain Pathol,2011,21(6):678-691.
[7] Slaney CY,Toker A,La Flamme A,etal.Naive blood monocytes suppress t-cell function.A possible mechanism for protection from autoimmunity[J].Immunol cell Biol,2011,89(1):7-13.
[8] King IL,Dickendesher TL,Segal BM.Circulating ly-6c+myeloid precursors migrate to the cns and play a pathogenic role during autoimmune demyelinating disease[J].Blood,2009,113(14):3190-3197.
[9] Guo CQ,Hu FL,Yi HF,etal.Myeloid-derived suppressor cells have a proinflammatory role in the pathogenesis of autoimmune arthritis[J].Ann Rheum Dis,2016,75(1):278-285.
[10] Zhang H,Wang S,Huang Y,etal.Myeloid-derived suppressor cells are proinflammatory and regulate collagen-induced arthritis through manipulating th17 cell differentiation[J].Clin Immunol,2015,157(2):175-186.
[11] Wu H,Zhen Y,Ma Z,etal.Arginase-1-dependent promotion of Th17 differentiation and disease progression by mdscs in systemic lupus erythematosus[J].Sci Transl Med,2016,8(331):331ra340.
[12] Yi H,Guo C,Yu X,etal.Mouse CD11b+gr-1+ myeloid cells can promote Th17 cell differentiation and experimental autoimmune encephalomyelitis[J].J Immunol,2012,189(9):4295-4304.
[13] Gabrilovich DI,Nagaraj S.Myeloid-derived suppressor cells as regulators of the immune system[J].Nat Rev Immunol,2009,9(3):162-174.
[14] Wynn TA.Myeloid-cell differentiation redefined in cancer[J].Nat Immunol,2013,14(3):197-199.
[15] Peranzoni E,Zilio S,Marigo I,etal.Myeloid-derived suppressor cell heterogeneity and subset definition[J].Curr Opin Immunol,2010,22(2):238-244.
[16] Zhao F,Hoechst B,Duffy A,etal.S100a9 a new marker for monocytic human myeloid-derived suppressor cells[J].Immunology,2012,136(2):176-183.
[17] Wesolowski R,Markowitz J,Carson WE 3rd.Myeloid derived suppressor cells-a new therapeutic target in the treatment of cancer[J].J Immunother Cancer,2013,1:10.
[18] Zoso A,Mazza EM,Bicciato S,etal.Human fibrocytic myeloid-derived suppressor cells express ido and promote tolerance via treg-cell expansion[J].Eur J Immunol,2014,44(11):3307-3319.
[19] Mazza EM,Zoso A,Mandruzzato S,etal.Gene expression profiling of human fibrocytic myeloid-derived suppressor cells (f-mdscs)[J].Geno Data,2014,2:389-392.
[20] Zhang H,Maric I,DiPrima MJ,etal.Fibrocytes represent a novel mdsc subset circulating in patients with metastatic cancer[J].Blood,2013,122(7):1105-1113.
[21] Gabrilovich DI,Ostrand-Rosenberg S,Bronte V.Coordinated regulation of myeloid cells by tumours[J].Nat Rev Immunol,2012,12(4):253-268.
[22] Kumar V,Patel S,Tcyganov E,etal.The nature of myeloid-derived suppressor cells in the tumor microenvironment[J].Trends Immunol,2016,37(3):208-220.
[23] Heuvers ME,Muskens F,Bezemer K,etal.Arginase-1 mrna expression correlates with myeloid-derived suppressor cell levels in peripheral blood of nsclc patients[J].Lung Cancer,2013,81(3):468-474.
[24] Rodriguez PC,Quiceno DG,Zabaleta J,etal.Arginase i production in the tumor microenvironment by mature myeloid cells inhibits t-cell receptor expression and antigen-specific t-cell responses[J].Cancer Res,2004,64(16):5839-5849.
[25] Srivastava MK,Sinha P,Clements VK,etal.Myeloid-derived suppressor cells inhibit t-cell activation by depleting cystine and cysteine[J].Cancer Res,2010,70(1):68-77.
[26] Ostrand-Rosenberg S,Sinha P.Myeloid-derived suppressor cells: Linking inflammation and cancer[J].J Immunol,2009,182(8):4499-4506.
[27] Soliman H,Mediavilla-Varela M,Antonia S.Indoleamine 2,3-dioxygenase: Is it an immune suppressor?[J].Cancer J,2010,16(4):354-359.
[28] Kusmartsev S,Su Z,Heiser A,etal.Reversal of myeloid cell-mediated immunosuppression in patients with metastatic renal cell carcinoma[J].Clin Cancer Res,2008,14(24):8270-8278.
[29] Hildeman DA,Mitchell T,Aronow B,etal.Control of bcl-2 expression by reactive oxygen species[J].Proc Natl Acad Sci U S A,2003,100(25):15035-15040.
[30] Schmielau J,Finn OJ.Activated granulocytes and granulocyte-derived hydrogen peroxide are the underlying mechanism of suppression of T-cell function in advanced cancer patients[J].Cancer Res,2001,61(12):4756-4760.
[31] Mazzoni A,Bronte V,Visintin A,etal.Myeloid suppressor lines inhibit t cell responses by an no-dependent mechanism[J].J Immunol,2002,168(2):689-695.
[32] Nagaraj S,Gupta K,Pisarev V,etal.Altered recognition of antigen is a mechanism of CD8+T cell tolerance in cancer[J].Nat Med,2007,13(7):828-835.
[33] Boros P,Ochando JC,Chen SH,etal.Myeloid-derived suppressor cells: Natural regulators for transplant tolerance[J].Hum Immunol,2010,71(11):1061-1066.
[34] Fujimura T,Mahnke K,Enk AH.Myeloid derived suppressor cells and their role in tolerance induction in cancer[J].J Dermatol Sci,2010,59(1):1-6.
[35] Vasquez-Dunddel D,Pan F,Zeng Q,etal.Stat3 regulates arginase-i in myeloid-derived suppressor cells from cancer patients[J].J Clin Invest,2013,123(4):1580-1589.
[36] Luan Y,Mosheir E,Menon MC,etal.Monocytic myeloid-derived suppressor cells accumulate in renal transplant patients and mediate CD4(+) Foxp3(+) Treg expansion[J].Am J Ransplantat,2013,13(12):3123-3131.
[37] Centuori SM,Trad M,LaCasse CJ,etal.Myeloid-derived suppressor cells from tumor-bearing mice impair tgf-beta-induced differentiation of CD4+CD25+Foxp3+tregs from CD4+CD25-Foxp3-t cells[J].J Leuk Biol,2012,92(5):987-997.
[38] Chou HS,Hsieh CC,Charles R,etal.Myeloid-derived suppressor cells protect islet transplants by b7-h1 mediated enhancement of t regulatory cells[J].Transplantation,2012,93(3):272-282.
[39] Berezhnaya NM.Interaction between tumor and immune system: The role of tumor cell biology[J].Exper Oncol,2010,32(3):159-166.
[40] Pan PY,Ma G,Weber KJ,etal.Immune stimulatory receptor CD40 is required for T-cell suppression and t regulatory cell activation mediated by myeloid-derived suppressor cells in cancer[J].Cancer Res,2010,70(1):99-108.
[41] Serafini P,Mgebroff S,Noonan K,etal.Myeloid-derived suppressor cells promote cross-tolerance in B-cell lymphoma by expanding regulatory t cells[J].Cancer Res,2008,68(13):5439-5449.
[42] Pan PY,Wang GX,Yin B,etal.Reversion of immune tolerance in advanced malignancy: Modulation of myeloid-derived suppressor cell development by blockade of stem-cell factor function[J].Blood,2008,111(1):219-228.
[43] Huang B,Pan PY,Li Q,etal.Gr-1+CD115+immature myeloid suppressor cells mediate the development of tumor-induced t regulatory cells and T-cell anergy in tumor-bearing host[J].Cancer Res,2006,66(2):1123-1131.
[44] Cripps JG,Gorham JD.MDSC in autoimmunity[J].Int Immunopharmacol,2011,11(7):789-793.
[45] Crook KR,Liu P.Role of myeloid-derived suppressor cells in autoimmune disease[J].World J Immunol,2014,4(1):26-33.
[46] Zhu B,Bando Y,Xiao S,etal.CD11b+ly-6c(hi) suppressive monocytes in experimental autoimmune encephalomyelitis[J].J Immunol,2007,179(8):5228-5237.
[47] Moline-Velazquez V,Ortega MC,Vila del Sol V,etal.The synthetic retinoid am80 delays recovery in a model of multiple sclerosis by modulating myeloid-derived suppressor cell fate and viability[J].Neurobiol Dis,2014,67:149-164.
[48] Bowen JL,Olson JK.Innate immune CD11b+gr-1+ cells,suppressor cells,affect the immune response during theiler's virus-induced demyelinating disease[J].J Immunol,2009,183(11):6971-6980.
[49] Fujii W,Ashihara E,Hirai H,etal.Myeloid-derived suppressor cells play crucial roles in the regulation of mouse collagen-induced arthritis[J].J Immunol,2013,191(3):1073-1081.
[50] Egelston C,Kurko J,Besenyei T,etal.Suppression of dendritic cell maturation and T cell proliferation by synovial fluid myeloid cells from mice with autoimmune arthritis[J].Arthritis Rheum,2012,64(10):3179-3188.
[51] Kurko J,Vida A,Glant TT,etal.Identification of myeloid-derived suppressor cells in the synovial fluid of patients with rheumatoid arthritis: A pilot study[J].BMC Musculoskelet Disord,2014,15:281.
[52] Iwata Y,Furuichi K,Kitagawa K,etal.Involvement of CD11b+gr-1 low cells in autoimmune disorder in mrl-fas lpr mouse[J].Clin Exp Nephrol,2010,14(5):411-417.
[53] Trigunaite A,Khan A,Der E,etal.Gr-1(high) CD11b+cells suppress b cell differentiation and lupus-like disease in lupus-prone male mice[J].Arthritis Rheum,2013,65(9):2392-2402.
[54] Der E,Dimo J,Trigunaite A,etal.Gr1+cells suppress t-dependent antibody responses in (nzb x nzw)f1 male mice through inhibition of t follicular helper cells and germinal center formation[J].J Immunol,2014,192(4):1570-1576.
[55] Ji J,Xu J,Zhao S,etal.Myeloid-derived suppressor cells contribute to systemic lupus erythaematosus by regulating differentiation of th17 cells and tregs[J].Clin Sci,2016,130(16):1453-1467.
[56] Cripps JG,Wang J,Maria A,etal.Type 1 T helper cells induce the accumulation of myeloid-derived suppressor cells in the inflamed tgfb1 knockout mouse liver[J].Hepatology,2010,52(4):1350-1359.
[57] Longhi MS,Mitry RR,Samyn M,etal.Vigorous activation of monocytes in juvenile autoimmune liver disease escapes the control of regulatory T-cells[J].Hepatology,2009,50(1):130-142.
[58] Senaldi G,Portmann B,Mowat AP,etal.Immunohistochemical features of the portal tract mononuclear cell infiltrate in chronic aggressive hepatitis[J].Arch Dis Child,1992,67(12):1447-1453.
[59] Haile LA,von Wasielewski R,Gamrekelashvili J,etal.Myeloid-derived suppressor cells in inflammatory bowel disease: A new immunoregulatory pathway[J].Gastroenterology,2008,135(3):871-881.
[60] Yin B,Ma G,Yen CY,etal.Myeloid-derived suppressor cells prevent type 1 diabetes in murine models[J].J Immunol,2010,185(10):5828-5834.
[61] McIntosh KR,Drachman DB.Induction of apoptosis in activated t cell blasts by suppressive macrophages: A possible immunotherapeutic approach for treatment of autoimmune disease[J].Cell Immunol,1999,193(1):24-35.
[62] Kerr EC,Raveney BJ,Copland DA,etal.Analysis of retinal cellular infiltrate in experimental autoimmune uveoretinitis reveals multiple regulatory cell populations[J].J Auto Immun,2008,31(4):354-361.
[63] Marhaba R,Vitacolonna M,Hildebrand D,etal.The importance of myeloid-derived suppressor cells in the regulation of autoimmune effector cells by a chronic contact eczema[J].J Immunol,2007,179(8):5071-5081.
[64] Matsushita S,Higashi T.Human Th17 cell clones and natural immune responses[J].Allergol Int,2008,57(2):135-140.
[65] Lubberts E.The IL-23-IL-17 axis in inflammatory arthritis[J].Nat Rev Rheum,2015,11(10):562.
[66] de Oliveira DM,de Oliveira EM,Ferrari Mde F,etal.Simvastatin ameliorates experimental autoimmune encephalomyelitis by inhibiting Th1/Th17 response and cellular infiltration[J].Inflammopharmacol,2015,23(6):343-354.
[67] Yiu G,Rasmussen TK,Ajami B,etal.Development of Th17-associated interstitial kidney inflammation in lupus-prone mice lacking the gene encoding stat-1[J].Arthritis Rheum,2015,68(5):1233-1244.
[68] Wu P,Wu D,Ni C,etal.γδT17 cells promote the accumulation and expansion of myeloid-derived suppressor cells in human colorectal cancer[J].Immunity,2014,40(5):785-800.
[69] Chen X,Churchill MJ,Nagar KK,etal.IL-17 producing mast cells promote the expansion of myeloid-derived suppressor cells in a mouse allergy model of colorectal cancer[J].Oncotarget,2015,6(32):32966-32979.
[70] Yazawa T,Shibata M,Gonda K,etal.Increased IL-17 production correlates with immunosuppression involving myeloid-derived suppressor cells and nutritional impairment in patients with various gastrointestinal cancers[J].Mole Clin Oncol,2013,1(4):675-679.
[71] Jiao Z,Hua S,Wang W,etal.Increased circulating myeloid-derived suppressor cells correlated negatively with Th17 cells in patients with rheumatoid arthritis[J].Scandinavian J Rheumatol,2013,42(2):85-90.
[收稿2016-12-05]
(编辑 许四平)
Role of myeloid-derived suppressor cells in autoimmune disease
WUHao,YIHuan-Fa,YANGYong-Guang.
TheFirstHospitalAcademyofTranslationalMedicineandInstituteofImmunologyofJilinUniversity,Changchun130061,China
Myeloid-derived suppressor cells (MDSC) are a bone marrow-derived heterogeneous cell population with immunosuppressive activity.Although there is convincing evidence that autoimmune diseases are associated with MDSC expansion,controversies remained regarding the role of MDSCs in controlling autoimmune responses.Recent studies have shown that the expansion of MDSCs,which are capable of inhibiting effector cell function in vitro,does not always lead to alleviation of autoimmune diseases,and in some cases paradoxically exacerbates the disease progression.This review summarizes recent insights into the role of MDSCs in the development of autoimmune responses and the potential of using MDSCs for the treatment of autoimmune diseases.
MDSC;Autoimmune disease;Th17 differentiation
10.3969/j.issn.1000-484X.2017.03.001
①本文受国家自然科学基金(81671592、81373159、81273334、81641064)、国家重点基础研究发展计划(973)项目(2013CB966903、2015CB964400)、教育部创新团队(IRT1133、IRT_15R24)和吉林省科技厅项目(20150101127JC、20140413058GH)资助。
R392
A
1000-484X(2017)03-0321-08
②通讯作者,E-mail:yihuanfa@jlu.edu.cn; E-mail:yongg@jlu.edu.cn。
