反射式共聚焦显微镜对不典型银屑病的辅助诊断: 附3例病例分析
2017-04-09李艳飞木其日都吉雅
李艳飞,木其日,都吉雅
随着现代生活节奏的加快,在压力及各种环境因素刺激作用下,银屑病的发病率呈逐年增加趋势,临床中也不乏各种不典型的银屑病皮损。组织病理检查是该病诊断的金标准,但由于其有创伤、周期长、特殊部位取材困难(如男性龟头部位)等限制因素,使之实施起来有较多阻力,从而增加了临床医生诊断的难度。近几年,随着反射式共聚焦显微镜(re fl ectance confocal microscopy,RCM)在皮肤科的临床应用,在一定程度上弥补了组织病理检查的缺憾,提高了诊断的正确率。
临床资料
病例1,女,53岁。因左侧下肢带状分布红斑3个月,于2016年9月5日就诊。3个月前,患者左大腿内侧出现3~5个淡红色斑丘疹,其上逐渐出现少许鳞屑,部分皮损缓慢扩大呈斑片,并沿着左侧下肢逐渐呈带状向两端蔓延,瘙痒不明显。患者自行口服治疗湿疹的中药汤剂(具体方剂不祥)2个月,无好转。患者自发病以来,精神状态良好,无发热、关节痛等全身症状,饮食及睡眠可,二便如常。既往史无特殊;否认有传染病史、外伤手术史、药物过敏史及家族遗传史。系统查体无异常。皮肤科情况:左下肢股内侧至踝关节内侧可见带状分布的红色或淡红色斑丘疹及斑片,部分皮损表面可见少许的白色鳞屑,鳞屑易刮除,Auspitz征可疑阳性(图1a)。初步诊断:①线状苔藓?②线状扁平苔藓?③银屑病?RCM示:角质层均匀分布的折光不均的颗粒状细胞结构,为灶状的角化不全,棘层上方分叶核炎性细胞聚集形成椭圆形Munro微脓肿,真皮乳头明显上延,血管扭曲扩张充血(图1b-1d)。皮损组织病理示:表皮角化过度、局限性角化不全,角质层可见Munro微脓肿,颗粒层变薄,棘层增厚,表皮突杵状下延,真皮乳头杵状上延,其上方棘层变薄,真皮乳头血管扩张,伴淋巴细胞及中性粒细胞浸润(图1e)。最后诊断:银屑病。
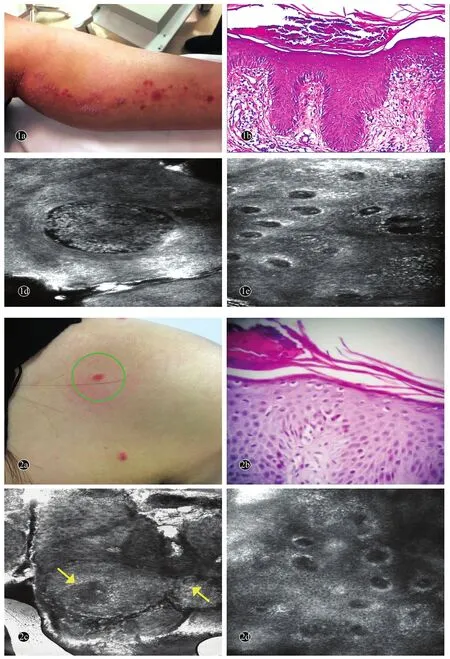
图2 不典型银屑病患者(例2)临床、组织病理及RCM图像
病例2,女,19岁。因左肩部及前胸红斑伴瘙痒1周,于2016年7月11日就诊。1周前,无明显诱因患者左侧肩部出现两片直径0.5~1 cm大小淡红色斑片,缓慢扩大伴轻度瘙痒。自行外用醋酸氟轻松软膏后局部瘙痒缓解,皮损颜色转暗,但仍有新发皮损。患者自发病以来,精神状态良好,无发热、关节痛、腹痛、腹泻等全身症状,饮食及睡眠可,二便如常。既往史无特殊;否认传染病史、外伤手术史、药物过敏史及家族遗传史。系统查体无异常。皮肤科情况:左侧肩部及前胸部散在分布5处直径0.5~1 cm大小的淡红或暗红色斑丘疹及斑片,局部皮损中央可见细薄鳞屑(图2a)。初步诊断:①银屑病?②玫瑰糠疹?③扁平苔藓?RCM示:分叶核炎性细胞聚集形成的境界清楚的Munro微脓肿,动态扫描时有闪烁感,真皮乳头轻度上延,血管扭曲增生(图2b-2c)。皮损组织病理示:表皮轻度角化过度伴局灶性角化不全,可见Munro微脓肿,颗粒层明显变薄,棘层增厚,表皮突轻度下延,真皮乳头杵状上延,其上方棘层变薄,真皮乳头血管轻度扩张伴少许炎性细胞浸润(图2d)。最后诊断:银屑病。

图1 不典型银屑病患者(例1)临床、组织病理及RCM图像
病例3,女,25岁。因躯干、四肢鳞屑性红斑2周,于2016年8月6日就诊。2周前,无明显诱因患者右侧手背出现一红色的斑丘疹,之后逐渐在胸部、臀部及股内侧陆续出现数片红斑;手背皮损因抓破出现水疱样改变。发病以来,患者精神状态良好,无发热、关节痛、腹痛、腹泻等全身症状,饮食及睡眠可,二便如常。既往史无特殊;否认传染病史、外伤手术史、药物过敏史及家族遗传史。系统查体无异常。皮肤科情况:右手背、胸部、肩部、左侧臀部及股内侧散在分布大小不等的红斑,其中肩部、臀部及股内侧红斑上可见少许白色鳞屑,手背红斑表面有假性水疱样改变(图3a,3b)。初步诊断:①银屑病?②多形红斑?③玫瑰糠疹?④恶性萎缩性丘疹病?RCM示:角质层下方可见高折光的分叶核炎性细胞形成的Munro微脓肿,棘层可观察到显著上延的均匀排列的真皮乳头,单位面积内真皮乳头数量增加,血管明显扭曲扩张充血(图3c,3d)。股内侧皮损组织病理示:表皮角化过度伴角化不全,可见Munro微脓肿,颗粒层明显变薄,棘层增厚,表皮突杵状下延,真皮乳头杵状上延、真皮乳头血管扩张,上方棘层变薄,周围可见明显的淋巴细胞、中性粒细胞浸润(3e)。最后诊断:银屑病。
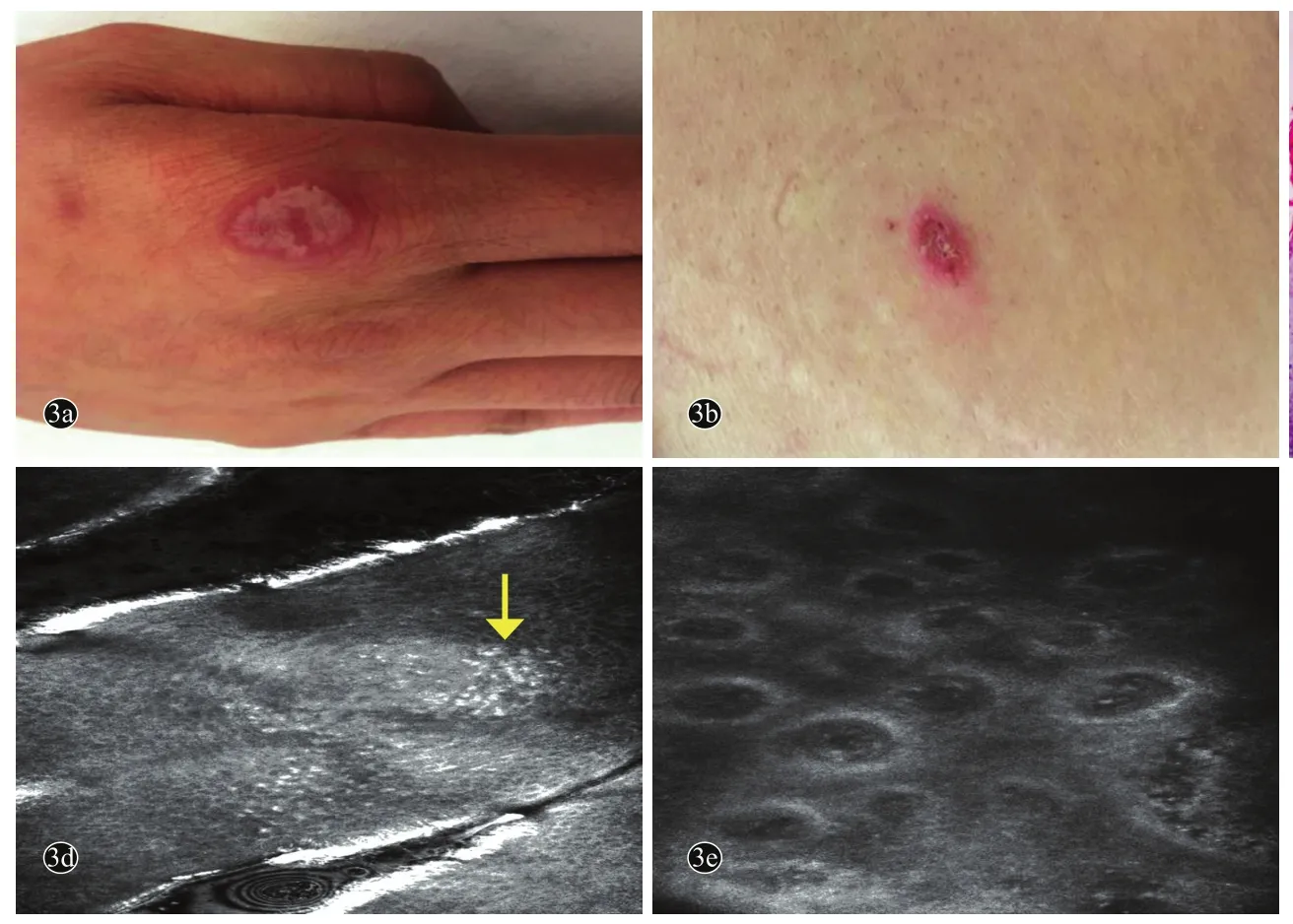
图3 不典型银屑病患者(例3)临床、组织病理及RCM图像
讨论
RCM是基于共聚焦原理的皮肤原位、在体、实时、动态三维成像技术,是近年来具有前景的无创性皮肤影像学方法之一[1,2]。早在1995—1999年,国外学者明确了RCM图像下正常组织细胞的成像特点[3],2000—2010年报告了疾病的成像特点,2002—2011年建立了诊断标准[4]以及判断标准的敏感性和特异性。2005年该技术进入中国,刘华绪成为国内最早从事该项研究的学者。应用以来,临床上发现其在诸多疾病的诊断上具有不可比拟的优势,比如色素性疾病、肿瘤性疾病和炎症性皮肤病[5-11],具有代表意义的疾病有白癜风、色素痣、恶性黑素瘤、基底细胞癌以及银屑病等,RCM图像下均具有特异性改变。
RCM在银屑病诊断的实际操作中,图像采集的皮损类型选择性很重要:①由于银屑病皮损的角质层厚度显著增加且比较疏松,因而折光显著增强,透射进入皮肤的光会减少,影响成像深度,所以一般选鳞屑较薄、未经破坏的原发皮损为好。因此对于初发的、病程较短的、斑丘疹样改变的皮损,RCM更具有临床诊断指导意义。本文例3患者的皮损均为初发,主要以斑疹或斑丘疹为主,鳞屑较薄,对RCM的穿透深度影响不大,操作者更容易捕捉到真皮浅中层的组织变化。②银屑病组织病理上分叶核炎性细胞聚集部位下方的棘层显著变薄,真皮乳头向上延伸,由于不同部位表皮的厚度不一,这需要在连续垂直方向扫描时与边缘正常皮肤进行对比方能确定;因此,图像采集宜选择皮损边缘、包含少部分正常皮肤的部位。
对照经典的组织病理改变,银屑病皮损的RCM图像特征具有如下特点[12,13]:①银屑病组织病理中的的弥漫性或局灶性角化不全在RCM图像中表现为较规则分布的折光性大颗粒,这种折光性大颗粒常位于角质层的中下方。虽然其他皮肤病如玫瑰糠疹等也可以出现这种折光性大颗粒,但实际操作中笔者发现,银屑病皮损中RCM图像出现折光性大颗粒的概率更高,所以一旦发现明显规则分布的折光性大的颗粒,应进一步寻找银屑病其他特征性改变。例1患者在最初的RCM扫描时发现了局限性折光性大颗粒,扩大扫描范围后陆续出现了Munro微脓肿等改变,最后经组织病理检查证实银屑病诊断成立。②RCM横断面下大部分Munro微脓肿呈境界清楚的圆形或椭圆形暗区,为聚集的分叶核炎性细胞,动态扫描时有流动感或闪烁感,一般位于角化不全和棘层之间。但是由于皮损时间长短以及其他外力搔抓等因素,Munro微脓肿有时会呈现为变形性改变,呈旋涡状、分散弥漫性分布等。这时分叶核炎性细胞特有的闪烁感即成为判定Munro微脓肿的特征性改变,例3的Munro微脓肿即呈现为弥漫分布。③银屑病增生模式:RCM动态扫描时较之周围正常皮肤,皮损区域RCM横断面表现为单位面积内色素环环绕的血管数量明显增加,间距较一致,色素环中央的血管明显扭曲扩张,动态扫描下可见明显流动的中高折光的白细胞以及红细胞,同时伴有基底层色素环减退或者消失。同时银屑病也可以出现其他非特异性改变,如真皮乳头中高折光的炎性细胞浸润,表皮内散在的炎性细胞移入等,当出现这些不典型改变时,需要注意将银屑病与玫瑰糠疹进行鉴别。玫瑰糠疹的RCM图像从角质层纵向逐渐向真皮浅层扫描,依次可见角质层规则分布的中高折光的大颗粒,颗粒层以及棘层内局限性分布的低折光的水疱样结构,真皮乳头高折光的色素环中央血管扩张及中高折光的炎性细胞的浸润等。
与组织病理学相比,RCM具有无创、可重复性,维持了组织细胞的正常形态和生理功能,可动态监测及成像迅速等优势,凭借RCM中的特异性改变,大大提高了银屑病不典型皮损的诊断率。
【参 考 文 献】
[1] 刘华绪. 反射式共聚焦显微镜皮肤病图谱 [M]. 北京:人民卫生出版社, 2013:68-74.
[2] 刘华绪, 郑志忠, 任秋实. 基于光学共聚焦原理的皮肤在体三维成像系统及应用 [J]. 中华皮肤科杂志, 2006, 39(10):616-619.
[3] Rajadhyaksha M, Anderson RR, Webb RH. Video-rate confocal scanning laser microscope for imaging human tissues in vivo [J].Appl Opt, 1999, 38(10):2105-2115.
[4] Alvarez-Roman R, Naik A, Kalia YN, et al. Visualization of skin penetration using confocal laser scanning microscopy [J]. Eur J Pharm Biopharm, 2004, 58(2):301-316.
[5] Li W, Wang S, Xu AE. Role of in vivo reflectance confocal microscopy in determining stability in vitiligo: a preliminary study[J]. Indian J Dermatol, 2013, 58(6):429-432.
[6] Dutt R, Rabinovitz HS, Singh R, et al. Dermoscopic and confocal features of an axillary "special site" nevus [J]. Dermatol Pract Concept, 2017, 7(1):55-58.
[7] Tavoloni Braga JC, de Paula Ramos Castro R, Moraes Pinto Blumetti TC, et al. Opening a window into living tissue: histopathologic features of confocal microscopic fi ndings in skin tumors [J].Dermatol Clin, 2016, 34(4):377-394.
[8] Song E, Grant-Kels JM, Swede H, et al. Paired comparison of the sensitivity and speci fi city of multispectral digital skin lesion analysis and reflectanceconfocal microscopyin the detection of melanoma invivo: A cross-sectional study [J]. J Am Acad Dermatol, 2016,75(6):1187-1192.
[9] Oliveira A, Zalaudek I. Reflectance confocal microscopy as a noninvasive diagnostic tool for naevoid basal cell carcinoma syndrome management [J]. Clin Exp Dermatol, 2017, 42(2):203-205.
[10] Agozzino M, Gonzalez S, Ardigò M. re fl ectance confocal microscopy for inflammatory skin diseases [J]. Actas Dermosifiliogr, 2016,107(8):631-639.
[11] Alessi SS, Nico MM, Fernandes JD, et al. Reflectance confocal microscopy as a new tool in the in vivo evaluation of desquamative gingivitis: patterns in mucous membrane pemphigoid, pemphigus vulgaris and oral lichen planus [J]. Br J Dermatol, 2013,168(2):257-264.
[12] Hoogedoorn L, Wolberink EA, van de Kerkhof PC, et al. Noninvasive diあerentiation between stable and unstable chronic plaque psoriasis using in vivo reflectance confocal microscopy [J]. J Am Acad Dermatol, 2015, 73(5):870-872.
[13] Wolberink EA, van Erp PE, de Boer-van Huizen RT, et al.Reflectance confocal microscopy: an effective tool for monitoring ultraviolet B phototherapy in psoriasis [J]. Br J Dermatol, 2012,167(2):396-403.
