rhMG53蛋白对小鼠创伤性脑损伤的保护作用*
2017-04-08黄团结马珊珊石振庆刘雯雯
黄团结,马珊珊#,程 田,邢 衢,程 康,石振庆,张 涛,刘雯雯,许 玲,杨 波,
关方霞1,2)#
1)郑州大学生命科学学院干细胞研究室 郑州 450001 2)郑州大学第一附属医院干细胞研究室 郑州 450052
rhMG53蛋白对小鼠创伤性脑损伤的保护作用*
黄团结1),马珊珊1)#,程 田2),邢 衢1),程 康1),石振庆1),张 涛1),刘雯雯1),许 玲1),杨 波2),
关方霞1,2)#
1)郑州大学生命科学学院干细胞研究室 郑州 450001 2)郑州大学第一附属医院干细胞研究室 郑州 450052
#通信作者:关方霞,女,1969年2月生,博士,教授,研究方向:干细胞与再生医学,E-mail:guanfangxia@126.com;马珊珊,女,1984年5月生,博士,副教授,研究方向:干细胞与神经功能修复,E-mail:mashanshan84@163.com
MG53蛋白;小鼠;创伤性脑损伤
目的:探讨重组人MG53(rhMG53)蛋白对小鼠创伤性脑损伤(TBI)的保护作用。方法:采用自由落体打击法建立小鼠TBI模型,将造模小鼠随机分为TBI组和TBI+MG53组,每组21只。造模术后第1、3、7、14、21、28天检测小鼠体重变化并进行神经功能缺损评分(mNSS);术后第3天,通过Western blot检测脑组织中MG53蛋白的表达,干湿重法检测小鼠脑含水量,ELISA法检测血清中SOD和MDA含量;术后第27天,采用新事物识别实验检测小鼠认知功能;术后第28天,通过强迫游泳实验检测小鼠抑郁情况,CV染色检测脑损伤体积,qRT-PCR检测小鼠脑组织中神经营养因子BDNF和NGF mRNA的表达。结果:MG53能够迁移并分布于脑损伤部位;与TBI组相比,TBI+MG53组小鼠体重增加,mNSS降低,抑郁程度减轻,认知功能改善,血清中SOD的表达增加,MDA含量降低,同时脑含水量减少,脑损伤体积减小,损伤部位BDNF和NGF mRNA的表达增强(P均<0.05)。结论:外源rhMG53蛋白对TBI小鼠有明显的保护作用。
创伤性脑损伤(traumatic brain injury,TBI)是由外力引起的大脑损伤[1-2]。TBI后引发的炎症和缺氧可进一步引起继发性脑损伤[3-5]。TBI是目前致死和致残的主要病因之一,现今仍未发现行之有效的治疗方法,寻求新型、快速修复脑损伤并改善神经功能的有效药物和靶点显得极为迫切。Mitsugumin53(MG53)蛋白是一种骨骼肌和心肌特异表达的Tripartite motif(TRIM)家族蛋白[6]。研究[7-8]发现,外源rhMG53蛋白能够治疗心肌梗死和肌营养不良症;外源rhMG53蛋白能定位于损伤部位,对多种非肌细胞(上皮细胞、间质细胞、星形胶质细胞等)损伤和急性组织损伤(肺损伤、肾损伤等)发挥保护作用。已有研究[9]显示rhMG53能够改善阿尔茨海默鼠的行为能力、延缓衰老。作者观察了外源rhMG53蛋白对TBI模型鼠的治疗效果。
1 材料与方法
1.1 实验材料 rhMG53蛋白由美国俄亥俄州州立大学麻建杰教授赠送,小鼠脑立体定位仪和颅脑打击器购于瑞沃德公司,RNA提取试剂盒、反转录试剂盒、实时荧光定量PCR试剂盒购置于TaKaRa公司,动物组织蛋白提取试剂盒购于上海生工生物工程有限公司,血清SOD活性测定和MDA含量测定试剂盒购于南京建成生物公司,水合氯醛、生理盐水、PBS、乙醇、络合碘消毒剂、注射器、多聚甲醛等均为市售。
1.2 脑损伤模型的建立 采用自由落体打击法建立小鼠TBI模型。小鼠经水合氯醛(3 mL/kg)腹腔注射麻醉后,颅顶部备皮,络合碘消毒剂消毒,固定于脑立体定位仪,于矢状正中切开头皮,暴露筋膜并钝性分离,剥离显露左侧颅骨,于前囟后约1.5 mm、中线旁侧1.5 mm,用牙科钻小心钻开3 mm骨窗,保证硬脑膜完整。然后调整颅脑打击器,使直径2.5 mm 20 g撞针正对骨窗中心,控制打击深度2 mm,从20 cm处垂直打击。造模成功标准为:打击后,小鼠一过性四肢抽搐、呼吸暂停,但数秒后可自行缓解。术后止血,以骨蜡闭合骨窗,缝合头皮。术后检测小鼠呼吸、心跳,给予保温处理,保持肛温(37.0±0.5) ℃,直至小鼠清醒。
1.3 实验动物及分组 清洁级雄性C57BL/6小鼠,10~12周龄,体重23~25 g,购于北京维通利华实验动物技术有限公司,适应环境1周后按1.2方法造模。术中、术后如果发现动物死亡,立即给予补充,确保每组实验小鼠21只。TBI组造模3 h后尾静脉注射0.1 mL生理盐水,1次/d,连续注射3 d。TBI+MG53组造模3 h后尾静脉注射0.75 g/L rhMG53 0.1 mL(3 mg/kg),1次/d,连续注射3 d。
1.4 观测指标
1.4.1 体重检测和mNSS评分 每组选定6只小鼠,于造模术后第1、3、7、14、21和28天固定时间称量体重并做神经功能缺损评分(modified neurological severity score,mNSS),期间按时补充食物和水,定期更换垫料。根据mNSS评分量表[10],采用双盲法评判并记录分值。mNSS评分标准从小鼠运动、感觉、平衡能力以及反射情况等方面进行评估,分值0(正常)~18(最严重)。
1.4.2 小鼠脑内MG53蛋白的检测 术后第3天,水合氯醛麻醉小鼠(每组3只),摘取新鲜大脑,蛋白提取和Western blot检测方法参照宋及时等[9]的报道。其中一抗MG53按11 000、β-actin按12 000稀释。
1.4.3 小鼠脑含水量检测 术后第3天,麻醉小鼠(每组6只),经活体心脏采血(备用)后,摘取受损的左侧新鲜半脑,迅速称取半脑质量,尽量避免大脑在空气中水分的蒸发,得到湿重。然后将脑组织放入100 ℃烤箱,24 h后测得干重。脑含水量=(湿重-干重)/湿重×100%。
1.4.4 小鼠血清SOD活性和MDA含量检测 取1.4.3收集的新鲜血液,室温静置过夜后,2 000g离心5 min,收集上清。根据试剂盒说明书推荐方法使用酶标仪检测血清中SOD活性和MDA含量。
1.4.5 新事物识别实验检测小鼠认知功能 术后第27天,每组选取6只小鼠,将小鼠放置在一个50 cm × 50 cm × 25 cm不透明箱子中,进行环境适应10 min。24 h后将2个相同体积、相同颜色的物体(4 cm×4 cm×4 cm红色立方体)放入箱子中,让小鼠探索10 min,然后将小鼠放入原来的笼子。1 h后,将其中1个红色立方体用绿色球形物体(直径4 cm)代替,再次将小鼠放置到此箱子中探索5 min。期间应用录像机记录小鼠探索情况。此时红色立方体为旧物体,而绿色球形物体为新物体,在电脑上分析小鼠探索新、旧物体所用时间,计算辨别指数。辨别指数=新物体所用时间/(新物体所用时间+旧物体所用时间)×100%。
1.4.6 强迫游泳实验检测小鼠抑郁情况 术后第28天,用1.4.5中6只小鼠做强迫游泳实验:在一个圆柱形水容器中,放入清水(高度25 cm,直径22 cm),水温(23±1)℃;将小鼠放入水中,用摄像机记录6 min;在电脑上分析后4 min视频,记录小鼠游泳时间,漂浮或仅有一肢体微动不计入游泳时间。悬浮时间(s)=240-游泳时间(s)。
1.4.7 小鼠脑损伤体积的检测 1.4.6实验完成后,麻醉小鼠,用预冷的20 mL 0.01 mol/L PBS心脏灌注后取出新鲜脑组织于40 g/L多聚甲醛中固定,24 h后进行梯度蔗糖脱水,72 h后脑组织沉底,经OCT包埋后,使用冰冻切片机制作厚度为25 μm 的切片。按照Paxions和Waston小鼠脑立体定位图谱,在小鼠病灶部位前后2 mm处,从头至尾连续冠状切片,每连续10张脑片取出1个,进行CV染色。使用Image J软件,结合比例尺,计算每个脑片中的缺损面积,计算大脑损伤体积。大脑损伤体积(mm3)=平均损伤面积×脑片数×10×0.03。
1.4.8 小鼠脑组织中脑源性营养神经因子(brain-derived neurotrophic factor,BDNF)和神经生长因子(nerve growth factor,NGF)的表达 1.4.7实验完成后,取小鼠脑组织材料,RNA提取和荧光定量PCR检测方法同孟楠等[11]的报道,引物序列见表1。

表1 小鼠NGF、BDNF引物序列
1.5 统计学处理 采用SPSS 21.0进行数据分析。两组小鼠体重、mNSS评分的比较采用重复测量数据的方差分析,脑损伤、脑含水量、血清中SOD活性及MDA含量、抑郁情况、认知功能和神经营养因子mRNA表达的比较均采用两独立样本t检验,检验水准α=0.05。
2 结果
2.1 两组小鼠术后体重和mNSS评分 两组小鼠术后体重变化情况见表2、3。从第14天,TBI+MG53组小鼠体重明显高于TBI组,mNSS得分亦开始明显低于TBI组。

表2 两组小鼠术后体重的比较 g
F组间=38.998,F时间=63.470,F交互=4.939,P均<0.001。

表3 两组小鼠术后mNSS评分的比较
F组间=88.235,F时间=221.706,F交互=10.353,P均<0.001。
2.2 两组小鼠脑组织中MG53蛋白的表达 见图1。术后第3天,MG53在TBI组小鼠脑组织中不表达,而在TBI+MG53组小鼠的脑组织中显著表达。

图1 两组小鼠脑组织中MG53蛋白的检测
2.3 两组小鼠脑含水量的比较 术后第3天,TBI+MG53组小鼠脑含水量为(74.32±2.41)%,TBI组小鼠为(82.78±2.63)%,TBI+MG53组明显低于TBI组(t=7.843,P<0.001)。
2.4 两组小鼠血清中SOD活性和MDA含量的比较 见表4。术后第3天,TBI+MG53组小鼠血清中SOD活性高于TBI组,MDA含量较TBI组降低。
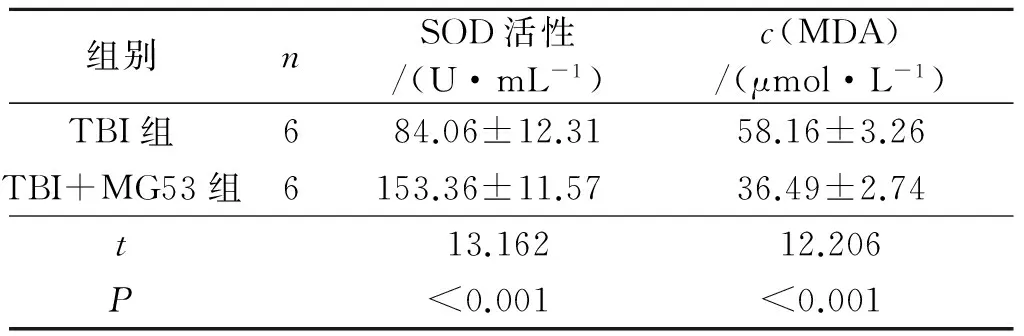
表4 术后第3天两组小鼠血清中SOD活性和MDA含量的比较
2.5 两组小鼠认知功能和抑郁情况的比较 见表5。TBI+rhMG53组小鼠术后第27天辨别指数高于TBI组,术后第28天悬浮时间低于TBI组。
2.6 两组小鼠脑损伤体积的比较 术后第28天,TBI+MG53组小鼠脑损伤体积小于TBI组,见表5。
2.7 两组小鼠脑组织中神经营养因子表达的比较
见表5,TBI+MG53组小鼠脑组织中BDNF和NGF mRNA的表达量均高于TBI组。
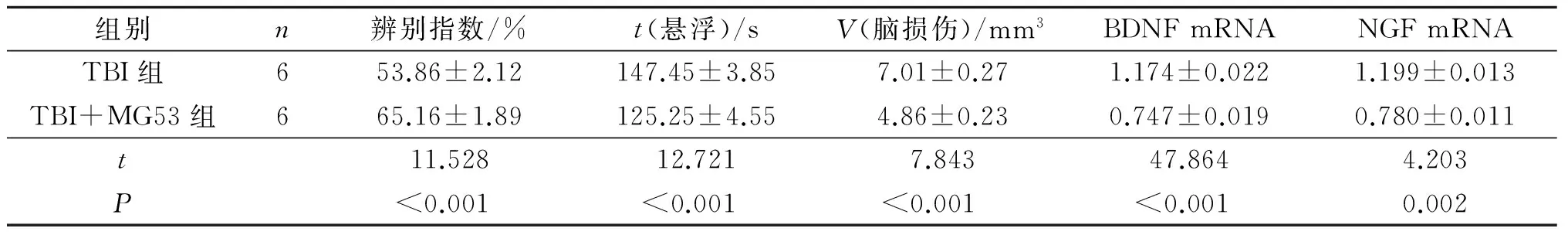
表5 两组小鼠术后辨别指数、悬浮时间、脑损伤体积及脑组织中神经营养因子mRNA表达的比较
3 讨论
TBI的发病率和致残率逐年提高,给人类健康带来极大的危害[12]。研究[13]显示MG53蛋白能参与神经细胞的损伤修复。该研究以此为出发点,探究外源rhMG53蛋白对TBI小鼠的神经保护作用。
目前最常用的脑外伤模型有自由落体打击模型、皮层控制撞击模型和液压撞击模型等。其中,自由落体打击法是一种经典、成熟的造模方法,它可以通过调整打击物重量和打击高度控制脑损伤的程度,制作方法简易、稳定性好、重复性高。因此,该实验利用瑞沃德立体定位仪和颅脑打击器,采用自由落体打击法构建小鼠TBI模型。
该实验结果显示,内源性MG53在脑组织中不表达,但注射外源rhMG53后,rhMG53能够选择性到达脑损伤部位的神经细胞中,提示MG53可能参与脑损伤的修复。进一步研究显示,与术前相比,两组小鼠在术后第1天和第3天体重有所减轻、mNSS得分也在前3天最高,这一结果可能与术后的炎症反应有关,也与已有文献[2]报道一致。TBI+MG53组小鼠在术后第14、21、28天时体重明显高于TBI组,且mNSS评分明显低于TBI组,说明MG53能提高TBI小鼠体重,减轻小鼠神经功能缺损。
脑外伤的发生通常伴随着脑内水平衡紊乱,过多的液体聚集在受损的脑细胞内或细胞外间隙,导致脑水肿,进而导致一系列的并发症[14-15]。该实验结果显示,术后第3天TBI+MG53组小鼠脑含水量明显低于TBI组,说明MG53能减轻TBI造成的脑水肿。在生化水平上,SOD的活性直接反映机体清除自由基的能力,而MDA的含量也能反映机体自由基堆积和脂质过氧化损伤程度。作者发现,术后第3天,TBI+MG53组小鼠血清中SOD活性较TBI组明显升高且MDA含量降低,说明MG53提高了小鼠抗氧化能力。
作者进一步观察rhMG53对TBI小鼠的长期(术后28 d)疗效。研究结果显示,术后第28天,TBI+MG53组小鼠大脑缺损体积明显小于TBI组,而悬浮时间较TBI组小鼠显著缩短,辨别指数升高;说明MG53能降低脑损伤体积,减轻TBI小鼠抑郁情况并提升认知功能。
BDNF和NGF是神经营养因子,它们表达量的高低直接决定脑损伤部位微环境的变化。作者利用荧光定量RT-PCR法检测两组小鼠术后第28天脑组织中BDNF和NGF mRNA的表达水平,结果发现TBI+MG53组小鼠二者的表达量均高于TBI组,说明MG53蛋白能改善受损大脑的微环境。
综上所述,外源rhMG53蛋白能增加TBI小鼠的体重,改善小鼠神经功能缺损,降低脑含水量和损伤体积,提高抗氧化水平,减少抑郁情况,提升认知功能,同时促进小鼠脑内神经营养因子的表达,改善损伤部位微环境,对TBI小鼠具有神经保护作用。
[1]LU Y,WANG D,XU G,et al.Pretreatment with tert-butylhydroquinone attenuates cerebral oxidative stress in mice after traumatic brain injury[J].J Surg Res,2014,188(1):206
[2]CHENG T,YANG B,LI D,et al.Wharton′s jelly transplantation improves neurologic function in a rat model of traumatic brain injury[J].Cell Mol Neurobiol,2015,35(5):641
[3]SONG J,ZHONG C,BONAGUIDI A,et al.Neuronal circuitry mechanism regulating adult quiescent neural stem-cell fate decision[J].Nature,2012,489(7414):150
[4]TAYLOR V.Hippocampal stem cells: so they are multipotent![J].J Mol Cell Biol,2011,3(5):270
[5]MING GL,SONG HJ.Adult neurogenesis in the mammalian central nervous system[J].Annu Rev Neurosci,2005,28:223
[6]CAI C,MASUMIYA H,WEISLEDER N,et al.MG53 nucleates assembly of cell membrane repair machinery[J].Nat Cell Biol,2009,11(1):56
[7]WANG X,XIE W,ZHANG Y,et al.Cardioprotection of ischemia/reperfusion injury by cholesterol-dependent MG53-mediated membrane repair[J].Circ Res,2010,107(1):76
[8]YAO YG,ZHANG B,ZHU H,et al.MG53 permeates through blood-brain barrier to protect ischemic brain injury[J].Oncotarget,2016,7(16):22474
[9]宋及时,马珊珊,孟楠,等.rhMG53蛋白联合 hUC-MSCs 移植对阿尔茨海默鼠的治疗作用[J].郑州大学学报(医学版),2016,51(4):442
[10]BONILLA C,ZURITA M,OTERO L,et al.Failure of delayed intravenous administration of bone marrow stromal cells after traumatic brain injury[J].J Neurotrauma,2012,29(2):394
[11]孟楠,马珊珊,王欣欣,等.氯化锂联合hUC-MSCs移植对阿尔茨海默鼠的治疗作用[J].郑州大学学报(医学版),2016,51(2):157
[12]MENDES ARENT A,DE SOUZA LF,WALZ R,et al.Perspectives on molecular biomarkers of oxidative stress and antioxidant strategies in traumatic brain injury[J].Biomed Res Int,2014.doi:10.1155/2014/723060
[13]WEISLEDER N,TAKIZAWA N,LIN P,et al.Recombinant MG53 protein modulates therapeutic cell membrane repair in treatment of muscular dystrophy[J].Sci Transl Med,2012,4(139):139ra85
[14]RAMKUMAR M,SEKAR V,BHAKKIYALAKSHMI E,et al.The impact of oxidative stress on islet transplantation and monitoring the graft survival by non-invasive imaging[J].Curr Med Chem,2013,20(9):1127
[15]BAINS M,HALL D.Antioxidant therapies in traumatic brain and spinal cord injury[J].Biochim Biophys Acta,2012,1822(5):675
(2016-09-19收稿 责任编辑王 曼)
Protective effect of rhMG53 protein on traumatic brain injury mouse model
HUANGTuanjie1),MAShanshan1),CHENGTian2),XINGQu1),CHENGKang1),SHIZhenqing1),ZHANGTao1),LIUWenwen1),XULing1),YANGBo2),GUANFangxia1,2)
1)StemCellLaboratory,SchoolofLifeSciences,ZhengzhouUniversity,Zhengzhou450001 2)StemCellLaboratory,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
MG53;mouse;traumatic brain injury
Aim: To investigate the protective effects of recombinant human MG53(rhMG53) protein on the mouse model of traumatic brain injury(TBI).Methods: A weight drop model was used to establish the mouse model of TBI,and model mice were randomly allocated into TBI group and rhMG53 treated group(TBI+MG53 group),21 mice in each group. On the 1st, 3ed, 7th, 14th, 21th, 28th day, the body weight was detected,at the same time mNSS score was used to observe the neurological deficits; on the 3ed day, Western blot was used to detect the expression of MG53 in brain tissue, dry wet weight method, to detect the content of brain water and ELISA, for detection of serum SOD and MDA content; After 27 or 28 days, the depression and cognitive function of mice were detected by forced swimming test and new thing recognition experiment, CV staining was used to observe the brain damage of the two groups and qRT-PCR, to analyze the expression of neurotrophic factor(BDNF and NGF) expression in brain tissue of each group.Results: rhMG53 could migrate and distribute in the area of brain injury; compared with the TBI group, injection of rhMG53 could increase the body weight, reduce the neurological deficit, alleviate depression and improve cognitive function of TBI mice(P<0.05); rhMG53 could increase the expression of SOD in serum and decrease the content of MDA(P<0.05),and reduce brain water content and the damage volume, increase mRNA expression of BDNF and NGF in the injury site(P<0.05). Conclusion: Exogenous rhMG53 protein has a significant protective effect on TBI mice.
10.13705/j.issn.1671-6825.2017.02.002
*国家自然科学基金资助项目 81601078,81471306;河南省高校科技创新团队项目 15IRTSTHN022;河南省科技创新人才计划项目154200510008;河南省国际人才合作项目 2016GH03,2016GH15
R742
